Advances in Clinical Medicine
Vol.
11
No.
01
(
2021
), Article ID:
39844
,
9
pages
10.12677/ACM.2021.111024
缬沙坦通过Akt信号通路抑制宫颈癌Hela细胞增殖、迁移及侵袭的研究
宗军宁1,张裕民2,谭雪莹3,李稳1,张萍1
1青岛大学附属青岛市市立医院,妇科,山东 青岛
2菏泽市食品药品检验检测研究院药品所,山东 菏泽
3青岛大学附属青岛市市立医院,卫生部细胞移植重点实验室,山东 青岛

收稿日期:2020年12月16日;录用日期:2021年1月5日;发布日期:2021年1月20日

摘要
目的:观察血管紧张素II 1型受体拮抗剂缬沙坦(Valsartan)对宫颈癌Hela细胞的增殖、迁移及侵袭的影响及机制。方法:体外培养宫颈癌Hela细胞。采用不同浓度(0.1、1、10和100 μmol/L)的缬沙坦分别处理Hela细胞0、24、48 h,CCK-8法检测Hela细胞的增殖能力。缬沙坦(100 μmol/L)处理Hela细胞24 h后,采用划痕愈合实验和Transwell小室侵袭实验分别检测迁移及侵袭能力,蛋白质印迹法检测缬沙坦(10和100 μmol/L)处理Hela细胞24 h后,Hela细胞中Akt、p-Akt蛋白的表达情况。随后,在Hela细胞中加入Akt激动剂预处理1 h后,再加入缬沙坦(100 μmol/L)培养Hela细胞,采用cck-8法检测Hela细胞增殖能力,采用划痕愈合实验和Transwell小室侵袭实验,检测Hela细胞的迁移和侵袭能力。结果:使用缬沙坦(10和100 μmol/L)处理Hela细胞,能够抑制Hela细胞的增殖作用(p < 0.01),缬沙坦(100 μmol/L)处理细胞后能够明显抑制Hela细胞的迁移及侵袭能力(p < 0.01);缬沙坦(100 μmol/L)处理过的Hela细胞中p-Akt蛋白的表达量降低(p < 0.01)。Akt激动剂减弱了缬沙坦对Hela细胞的增殖、迁移及侵袭的抑制作用。结论:缬沙坦对宫颈癌Hela细胞的增殖、迁移及侵袭能力有明显的抑制作用,这种抑制作用可能是通过抑制Akt信号通路实现的。
关键词
宫颈癌,血管紧张素受体拮抗剂,PI3K-Akt信号通路
Valsartan Inhibits Proliferation, Migration and Invasion of Cervical Cancer Hela Cells through Akt Signaling Pathway
Junning Zong1, Yuming Zhang2, Xueying Tan3, Wen Li1, Ping Zhang1
1Department of Gynecology, Qingdao Municipal Hospital Affiliated to Qingdao University, Qingdao Shandong
2Shandong Heze Food and Drug Inspection and Research Institute, Heze Shandong
3Cell Laboratory of Qingdao Municipal Hospital Affiliated to Qingdao University, Qingdao Shandong

Received: Dec. 16th, 2020; accepted: Jan. 5th, 2021; published: Jan. 20th, 2021

ABSTRACT
Objective: To observe the effect and mechanism of angiotensin II type 1 receptor antagonist Valsartan on the proliferation, migration and invasion of cervical cancer Hela cells. Methods: Hela cells were cultured in vitro. Different concentrations (0.1, 1, 10, and 100 μmol/L) of valsartan were used to treat Hela cells for 0, 24, and 48 hours, respectively. The proliferation ability of Hela cells was detected by CCK-8 method. After treatment of Hela cells with valsartan (100 μmol/L) for 24 h, the migration and invasion ability were detected by scratch healing test and transwell cell invasion test respectively. Western blotting was used to detect the expression of Akt and p-Akt proteins in HeLa cells after 24 h treatment with Valsartan (10 and 100 μmol/L) Then, HeLa cells were pretreated with Akt agonist for 1 h, and then cultured with Valsartan (100 μmol/L). The proliferation ability of HeLa cells was detected by CCK-8 assay. The migration and invasion ability of HeLa cells were detected by wound-healing assay and Transwell assay. Results: Treatment of Hela cells with 10 and 100 μmol/L valsartan can inhibit the proliferation of Hela cells (p < 0.01). After treatment with valsartan (100 μmol/L), cells can significantly inhibit the migration and invasion ability of Hela cells (p < 0.01); the expression of p-Akt protein in Hela cells treated with 100 μmol/L valsartan was reduced (p < 0.01). Akt agonist eliminates the inhibitory effect of valsartan on the proliferation, migration and invasion of Hela cells. Conclusion: Valsartan has a significant inhibitory effect on the proliferation, migration and invasion of cervical cancer Hela cells. This inhibitory effect may be achieved by inhibiting the Akt signaling pathway.
Keywords:Cervical Cancer, Angiotensin Receptor Antagonist, PI3K-Akt Signaling Pathway

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
宫颈癌是危害女性身体健康的重要疾病之一,在全球妇女癌症中发病率位于第四位 [1]。据统计,晚期宫颈癌5年生存率不足40% [2]。因此,寻找抑制宫颈癌增殖及早期转移的方法及可能机制,具有重要的临床意义。血管紧张素II (angiotensin II, AngII)通过与血管紧张素II 1型受体(AngII type 1 receptor AT1R)结合,上调血管内皮生长因子(VEGF),增加MMP-2、MMP-9的表达量,激活MAPK、PI3K/Akt等信号通路影响肿瘤的发生与发展 [3]。缬沙坦(Valsartan)是一种血管紧张素II 1型受体拮抗剂(ARBs) [4],有学者研究发现,缬沙坦可以抑制宫颈癌细胞的增殖 [5]。既往研究发现,宫颈癌患者的疾病进展和预后与PI3K-Akt信号通路的异常激活相关,发生Akt高水平的磷酸化宫颈癌患者化疗后预后较差,生存期也较短 [6]。因此,本文旨在探讨缬沙坦(Valsartan)是否可以通过影响Akt、p-Akt的表达,继而影响宫颈癌Hela细胞的增殖、转移及侵袭等生物学作用。
2. 材料与方法
2.1. 细胞、试剂及器材
人宫颈癌Hela细胞株由青岛市市立医院肝胆胰细胞实验室馈赠;缬沙坦购自大连美仑生物技术有限公司;胎牛血清(FBS),DMEM培养液,PBS缓冲液,0.25%胰酶-EDTA购自美国ThermoFisher公司;SDS-凝胶配制试剂盒、Akt激动剂、RIPA裂解液、蛋白酶抑制剂和PVDF膜购自上海碧云天生物技术有限公司;单克隆抗体鼠抗人Akt、p-Akt及单克隆山羊抗鼠抗体(辣根过氧化物酶)购自美国CST公司;单克隆抗体鼠抗人肌动蛋白(β-action)购自美国ABcam公司,6孔板,24孔板,96孔板,25 cm2培养瓶,Transwell细胞培养插件,Matrige胶购自美国Corning公司;CCK-8试剂盒购自日本同仁化学研究所;倒置显微镜购自日本Nikon公司;微孔板检测系统VersaMax (酶标仪)购自美国MolecμlarDevices公司。
2.2. 实验方法
2.2.1. 细胞培养及药物配置
宫颈癌Hela细胞株在含10% FBS、1%双抗(青霉素 + 链霉素)的DMEM培养液中,置于5% CO2、37℃和95%空气培养箱中孵育。每隔1~2 d传代一次,取对数生长期细胞进行实验。使用DMSO配置缬沙坦储存液,置于−80℃冰箱中保存备用,使用时用DMEM培养液稀释至合适浓度。
2.2.2. CCK-8增殖实验
取对数生长期的Hela细胞,调整每孔细胞数为5 × 103个,接种于96孔板中,待细胞贴壁。稀释缬沙坦,终浓度分别为0.1、1、10和100 μmol/L,设置对照组(仅加入等体积DMEM培养液)。每组设置6个复孔,分别培养0、24、48 h后,每孔加入10 μLCCK-8试剂,继续孵育2 h。使用酶标仪测定450 nm处每孔的吸光度(OD)值。
2.2.3. 细胞划痕实验
取对数生长期Hela细胞,在6孔板中每孔接种5 × 105个Hela细胞,然后置于培养箱中过夜,使用10 μL枪头在细胞中进行划痕,PBS冲洗细胞3次。实验组每孔加入含100 μmol/L缬沙坦的DEME培养液,对照组加入等体积的DMEM培养液,每组设置3个复孔,过夜。取划痕后0 h及24 h为时间点,置于倒置光学显微镜下拍照,实验重复3次。计算划痕愈合率。划痕愈合率(%) = (0 h划痕宽度 − 24 h划痕宽度)/0 h划痕宽度 × 100%。
2.2.4. transwell小室侵袭实验
将matrigel胶与无血清DMEM培养液以1:8的比例稀释并混匀,然后在transwell小室上室均匀平铺稀释的matrigel胶60 μL,置于培养箱中待其聚合成凝胶。取Hela细胞,实验组使用加入100 μmol/L缬沙坦的DMEM培养液培养24 h,对照组加入DMEM培养液,调整细胞浓度为1 × 105个/mL,各取100 μL加入transwell小室上室中,下室各加入含20% FBS的DMEM培养液600 μL。每组设置3个复孔,置于培养箱中培养24 h。取出小室,使用4%多聚甲醛固定30分钟。PBS清洗2次,使用0.1%结晶紫染色30分钟,PBS清洗3次。风干后,置于倒置光学显微镜下,随机选取5个视野拍照并计数穿过小室的细胞数。每组设置3个复孔,实验重复3次,取平均值。
2.2.5. 蛋白质印迹法
分别用0、10、100 μmol/L的缬沙坦处理宫颈癌Hela细胞24 h后,收集各组细胞。使用RIPA裂解液冰上裂解细胞1 h,每10 min震荡混匀1次;在4℃条件下15,000 r/min离心20 min,收集上清液,获得总蛋白。采用BCA试剂盒测定总蛋白浓度。100℃沸水煮沸蛋白5 min,使其变性。待冷却后,上样,使用10%SDS-PAGE分离蛋白后进行转膜,将蛋白转移至PVDF膜上,用含5%脱脂奶粉室温下封闭1 h,TBST洗膜10 min × 3次。分别使用Akt、p-Akt及β-action一抗,4℃条件下摇床孵育过夜。TBST清洗3次,每次10 min。室温下孵育二抗2 h,充分洗涤后,滴入ECL发光液后置入暗盒中压片,并依次显影、定影。
2.3. 统计学方法
应用SPSS 22.0对实验数据进行统计学分析,结果以(均数 ± 标准差)表示,多组间比较采用单因素方差分析,组间两两对比采用LSD-t检验,以p < 0.05认为有统计学意义。
3. 结果
3.1. 缬沙坦对宫颈癌细胞增殖能力的抑制作用
CCK-8检测结果显示,缬沙坦对Hela细胞增殖的有抑制作用,且呈浓度依赖性,结果如图1所示,当处理24 h时,细胞OD值分别为(2.489 ± 0.082)、(2.143 ± 0.097),48 h时分别为(3.128 ± 0.059)、(2.858 ± 0.113),与对照组相比p值均 < 0.01。
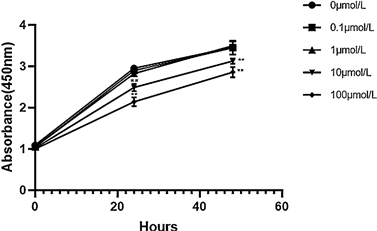 注:vs对照组,**p < 0.01
注:vs对照组,**p < 0.01
Figure 1. CCK-8 method to detect the effect of different concentrations of valsartan on proliferation of Hela cells
图1. CCK-8法检测不同浓度缬沙坦对Hela细胞增殖作用的影响
3.2. 缬沙坦对Hela细胞迁移、侵袭能力的抑制作用
在划痕愈合实验中,结果如图2(a)、图2(b)所示,实验组Hela细胞迁移率为(18.13 ± 1.12)%,与对照组迁移率(36.14 ± 1.67)%相比,差别有统计学意义(p < 0.01),表明缬沙坦具有抑制Hela细胞迁移的能力。
进一步采用Transwell侵袭实验检测缬沙坦对Hela细胞侵袭能力的影响,结果如图2(c)、图2(d)所示,100 μL缬沙坦处理Hela细胞24 h后,对照组穿过小室膜的细胞数为(335 ± 20)个,缬沙坦处理组穿过小室膜的细胞数(267 ± 15)个。与对照组相比,缬沙坦处理组穿过小室膜的细胞数明显减少,差别有统计学意义(p < 0.01)。上述结果表明,缬沙坦对宫颈癌细胞的迁移及侵袭有明显的抑制作用。
 (a)
(a)
 (b)
(b)
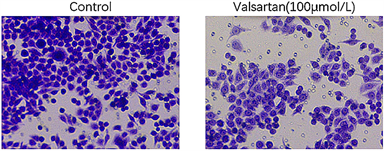 (c)
(c)
 (d)注:vs对照组,**p < 0.01
(d)注:vs对照组,**p < 0.01
Figure 2. Effect of Valsartan (100 μmol/L) treatment on Hela cell migration and invasion after 24 h
图2. 缬沙坦(100 μmol/L)处理24 h后对Hela细胞迁移、侵袭能力的影响(×100)
3.3. 缬沙坦抑制Akt信号通路的表达
采用Western blot检测不同浓度缬沙坦(10和100 μmol/L)处理Hela细胞24 h后,细胞中p-Akt的表达情况,结果如图3所示,与对照组蛋白相对表达量(2.62 ± 0.07)相比,实验组呈下降趋势,分别为2.58 ± 0.08、1.88 ± 0.05,但仅100 μmol/L缬沙坦处理组与对照组相比,结果具有统计学意义(p < 0.05)。
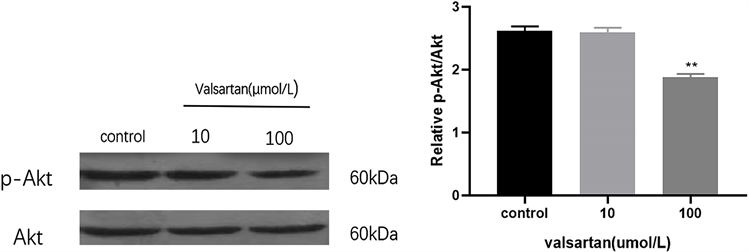 (a) (b)注:vs对照组,**p < 0.01
(a) (b)注:vs对照组,**p < 0.01
Figure 3. Expression of related proteins after treatment of Hela cells with different concentrations of valsartan
图3. 不同浓度缬沙坦处理Hela细胞后相关蛋白的表达
3.4. Akt激动剂减弱缬沙坦的作用
为进一步探讨缬沙坦是否通过Akt信号通路抑制Hela细胞的增殖,对照组(仅加入等体积DMEM培养液),实验组1中仅加入缬沙坦(100 μmol/L),实验组2中先加入Akt激动剂培养1 h后,再加入缬沙坦(100 μmol/L),分别检测0、24、48 h时的吸光度(OD)值,每组设6个复孔,实验重复3次,取平均值。结果如图4所示,加入Akt激动剂明显消除了缬沙坦的作用。
 注:vs对照组,***p < 0.001
注:vs对照组,***p < 0.001
Figure 4. CCK-8 method was used to detect the effect of adding valsartan and Akt agonist on proliferation of Hela cells
图4. CCK-8法检测加入缬沙坦、Akt激动剂对Hela细胞增殖作用的影响
 (a)
(a)
 (b)
(b)
 (c)
(c)
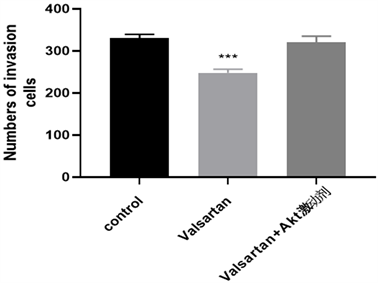 (d)注:vs对照组,***p < 0.001
(d)注:vs对照组,***p < 0.001
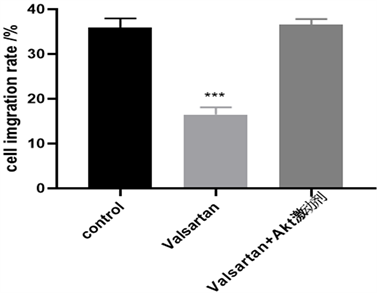
Figure 5. Effects of Akt agonist and valsartan on Hela cell migration and invasion after 24 h
图5. Akt激动剂及缬沙坦处理24 h后对Hela细胞迁移、侵袭能力的影响(×100)
3.5. 加入Akt激动剂对Hela细胞迁移及侵袭能力的影响
同3.4处理Hela细胞,采用划痕愈合实验检测Hela迁移、侵袭能力,实验结果如图5所示,Akt激动剂消除了缬沙坦对Hela细胞迁移及侵袭能力的抑制作用。
4. 讨论
宫颈癌的发病率在全世界范围内仍处于较高水平,目前治疗方式仍以手术治疗为主,中晚期可行放疗,辅以化疗及其它靶向治疗手段,但是对于有远处转移及复发患者的预后依然很不乐观 [7]。近年来研究发现,血管紧张素II与肿瘤细胞的发生发展有着重要的联系,血管紧张素II与肿瘤细胞中的AT1R结合发挥生物学作用,促进肿瘤细胞的血管生成、生长及转移 [3]。研究表明,血管紧张素II受体拮抗剂(ARBs)在减缓肿瘤进展、血管生成和转移方面发挥着一定作用。在小鼠肺癌模型中,坎地沙坦可降低肿瘤血管的生成和肺转移 [8],厄贝沙坦能显著降低大肠癌的生长、血管生成及肝转移率 [9]。早在2003年就有学者研究发现宫颈癌中表达AT1R,并且血管紧张素II可通过与AT1R结合增加血管内皮生长因子(VEGF)的分泌促进子宫颈癌的增殖与侵袭能力,加入坎地沙坦则可以抑制这种作用 [10]。本研究通过CCK-8增殖实验证实,当缬沙坦浓度为10、100 μmol/L时能够抑制Hela细胞的增殖作用。在既往研究中,Wu等人发现,使用ARBs可以抑制膀胱癌细胞的增殖作用 [11]。此外,还有研究证明血管紧张素II可以促进乳腺癌细胞的粘附和迁移能力 [12]。并且在卵巢癌中研究发现,血管紧张素II可以促进肿瘤细胞的上皮间质转化(EMT),从而增强卵巢癌细胞的转移性 [13]。在本实验中,使用100 μmol/L缬沙坦处理Hela细胞24 h后,通过划痕愈合实验和Transwell侵袭实验发现缬沙坦对Hela细胞迁移及侵袭能力有一定的抑制作用。
PI3K-Akt信号通路在许多不同的细胞和组织中及生长发育的各个阶段都发挥着重要作用,并且在多种肿瘤细胞中均呈现过度激活状态 [14],Akt可被广泛的生长信号激活而发生磷酸化,生物学作用涉及细胞生存、增殖、迁移、代谢和血管生成等方面 [15]。临床研究表明,在宫颈癌患者中,高水平表达p-Akt的患者经过治疗后转移率升高,生存率降低 [16]。有研究表明,通过降低Akt的磷酸化水平,可以促进宫颈癌细胞的凋亡,抑制其增殖 [17]。本实验中,我们发现在100 μmol/L缬沙坦处理Hela细胞后,可以下调细胞中p-Akt的表达,而对Akt的表达无明显影响。这表明缬沙坦对Hela细胞的生物学作用可能是通过抑制了Akt信号通路实现的。因此,我们进一步在缬沙坦处理组中加入Akt激动剂来印证这一推测。最终结果表明,加入Akt激动组中的缬沙坦的生物学作用被抑制,结果与对照组相比无统计学意义(p > 0.05)。以上结果表明,缬沙坦可以通过抑制Akt信号通路,从而对宫颈癌Hela细胞的增殖、迁移及侵袭产生抑制作用。
综上所述,本研究从细胞层面表明,抑制宫颈癌Hela细胞中的AT1R的作用可以影响PI3K-Akt信号通路的表达,从而抑制宫颈癌的增殖及侵袭能力。这提示我们AT1R可能成为治疗宫颈癌新的靶点,ARBs有望成为预防宫颈癌早期扩散及转移的辅助药物,但是肿瘤细胞的增殖及侵袭是多因素参与的结果,ARBs是否可以通过其它方式对宫颈癌产生影响,在个体层面是否也会产生同样的生物学作用还有待我们进一步研究。
文章引用
宗军宁,张裕民,谭雪莹,李 稳,张 萍. 缬沙坦通过Akt信号通路抑制宫颈癌Hela细胞增殖、迁移及侵袭的研究
Valsartan Inhibits Proliferation, Migration and Invasion of Cervical Cancer Hela Cells through Akt Signaling Pathway[J]. 临床医学进展, 2021, 11(01): 165-173. https://doi.org/10.12677/ACM.2021.111024
参考文献
- 1. Balasubramaniam, S.D., Balakrishnan, V., Oon, C.E. and Kaur, G. (2019) Key Molecular Events in Cervical Cancer Development. Medicina, 55, 384. https://doi.org/10.3390/medicina55070384
- 2. 申利, 魏军成. miRNA-409-3p表达水平对宫颈癌细胞增殖及顺铂化疗敏感性的影响[J]. 实用肿瘤学杂志, 2019, 33(4): 300-304. http://dx.chinadoi.cn/10.%2011904/j.%20issn.%201002-3070.%202019.%2004.%20003
- 3. Ishikane, S. and Takahashi-Yanaga, F. (2018) The Role of Angiotensin II in Cancer Metastasis: Potential of Renin-Angiotensin System Blockade as a Treatment for Cancer Metastasis. Biochemical Pharmacology, 151, 96-103. https://doi.org/10.1016/j.bcp.2018.03.008
- 4. Abraham, H.M.A., White, C.M. and White, W.B. (2015) The Comparative Efficacy and Safety of the Angiotensin Receptor Blockers in the Management of Hypertension and Other Cardiovascular Diseases. Drug Safety, 38, 33-54. https://doi.org/10.1007/s40264-014-0239-7
- 5. 欧靖华, 杨永秀, 刘梅毅. 血管紧张素抑制剂对宫颈癌HeLa细胞的AT1R, MMP2和MMP9表达的影响[J]. 国际妇产科学杂志, 2011, 38(5): 452-454+464.
- 6. Bossler, F., Hoppe-Seyler, K. and Hoppe-Seyler, F. (2019) PI3K/Akt/mTOR Signaling Regulates the Virus/Host Cell Crosstalk in HPV-Positive Cervical Cancer Cells. International Journal of Molecular Sciences, 20, 2188. https://doi.org/10.3390/ijms20092188
- 7. Mackay, H.J., Wenzel, L. and Mileshkin, L. (2015) Nonsurgical Management of Cervical Cancer: Locally Advanced, Recurrent, and Metastatic Disease, Survivorship, and Beyond. American Society of Clinical Oncology Educational Book, 35, e299-e309. https://doi.org/10.14694/EdBook_AM.2015.35.e299
- 8. Fujita, M., Hayashi, I., Yamashina, S., Itoman, M. and Majima, M. (2002) Blockade of Angiotensin AT1a Receptor Signaling Reduces Tumor Growth, Angiogenesis, and Metastasis. Biochemical and Biophysical Research Communications, 294, 441-447. https://doi.org/10.1016/S0006-291X(02)00496-5
- 9. Neo Jaclyn, H., Malcontenti-Wilson, C., Muralidharan, V. and Christophi, C. (2007) Effect of ACE Inhibitors and Angiotensin II Receptor Antagonists in a Mouse Model of Colorectal Cancer Liver Metastases. Journal of Gastroenterology and Hepatology, 22, 577-584. https://doi.org/10.1111/j.1440-1746.2006.04797.x
- 10. Kikkawa, F., Mizuno, M., Shibata, K., Kajiyama, H., Morita, T., Ino, K., et al. (2004) Activation of Invasiveness of Cervical Carcinoma Cells by Angiotensin II. American Journal of Obstetrics and Gynecology, 190, 1258-1263. https://doi.org/10.1016/j.ajog.2003.12.013
- 11. Woo, Y. and Jung, Y.-J. (2017) Angiotensin II Receptor Blockers Induce Autophagy in Prostate Cancer Cells. Oncology Letters, 13, 3579-3585. https://doi.org/10.3892/ol.2017.5872
- 12. Rodrigues-Ferreira, S., Abdelkarim, M., Dillenburg-Pilla, P., Luissint, A.-C., Di-Tommaso, A., Deshayes, F., et al. (2012) Angiotensin II Facilitates Breast Cancer Cell Migration and Metastasis. PLoS ONE, 7, e35667. https://doi.org/10.1371/journal.pone.0035667
- 13. Zhang, Q.Y., Yu, S., Lam, M.M.T., Poon, T.C.W., Sun, L.T., Jiao, Y.F., et al. (2019) Angiotensin II Promotes Ovarian Cancer Spheroid Formation and Metastasis by Upregulation of Lipid Desaturation and Suppression of Endoplasmic Reticulum Stress. Journal of Experimental & Clinical Cancer Research, 38, Article No. 116. https://doi.org/10.1186/s13046-019-1127-x
- 14. Sugiyama Michael, G., Fairn Gregory, D. and Antonescu Costin, N. (2019) Akt-ing Up Just about Everywhere: Compartment-Specific Akt Activation and Function in Receptor Tyrosine Kinase Signaling. Frontiers in Cell and Developmental Biology, 7, 70. https://doi.org/10.3389/fcell.2019.00070
- 15. Revathidevi, S. and Kannan Munirajan, A. (2019) Akt in Cancer: Mediator and More. Seminars in Cancer Biology, 59, 80-91. https://doi.org/10.1016/j.semcancer.2019.06.002
- 16. Rashmi, R., De Selm, C., Helms, C., Bowcock, A., Rogers, B.E., Rader, J., et al. (2014) Akt Inhibitors Promote Cell Death in Cervical Cancer through Disruption of mTOR Signaling and Glucose Uptake. PLoS ONE, 9, e92948. https://doi.org/10.1371/journal.pone.0092948
- 17. Li, C.M., Zheng, X.J., Li, W., Bai, F.M., Lyu, J.X. and Meng, Q.H. (2018) Serum miR-486-5p as a Diagnostic Marker in Cervical Cancer: With Investigation of Potential Mechanisms. BMC Cancer, 18, Article No. 61. https://doi.org/10.1186/s12885-017-3753-z