Traditional Chinese Medicine
Vol.
12
No.
02
(
2023
), Article ID:
61725
,
9
pages
10.12677/TCM.2023.122073
中医药对重症急性胰腺炎细胞因子影响的 研究进展
覃鹏恩1,陈国忠2*,黄梦遥1,谭琦1,钟丽1,李德文1,谢章瑜1
1广西中医药大学,广西 南宁
2广西中医药大学第一附属医院,广西 南宁
收稿日期:2023年1月23日;录用日期:2023年2月15日;发布日期:2023年2月23日

摘要
重症急性胰腺炎(SAP)是一种起病急、进展快、治疗或手术费用高的常见临床严重消化系统疾病,病情进展中易出现多器官功能衰竭和全身炎症反应综合征,治疗手术难度系数大,预后差,死亡率高。中医药在调节SAP病情进展中相关细胞因子效果显著,且中医疗法具有治疗途径多、成本低、副作用少等突出优点,是治疗重症急性胰腺炎的有效补充疗法。探索中医药对SAP细胞因子靶向治疗方案及中医药临床治疗与调控作用机制,将能为SAP未来的防治带来科学的新思路。
关键词
重症急性胰腺炎,中医药,细胞因子,治疗,综述

Research Progress on the Effect of Traditional Chinese Medicine on Inflammatory Factors of Severe Acute Pancreatitis
Pengen Qin1, Guozhong Chen2*, Mengyao Huang1, Qi Tan1, Li Zhong1, Dewen Li1, Zhangyu Xie1
1Guangxi University of Chinese Medicine, Nanning Guangxi
2The First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning Guangxi
Received: Jan. 23rd, 2023; accepted: Feb. 15th, 2023; published: Feb. 23rd, 2023

ABSTRACT
Severe acute pancreatitis is a common clinical digestive disease with rapid onset, rapid progression and high treatment cost. Systemic inflammatory response syndrome and multiple organ failure are prone to occur in the progression of the disease, with high difficulty of treatment, poor prognosis and high mortality. Chinese medicine has a significant effect on regulating the progression of SAP related cytokines, and Chinese medicine therapy has many therapeutic approaches, low cost, fewer side effects and other advantages, which is an effective complementary therapy for severe acute pancreatitis. Research on the influence of TCM on the course of SAP and the mechanism of action will bring new ideas for the prevention and treatment of SAP in the future.
Keywords:Sever Acute Pancreatitis, Traditional Chinese Medicine, Cytokines, Treatment, Review

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
重症急性胰腺炎(severe acute pancreatitis, SAP)是一种临床常见的腹部消化道疾病,发病机制复杂多样,目前主流学说有“胰腺胰酶自身消化学说”、“胰腺血循环障碍学说”和“肠道细菌易位”等学说,而这些学说均与细胞因子有着直接或间接的关系 [1] ,主流“炎性细胞过度活化学说”认为 [2] [3] 在坏死因子和组织损伤的反复的刺激和诱导下,淋巴细胞和中性粒细胞系统等会释放出大量的炎症因子和内源性介质,导致机体抗炎性和促炎性细胞因子失去在原有组织中的生理稳态,使炎症因子透过病变局部血管壁,进入病灶血液循环,再进入相关组织器官,从而进一步刺激其它炎性细胞释放更多的炎症因子,终而形成炎症瀑布反应,加重胰腺和胰腺外器官的炎症及损伤,最终造成多器官功能障碍综合征。目前,SAP发病机理与细胞因子的关系得到日益重视并逐渐成为领域研究热点 [4] [5] 。研究表明中医药在提升抗炎细胞的水平,抑制炎症细胞过度激活,防止其在组织器官内发展扩散中起着重要作用,这对缓解SAP病情进展,以及缩短SAP病程、预防多种并发症的出现有着积极的意义 [6] 。现将近年来中医药影响细胞因子而防治SAP的研究成果进行综述。
2. 中医对重症急性胰腺炎以及细胞因子的认识
古代典籍记载 [7] ,《灵枢》:厥心痛,痛如以锥针刺其心,心痛甚者,脾心痛也。《灵枢》:厥心痛,腹胀胸满,心万痛甚,胃心痛也,这些描述与现代SAP症状相似。古代中医相关典籍中虽然没有提及细胞因子等概念,但现代研究,如陈国忠教授认为 [8] SAP早期虽病因各异,然主要病因不外乎湿热、气滞、瘀血诸邪杂糅,酿而生毒,内停中焦,造成脾胃升降失常,肠道传导失司,肝胆失于疏泄,酿成邪实阻遏中焦,以致“腑气不通,不通则痛”发而为病。SAP早期病情往往具有急、危、重的特点,“湿热毒瘀”仍为其主要病机。湿热毒瘀等多种病理产物相互作用在导致SAP病情迅速发展中的作用与细胞因子的作用类似 [9] 。中医基础理论里有五脏一体观,认为各个脏腑之间相互联系、相互影响,与全身气血津液功能正常密切相关,当任何一个脏腑出现病变,都会对人体其他脏腑病理损坏,出现各种临床并发症状,加重炎症反应。中医对于SAP的防治过程,主要体现在对湿、热、痰、毒、等各种致病因素的祛除,避免其继续给胰腺及其它重要器官组织造成损伤,防止并发症。
3. 重症急性胰腺炎与炎症细胞因子
随着对SAP炎症反应的深入研究,发现 [3] [10] [11] 大量炎症细胞因子的作用机理与SAP的发生、病情变化以及愈后密切相关。当机体炎症爆发时,一方面促炎细胞过度活化,导致炎症因子大量释放,炎症介质失控。另一方面机体抗炎系统被启动,释放抗炎因子与促炎因子抗衡。但在SAP情况下,促炎因子和抗炎因子在体内的稳态平衡被打破,炎症反应失控,这些都是造成SAP发生进展和病情加重的病因。在SAP的发生过程中,由于胰腺组织水肿炎症渗出刺激周围组织,进而压迫胆道致胆汁反流、胰液分泌亢进,胰腺内压增高,胰腺腺泡细胞破裂,释放出胞内的酶原激活物,激活胰腺内的胰蛋白酶原,损伤胰腺,引起胰腺的局部炎症反应,若病情控制不及时,导致多种蛋白酶原分泌的胰腺腺泡细胞从胰腺漏出,进入细胞间质,细胞继续产生酶原并在碱性环境中激活,被吸收进入血液循环,进入各个脏器组织中进行消化损伤,造成组织坏死,不断恶化,进一步加重病情进展 [12] [13] 。
4. 中医药治疗AP
从古代到近现代,中医药历经千年,历史悠久,治疗效果经受住了时间的考验,现代中医药的药用价值更值得我们深入的探讨研究和临床应用。在SAP发病进展过程中,炎症因子在病情进展恶化中影响重大,阻断炎症因子信号转导各个通路可能是临床治疗SAP的潜在途径,与单一靶点治疗的西药相比,联合中医药是治疗SAP非常有前景的选择疗法。许多 [14] [15] [16] 中药复方和单味中药有效成分如大黄素、柴胡皂苷、黄芩苷、丹参酮、栀子苷、厚朴酚等能有效抑制SAP病情进程中炎症因子的释放,而且几乎没有副作用,可以有效减少炎症反应综合征,缩短病人住院治疗时间,减少治疗费用,我国传统中医药参与SAP的治疗适应现代医疗现状,中医药的抗炎药理研究逐渐成为世界新药研究的热点。
5. 降低促炎因子释放,缓解全身炎症反应
5.1. 半胱天冬酶(Caspase-1)
Caspase-1是一种特异蛋白酶,有研究发现 [17] ,在SAP进程中caspase-1可活化白介素-1β (IL-1β)和白介素-18 (IL-18),使IL-6、TNF-α等炎症因子进一步激活及释放,使炎症反应在全身多脏器中呈现级联放大的效应,对肠黏膜屏障造成继发性损害,加重由此引发的肠内细菌和内毒素易位入血(见图)。研究表明 [18] [19] [20] SAP病程早期存在胰腺及肠道黏膜炎症细胞过度活化,由此产生大量的炎症细胞因子如IL-6、TNF-α等,介导肠道黏膜的过度炎症反应,进而损伤肠道黏膜屏障的完整性,而caspase-1就是作为激活促炎因子IL-1β和IL-18的特异性蛋白酶存在的,故caspase-1在SAP炎症进展和引发一系列其他组织器官损伤的过程中起着非常重要的作用。黄立强 [21] 等研究证明中药组的大鼠死亡率明显降低,血清中TNF-α、IL-1β、IL-6和IL-18的含量与对照组相比也明显下降说明中医药可以通过抑制SAP相关靶点通路,减轻动物胰腺组织和胃肠道的炎症反应而缓解SAP症状。在讨论caspase-1的作用机制时,不得不说与它关系密切的蛋白消皮素D (GSDMD),GSDMD主要表达在肠上皮细胞 [22] ,炎症小体(炎性小体是蛋白质复合体能识别各种诱导的刺激信号,如PAMPs、DAMPs以及能控制促炎性细胞因子如IL-1β及IL-18的产生 [23] )的激活可将GSDMD (53 kDa)分为一个n端片段(31 kDa)和一个c端片段(22 kDa)。n端片段可以在细胞膜上穿孔 [24] ,促进IL-1β和IL-18的分泌。有研究表明 [25] 在SAP模型中,下调GSDMD蛋白的表达,血清IL-1β和IL-18水平降低,提示GSDMD蛋白可能与SAP引起的全身炎症反应有关,而全身炎症表达会进一步损伤组织器官。据研究发现 [26] [27] caspase-1可导致GSDMD分解形成的GSDMD氨基末端(Gsdermin D-NT)转移到细胞膜上形成有活性孔隙,使水分子等物质进入细胞内而引起细胞肿胀、裂解及死亡。GSDMD及caspase-1可表达于肠黏膜上皮细胞,其激活在SAP发病过程中可以介导炎症因子释放,下调肠上皮细胞紧密连接蛋白ZO-1及封闭蛋白(Occludin)的表达,导致炎症反应剧烈,肠道黏膜损伤 [25] [27] 。大黄作为一味经典的泻下药,有多种天然活性成分和广泛的药理作用,在临床被普遍使用。现代医学发现大黄具有抗炎、抗菌、保肝利胆等作用,其“通下”、消炎和改善血液循环的功能更是在SAP治疗中作用重大 [28] 。宁建文 [29] 通过大鼠造模SAP实验证明大黄素可以通过抑制caspase-1表达,减少通道下游的IL-1β及IL-18等炎症细胞因子的产生和释放,减轻全身多脏器的炎症反应程度,从而起到治疗SAP的作用。这表明中医药可以通过抑制caspase-1/GSDMD信号通路,降低其活性表达,减轻相关炎性细胞因子释放,便可以抑制SAP及其并发症带来的炎症反应,也可减轻全身器官组织的损伤。
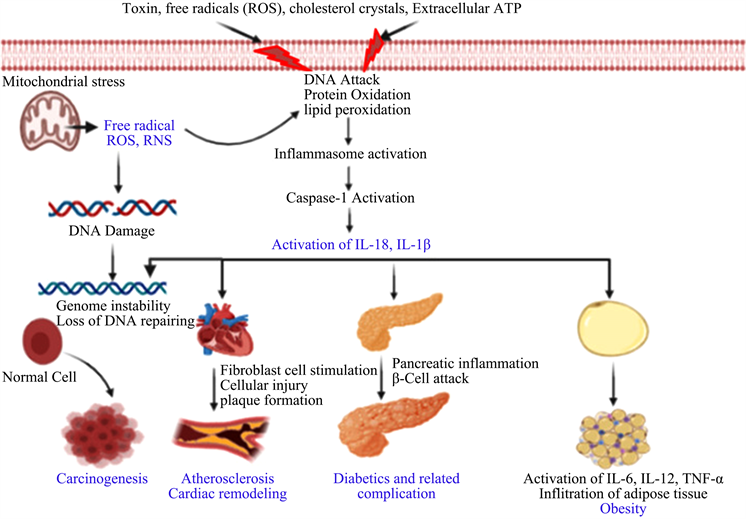
Caspase-1活化造成SAP相关炎性损伤过程 [30]
5.2. TNF-α
在SAP进展过程中,TNF-α是病变的主要的炎症因子,具有基本的调节生物学功能,如细胞分化,增殖,存活,凋亡,以及对应激和损伤的广泛应用。其在SAP发展过程中起着十分重要的作用,能介导胰腺局部及全身炎症反应,促进多种炎性因子产生,进而导致全身炎症反应综合征和多器官功能障碍综合征,是评价SAP病情及预后及转归的重要标志 [31] [32] 。清胰汤是临床上常用的治疗SAP的中药复方。清胰汤的活性成分具有重要的生物学功能,比如抗炎活性,清除氧自由基,促近微循环等 [33] 。SAP患者对清胰汤表现出良好的耐受能力,清胰汤能促近排便,血液循环,消除淤血,减轻炎症反应,直接综合内毒素,保护肠道屏障等 [34] 。这说明与其他常规疗法相比,清胰汤有更广泛的药理作用,更少的不良反应,表现出良好的疾病预后价值,值得临床推广。大承气汤出自张仲景《伤寒论》,广大临床工作者已经认同其治疗SAP的疗效。研究证明 [35] [36] 大承气汤可以促进肠蠕动、减轻肠麻痹、抑制细胞因子活性、防止肠道细菌及毒素移位,显著降低血清中IL-6的水平。这说明大承气汤通过降低炎症细胞表达水平有效抑制SAP病情进展中出现的组织器官炎症反应。以上研究都为中医药临床治疗SAP、防治并发症、改善预后带来了希望。
5.3. IL-6
IL-6是一种组织损伤时出现的在机体免疫反应和炎症反应中都占有重要位置的多效性的炎症细胞因子。在正常生理情况下,IL-6可以调节人体的免疫应答,但在病理状态下,人体内的IL-6增加过甚,引起病理损伤。通常1L-6在SAP早期阶段作用明显,它能通过刺激患者血管内皮细胞收缩,增加血管通透性,大分子物质进入组织间液,并在其它细胞因子的介导下加速白细胞集聚、附壁和游出血管,使血管内皮细胞过度激活,组织因子表达并激活外源性凝血系统,造成循环血栓形成及组织损伤 [37] 。此外,除了导致胰腺持续性坏死,加剧病情,促使TNF-α含量增加,IL-6还可以诱导急性期蛋白合成,催化并放大炎性反应,形成恶性循环 [38] 。IL-6还可提示体内炎症反应状态以及损伤程度,其血清水平能作为评估SAP病情严重度、评价治疗及判断预后转归的重要指标 [39] 。朱晶晶医师 [40] 在临床SAP常规治疗基础上增加中药保留灌肠配合单味中药芒硝外敷,以一周为观察期,与单纯使用常规西医治疗相比,联合中药外治明显降低了患者体内TNF-α、IL-6的水平。黄福霞等 [41] 对临床70例住院AP患者进行治疗研究,发现大承气汤高位灌肠能更好的提高AP治疗总体效率,改善AP病人的肠粘膜屏障功能,减轻病人的炎性反应。这表明中医联合西医治疗在改善临床症状、缩短病程等方面优于单纯西药治疗。
5.4. IL-8
趋化因子是一组招募和激活炎症细胞的小分子量细胞因子。IL-8是最早描述的趋化因子之一 [42] 。根据趋化因子在一级结构保守位置的四个半胱氨酸残基的前半胱氨酸距离,以及两个氨基末端半胱氨酸残基是相邻还是相隔,可以将趋化因子分为四个亚家族,分别是CXC、CC、C和CX3C。IL-8主要属于CXC亚型 [43] 。既往研究表明,IL-8作为中性粒细胞的趋化因子参与机体的炎症反应 [44] ,IL-8在SAP早期增加明显,其血清浓度与疾病炎症反应和严重程度存在相关性 [45] 。嵇天一研究证实 [46] 清胰颗粒可以通过抑制IL-8的趋化活性减轻中性粒细胞在肺组织中集会,不仅减轻胰腺组织炎症反应,还可缓解SAP并发的肺损伤,在SAP并发肺损伤的防治上具有明显优势。李波等 [47] 在临床用清胰汤予SAP患者口服,在患者发病48 h和第10天采集患者外周静脉血进行检测,结果表明清胰汤可以明显降低患者血清中IL-6、IL-8等促炎因子的水平,还可以激活恢复肠道功能,减少细菌易位以及促进患者凝血功能恢复。这充分体现了中医药抑制炎症因子水平,保护胰腺、肠道等组织器官的作用。
5.5. IL-18
IL-18作为一种独特的细胞因子,参与了各种T细胞群的活化和分化,还是初始T细胞分化产生IL-13和IL-4的Th2细胞的诱导剂 [48] 。上述说过IL-18前体主要由caspase-1活化,caspase-1可以被各种典型的炎症小体激活,IL-18经过caspase-1活化后变得成熟,而成熟形式的IL-18可以通过其受体的连接参与激活NF-κB和JNK/p38 MAPK相关通路 [49] ,因此不难看出IL-18参与了炎症反应的发生发展。研究表明重症急性胰腺炎住院患者的血清IL-18水平升高,10天观察期间IL-18浓度与SAP严重程度成正比 [50] 。王魁彬等通过检测住院SAP患者肠黏膜组织及血清中IL-18的表达情况,发现患者肠黏膜屏障功能破坏严重时,IL-18表达升高。这些研究都说明IL-18的存在及其与SAP疾病严重程度相关,这种细胞因子值得考虑作为潜在的治疗靶点用于指导临床治疗。李劼 [51] 等对SAP住院患者采用大承气汤治疗,第3天和第7天血清中IL-18水平分别下降了二分之一和三分之二,抑制炎性因子效果显著。这说明中医药可以通过相关通路减轻IL-18释放,减缓SAP病情发展,降低全身性炎症反应的风险。
6. 提高抗炎因子释放,保护胰腺组织器官
IL-10在SAP疾病进展中,机体除了释放促炎因子,同时也会释放抗炎细胞因子,促、抗炎细胞之间保持着动态平衡,病理状态则打破了这种平衡 [52] ,机体炎症反应加剧,组织器官损伤,所以调整两类细胞因子在病理状态的平衡对治疗SAP具有重大意义。TNF-α、IL-6、IL-8等属于促炎细胞类型,IL-10则是机体的抗炎与免疫性抑制细胞,来源于TH2淋巴细胞,是人体内诸多抗炎细胞因子中最重要的多功能调节因子,可降低炎症细胞因子TNF-α、IL-6、IL-8和巨噬细胞的表达,同时抗炎减少氧自由基的释放降低对胰腺组织的损害 [53] ,在阻止胰腺组织持续坏死,SAP的早期诊断、治疗及预防中均起到了关键的作用。研究表明 [54] 清胰汤通过上调大鼠体内IL-10水平的表达,达到缓解大鼠急性坏死性胰腺炎炎症反应及肠道通透性的效果。尚丽 [55] 等在SAP常规治疗基础上增加加减大陷胸汤保留灌肠作为治疗组,在入院当天,和第3、7天清晨抽血检查患者体内TNF-α、IL-6和IL-10的含量变化情况,经过对比后,发现对加减大陷胸汤保留灌肠AP患者的疗效显著,能够有效降低促炎因子水平同时促进抗炎因子水平提高。这表明血清IL-10浓度能够反映AP的严重程度,SAP患者血清IL-10浓度降低提示免疫系统应答反应减弱,增强IL-10的释放是AP早期治疗的一种方法,而结合中医药治疗可更有效增加IL-10的释放而达到治疗SAP的目的。
7. 总结与展望
SAP是临床易发生的急腹症,在病情进展过程中,患者往往因继发感染和脏器功能衰竭而死亡。在治疗SAP方面,除了采取肠内营养支持,抗生素应用以及脏器维护等常规西医疗法外,还可积极采用中医药作为辅助疗法。中医药可以通过内服、外敷、灌肠等多种途径降低血管通透性、抑制炎症因子释放,保护肠粘膜屏障功能、改善早期AP患者炎症病理状态,恢复胃肠道功能,防治肠道细菌移位,减少并发症,促进病情恢复。上文所述的许多研究已经证明中医药可以通过抑制炎症因子水平或提高促炎因子释放而改善SAP的临床症状和预后。但中医药因人而异用药使得中药配方药量不定,且多数中药配方复杂,含多种生物活性成分,部分中药成分的不确定以及无法大规模统一规范用药都是中医药国际化的障碍。但我们可以相信,随着对中医药作用机制以及其成分的进一步研究,中医药干预细胞因子的治疗SAP一定会得到更多研究证明,为中医药治疗SAP提供现代化依据。
基金项目
国家自然科学地区基金项目(82160890)、广西自然科学基金面上项目(81560789)。
文章引用
覃鹏恩,陈国忠,黄梦遥,谭 琦,钟 丽,李德文,谢章瑜. 中医药对重症急性胰腺炎细胞因子影响的研究进展
Research Progress on the Effect of Traditional Chinese Medicine on Inflammatory Factors of Severe Acute Pancreatitis[J]. 中医学, 2023, 12(02): 481-489. https://doi.org/10.12677/TCM.2023.122073
参考文献
- 1. Lee, P.J. and Papachristou, G.I. (2019) New Insights into Acute Pancreatitis. Nature Reviews Gastroenterology & Hepatology, 16, 479-496. https://doi.org/10.1038/s41575-019-0158-2
- 2. Gao, L., Dong, X., Gong, W., Huang, W., et al. (2021) Acinar Cell NLRP3 Inflammasome and Gasdermin D (GSDMD) Activation Mediates Pyroptosis and Systemic Inflammation in Acute Pancreatitis. British Journal of Pharmacology, 178, 3533-3552. https://doi.org/10.1111/bph.15499
- 3. Boxhoorn, L., Voermans, R.P., Bouwense, S.A., Bruno, M.J., et al. (2020) Acute Pancreatitis. The Lancet, 396, 726-734. https://doi.org/10.1016/S0140-6736(20)31310-6
- 4. Wang, X.D., Yu, W.L. and Sun, Y. (2021) Activation of AMPK Restored Impaired Autophagy and Inhibited Inflammation Reaction by Up-Regulating SIRT1 in Acute Pancreatitis. Life Sciences, 277, 119435. https://doi.org/10.1016/j.lfs.2021.119435
- 5. Bansod, S., Chilvery, S., Saifi, M.A., et al. (2021) Borneol Protects against Cerulein-Induced Oxidative Stress and Inflammation in Acute Pancreatitis Mice Model. Environmental Toxicology, 36, 530-539. https://doi.org/10.1002/tox.23058
- 6. 汤国军, 童骎, 胡丛岗, 吴俊, 姚叶峰. 急性胰腺炎患者腹腔感染血清炎症因子与Ghrelin及影响因素分析[J]. 中华医院感染学志, 2019, 29(4): 586-588+593.
- 7. 崔乃强. 中西医结合治疗胰腺炎临床与基础研究[M]. 武汉: 华中科技大学出版社, 2009: 91.
- 8. 吴瑕, 彭飞燕, 张天彬, 陈国忠. 清解化攻法浅析[J]. 辽宁中医杂志, 2020, 47(6): 43-45.
- 9. 宋杰, 银艳桃, 雷力民, 林寿宁, 王建超, 廖健思. 中医药从“瘀”论治急性胰腺炎微循环障碍研究进展[J]. 辽宁中医药大学学报, 2020, 22(8): 62-66.
- 10. Ou, X., Hua, Y., Liao, X., et al. (2018) Cognitive Impairments Induced by Severe Acute Pancreatitis Are Attenuated by Berberine Treatment in Rats. Molecular Medicine Reports, 18, 3437-3444. https://doi.org/10.3892/mmr.2018.9313
- 11. Du, D., Hu, L., Wu, J., et al. (2017) Neuroinflammation Contributes to Autophagyflux Blockage in the Neurons of Rostral Ventrolateral Medulla in Stress-Induced Hypertension Rats. Journal of Neuroinflammation, 14, 169. https://doi.org/10.1186/s12974-017-0942-2
- 12. 曹东升. 甘遂对重症急性胰腺炎患者炎症细胞因子影响的研究[D]: [硕士学位论文]. 广州: 广州中医药大学, 2014.
- 13. 赵祥. 甘遂对重症急性胰腺炎炎症“瀑布效应”相关因子影响的研究[D]: [硕士学位论文]. 广州: 广州中医药大学, 2016.
- 14. 项红, 胡凤林, 陶旭锋, 齐心, 张金楠, 尚东. 茵陈蒿汤调控lncRNA PVT1/miRNA-30a-5p信号通路对重症急性胰腺炎大鼠模型的保护作用[J]. 临床肝胆病杂志, 2021, 37(1): 147-152.
- 15. 张洁慧, 肖铁刚, 阙任烨, 赵思宇, 傅志泉. 大承气汤治疗胃肠功能障碍的临床及作用机制研究进展[J]. 中国中西医结合消化杂志, 2019, 27(1): 72-76.
- 16. 付娟, 陆俊, 宋倩, 姜朝丽, 李志. 柴黄清胰活血颗粒对重症急性胰腺炎患者血清炎症因子的影响及机制研究[J]. 西南军医, 2021, 23(3): 215-218.
- 17. Liu, Y., Chen, X.D., Yu, J., et al. (2017) Deletion of XIAP Reduces the Severity of Acute Pancreatitis via Regulation of Cell Death and Nuclear Factor-κB Activity. Cell Death & Disease, 8, e2685. https://doi.org/10.1038/cddis.2017.70
- 18. Wang, B., Zhao, K.L., Hu, W.J., et al. (2019) Macrophage Migration Inhibitor Promoted the Intrahepatic Bile Duct Injury in Rats with Severe Acute Pancreatitis. Digestive Diseases and Sciences, 64, 759-772. https://doi.org/10.1007/s10620-018-5379-7
- 19. Song, G., Ma, Z., Liu, D., et al. (2019) Bone Marrow-Derived Mesenchymal Stem Cells Ameliorate Severe Acute Pancreatitis by Inhibiting Necroptosis in Rats. Molecular and Cellular Biochemistry, 459, 7-19. https://doi.org/10.1007/s11010-019-03546-3
- 20. Zhao, X., Jin, B., Yang, B., et al. (2017) Gadolinium Chloride Ameliorates Acute Lung Injury Associated with Severe Acute Pancreatitis in Rats by Regulating CYLD/NF-κB Signaling. Biochemical and Biophysical Research Communications, 492, 255-261. https://doi.org/10.1016/j.bbrc.2017.08.061
- 21. 黄力强, 曾悦, 庄倩, 罗静雅, 王璐璐, 范玲, 熊玉霞. 大黄游离蒽醌抑制NLRP3/Caspase-1通路改善大鼠重症急性胰腺炎肝损伤的研究[J]. 中药药理与临床, 2021, 37(5): 54-59.
- 22. Zhang, X.H., Li, M.L., Wang, B., et al. (2014) Caspase-1 Inhibition Alleviates Acute Renal Injury in Rats with Severe Acute Pancreatitis. World Journal of Gastroenterology, 20, 10457-10463. https://doi.org/10.3748/wjg.v20.i30.10457
- 23. Strowig, T., Henao-Mejia, J., Elinav, E. and Flavell, R. (2012) Inflammasomes in Health and Disease. Nature, 481, 278-286. https://doi.org/10.1038/nature10759
- 24. Ding, J., Wang, K., Liu, W., et al. (2016) Erratum: Pore-Forming Activity and Structural Autoinhibition of the Gasdermin Family. Nature, 540, 150. https://doi.org/10.1038/nature20106
- 25. Lin, T., Song, J., Pan, X., et al. (2021) Downregulating Gasdermin D Reduces Severe Acute Pancreatitis Associated with Pyroptosis. Medical Science Monitor, 27, e927968. https://doi.org/10.12659/MSM.927968
- 26. Lin, T., Pan, X., Wan, Y., et al. (2021) Mechanism of Gasdermin D on Intestinal Injury in Severe Acute Pancreatitis by Mediating Pyroptosis. Chinese Critical Care Medicine, 33, 89-94.
- 27. Wan, J., Chen, J., Wu, D., et al. (2018) Regulation of Autophagy Affects the Prognosis of Mice with Severe Acute Pancreatitis. Digestive Diseases and Sciences, 63, 2639-2650. https://doi.org/10.1007/s10620-018-5053-0
- 28. Yang, G.H. (2018) Early Chinese Medicine Intervention and Mechanism of Acute Pancreatitis. Journal of Clinical Hepatology, 34, 710-715.
- 29. 宁建文. Caspase-1信号通路在重症急性胰腺炎肠黏膜屏障损伤保护中作用和分子机制研究[D]: [硕士学位论文]. 杭州: 浙江大学, 2019.
- 30. Molla, M.D., Akalu, Y., Geto, Z., et al. (2020) Role of Caspase-1 in the Pathogenesis of Inflammato-ry-Associated Chronic Noncommunicable Diseases. Journal of Inflammation Research, 13, 749-764. https://doi.org/10.2147/JIR.S277457
- 31. 戴奇成, 姚常柏, 陈文娜. 丹参注射液对急性胰腺炎大鼠血清肿瘤坏死因子α变化的研究[J]. 辽宁中医药大学学报, 2016, 18(6): 29-31.
- 32. 钟宏, 史勇, 李观强. TNF-α和IL-6在重症急性胰腺炎患者血清中的变化及临床意义[J]. 中国医药导报, 2012, 9(19): 157-158.
- 33. Liu, G., Zhang, J., Chen, H., et al. (2014) Effects and Mechanisms of Alveolar Type II Epithelial Cell Apoptosis in Severe Pancreatitis-Induced Acute Lung Injury. Experimental and Therapeutic Medicine, 7, 565-572. https://doi.org/10.3892/etm.2013.1453
- 34. Zhang, J.-W., Zhang, G.-X., Chen, H.-L., et al. (2015) Therapeutic Effect of Qingyi Decoction in Severe Acute Pancreatitis-Induced Intestinal Barrier Injury. World Journal of Gastroenterology, 21, 3537-3546. https://doi.org/10.3748/wjg.v21.i12.3537
- 35. Jin, W. and Shen, Y. (2019) Da-Cheng-Qi Decoction Alleviates Intestinal Injury in Rats with Severe Acute Pancreatitis by Inhibiting the JAK2-STAT3 Signaling Pathway. Evi-dence-Based Complementary and Alternative Medicine, 2019, Article ID: 3909468. https://doi.org/10.1155/2019/3909468
- 36. Pan, L.-Y., Chen, Y.-F., Li, H.-C., et al. (2017) Dachengqi Decoction Attenuates Intestinal Vascular Endothelial Injury in Severe Acute Pancreatitis in Vitro and in Vivo. Cellular Physiology and Biochemistry, 44, 2395-2406. https://doi.org/10.1159/000486155
- 37. 丁黎莉. 白介素-37通过髓源性抑制细胞影响急性胰腺炎炎症反应的机制研究[D]: [硕士学位论文]. 长春: 吉林大学, 2021.
- 38. Rao, S.P. and Kunte, A. (2017) Interleukin-6: An Early Predictive Marker for Severity of Acute Pancreatitis. Indian Journal of Critical Care Medicine, 21, 424-428. https://doi.org/10.4103/ijccm.IJCCM_478_16
- 39. 鲁蕾, 殷海波. 生大黄保留灌肠对急性胰腺炎患者IL-6、hs-CRP及血清内毒素的影响[J]. 中国中医基础医学杂志, 2017, 23(3): 408-410.
- 40. 朱晶晶. 中药保留灌肠联合芒硝外敷辅助治疗重症急性胰腺炎的疗效观察及对TNF-α、IL-6的影响[J]. 中国中医药科技, 2022, 29(2): 242-243+349.
- 41. 黄福霞, 韩晓玲, 蔡晖. 大承气汤高位灌肠改善急性胰腺炎肠黏膜屏障和炎症反应的临床研究[J]. 护理研究, 2019, 33(6): 1072-1074.
- 42. Granger, J. and Remick, D. (2005) Acute Pancreatitis: Models, Markers, and Mediators. Shock, 24, 45-51. https://doi.org/10.1097/01.shk.0000191413.94461.b0
- 43. Chen, W.C. and Nie, J.S. (2008) Genetic Polymorphism of MCP-1-2518, IL-8-251 and Susceptibility to Acute Pancreatitis: A Pilot Study in Population of Suzhou, China. World Journal of Gastroenterology, 14, 5744-5748. https://doi.org/10.3748/wjg.14.5744
- 44. 雷云洁, 杨晋辉. IL-8与自身免疫性肝病的关系[J]. 临床肝胆病杂志, 2019, 35(2): 411-413.
- 45. Weitz, G., Woitalla, J., Wellhöner, P., et al. (2015) Does Etiology of Acute Pancreatitis Matter? A Review of 391 Consecutive Episodes. JOP, 16, 171-175.
- 46. 嵇天一. IL-8在重症急性胰腺炎肺损伤发病机制中的作用及清胰颗粒干预的实验研究[D]: [硕士学位论文]. 大连: 大连医科大学, 2018.
- 47. 李波, 陈国兵, 葛利. 中药清胰汤对于急性坏死性胰腺炎血清白细胞介素-6和8及凝血功能的影响[J]. 中华中医药学刊, 2018, 36(4): 887-889.
- 48. Yoshimoto, T., Mizutani, H., Tsutsui, H., et al. (2000) IL-18 Induction of IgE: Dependence on CD4+ T Cells, IL-4 and STAT6. Nature Immunology, 1, 132-137. https://doi.org/10.1038/77811
- 49. Li, Z., Yu, X., Werner, J., et al. (2019) The Role of Interleukin-18 in Pancreatitis and Pancreatic Cancer. Cytokine and Growth Factor Reviews, 50, 1-12. https://doi.org/10.1016/j.cytogfr.2019.11.001
- 50. 莫艳波, 王静, 李新. 急性胰腺炎患者检测血清IL-18、TNF-α、IL-10的临床意义[J]. 河北联合大学学报(医学版), 2013, 15(1): 12-13. https://doi.org/10.19539/j.cnki.2095-2694.2013.01.007
- 51. 李劼, 陈亚峰, 奉典旭. 大承气汤对胰腺白介素18表达的影响[J]. 时珍国医国药, 2020, 31(11): 2681-2684.
- 52. Tian, F., Lin, T., Zhu, Q., et al. (2022) Correlation between Severity of Illness and Levels of Free Triiodothyronine, Interleukin-6, and Interleukin-10 in Patients with Acute Pancreatitis. Medical Science Monitor, 28, e933230. https://doi.org/10.12659/MSM.933230
- 53. 解松龄, 蒋正, 赵涛, 等. 辅助性T细胞17及其细胞因子在急性胰腺炎患者诊治中的作用[J]. 中华肝胆外科杂志, 2020, 26(2): 134-138.
- 54. 杨兴华. 清胰汤对大鼠急性坏死性胰腺炎IL-6, IL-10及肠道通透性影响[D]: [硕士学位论文]. 青岛: 青岛大学, 2011.
- 55. 尚丽, 李秀丽, 马少未, 梁晓敏, 王芬. 加减大陷胸汤保留灌肠对急性胰腺炎患者血清肿瘤坏死因子-α与白介素-6及白介素-10水平影响研究[J]. 四川中医, 2017, 35(9): 44-47.
NOTES
*通讯作者。