Advances in Clinical Medicine
Vol.
13
No.
03
(
2023
), Article ID:
63055
,
7
pages
10.12677/ACM.2023.133650
人参皂苷Rg3负载PCL-PEG纳米系统在卵巢癌中的优化研究
杨瑾,邹丹,梁蕾,武艳玲,张焕灵,黄树峰*
深圳市前海蛇口自贸区医院,南山区重点学科,广东 深圳
收稿日期:2023年2月21日;录用日期:2023年3月17日;发布日期:2023年3月24日

摘要
目的:为了提高人参皂苷Rg3的有效性和靶向性,研究人参皂苷Rg3脂质体、纳米粒及微乳的制备及其在小鼠体内组织分布的差异,比较各类纳米制剂的靶向特异性。方法:采用薄膜超声分散法、纳米沉淀法、微乳法分别制备人参皂苷Rg3脂质体及人参皂苷Rg3PLGA纳米粒,人参皂苷Rg3微乳粒,通过比较三种方案效果,制定优化方案。结果:1) 磷脂、胆固醇、人参皂苷Rg3制备的脂质体平均粒径为111.8 nm,Zeta电位为−38.67 mV,。2) PLGA浓度为10 mg∙mL−1,人参皂苷Rg3浓度为3 mg∙mL−1,有机相与水相体积比为1:3。制备的纳米粒平均粒径为186.1 nm,Zeta电位为−29.56 mV。3) 油酸乙酯、EL35、PEG400与水的最佳质量比为8.25:12:4.75:75,平均粒径为60.50 nm,Zeta电位为−15.63 mV。结论:三种人参皂苷Rg3纳米制剂的工艺方法均简便、稳定可行。微乳法分别制备人参皂苷Rg3脂质体分层结构最明显。
关键词
人参皂苷Rg3,脂质体,纳米粒,微乳

Improvements on Ginsenoside Rg3 Nanopreparations Delivery Systems in Ovarian Cancer
Jin Yang, Dan Zou, Lei Liang, Yanling Wu, Huanling Zhang, Shufeng Huang*
Shenzhen Qianhai Shekou Free Trade Zone Hospital, Key Discipline in Nanshan District, Shenzhen Guangdong
Received: Feb. 21st, 2023; accepted: Mar. 17th, 2023; published: Mar. 24th, 2023

ABSTRACT
Objective: To improve the effectiveness and targeting of ginsenoside Rg3, to study the preparation and distribution of ginsenoside Rg3 liposomes, nanoparticles and microemulsion in mice, and to compare the targeting specificity of various nano preparations. Methods: Ginsenoside Rg3 liposomes, ginsenoside Rg3 PLGA nanoparticles and ginsenoside Rg3 microemulsion granules were prepared by ultrasonic film dispersion method, nano precipitation method and microemulsion method respectively. The optimization scheme was developed by comparing the effect of the three schemes. Results: 1) Using chloroform-ethanol (1:1) as solvent, the mass ratio of phospholipid, cholesterol and ginsenoside Rg3 was 4:2:1, the average particle size of the liposome was 111.8 nm, the Zeta potential was −38.67 mV, and the encapsulation rate was 87.85%. 2) PLGA conase tcentration was 10 mg∙mL−1, human ginseng saponin Rg3 concentration was 3 mg∙mL−1, organic pho water phase volume ratio was 1:3. The average particle size of the prepared nanoparticles was 186.1 nm, the Zeta potential was −29.56 mV, and the encapsulation rate was 87.29%. 3) The optimum mass ratio of ethyl oleate, EL35, PEG400 to water was 8.25:12:4.75:75, the average particle size was 60.50 nm, and the Zeta potential was −15.63 mV. There was no stratification after centrifugation at 4000 r∙min−1 for 10 min. Conclusion: The three kinds of ginsenoside Rg3 nanopreparations are simple, stable and feasible. The stratification structure of ginsenoside Rg3 liposomes prepared by microemulsion method is the most obvious.
Keywords:Ginsenoside Rg3, Liposome, Nanoparticles, Microemulsion

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
人参是我国传统中草药,其药用价值早以为世界所公认,而人参皂苷是人参最重要的活性成分 [1]。人参皂苷Rg3是一种原人参二醇型人参皂苷,分为20(S)-Rg3(Rg3S)和20(R)-Rg3(Rg3R) 2种差向异构体(图1),是人参的药理和生理天然活性成分之一,已被证明具有抗肿瘤、提高免疫力、抑制癌细胞的增殖、浸润和转移以及促进癌细胞凋亡等作用,其对肺癌、乳腺癌、胃癌、肝癌、卵巢癌、黑色素瘤等多种肿瘤均表现出低毒、高效的作用。特别是人参皂苷Rg3R比Rg3S具有更强的抗氧化作用和更多的佐剂活性,人参皂苷Rg3R已显示出抗黑色素瘤、肝癌和肺癌的作用 [2]。上皮间质转化(Epithelial-Mesenchymal transition, EMT)是指上皮细胞在特定的生理和病理情况下向间充质细胞转分化的现象 [3]。生理性EMT是组织修复所需的自我调节能力,与胚胎发育、组织再生、器官形成和伤口愈合有关。在不受控制的情况下形成的病理性EMT则失去了自我调节的能力,可导致纤维化、正常器官功能丧失以及上皮细胞肿瘤恶性进展 [4],被认为是肿瘤和器官纤维化等疾病治疗的重要靶点。目前 [5],人参皂苷Rg3单体制剂参一胶囊已在临床上广泛应用于多种恶性肿瘤的辅助治疗。
据报道,人参皂苷Rg3R在体外和体内均能有效阻断低氧诱导的卵巢癌细胞EMT,其通过激活泛素–蛋白酶体途径促进HIF-1α降解来降低其表达。在缺氧条件下,HIF-1α的减少又会导致通过Snail的转录抑制E-cadherin的上调及波形蛋白的下调。同时成束蛋白(Fascin-1, FSCN1)在卵巢癌细胞中通过与Snail1进行生理相互作用可促进卵巢癌细胞EMT [6],FSCN1是抑制卵巢癌细胞侵袭和转移的有吸引力的新型靶标。而在Li等 [7] [8] 研究发现人参皂苷Rg3R通过下调甲基转移酶DNMT3A来减弱miRNA-145中启动子区域的高甲基化,从而提高miRNA-145表达,抑制人卵巢癌细胞EMT的靶标FSCN1,使其和Snail生理结合含量变低,抑制EMT,从而抑制卵巢癌细胞的迁移和侵袭(图2)。以上实验结果表明,人参皂苷Rg3R作为一种高效、低毒、多靶点的天然药物,在体内对缺氧诱导的EMT和肿瘤生长具有显著的活性,能有效抑制卵巢癌细胞的增殖和迁移,强调了其作为广谱抗癌药物分子的治疗潜力,有望成为抗卵巢癌的新型天然药物。

Figure 1. Structural formula of ginsenoside
图1. 人参皂苷的结构式
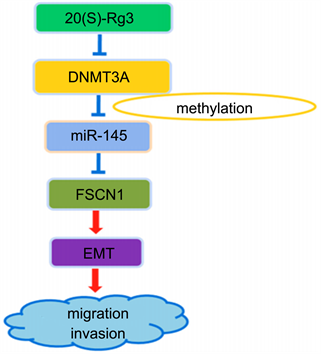
Figure 2. Antitumor mechanism of ginsenosides
图2. 人参皂苷的抗肿瘤作用机制
现如今被动靶向制剂是一类主要的、研究较多的靶向制剂,其中工艺较成熟、易实现纳米级的是脂质体、纳米粒、微乳等微粒给药系统,但对于这几种纳米给药系统的靶向性差异的报道较少。本研究探索了稳定性更好,药效更佳的人参皂苷Rg3制剂,对临床治疗有重要意义,也为后续导入卵巢癌的研究提供了稳定高效的药物模式,奠定了深入研究的基础。
2. 材料与方法
2.1. 仪器与材料
2.1.1. 仪器
LC-10A高效液相色谱仪(日本岛津公司);Diamonsil C18色谱柱(250 mm × 4.6 mm,5 μm);RE-2000B旋转蒸发仪(上海亚荣生化仪器厂);SK3300LH超声波清洗器(上海科导超声波仪器有限公司);TGL-16B台式高速离心机(上海安亭科学仪器厂);JEM100CXII透射电镜(日本电子公司);DelsaTMNancC激光粒度分析仪(美国贝克曼库尔特有限公司)。
JEM100CXII透射电镜(日本电子公司);DelsaTMNancC激光粒度分析仪(美国贝克曼库尔特有限公司);HJ-3恒温磁力搅拌器(金坛市新航仪器厂),乌氏黏度仪,上海亚太有限公司;pHS-25型pH计,上海精科雷磁有限公司。
2.1.2. 材料
卵磷脂(上海蓝季科技发展有限公司,批号:090109);胆固醇(上海润捷化学试剂有限公司,批号:20090203);20 (R)-人参皂苷Rg3原料药(南京泽朗医药科技有限公司,批号:ZL20140216YY,含量 ≥ 95%);20 (R)-人参皂苷Rg3对照品(成都曼斯特生物科技有限公司,批号:13080811,含量 ≥ 98%);乙腈为色谱纯,其余试剂均为分析纯。聚乳酸–羟基乙酸共聚物(PLGA,Mr15000,DL-LA/GA:8515、75/25、60/40、50/50,山东省医疗器械研究所),聚氧乙烯氢化蓖麻油(RH40,德国BASF公司),泊洛沙姆188 (F68,德国BASF公司),聚乙烯醇(PVA,Sigma公司),肉豆蔻酸异丙酯(批号:C1424025,阿拉丁试剂有限公司),大豆油(广州白云山汉方现代药业有限公司),泊洛沙姆188 (F68,德国BAS公司)、聚氧乙烯蓖麻油(EL35,德国BAS公司)、聚乙二醇硬酯酸(HS15,德国BAS公司),甘油(广州化学试剂厂);聚乙二醇400 (PEG400,天津市大茂化学试剂厂);乙腈为色谱纯,其余试剂均为分析纯。
2.2. 方法
2.2.1. 人参皂苷Rg3脂质体的制备
采用薄膜超声分散法。将脂质体混悬液滴入铜网,然后用2%磷钨酸染色制备样品。然后对样品进行干燥,置于透射电镜下观察。单因素试验确定磷脂浓度、磷脂胆固醇质量比、溶剂后,再进行L9 (34)正交试验,以脂药比、载药温度和pH值为考察因素,包封率为指标,筛选处方和制备工艺。
2.2.2. 人参皂苷Rg3PLGA纳米粒的制备
采用纳米沉淀法。按照优选工艺制备载药纳米粒混悬液,取一滴置于400目铜网上,静置1 min,使样品渗入铜网孔内,再用2%磷钨酸溶液负染1 min,用滤纸吸去负染液,镜下观察。单因素试验确定PLGA配比、表面活性剂种类和浓度后,选用L9 (34)正交试验法进行实验,以PLGA浓度、药物浓度、有机相与水相体积比为考察因素,包封率为指标,优化处方和制备工艺。
2.2.3. 人参皂苷Rg3微乳的制备
取VLB亲水基修饰阳离子脂质体1 mL,加水稀释至10 mL,取稀释液适量至小烧杯中,静置10 min,3%磷钨酸负染,吸取负染液滴至铜网上,滤纸吸去多余染色液,静置30 min,使微粒在铜网沉积,利用透射电镜观察粒径大小和形态。采用星点设计–效应面法试验设计,以油相质量分数、表面活性剂质量分数和助表面活性剂质量分数为考察因素,粒径、Zeta电位和药物平衡溶解度为指标,根据直观分析和实际情况确定最优处方。
2.3. 观察指标
脂药比、载药温度、pH值、油相质量分数、表面活性剂质量分数、助表面活性剂质量分数、粒径、Zeta电位和药物平衡溶解度为考察因素,包封率为指标,筛选处方和制备工艺。
3. 结果
3.1. 人参皂苷Rg3PLGA纳米粒形态(图3)
采用薄膜超声分散法制备脂质体,人参皂苷Rg3脂质体的最佳处方和工艺条件为:以氯仿–乙醇(1:1)为溶剂,磷脂、胆固醇、人参皂苷Rg3的质量比为4:2:1,载药温度为50℃,PBS缓冲溶液的pH值为6.8。制备的脂质体平均粒径为111.8 nm,Zeta电位为−38.67 mV,包封率为87.85%。可见球体光滑完整,无明显分层。

Figure 3. Transmission electron microscopy of nanoparticles (6000×)
图3. 纳米粒透射电镜照片(6000×)
3.2. 人参皂苷Rg3脂质体形态(图4)
采用纳米沉淀法制备纳米粒,人参皂苷Rg3PLGA纳米粒的最佳处方和工艺条件为:PLGA浓度为10 mg∙mL−1,人参皂苷Rg3浓度为3 mg∙mL−1,有机相与水相体积比为1:3。制备的纳米粒平均粒径为186.1 nm,Zeta电位为−29.56 mV,包封率为87.29%。镜下可见本法制备的纳米粒在电镜下呈较圆整的球状。
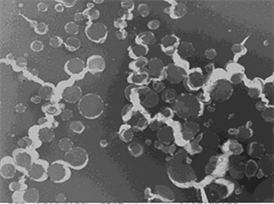
Figure 4. Transmission electron microscopy of liposomes (2000×)
图4. 脂质体透射电镜照片(2000×)
3.3. 人参皂苷脂质体微乳例(图5)
人参皂苷Rg3微乳的最优处方:油酸乙酯、EL35、PEG400与水的最佳质量比为8.25:12:4.75:75,平均粒径为60.50 nm,Zeta电位为−15.63 mV。微乳经4000 r∙min−1离心10 min后无分层现象。镜下显示脂质体外观呈圆球形或椭圆形的球形粒子,大小均匀,粒径约100 nm,可见明显的双分子层结构。

Figure 5. Transmission electron microscopy of liposomes (2000×)
图5. 脂质体透射电镜照片(2000×)
4. 讨论
人参皂苷是人参具有药物活性的精华成分 [9]。目前已分离获得70种以上的人参皂苷单体,包括Ra1-3、Rb1-3、Rg1、Rg3、Rh1等 [10]。其中Rg3的抗肿瘤活性吸引了众多注目,已报道Rg3在胶质瘤 [11] 、结肠癌 [12] 、肺癌 [13] 、前列腺癌 [14] 、乳腺癌 [15] 、宫颈癌 [16] 、卵巢癌 [17] 等多种肿瘤中具有抗肿瘤作用。人参皂苷Rg3预防肿瘤术后复发转移方面具有广阔的发展前景。但Rg3的口服生物利用度较低也限制了Rg3的应用。仍有必要评估这些优化疗法的体内疗效,开发新的Rg3类似物提高生物利用度特性。
脂质体是指用类脂质双分子层包封药物而形成的纳米级囊泡,主要由具有极性的磷脂质为膜材并加入胆固醇等构成 [17]。脂质体因为具有与生物膜相似的功能结构,可吸附在靶细胞外壁,使药物能作用与靶部位,其已经用作多种药物的载体。脂质体具有很多独特的生物学特征,例如具有生物相容性,可以在膜上装载疏水性药物同时在内部水相装载亲水药物;可以将药物与外部环境隔离,保证药物活性,为药物传递进入细胞甚至是细胞器提供了可能。聚乳酸–羟基乙酸共聚物(PLGA)有良好的组织相容性 [18],是由乳酸(LA)和羟基乙酸(GA)的聚合而成,该聚合物性质温和,其水解的中间产物乳酸与机体糖代谢产物一致,最终产物是水和二氧化碳。PLGA骨架生物可降解度对纳米粒中药物的释放度有密切相关性,PLGA降解时间可以通过调节PLGA中LA和GA的相对分子质量和摩尔比来改变,从而使药物释放时间延长 [19]。微乳 [20] 是由表面活性剂、助表面活性剂、油相和水相以一定比例自发形成的热力稳定的混合系统。作为新型的药物载体,微乳可以增加疏水药物的溶解性,对于性质不稳定的药物可以提高其稳定性,组成中的油相可以提高淋巴转运 [20],从而增大淋巴对抗肿瘤药物的吸收。目前微乳已成为各种抗肿瘤药物的载药剂型 [21]。基于以上问题,我们对Rg3进行了详细、合理的分子机制研究,以证实其有效性和更好的临床应用。本研究为人参皂苷Rg3纳米制剂在临床卵巢癌的靶向治疗提供了实验依据,亦可为其他药物的体内分布研究提供参考。
文章引用
杨 瑾,邹 丹,梁 蕾,武艳玲,张焕灵,黄树峰. 人参皂苷Rg3负载PCL-PEG纳米系统在卵巢癌中的优化研究
Improvements on Ginsenoside Rg3 Nanopreparations Delivery Systems in Ovarian Cancer[J]. 临床医学进展, 2023, 13(03): 4531-4537. https://doi.org/10.12677/ACM.2023.133650
参考文献
- 1. 柳鹏, 李勇. 人参皂苷生物活性的研究进展[J]. 中国生育健康杂志, 2004, 15(5): 317-319.
- 2. Chen, X.J., Zhang, X.J., Shui, Y.M., Wan, J.B. and Gao, J.L. (2016) Anticancer Activities of Protopanaxadiol- and Protopanaxatriol-Type Ginsenosides and Their Metabolites. Evidence-Based Complementary and Alternative Medicine, 2016, Article ID: 5738694.
- 3. 姚婵, 来茂德. 上皮间质转化(EMT)及其分子机制[J]. 国际遗传学杂志, 2006, 29(4): 290-294.
- 4. Kalluri, R. (2009) EMT: When Epithelial Cells Decide to Become Mesenchymal-Like Cells. Journal of Clinical Investigation, 119, 1417-1419. https://doi.org/10.1172/JCI39675
- 5. 胡倩雯, 韩向晖. 中药干预肿瘤及纤维化疾病上皮间充质转化的研究进展[J]. 云南中医中药杂志, 2015, 36(3): 69-72.
- 6. Liu, T., Zhao, L., Zhang, Y., et al. (2014) Ginsenoside 20(S)-Rg3 Targets HIF-1α to Block Hypoxia-Induced Epithelial-Mesenchymal Transition in Ovarian Cancer Cells. PLOS ONE, 9, e103887. https://doi.org/10.1371/journal.pone.0103887
- 7. Li, J., Lu, J.J., Ye, Z.X., et al. (2017) 20(S)-Rg 3 Blocked Epi-thelial-Mesenchymal Transition through DNMT3A/miR- 145/FSCN1 in Ovarian Cancer. Oncotarget, 8, 53375-53386. https://doi.org/10.18632/oncotarget.18482
- 8. Li, J., Zhang, S.L., Pei, M.L., et al. (2018) FSCN1 Promotes Epi-thelial-Mesenchymal Transition through Increasing Snail1 in Ovarian Cancer Cells. Cellular Physiology and Biochemis-try, 49, 1766-1777. https://doi.org/10.1159/000493622
- 9. Wang, C.Z., Anderson, S., Du, W., et al. (2016) Red Ginseng and Cancer Treatment. Chinese Journal of Natural Medicines, 14, 7-16.
- 10. Zhou, Q.L., Zhu, D.N., Yang, X.W., et al. (2018) De-velopment and Validation of a UFLC-MS/MS Method for Simultaneous Quantification of Sixty-Six Saponins and Their Six Aglycones: Application to Comparative Analysis of Red Ginseng and White Ginseng. Journal of Pharmaceutical and Biomedical Analysis, 159, 153-165. https://doi.org/10.1016/j.jpba.2018.06.048
- 11. Chen, Z., Wei, X., Shen, L., et al. (2019) 20(S)-ginsenoside-Rg3 Reverses Temozolomide Resistance and Restrains Epithelial-Mesenchymal Transition Progression in Glioblastoma. Cancer Science, 110, 389-400. https://doi.org/10.1111/cas.13881
- 12. Qiu, R., Qian, F., Wang, X., et al. (2019) Targeted Delivery of 20(S)-Ginsenoside Rg3-Based Polypeptide Nanoparticles to Treat Colon Cancer. Biomed Microdevices, 21, 18. https://doi.org/10.1007/s10544-019-0374-0
- 13. Wang, X.J., Zhou, R.J., Zhang, N., et al. (2019) 20(S)-ginsenoside Rg3 Sensitizes Human Non-Small Cell Lung Cancer Cells to Icotinib through Inhibition of Autophagy. European Journal of Pharmacology, 850, 141-149. https://doi.org/10.1016/j.ejphar.2019.02.023
- 14. Peng, Y., Zhang, R., Yang, X., et al. (2019) Ginsenoside Rg3 Suppresses the Proliferation of Prostate Cancer Cell Line PC3 through ROS-Induced Cell Cycle Arrest. Oncology Letters, 17, 1139-1145. https://doi.org/10.3892/ol.2018.9691
- 15. Guo, Y.H., Kuruganti, R. and Gao, Y. (2019) Recent Advances in Ginsenosides as Potential Therapeutics against Breast Cancer. Current Topics in Medicinal Chemistry, 19, 2334-2347. https://doi.org/10.2174/1568026619666191018100848
- 16. Bian, S., Zhao, Y., Li, F., et al. (2019) 20(S)-ginsenoside Rg3 Promotes HeLa Cell Apoptosis by Regulating Autophagy. Molecules, 24, 3655. https://doi.org/10.3390/molecules24203655
- 17. 董方言. 现代实用中药新剂型新技术[M]. 北京: 人民卫生出版社, 2001: 363-378.
- 18. Mundargi, R.C., Babu, V.R., Rangaswamy, V., et al. (2008) Nano/Micro Technologies for Delivering Macromolecular Theapeutics Using Poly(D, L-lactide-co-glycolide)and Its Derivatives. Journal of Controlled Release, 125, 193-209. https://doi.org/10.1016/j.jconrel.2007.09.013
- 19. Lu, J.M., Wang, X., Marin-Muller, C., et al. (2009) Current Advances in Research and Clinical Applications of PLGA Based Nanotecheology. Expert Review of Molecular Diagnos-tics, 9, 325-341. https://doi.org/10.1586/erm.09.15
- 20. 杨华, 易红. 我国微乳技术在药学领域中的研究进展[J]. 中国新药杂志, 2006, 15(10): 764-769.
- 21. 胡译丽, 程国华. 抗肿瘤药物靶向制剂的研究进展[J]. 今日药学, 2021, 21(5): 317-320.
NOTES
*通讯作者。