Advances in Clinical Medicine
Vol.
14
No.
02
(
2024
), Article ID:
81586
,
6
pages
10.12677/ACM.2024.142564
葛根素对庆大霉素毒性小鼠p53-ROS通路和 螺旋神经元的细胞学的影响机制研究
牛苹1,张在涛2,李荣兴1
1青州市人民医院,耳鼻喉科,山东 青州
2青州市人民医院,骨一科,山东 青州
收稿日期:2024年1月29日;录用日期:2024年2月23日;发布日期:2024年2月29日

摘要
目的:探讨葛根素注射液在庆大霉素毒性小鼠中的作用效果及对p53-ROS通路和螺旋神经元细胞学的影响。方法:购置SPF级C57BL/6J小鼠30只,随机取10只为空白对照组;其余小鼠建立庆大霉素耳毒性模型,建模成功后随机分为模型对照组和葛根素组各10只。空白对照组和模型对照组不采取任何措施,葛根素组采用葛根素注射液腹腔注射,比较3组小鼠听力水平、耳蜗形态学变化及p53-ROS通路关键蛋白水平。结果:葛根素组ABR低于模型对照组(P < 0.05);高于空白对照组(P < 0.05);模型对照组ABR高于空白对照组(P < 0.05);葛根素组干预14 d后听力水平0.75 kHz、1.0 kHz、2.0 kHz、4.0 kHz及8.0 kHz小鼠DPOAE水平高于模型对照组(P < 0.05);HE染色结果表明,葛根素组经药物干预后耳蜗部位毛细胞数量减少,耳蜗底转血管纹细胞未见水肿,形态正常。葛根素组Bax、Bcl-2及Cytochrome C mRNA及相关蛋白水平低于模型对照组(P < 0.05)。结论:葛根素用于庆大霉素毒性小鼠动物模型中效果显著,能抑制p53-ROS通路,改善螺旋神经元的细胞学水平,有助于提升小鼠听力水平。
关键词
葛根素,庆大霉素,p53-ROS通路,螺旋神经元,细胞学,影响机制

A Study on the Mechanisms of Puerarin’s Effects on the p53-ROS Pathway and Spiral Neurons in Gentamicin Toxic Mice
Ping Niu1, Zaitao Zhang2, Rongxing Li1
1Otolaryngology Department of Qingzhou People’s Hospital, Qingzhou Shandong
2Orthopedics Department I of Qingzhou People’s Hospital, Qingzhou Shandong
Received: Jan. 29th, 2024; accepted: Feb. 23rd, 2024; published: Feb. 29th, 2024

ABSTRACT
Objective: To explore the effects of puerarin injection on gentamicin induced toxicity in mice and its effects on the p53-ROS pathway and spiral neuron cytology. Method: 30 SPF grade C57BL/6J mice were purchased, and 10 mice were randomly selected as the blank control group; The remaining mice were established with gentamicin ototoxicity models, and after successful modeling, they were randomly divided into a model control group and a puerarin group, with 10 mice in each group. No measures were taken in the blank control group and model control group, while the puerarin group was injected intraperitoneally with puerarin injection. The hearing levels, cochlear morphological changes, and key protein levels of the p53-ROS pathway were compared among the three groups of mice. Result: The ABR of the puerarin group was lower than that of the model control group (P < 0.05) and higher than the blank control group (P < 0.05); The ABR of the model control group was higher than that of the blank control group (P < 0.05); After 14 days of intervention with puerarin, the DPOAE levels in mice with hearing levels of 0.75 kHz, 1.0 kHz, 2.0 kHz, 4.0 kHz, and 8.0 kHz were higher than those in the model control group (P < 0.05); The HE staining results showed that after drug intervention, the number of hair cells in the cochlea of the puerarin group decreased, and there was no edema in the vascularized striated cells at the cochlea floor, with normal morphology. The levels of Bax, Bcl-2, Cytochrome C mRNA and related proteins in the puerarin group were lower than those in the model control group (P < 0.05). Conclusion: Puerarin has a significant effect in a mouse model of gentamicin toxicity, inhibiting the p53-ROS pathway, improving the cytological level of spiral neurons, and helping to enhance the hearing level of mice.
Keywords:Puerarin, Gentamicin, p53-ROS Pathway, Spiral Neurons, Cytology, Impact Mechanism

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
听力障碍是指听觉系统中的传音、感音及对声音综合分析的各级神经中枢发生器质性或功能性异常,从而引起听力出现不同程度减退 [1] 。临床上,听力障碍病因复杂,普遍认为与遗传因素、环境因素、药物和化学制剂致聋、噪声性耳聋及外伤等因素有关,临床多表现为耳鸣、耳聋、听觉过敏及听觉失认等 [2] 。近年来,听力障碍越来越受到国内外学者的关注,且全球听力受损人数超过15亿人,并持续增长,不仅降低学习和工作效率,给家庭和社会增加负担 [3] 。Alikhani M等研究表明 [4] ,耳毒性药物、噪音损害、老龄化及遗传因素等引起的内耳听觉功能异常,是感音神经性听力损失的主要原因,其中在后天引起的听力张力中,药物性耳聋占主要原因。葛根素是从中药葛根中分离出的、具有扩冠作用的异黄酮类衍生物,能发挥退热、镇静及使得冠状动脉血流量增加作用,对于垂体后叶素引起的急性心肌出血具有保护作用,但是在听力障碍中的作用机制研究较少 [5] [6] 。本研究主要探讨葛根素对庆大霉素毒性小鼠p53-ROS通路和螺旋神经元的细胞学的影响机制,报道如下。
2. 资料与方法
2.1. 动物资料
购置SPF级雄性C57BL/6J小鼠30只为对象,体重在200~220 g,平均(200.00 ± 20.00) g。随机取10只小鼠设为空白对照组;剩余20只小鼠建立庆大霉素耳毒性模型,建模成功后随机分为模型对照组和葛根素组各10只。动物合格证号:SCXX-2015-0021,所选动物均购置于实验动物中心,大鼠均置于我院实验室医院动物房进行14 d适应性喂养,安静环境饲养,室温(22 ± 2)℃,12 h交替光照,自由饮水。本实验经本院医学伦理委员会审批并通过 [7] 。
2.2. 仪器与设备
苏木精,购置于Sigma公司;庆大霉素,购置于武汉福星生物药业有限公司,国药准字H42020795,规格:2 ml:8万单位;生物组织脱水机,型号:JT-12J,购置于武汉俊杰实业集团有限公司;组织切片机,型号:徕卡-2016,购置于德国徕卡公司;TDT神经生理信号采集系统,购置于美国The versatile RZ6 auditory Processor公司;耳声发射测试仪,购置于北京科海恒生科技有限公司;耳蜗电图,购置于北京爱生科贸有限公司。
2.3. 方法
(1) 动物模型建立。20只C57BL/6J小鼠建立庆大霉素耳毒性模型,具体方法如下。选择购置的小鼠,常规颗粒饲料喂养,隔天更换垫料(保证本研究遵循动物实验的3R原则) [8] 。参考相关文献方法 [9] 完成动物模型的赋值,肌肉注射庆大霉素80 mg/(kg∙d),每天2次,连续用药14 d后评价建模效果,采用听觉脑干诱发电位ABR进行检测,所有小鼠均达到模型标准;建模成功后随机分为模型对照组和葛根素组。(2) 干预方法。空白对照组和模型对照组不采取任何措施,腹腔注射等量0.9%氯化钠溶液,正常的饲养,并到实验第28 d;葛根素组:采用中药葛根素注射液腹腔注射干预。每天腹腔注射葛根素注射液50 mg/kg,连续用药14 d后停药,用药期间动态监测体质量以调整药物剂量,三组均完成14 d干预。
2.4. 观察指标
(1) 听力水平。三组干预14 d后采用TFT神经生理信号采集、耳声发射测试仪监测小鼠ABR、DPOAE (频率包括:0.75、1.0、2.0、4.0及8.0)水平;(2) 耳蜗形态学变化。三组干预14 d后小鼠以断颈方式处死,取耳蜗组织,经石蜡包埋后制备冰冻切片,观测血管纹组织及耳蜗形态 [10] ;(3) p53-ROS通路关键蛋白水平。取上述处理后的耳蜗组织,采用Western Blot和实时荧光PCR技术测定小鼠p53-ROS通路关键蛋白水平,包括:Bax、Bcl-2及Cytochrome C水平 [11] 。
2.5. 统计分析
采用SPSS26.0软件处理,计数资料行χ2检验,采用n(%)表示,计量资料行t检验,采用( )表示,P < 0.05差异有统计学意义。
3. 结果
3.1. 三组听力水平比较
葛根素组ABR水平低于模型对照组(P < 0.05);高于空白对照组(P < 0.05);模型对照组ABR水平高于空白对照组(P < 0.05),见表1。
Table 1. Comparison of ABR levels among three groups ( )
表1. 三组ABR水平比较( )
与空白对照组比较,#P < 0.05;与模型对照组比较,*P < 0.05。
葛根素组干预14 d后听力水平0.75 kHz、1.0 kHz、2.0 kHz、4.0 kHz、及8.0 kHz小鼠DPOAE水平高于模型对照组(P < 0.05),略低于空白对照组(P < 0.05),见表2。
Table 2. Comparison of listening levels among three groups ( )
表2. 三组听力水平比较( )
与空白对照组比较,#P < 0.05;与模型对照组比较,*P < 0.05;与干预前比较,△P < 0.05。
3.2. 三组耳蜗形态学变化比较
三组干预14 d后行HE染色,并完成耳蜗形态学观察,结果表明:葛根素组耳蜗底转柯替器外毛细胞数量明显减少,有较多确实,且耳蜗底转血管纹细胞水肿不明显,形态基本正常;而空白对照组螺旋神经元的细胞形态正常,排列整齐,且无缺失,耳蜗底转血管纹细胞形态正常,排列整齐;而模型对照组耳蜗形态学变化明显,细胞形态异常,见图1。
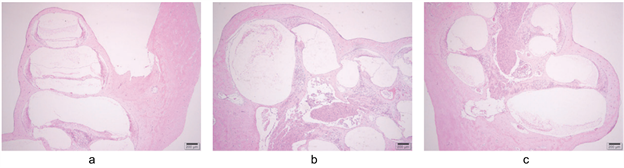 注:a图为空白对照组HE染色结果;b图为模型对照组HE染色结果;c吐为葛根素组HE染色结果。
注:a图为空白对照组HE染色结果;b图为模型对照组HE染色结果;c吐为葛根素组HE染色结果。
Figure 1. Comparison of morphological changes in three groups of cochlea (×50)
图1. 三组耳蜗形态学变化比较(×50)
3.3. 三组p53-ROS通路关键蛋白水平比较
葛根素组Bax、Bcl-2及Cytochrome C mRNA及相关蛋白水平低于模型对照组(P < 0.05);高于空白对照组(P < 0.05),见表3和图2。
Table 3. Comparison of key protein levels in the p53-ROS pathway among three groups ( )
表3. 三组p53-ROS通路关键蛋白水平比较( )
与空白对照组比较,#P < 0.05;与模型对照组比较,*P < 0.05。
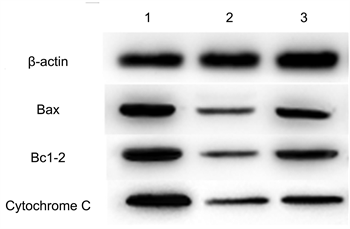 注:图中1模型对照组;2为空白对照组;3为葛根素组。
注:图中1模型对照组;2为空白对照组;3为葛根素组。
Figure 2. Key protein levels of the p53-ROS pathway in three groups
图2. 三组p53-ROS通路关键蛋白水平
4. 讨论
庆大霉素引起的耳损伤机制相对复杂,该药物属于氨基甙类抗生素,作为耳毒性药物,导致感音神经聋。王跃鸣等研究表明 [12] ,庆大霉素与铁螯合形成庆大霉素和铁的复合物,能诱发氧自由基的产生,导致毛细胞损伤。同时,庆大霉素具有聚胺的特性,能激活NMDA受体,导致神经细胞凋亡。本研究中,葛根素组ABR低于模型对照组(P < 0.05);高于空白对照组(P < 0.05);模型对照组ABR高于空白对照组(P < 0.05),葛根素组干预14 d后听力水平0.75 kHz、1.0 kHz、2.0 kHz、4.0 kHz及8.0 kHz小鼠DPOAE水平高于模型对照组(P < 0.05),从该结果看出,葛根素能提高庆大霉素毒性小鼠听力水平,利于小鼠恢复。分析原因:葛根素作为常用的中成药,能扩张微动脉血管,减慢动脉内皮细胞多糖代谢,有助于降低外周血管阻力,增加血流速度,可改善内耳微循环。同时,葛根素用于庆大霉素毒性小鼠动物模型中,药物有效成分异黄酮,能发挥抗氧化、清除氧自由基作用,减轻自由基对于毛细胞损伤。现代药理结果表明,葛根素注射液作为中成药,能降低机体内血液黏度,抑制血小板及红细胞聚集,从而减轻庆大霉素对血管纹的损伤,降低血栓发生率。本研究中,HE染色结果表明,葛根素组耳蜗底转柯替器外毛细胞数量明显减少,且耳蜗底转血管纹细胞水肿不明显,形态基本正常,从该结果看出,葛根素注射液能改善螺旋神经元的细胞学水平。p53-ROS通路作为人体重要的抑制因子,在细胞周期的调控及细胞凋亡中发挥了重要的作用。在细胞发生DNA损伤时,p53蛋白能终止细胞分裂过程,以使得细胞具有充足的时间修复损伤。本研究中,葛根素组Bax、Bcl-2及Cytochrome C mRNA及相关蛋白水平低于模型对照组(P < 0.05),从该结果看出,葛根素注射液用于庆大霉素毒性小鼠动物模型中,能抑制p53-ROS通路,在细胞周期组织及病情发展中发挥了重要的作用。
综上所述,葛根素用于庆大霉素毒性小鼠动物模型中效果显著,能抑制p53-ROS通路,改善螺旋神经元的细胞学水平,有助于提升小鼠听力水平,能为临床诊疗提供新方法。
基金项目
项目名称:潍坊市卫生健康委员会中医药科研项目;项目编号:2023年(第二类)第005号。
文章引用
牛 苹,张在涛,李荣兴. 葛根素对庆大霉素毒性小鼠p53-ROS通路和螺旋神经元的细胞学的影响机制研究
A Study on the Mechanisms of Puerarin’s Effects on the p53-ROS Pathway and Spiral Neurons in Gentamicin Toxic Mice[J]. 临床医学进展, 2024, 14(02): 4067-4072. https://doi.org/10.12677/ACM.2024.142564
参考文献
- 1. 龙佳欣, 田梦芝, 陈笑一, 等. 黄芪甲苷介导Akt/mTOR/HIF-1α通路调控氧糖剥夺PC12细胞自噬的机制研究[J]. 中国中药杂志, 2023, 48(19): 5271-5277.
- 2. 胡云霞, 倪永骋, 张彪, 等. 运脾开胃方对小鼠下丘脑神经元细胞NPY水平的干预作用及机制研究[J]. 中医药学报, 2023, 51(6): 25-30.
- 3. 唐健文, 钟秀, 安信业. 瑞马唑仑对缺氧/复氧神经元细胞的保护作用及其机制[J]. 中国临床药理学杂志, 2023, 39(18): 2631-2634.
- 4. Alikhani, M., Aalikhani, M. and Khalili, M. (2022) Reduction of Iron Toxicity in the Heart of Iron-Overloaded Mice with Natural Compounds. European Journal of Pharmacology, 924, Article ID: 174981. https://doi.org/10.1016/j.ejphar.2022.174981
- 5. 李震, 孙晓, 谢永鹏, 等. 神经元来源细胞外囊泡促进神经干细胞的神经生成[J]. 中国组织工程研究, 2024, 28(25): 3994-3999.
- 6. 张鼎, 李方存, 姜明贺, 等. 温阳复元方对脑缺血再灌注损伤大鼠JNK1/Bcl-2/Beclin1信号通路相关蛋白及基因表达的影响[J]. 中华中医药杂志, 2023, 38(11): 5208-5213.
- 7. Philipopoulos, G.P., Chan, A., Jiang, J., et al. (2022) Methyl Mercaptan Gas: Mechanisms of Toxicity and Demonstration of the Effectiveness of Cobinamide as an Antidote in Mice and Rabbits. Clinical Toxicology, 60, 615-622. https://doi.org/10.1080/15563650.2021.2017949
- 8. 何璎, 邹蔓姝, 任廷婷, 等. 逍遥抗癌解郁方通过调控COX通路对乳腺癌并发抑郁模型小鼠的治疗作用及机制研究[J]. 中国中药杂志, 2023, 48(14): 3874-3881.
- 9. 刘妍, 徐钊, 程波, 等. 考虑细胞外基质刚度的神经轴突力学模型[J]. 科学通报, 2023, 68(21): 2748-2755.
- 10. Wu, H., Xu, T., Chen, T., et al. (2022) Oxidative Stress Mediated by the TLR4/NOX2 Signalling Axis Is Involved in Polystyrene Microplastic-Induced Uterine Fibrosis in Mice. The Science of the Total Environment, 838, Article ID: 155825. https://doi.org/10.1016/j.scitotenv.2022.155825
- 11. 曹银利, 孙亚洲, 崔清洋, 等. 青蒿琥酯通过抑制NLRP3炎性体激活和炎性细胞因子分泌减轻新生大鼠缺氧缺血性脑损伤[J]. 细胞与分子免疫学杂志, 2023, 39(5): 410-415.
- 12. 王跃鸣, 胡慧娜, 张璐. MIR-199b-3p对癫痫小鼠海马神经元的保护作用及对mTOR信号通路的影响[J]. 卒中与神经疾病, 2023, 30(2): 124-136.
