Advances in Clinical Medicine
Vol.08 No.02(2018), Article ID:24559,9
pages
10.12677/ACM.2018.82041
The Effects of Different Doses of HOE-642 for the Protection of Neuronal Mitochondrial Function after Cardiac Arrest in Rats
Lanying Wei, Wenshuai Zhao, Xifan Wang, Yanan Hu, Fei Han*
Department of Anesthesiology, The Third Affiliated Hospital, Harbin Medical University, Harbin Heilongjiang

Received: Mar. 28th, 2018; accepted: Apr. 19th, 2018; published: Apr. 26th, 2018

ABSTRACT
Objective: This study was to explore the effects of different doses of HOE-642 for the protection of neuronal mitochondrial function after cardiac arrest in rats. Methods: Cardiac arrest was induced by 8 min of asphyxia in rats. Six groups were included: N group, normothermia; HOE groups, HOE-642 1 or 5 mg/kg, iv, when initiating CPR; Hypo group, mild hypothermia (33˚C ± 0.5˚C) induced following the return of spontaneous circulation; Hypo + HOE groups, HOE-642, 1 or 5 mg/kg, plus mild hypothermia. Survival and NDS were evaluated after 24 h of resuscitation. Mitochondrial function of the hippocampus was detected. Results: Survival in the Hypo + HOE 1 mg group was the best and significantly higher than in the N and HOE 1 mg groups (P < 0.05). NDS in the Hypo + HOE 1 mg group was significantly lower than in the N group (P < 0.05). The mitochondrial function in the Hypo + HOE 1 mg group was better than in the Hypo + HOE 5 mg group. Conclusions: HOE-642 1 mg/kg was beneficial compared to HOE-642 5 mg/kg used when initiating resuscitation for the protection of neuronal mitochondrial function after cardiac arrest.
Keywords:CPR, Cardiac Arrest, HOE-642, Ischemia/Reperfusion, Mitochondria
评价不同剂量的HOE-642对大鼠心脏骤停后神经线粒体功能的保护作用
魏兰璎,赵文帅,王喜繁,胡亚楠,韩非*
哈尔滨医科大学附属第三医院麻醉科,黑龙江 哈尔滨

收稿日期:2018年3月28日;录用日期:2018年4月19日;发布日期:2018年4月26日

摘 要
目的:评价不同剂量的HOE-642对大鼠心脏骤停后神经线粒体功能的保护作用。方法:大鼠采用窒息性心脏骤停,8 min后进行心肺复苏。共分为6组:常温组(N组);HOE-642用药组(HOE组),在开始复苏前分别静脉注射HOE-642 1 mg/kg或5 mg/kg;低温组(Hypo组),在恢复血流后采用中度低温(33℃ ± 0.5℃)治疗;低温复合HOE-642用药组(Hypo + HOE组),在开始进行复苏前分别静脉注射HOE-642 1 mg/kg或5 mg/kg,并在循环恢复后采用中度低温治疗。成功复苏后24 h,计算大鼠的存活率,并进行神经功能损伤的评估(NDS)。其后提取大鼠的海马组织并分离线粒体以测量线粒功能。结果:在复苏24 h后,大鼠的存活率在Hypo + HOE 1 mg组明显比N组和HOE 1 mg组高(P < 0.05);NDS在Hypo + HOE 1 mg组明显比N组低(P < 0.05);线粒体的功能在Hypo + HOE 1 mg组明显优于Hypo + HOE 5 mg组。结论:相比于HOE-642,5 mg/kg的剂量,在开始复苏时静注HOE-642,1 mg/kg的剂量对神经线粒体的功能更有益。
关键词 :心肺复苏,心脏骤停,HOE-642,缺血/再灌注,线粒体

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脑缺血后导致神经线粒体损伤,加剧氧化应激反应,氧化应激活性氧(Reactive oxygen species, ROS)生成增加 [1] [2] 。线粒体损伤的主要特征为线粒体膜蛋白(Mitochondrial membrane potential, ΔΨm)减少,线粒体膜通透性转换孔(Mitochondrial permeability transition pore, mPTP)不可逆性开放,线粒体内细胞色素C(Cytochrome c, Cyt c)释放,并向细胞质中释放毒性蛋白 [3] [4] 。这一系列机制都会加剧脑缺血后神经细胞凋亡及神经功能障碍。
Na+/H+交换体1型(Na+/H+ exchanger isoform 1, NHE1)是存在于细胞表面的一种膜蛋白,通过调节细胞内外H+和Na+的交换以维持细胞正常pH值和稳定细胞容积 [5] 。在诸多心肌缺血再灌注动物模型中,抑制NHE的活性已显示出明显保护效应,改善心肌功能恢复,维持细胞正常超微结构,抑制细胞凋亡 [6] - [11] 。HOE-642,一种选择性NHE1型抑制剂,在室颤复苏前使用1 mg/kg的剂量,已证明也可以提高复苏后血流动力学的恢复,改善复苏后心脏效能 [12] [13] [14] 。在脑缺血的猪模型中,使用HOE-642 5 mg/kg的剂量,也可以防止神经功能损伤 [15] 。现阶段还没有研究证明HOE-642在心脏骤停模型中应用对神经线粒体功能的影响,所以,本研究主要探索不同剂量的HOE-642对大鼠心脏骤停后神经线粒体功能的影响。
2. 材料和方法
2.1. 实验动物
本研究选用健康雄性Wistar大鼠,体重240 g~340 g,年龄8~10周,购自哈尔滨医科大学附属第二医院实验动物中心,不限制其饮食和饮水,鼠笼内饲养。实验中所有动物操作都严格遵循哈尔滨医科大学实验动物保护和使用的相关规定,并取得了哈尔滨医科大学附属第三医院动物保护与使用委员会的批准。
2.2. 实验分组
本实验共分为6组:常温组(N组),该组大鼠行窒息性心脏骤停后8 min开始进行心肺复苏(Cardiopulmonary resuscitation, CPR),待自主循环恢复(Return of spontaneous circulation, ROSC)后,维持鼓膜及直肠温度为37℃ ± 0.5℃;HOE 1 mg组,HOE 5 mg组,这两组大鼠在行CPR前分别静脉注射HOE-642 1 mg/kg和HOE-642 5 mg/kg,待ROSC后,维持鼓膜及直肠温度为37℃ ± 0.5℃;低温组(Hypo组),该组大鼠在心脏骤停后行CPR,待ROSC后立即进行低温处理,维持鼓膜及直肠温度为33℃ ± 0.5℃,并持续1 h,随后开始恢复体温至37℃ ± 0.5℃,并持续1 h;HOE 1 mg复合低温组(Hypo + HOE 1 mg组),HOE 5 mg复合低温组(Hypo + HOE 5 mg组),这两组大鼠在行CPR前分别静脉注射HOE-642 1 mg/kg和HOE-642 5 mg/kg,待ROSC后立即进行低温处理,维持鼓膜及直肠温度位33℃ ± 0.5℃并持续1 h,随后开始恢复体温至37℃ ± 0.5℃,并持续1 h。
2.3. 实验方案
对实验大鼠用4%的异氟烷麻醉后行气管内插管,插管成功后连接呼吸机(Harvard-683,美国Harvard仪器)进行机械通气,呼吸频率为40次/min,并进行呼气末正压(5 cmH2O)通气,吸呼比I:E = 1:1,吸入氧分数FiO2 = 0.5。维持呼吸末二氧化碳分压在35~45 mmHg之间并以此为根据调节潮气量的大小(8~12 ml/kg),用2%的异氟烷进行麻醉维持。应用加热毯使大鼠鼓膜温度及直肠温度维持在37℃ ± 0.5℃。动静脉穿刺后开始记录动脉血压,并维持平均动脉压(MAP),心率(HR)及血气值在正常范围内。待大鼠的各项生命体征保持平稳后,静脉给予2 mg/kg的维库溴胺,夹闭气管导管,以诱导窒息性心脏骤停。当MAP < 20 mmHg时视为大鼠窒息性心脏骤停,大鼠窒息期间维持体温在37℃ ± 0.5℃。窒息发生8 min后开始进行CPR,在复苏开始之前,静脉给予0.01 mg/kg的肾上腺素,并根据不同的组别要求静注不同剂量的HOE-642,复苏即刻开始进行胸外按压,按压频率为200~300次/min,并打开呼吸机进行纯氧吸入。待ROSC后,根据不同的组别要求应用加热毯或冰水维持相应的体温。所有实验组动物在复苏成功后均进行机械通气1 h,并维持MAP在50 mmHg以上,如果MAP < 50 mmHg,静注1 µg的肾上腺素。若胸外按压3 min后仍未恢复自主循环,则再给予一次0.01 mg/kg肾上腺素,若胸外按压超过5 min仍未恢复自主循环,则视为复苏失败。复苏成功的大鼠存活24 h后,对其进行神经功能损伤程度评估,该项评估使用神经缺损评分量表(Neurologic deficit score, NDS),共分为5部分,分别为呼吸功能,运动功能,感觉,意识和反应能力,每一部分100分,共500分,0分为正常,500分为脑死亡 [16] 。其后在深麻醉下将大鼠断头,提取大脑海马组织,分离海马组织的线粒体,用以检测线粒体的膜电位,肿胀,ROS的产生,以及线粒体复合物I和III的活性。
2.4. 海马线粒体的分离
将断头后的大鼠分离脑组织,识别并夹取出两侧的海马组织。海马线粒体的分离采用组织线粒体分离试剂盒(Beyotime Institute of Biotechnology),将海马组织的匀浆液在4℃,1000 g条件下进行第一次离心,离心5 min以去除细胞核及破损的细胞残片;将上清液在4℃,3500 g条件下进行第二次离心,离心10 min以获得高纯度线粒体。以上所有操作步骤均在冰浴条件下进行。
2.5. 线粒体膜电位的检测
线粒体膜电位的检测采用荧光探针JC-1线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司)以及荧光酶标仪(Infinite®M1000),所有操作均在避光条件下进行。将线粒体(1 μg/10 μl)加入JC-1染色工作液中,立即用荧光酶标仪检测。激发光波长为490 nm,发射光波长为530 nm,以检测加样孔中JC-1聚合物的量;激发光波长为525 nm,发射光波长为590 nm,以检测加样孔中JC-1单体的量。聚合物与单体的比值即为膜电位的大小,比值越大,膜电位越高。
2.6. 线粒体肿胀的测定
线粒体肿胀的测定采用线粒体肿胀光度法测定试剂盒(美国GENMED SCIENTIFICS公司)。线粒体的肿胀是因线粒体膜的mPTP开放,线粒体外的离子或大分子物质通过mPTP进入线粒体内引起的,以致线粒体的吸光度减少。将线粒体(200 μg/20 μl)加入缓冲液中,混匀,即刻放用酶标仪检测,波长为520 nm,得初始吸光度值。室温下静置1 min后,加入肿胀触发液CaCl2,即刻用酶标仪检测,波长为520 nm,动态记录10 min吸光度值的变化,每1 min记录一次。计算加入CaCl2之前和之后线粒体吸光度的下降比即代表线粒体的肿胀程度,下降越大,肿胀越明显。
2.7. 线粒体ROS产生的测定
线粒体ROS产生的测定采用线粒体ROS初级荧光测定试剂盒(美国GENMED SCIENTIFICS公司)。在线粒体(50 μg/50 μl)中加入缓冲液及染色液后置于37℃温箱中孵育15 min。然后放入荧光酶标仪中检测,激发波长为490 nm,发射波长为530 nm,测定其荧光强度,即代表ROS的产生量。以上所有操作均在避光条件下进行。
2.8. 线粒体呼吸链链复合物I和III活性的比色法定量检测
2.8.1. 复合物I(NADH-辅酶Q还原酶)的活性
线粒体呼吸链复合物I催化线粒体内电子由供体NADH传递到内膜上辅酶Q受体的能量转移反应,同时NADH转化为NAD,在分光光度计340 nm波长下产生吸收峰值的变化,复合物I的活性即取决于NADH的氧化量。采用复合物I活性比色法定量检测试剂盒(南京建成生物工程研究所),将100 μl浓度为0.1 μg/μl的线粒体蛋白以及900 μl的反应液加入比色皿中,用分光光度计检测在340 nm波长下吸光度的变化,用鱼藤酮敏感的抑制剂以验证检测的特异性。通过计算NADH的氧化率即为复合物I的活性(nmol NADH oxidized/min/mg protein)。
2.8.2. 复合物III(辅酶Q-Cyt c还原酶)的活性
线粒体呼吸链复合物III催化线粒体内电子由供体还原型辅酶Q传递到Cyt c上的能量转移反应,同时氧化型Cyt c被还原为还原型Cyt c,在分光光度计550 nm波长下产生吸收峰值的变化,复合物III的活性即取决于氧化型Cyt c的还原量。采用复合物III活性比色法定量检测试剂盒(南京建成生物工程研究所),将100 μl浓度为0.1 μg/μl的线粒体蛋白以及900 μl的反应液加入比色皿中,用分光光度计检测在550 nm波长下吸光度的变化,用抗霉素A抑制剂以验证检测的特异性。通过计算氧化型Cyt c的还原率即为复合物III的活性(nmol ferricytochrome c reduced/min/mg protein)。
2.9. 统计分析
研究数据用SPSS 22.0软件进行统计分析。除非另有说明的数据外,其他所有数据均以平均数±标准差表示。符合正态分布的计量资料,各组组间比较采用单因素方差分析,两两比较选用LSD检验。各组存活率的分析采用χ2检验,NDS的比较采用Kruskal-Wallis检验和Mann-Whitney U检验。P < 0.05认为有统计学意义。
3. 结果
3.1. 生理学参数和血流动力学数据
各组的一般资料,包括动物体重,体温,心率,血气值均无明显差异。各组CPR所用时间在N组(35.5 ± 4.3 s)和HOE-642 1 mg/kg用药组(36.4 ± 3.3 s)明显比HOE-642 5 mg/kg 用药组(44.3 ± 7.0 s,P < 0.05)低。复苏率在N组(84.4%),HOE-642 1 mg/kg用药组(79.3%),和HOE-642 5 mg/kg用药组(82.3%)无明显差异。MAP的值如表1所示,在ROSC后的20 min到60 min时间段内,HOE 1 mg组和HOE 5 mg组的MAP分别比Hypo + HOE 1 mg组和Hypo + HOE 5 mg组明显偏低(P < 0.05);N组的MAP和所有的HOE-642用药组相比没有统计学差异。
3.2. 存活率和神经功能评估
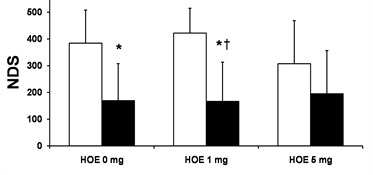
复苏成功后24 h的存活率如图1(a)所示,存活率在Hypo + HOE 1 mg组(85.7%)明显比N组(42.9%)和HOE 1 mg组(31.8%)高,P < 0.05;存活率在N组,Hypo组(70%),HOE 1 mg组,HOE 5 mg组(62.5%)和Hypo + HOE 5 mg组(55.6%)无明显差异。NDS评分如图1(b)所示,NDS评分在Hypo组和Hypo + HOE
 (a)
(a) 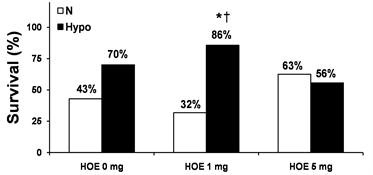 (b)Note: *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group. NDS, neurological deficit scores; N, normothermia; Hypo, hypothermia; HOE, HOE-642V. 注:*表示与N组比较,P < 0.05;†表示与HOE 1 mg组比较,P < 0.05。NDS代表神经损伤功能评估;N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
(b)Note: *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group. NDS, neurological deficit scores; N, normothermia; Hypo, hypothermia; HOE, HOE-642V. 注:*表示与N组比较,P < 0.05;†表示与HOE 1 mg组比较,P < 0.05。NDS代表神经损伤功能评估;N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
Figure 1. Survival and NDS at 24 h after resuscitation
图1. 复苏后24 h的存活率和神经功能损伤评估
Table 1. MAP during the course of the experiment
表1. 各组动物实验期间平均动脉压的情况
Note: Data are expressed as mean ± SD. *P < 0.05 vs. the N group at the same time point; †P < 0.05 vs. the HOE 1 mg group at the same time point; ‖P < 0.05 vs. the HOE 5 mg group at the same time point. MAP, mean arterial pressure, mmHg; ROSC, return of spontaneous circulation; N, normothermia; Hypo, hypothermia; HOE, HOE-642. 注:数据用均数±标准差表示。*表示与N组比较P < 0.05;†表示与HOE 1 mg组比较P < 0.05;‖表示与HOE 5 mg组比较P < 0.05。MAP代表平均动脉压;ROSC代表自主循环恢复;N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
1 mg组明显比N组的低(P < 0.05);在Hypo + HOE 1 mg组明显比HOE 1 mg组的低(P < 0.05);在N组,HOE 1 mg组,HOE 5 mg组和Hypo + HOE 5 mg组没有统计学差异。
3.3. 线粒体膜电位和肿胀
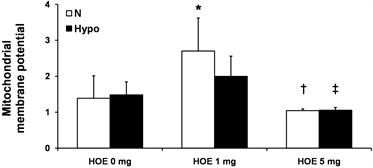
线粒体膜电位如图2(a)所示,ΔΨm在HOE 1 mg组明显比N组和HOE 5 mg组高(P < 0.05);在Hypo + HOE 1 mg组明显比Hypo + HOE 5 mg组高(P < 0.05);ΔΨm在N组,Hypo组,HOE 5 mg组和Hypo + HOE 5 mg组没有明显的差异。线粒体的肿胀如图2(b)所示,线粒体肿胀程度在N组比Hypo组,HOE 1 mg组更严重(P < 0.05);肿胀度在Hypo组,HOE 1 mg组,Hypo + HOE 1 mg组,HOE 5 mg组和Hypo + HOE 5 mg组没有明显的统计学差异。
3.4. 线粒体ROS的产生
线粒体ROS的产生如图3所示。ROS的产生在N组明显比HOE 1 mg组和Hypo + HOE 1 mg组增多(P < 0.05);在HOE 5 mg组明显比HOE 1 mg组增多(P < 0.05);在Hypo组,HOE 1 mg组,Hypo + HOE 1 mg组和Hypo + HOE 5 mg组的无明显统计学意义。
 (a)
(a)
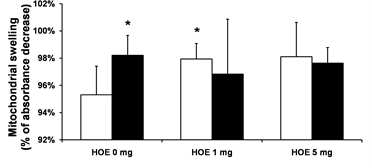 (b) Note: Data are expressed as mean ± SD, n = 5 - 7/group. *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group; ‡P < 0.05 vs. the Hypo + HOE 1 mg group. N, normothermia; Hypo, hypothermia; HOE, HOE-642. 注:数据用均数±标准差表示,每组5~7例。*表示与N组比较P < 0.05;†表示与HOE 1 mg 组比较P < 0.05;‡表示与Hypo + HOE 1 mg组比较P < 0.05。N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
(b) Note: Data are expressed as mean ± SD, n = 5 - 7/group. *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group; ‡P < 0.05 vs. the Hypo + HOE 1 mg group. N, normothermia; Hypo, hypothermia; HOE, HOE-642. 注:数据用均数±标准差表示,每组5~7例。*表示与N组比较P < 0.05;†表示与HOE 1 mg 组比较P < 0.05;‡表示与Hypo + HOE 1 mg组比较P < 0.05。N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
Figure 2. Mitochondrial transmembrane potential and swelling
图2. 线粒体膜电位和线粒体的肿胀程度
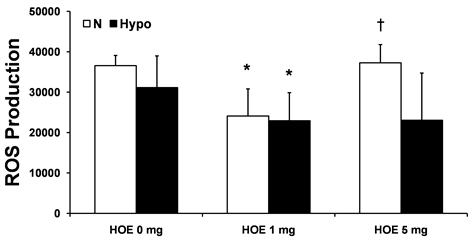 Note: Data are expressed as mean ± SD, n = 5 - 7/group. *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group. ROS, reactive oxygen species; N, normothermia; Hypo, hypothermia; HOE, HOE-642. 注:数据用均数±标准差表示,每组5~7例。*表示与N组比较P < 0.05;†表示与HOE 1 mg组比较P < 0.05。N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
Note: Data are expressed as mean ± SD, n = 5 - 7/group. *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group. ROS, reactive oxygen species; N, normothermia; Hypo, hypothermia; HOE, HOE-642. 注:数据用均数±标准差表示,每组5~7例。*表示与N组比较P < 0.05;†表示与HOE 1 mg组比较P < 0.05。N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
Figure 3. Mitochondrial ROS production
图3. 线粒体氧化应激活性氧的产生
3.5. 复合物I和III的活性
线粒体复合物的活性如图4所示。复合物I的活性在Hypo + HOE 1 mg组明显比N组,HOE 1 mg组和Hypo + HOE 5 mg组高(P < 0.05,见图4(a));复合物III的活性在Hypo + HOE 1 mg组明显比N组,HOE 1 mg组和Hypo + HOE 5 mg组高(P < 0.05,见图4(b))。
4. 讨论
有很多报道都已经证明HOE-642在缺血/再灌注损伤中是有保护效应的 [13] [14] [17] ,然而,HOE-642不同的剂量在心脏骤停模型中对神经线粒体功能所产生保护效应目前还不清楚。我们的数据表明,相比于N组和HOE-642 5 mg/kg用药组,HOE-642 1 mg/kg用药组对复苏后神经线粒体功能更有益。此外,复苏前静注HOE-642 1 mg/kg的剂量并复合低温,相比于单独采用低温或单独静注HOE-642,提高了复苏后24 h的存活率,以及神经功能的恢复。HOE-642 1 mg/kg复合低温显示出了有利的效应,而HOE-642 5 mg/kg的剂量复合低温并没有显示出其保护效应。而且还有一点,复苏前静注HOE-642 5 mg/kg的剂量延长了心脏骤停后复苏时间,但对复苏率并没有影响。
已有研究指出,脑皮质神经元细胞NHE1活性的激活,将导致细胞内Na+超载,继而触发细胞外的Ca2+通过细胞膜上的Na+/Ca2+反向交换模式涌入细胞内,从而导致细胞内或线粒体内Ca2+超载 [18] 。线粒体内Ca2+超载是线粒体死亡途径的主要触发机制,主要表现为线粒的膜蛋白缺失,膜电位下降,mPTP开放,线粒体内的Cyt c释放,以及ROS的产生增加 [19] [20] 。所以,抑制NHE1的激活,可以防止细胞内和线粒体内的Ca2+超载,从而减低Ca2+所介导的一系列有害事件。在本研究中,我们发现复苏前静注HOE-642 1 mg/kg的剂量,增加了膜电位,以及预防线粒体的肿胀,减少了线粒体ROS的产生。而复苏前静注HOE-642 5 mg/kg的剂量,展现出了明显不利的结果。也许是因为相比于使用HOE-642 1 mg/kg
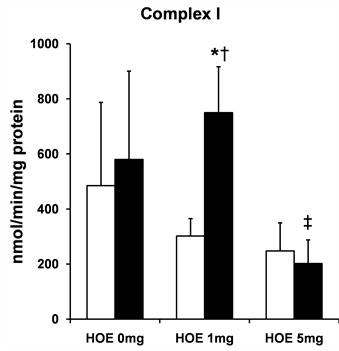 (a)
(a)
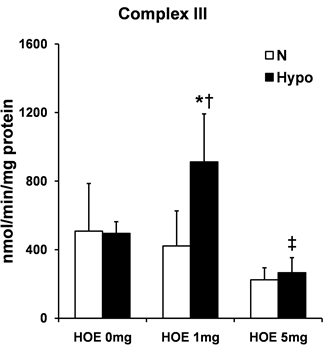 (b)Note: Data are expressed as mean ± SD, n = 5 - 7/group. *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group; ‡P < 0.05 vs. the Hypo + HOE 1 mg group. N, normothermia; Hypo, hypothermia; HOE, HOE-642. 注:数据用均数±标准差表示,每组5~7例。*表示与N组比较P < 0.05;†表示与HOE 1 mg 组比较P < 0.05;‡表示与Hypo + HOE 1 mg组比较P < 0.05。N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
(b)Note: Data are expressed as mean ± SD, n = 5 - 7/group. *P < 0.05 vs. the N group; †P < 0.05 vs. the HOE 1 mg group; ‡P < 0.05 vs. the Hypo + HOE 1 mg group. N, normothermia; Hypo, hypothermia; HOE, HOE-642. 注:数据用均数±标准差表示,每组5~7例。*表示与N组比较P < 0.05;†表示与HOE 1 mg 组比较P < 0.05;‡表示与Hypo + HOE 1 mg组比较P < 0.05。N代表常温;Hypo代表低温;HOE代表实验用药HOE-642。
Figure 4. Mitochondrial ROS production
图4. 线粒体呼吸链复合物I和复合物III的活性
的剂量,使用5 mg/kg这样高剂量的HOE-642更明显的抑制了NHE1的活性。而且已证实,NHE1不仅是一个脑缺血出现细胞内酸中毒后,细胞内酸性物质排除的重要机制,也是一个重要的信号分子 [21] [22] 。复苏前静注了HOE-642 5 mg/kg剂量的大鼠,因NHE1活性被明显抑制,在心脏骤停脑缺血,出现细胞内酸性物质堆积时,不能进行细胞内正常的pH调节,也会引起大脑不同区域某些基因的表达,这些都会加剧神经元细胞的坏死和凋亡,反过来削弱了HOE-642所能产生的神经保护效应。
心脏骤停导致血流中断,大脑和全身系统氧供减少,有氧代谢活动急剧下降,即使无氧代谢增加,也不能为机体提供充足的ATP。线粒体呼吸链受损,导致线粒体氧化磷酸化障碍 [23] 。据报道,细胞内高达90%的ROS都产生于线粒体电子传递链中,尤其是在复合物I和复合物III传递的环节,通常是由于发生电子漏出 [24] 。也有其他研究指出,复合物I和复合物III是ROS产生的主要部位,而且比起其他电子传递链的复合物,复合物I和复合物III的活性在发生缺血时更易受损 [23] [25] [26] 。在本研究中,我们发现,复苏前静注1 mg/kg剂量的HOE-642并且复合低温明显的减少了ROS的产生;同时HOE-642 1 mg/kg的剂量复合低温明显的增加了线粒体复合物I和复合物III的活性。这一结果与前面探讨的HOE-642 1 mg/kg的剂量复合低温,相比于HOE-642 5 mg/kg的剂量,提高了复苏后的生存率以及神经功能的恢复是一致的。
综上所述,心脏骤停后,复苏前静注HOE-642 1 mg/kg的剂量比静注HOE-642 5 mg/kg的剂量对神经线粒体的功能更有益。此外,静注HOE-642 1 mg/kg的剂量并复合中度低温也展现出更有益的结果,提高了复苏后的存活率,改善了神经功能的恢复,保护了线粒体的功能;而HOE-642 5 mg/kg的剂量复合低温并没有展现出明显有益的结果。
致谢
所有作者由衷地感谢哈尔滨医科大学附属第二医院麻醉与危重病学重点实验室各位老师对实验技术以及实验条件的支持与帮助。
基金项目
黑龙江省留学归国人员科学基金(LC2012C40);哈尔滨医科大学附属第三医院海燕基金重点项目(JJZD2014-02)。
文章引用
魏兰璎,赵文帅,王喜繁,胡亚楠,韩 非. 评价不同剂量的HOE-642对大鼠心脏骤停后神经线粒体功能的保护作用
The Effects of Different Doses of HOE-642 for the Protection of Neuronal Mitochondrial Function after Cardiac Arrest in Rats[J]. 临床医学进展, 2018, 08(02): 238-246. https://doi.org/10.12677/ACM.2018.82041
参考文献
- 1. Chan, P.H. (2005) Mitochondrial Dysfunction and Oxidative Stress as Determinants of Cell Death/Survival in Stroke. Annals of the New York Academy of Sciences, 1042, 203-209.
https://doi.org/10.1196/annals.1338.022 - 2. Jaiswal, A.K. (2004) Nrf2 Signaling in Coordinated Activation of Antioxidant Gene Expression. Free Radical Biology & Medicine, 36, 1199-1207.
https://doi.org/10.1016/j.freeradbiomed.2004.02.074 - 3. Teshima, Y., Akao, M., Jones, S.P., et al. (2003) Cariporide (HOE642), a Selective Na+-H+ Exchange Inhibitor, Inhibits the Mitochondrial Death Pathway. Circulation, 108, 2275-2281.
https://doi.org/10.1161/01.CIR.0000093277.20968.C7 - 4. Hausenloy, D.J., Maddock, H.L., Baxter, G.F., et al. (2002) Inhibiting Mitochondrial Permeability Transition Pore Opening: A New Paradigm for Myocardial Preconditioning? Cardiovascular Research, 55, 534-543.
https://doi.org/10.1016/S0008-6363(02)00455-8 - 5. Wang, Y., Luo, J., Chen, X., et al. (2008) Gene Inactivation of Na+/H+ Exchanger Isoform 1 Attenuates Apoptosis and Mitochondrial Damage Following Transient Focal Cerebral Ischemia. The European Journal of Neuroscience, 28, 51-61.
https://doi.org/10.1111/j.1460-9568.2008.06304.x - 6. Karmazyn, M. (1996) The Sodium-Hydrogen Exchange System in the Heart: Its Role in Ischemic and Reperfusion Injury and Therapeutic Implications. The Canadian Journal of Cardiology, 12, 1074-1082.
- 7. Scholz, W., Albus, U., Counillon, L., et al. (1995) Protective Effects of HOE642, a Selective Sodium-Hydrogen Exchange Subtype 1 Inhibitor, on Cardiac Ischaemia and Reperfusion. Cardiovascular Research, 29, 260-268.
https://doi.org/10.1016/S0008-6363(96)88579-8 - 8. Myers, M.L. and Karmazyn, M. (1996) Improved Cardiac Function after Prolonged Hypothermic Ischemia with the Na+/H+ Exchange Inhibitor HOE 694. The Annals of Thoracic Surgery, 61, 1400-1406.
https://doi.org/10.1016/0003-4975(96)00088-4 - 9. Avkiran, M. (1996) Sodium-Hydrogen Exchange in Myo-cardial Ischemia and Reperfusion: A Critical Determinant of Injury? Myocardial Ischemia: Mechanisms, Reperfusion, Protection, 76, 299-311.
https://doi.org/10.1007/978-3-0348-8988-9_18 - 10. Frolich, O. and Karmazyn, M. (1997) The Na-H Exchanger Revisited: An Update on Na-H Exchange Regulation and the Role of the Exchanger in Hypertension and Cardiac Function in Health and Disease. Cardiovascular Research, 36, 138-148.
https://doi.org/10.1016/S0008-6363(97)00200-9 - 11. Chakrabarti, S., Hoque, A.N. and Karmazyn, M. (1997) A Rapid Ischemia-Induced Apoptosis in Isolated Rat Hearts and Its Attenuation by the Sodium-Hydrogen Exchange In-hibitor HOE 642 (Cariporide). Journal of Molecular and Cellular Cardiology, 29, 3169-3174.
https://doi.org/10.1006/jmcc.1997.0561 - 12. Ayoub, I.M., Kolarova, J., Yi, Z., et al. (2003) Sodium-Hydrogen Exchange Inhibition during Ventricular Fibrillation: Beneficial Effects on Ischemic Contracture, Action Potential Duration, Reperfusion Arrhythmias, Myocardial Function, and Resuscitability. Circulation, 107, 1804-1809.
https://doi.org/10.1161/01.CIR.0000058704.45646.0D - 13. Kolarova, J.D., Ayoub, I.M. and Gazmuri, R.J. (2005) Cariporide Enables Hemodynamically More Effective Chest Compression by Leftward Shift of Its Flow-Depth Relationship. American Journal of Physiology Heart and Circulatory Physiology, 288, H2904-H2911.
https://doi.org/10.1152/ajpheart.01181.2004 - 14. Ayoub, I.M., Kolarova, J. and Gazmuri, R.J. (2010) Cariporide Given during Resuscitation Promotes Return of Electrically Stable and Mechanically Competent Cardiac Activity. Re-suscitation, 81, 106-110.
https://doi.org/10.1016/j.resuscitation.2009.09.013 - 15. Castella, M., Buckberg, G.D. and Tan, Z. (2005) Neuro-logic Preservation by Na+-H+ Exchange Inhibition Prior to 90 Minutes of Hypothermic Circulatory Arrest. The Annals of Thoracic Surgery, 79, 646-654; discussion 646-654.
https://doi.org/10.1016/j.athoracsur.2004.07.007 - 16. Liakopoulos, O.J., Allen, B.S., Buckberg, G.D., et al. (2010) Resuscitation after Prolonged Cardiac Arrest: Role of Cardiopulmonary Bypass and Systemic Hyperkalemia. The Annals of Thoracic Surgery, 89, 1972-1979.
https://doi.org/10.1016/j.athoracsur.2010.02.052 - 17. Gazmuri, R.J., Ayoub, I.M., Hoffner, E., et al. (2001) Successful Ventricular Defibrillation by the Selective Sodium-Hydrogen Exchanger Isoform-1 Inhibitor Cariporide. Circulation, 104, 234-239.
https://doi.org/10.1161/01.CIR.104.2.234 - 18. Luo, J., Chen, H., Kintner, D.B., et al. (2005) Decreased Neuronal Death in Na+/H+ Exchanger Isoform 1-Null Mice after in Vitro and in Vivo Ischemia. The Journal of Neuroscience, 25, 11256-11268.
https://doi.org/10.1523/JNEUROSCI.3271-05.2005 - 19. Brookes, P.S., Yoon, Y., Robotham, J.L., et al. (2004) Calcium, ATP, and ROS: A Mitochondrial Love-Hate Triangle. American Journal of Physiology Cell Physiology, 287, C817-C833.
https://doi.org/10.1152/ajpcell.00139.2004 - 20. Cao, G., Xiao, M., Sun, F., et al. (2004) Cloning of a Novel Apaf-1-Interacting Protein: A Potent Suppressor of Apoptosis and Ischemic Neuronal Cell Death. The Journal of Neuroscience, 24, 6189-6201.
https://doi.org/10.1523/JNEUROSCI.1426-04.2004 - 21. Zhou, D., Xue, J., Gavrialov, O., et al. (2004) Na+/H+ Exchanger 1 Deficiency Alters Gene Expression in Mouse Brain. Physiological Genomics, 18, 331-339.
https://doi.org/10.1152/physiolgenomics.00076.2004 - 22. Cox, G.A., Lutz, C.M., Yang, C.L., et al. (1997) So-dium/Hydrogen Exchanger Gene Defect in Slow-Wave Epilepsy Mutant Mice. Cell, 91, 139-148.
https://doi.org/10.1016/S0092-8674(01)80016-7 - 23. Gong, P., Li, C.S., Hua, R., et al. (2012) Mild Hypothermia Attenuates Mitochondrial Oxidative Stress by Protecting Respiratory Enzymes and Upregulating MnSOD in a Pig Model of Cardiac Arrest. PLoS ONE, 7, e35313.
https://doi.org/10.1371/journal.pone.0035313 - 24. Balaban, R.S., Nemoto, S. and Finkel, T. (2005) Mitochondria, Oxidants, and Aging. Cell, 120, 483-495.
https://doi.org/10.1016/j.cell.2005.02.001 - 25. Busl, K.M. and Greer, D.M. (2010) Hypoxic-Ischemic Brain Injury: Pathophysiology, Neuropathology and Mechanisms. NeuroRehabilitation, 26, 5-13.
- 26. Almeida, A., Allen, K.L., Bates, T.E., et al. (1995) Effect of Reperfusion Following Cerebral Ischaemia on the Activity of the Mitochondrial Respiratory Chain in the Gerbil Brain. Journal of Neurochemistry, 65, 1698-1703.
https://doi.org/10.1046/j.1471-4159.1995.65041698.x
NOTES
*通讯作者。
