Advances in Clinical Medicine
Vol.
10
No.
07
(
2020
), Article ID:
36512
,
12
pages
10.12677/ACM.2020.107199
Prognostic Significance of the Bloodcell Parameters in Patients with Metastatic Gastric Cancer
Guanghui Zhao, Aiping Ding, Guohong Yu, Hui Li, Yingji Ma, Zhiwei Liang, Wensheng Qiu*
Department of Oncology, The Affiliated Hospital of Qingdao University, Qingdao Shandong

Received: Jun. 26th, 2020; accepted: Jul. 8th, 2020; published: Jul. 15th, 2020

ABSTRACT
Objective: The purpose of this study was to evaluate the significance of neutrophil-to-lymphocyte ratio (NLR) and platelet-to-lymphocyte ratio (PLR) on the prognosis of metastatic gastric cancer (GC). This was a retrospective review of 110 patients were at presentation diagnosed with stage IV metastatic GC and all patients received palliative chemotherapy between January 2012 and January 2016 at the Affiliated Hospital of Qingdao University. Pretreatment NLR and PLR, as well as clinicopathological characteristics were collected. Patients were divided into high and low groups according to the cutoff values for NLR and PLR. The Kaplan-Meier method was applied to estimate the overall survival (OS) and progress free survival (PFS) the Cox proportional hazards model to evaluate the related risk factors for OS. All tests were 2-tailed and a P < 0.05 was considered to indicate a statistically significant difference. Results: Patients with high NLR and high PLR had poor overall survival compared with those who had low NLR and low PLR. Our multivariate analysis had indicated that high NLR and peritoneal metastasis was independent prognostic factors for overall survival; however, the PLR was not shown to be an independent prognostic factor. Conclusions: NLR is related to the poor clinicopathological characteristics of gastric cancer patients, and is an independent prognostic risk factor for OS and PFS. PLR is an independent risk factor for PFS.
Keywords:Gastric Cancer, Hematological Indicators, Prognosis

血常规参数对转移性胃癌患者的预后分析
赵光辉,丁爱萍,于国红,李晖,马英骥,梁志威,邱文生*
青岛大学附属医院肿瘤科,山东 青岛

收稿日期:2020年6月26日;录用日期:2020年7月8日;发布日期:2020年7月15日

摘 要
目的:本研究探讨中性粒细胞与淋巴细胞比值(NLR)及血小板与淋巴细胞比值(PLR)与转移性胃癌(metastatic gastric carcer, mGC)患者临床病例特征关系及预后的影响。方法:本文采用回顾性统计分析方法,搜集我院的110例确诊为IV期转移性胃癌的患者的临床病理特征。统计分析在SPSS 24.0统计软件中进行。用Kaplan-Meier方法绘制总生存期(OS, Overall Survival)、无进展生存期(PFS, Progression Free Survival)与NLR、PLR的关系。Cox比例危险度模型评价OS、PFS的相关危险因素。结果:低NLR组的OS和PFS均高于高NLR组,低PLR组的OS和PFS均高于高PLR组。高NLR和腹膜转移是OS的独立危险因素。高NLR和高PLR是PFS的独立危险因素。结论:NLR与胃癌患者的较差的临床病理特征相关,且是OS、PFS独立预后危险因素。此外,PLR是PFS的独立危险因素。
关键词 :胃癌,血常规参数,预后

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
胃癌(Gastric cancer, GC)在肿瘤中的发病率居第五位,是世界第三大肿瘤相关死亡主要原因 [1]。我国又是胃癌的高发国家,大多数胃癌患者初次确诊时,即发生不同部位及器官的转移,因此生存率总体较差。流行病学研究表明,全世界15%~20%的肿瘤死亡与潜在的感染和炎症反应相关 [2]。外周中性粒细胞与淋巴细胞比值(NLR)和血小板与淋巴细胞比值(PLR)反映了这些炎症因子和相关细胞的变化。研究表明,NLR和PLR是多种肿瘤的预后相关因素,包括软组织肉瘤、肺癌、结直肠癌 [3] [4] [5];然而,目前还没有观察到NLR和PLR对胃癌腹膜转移等其他转移部位生存的影响。也没有观察到NLR对不同转移部位亚群之间的影响。为了预测胃癌不同亚组之间的生存期,本研究回顾性分析了化疗前NLR和PLR对胃癌OS、PFS的影响,特别是NLR对不同转移部位生存获益的影响,全面评估NLR和PLR对预测胃癌患者预后的能力,为胃癌患者的诊治、预后的判断提供参考。
2. 资料与方法
2.1. 研究对象
回顾性分析2012年1月至2016年1月于青岛大学附属医院初次诊断IV期转移性胃癌的患者,所有患者均在青岛大学附属医院接受姑息性化疗。本研究项目已由青岛市附属医院伦理委员会批准。
2.1.1. 纳入标准
1) 经组织学证实为胃腺癌;2) 无感染、白血病和炎症相关疾病;3) 既往无抗肿瘤治疗;4) 其他部位无原发肿瘤;5) 完整的病历资料;6) 治疗前未服用促细胞生成药物;7) 至少有一个可测量或可评估的病灶不符合根治性切除的条件;8) 所有患者均接受以氟尿嘧啶为基础的化疗方案。
2.1.2. 排除标准
1) 严重的肝肾、心脏功能损害;2) 初次化疗前合并发热、糖尿病、血液系统疾病、其他创伤类疾病合并严重感染者;3) 已确诊的双源发肿瘤;4) 没有定期的随访评估。
2.2. 资料搜集
搜集开始行姑息性化疗前一天的临床病理特征包括性别、年龄、ECOG、胃癌具体原发组织部位、转移部位。有无肝转移,转移部位数目,CEA水平(CEA根据青岛大学检验科标准,以5 ng/ml为界值,分为CEA < 5组和CEA ≥ 5组),有无左锁骨上淋巴结,有无H. pylori感染,有无腹膜转移,HER2表达状态,CA199值(根据青岛大学检验科标准,以45 U/ml为界值,分为CA199 < 45组,和CA199 ≥ 45组)、中性粒细胞计数、淋巴细胞计数、血小板计数。由中性粒细胞计数和淋巴细胞计数相比获得NLR。PLR由血小板计数除以淋巴细胞计数获得。OS时间定义为从患者初次化疗时间到死亡或最后一次随访评估的时间。PFS定义为从患者初次化疗时间到第一次影像学评估为疾病进展的时间 [6]。所有患者均接受以氟尿嘧啶为基础的化疗方案。根据实体瘤反应评估标准(Response Evaluation Criteria in Solid Tumor, RECIST [1.1版])对原发性和转移性肿瘤病灶进行基线评估,疾病进展(progressive disease, PD):所有测量的靶病灶最大径之和增加>20%或出现新病灶 [7]。
2.3. 数据统计
应用受试者工作曲线(ROC: receiver operating characteristic)曲线,计算NLR和PLR 的最大约登指数,确定NLR和PLR的最佳临界点。采用Kaplan-Meier法对各组患者的OS、PFS进行分析。使用卡方检验或Fisher精确概率法检验评估年龄、性别、EOCG评分,转移的具体部位、HER2表达情况等临床病例特征与NLR和PLR的相关性。应用单变量和多变量Cox回归分析检验OS、PFS的独立危险因子。以上分析均使用SPSS 24.0进行。P < 0.05表示有统计学意义。
3. 结果
3.1. 患者基本临床特征
NLR曲线下面积(AUC)为0.845,基于ROC曲线的最佳截止值为2.48 (P = 0.005)。PLR的AUC为0.675,基于ROC曲线的最优截止值为143.39 (P = 0.002)。在表1中,我们删除失访病例后,符合标准的病例有110例,根据NLR和PLR的临界值将患者分为各亚组,各亚组的临床病理特征如表1:
Table 1. Association of the patients’ characteristics with the neutrophil-to-lymphocyte and platelet-to-lymphocyte ratio
表1. 患者临床病例特征与中性粒细胞/淋巴细胞及血小板/淋巴细胞比值的关系
a:连续性校正;*:P < 0.05;#:Fisher确切概率法。
NLR升高与高龄(P = 0.008)、肝转移(P < 0.001)、H. pylori感染(P = 0.008)、腹膜转移(P = 0.003)显著相关。PLR与肝转移(P = 0.021)、男性(P = 0.048)、H. pylori感染(P = 0.008)有关,与年龄、HER2表达状态、CA199水平、转移部位的个数、左颈淋巴结转移无关。
3.2. 总生存率各NLR和各PLR组的生存率
如表2所示,110例患者的1年、3年和5年OS分别为48.19%、11.82%和2.73%。对于高NLR患者,1年、3年和5年的OS分别为24.49%、6.12%和0.00%。对于低NLR的患者,1年、3年和5年的OS分别为67.21%、16.40%和4.92%。对于高PLR的患者,1年、3年和5年的OS分别为35.21%、9.89%和0.00%。低PLR患者的1年、3年和5年OS分别为71.79%、15.38%和7.69%。
Table 2. The overall survival (OS) of patients
表2. 各组患者的OS
3.3. OS的单因素和多因素分析
如表3所示,根据单因素分析,年龄(P = 0.013)、肝转移(P = 0.001)、1个以上转移部位(P = 0.028)、较高的NLR (P < 0.001)、腹膜转移(P = 0.002)和较高的PLR (P = 0.014)被认为是与OS相关的不良预后因素。基于Cox回归模型对这些参数的多因素分析,只有NLR (HR: 1.617, 95%CI: 1.032~2.525, P = 0.036)和腹膜转移(HR: 1.547, 95%CI: 1.009~2.454, P = 0.045)被确定为与OS相关的独立预后因素。
Table 3. Univariate and multivariate analyses of factors for the prediction of overall survival
表3. OS相关的单因素及多因素分析
95%CI:95%可信区间;HR:危险比;NLR:中性粒细胞与淋巴细胞比值;PLR:血小板与淋巴细胞比值;*:P < 0.05;CEA:癌胚抗原;CA199:癌胚抗原199;ECOG体力状态评分;HER2人表皮生长因子受体2。
3.4. PFS的单因素和多因素分析
如表4在PFS相关的单因素分析结果中,肝转移(P = 0.028)、高NLR (P < 0.001)、高PLR (P = 0.002)是其不良预后因素。多因素分析中,高NLR (HR: 3.148, 95%CI: 1.916~5.172, P < 0.001)和高PLR (HR: 1.810, 95%CI: 1.113~2.944, P = 0.017)是PFS的独立危险因素。
Table 4. Univariate and multivariate analyses of factors for the prediction of progression free survival
表4. PFS相关的单因素及多因素分析
95%CI:95%可信区间;HR:危险比;NLR:中性粒细胞与淋巴细胞比值;PLR:血小板与淋巴细胞比;*:P < 0.05; CEA:癌胚抗原;CA199:癌胚抗原199;ECOG体力状态评分;HER2:人表皮生长因子受体2。
3.5. 各亚组患者的OS及PFS
3.5.1. 不同NLR和不同PLR之间OS比较
在图1和图2中,所有患者的中位总生存时间(OS)为11.5个月。高NLR组的中位OS为8.37个月。低NLR组中位OS为17.47个月(P < 0.001)。高PLR组和低PLR组的中位OS分别为9.60个月和15.1个月(P = 0.013)。6.2不同NLR和不同PLR之间PFS比较。
3.5.2. 不同NLR和不同PLR之间PFS比较
在图3和图4中,所有患者的中位无进展生存期时间(PFS)为11.4个月。高NLR组的PFS时间为8.7个月,低NLR组中位PFS为15.9个月(P < 0.001)。高PLR组和低PLR组的中位PFS分别为9.30个月和15.5个月(P = 0.001)。

Figure 1. Kaplan-Meier survival curves of overall survival according to the neutrophil-to-lymphocyte ratio (NLR)
图1. NLR与患者OS之间的K-M生存曲线

Figure 2. Kaplan-Meier survival curves of overall survival according to the platelet-to-lymphocyte ratio (PLR)
图2. PLR与患者OS之间的K-M生存曲线

Figure 3. Kaplan-Meier survival curves of progression free survival according to the neutrophil-to-lymphocyte ratio (NLR)
图3. NLR与患者PFS之间的K-M生存曲线
3.5.3. 对影响OS的单因素的OS进行分层分析
图5显示了根据最佳临界值分为高低NLR两组后,又按年龄、有无肝转移、有无腹膜转移这些影响OS的单因素,分为各亚组,通过Kaplan-Meier曲线分析各亚组的生存曲线。高NLR和低NLR在<65岁和≥65岁的患者中都有意义。在<65岁组,低NLR组的中位OS为18.1个月,而高NLR组的中位OS为10.03个月(P = 0.036)。在年龄 ≥ 65岁组中,低NLR组的中位OS位13.1个月,而高NLR组的中位OS位9.2个月(P = 0.01)。在没有腹膜转移的患者,NLR的值对生存影响的差异没有统计学意义(P = 0.26)。在腹膜转移组患者中,低NLR组的中位OS为13.03个月,高NLR组的中位OS为8.38个月(P = 0.001)。在没有肝转移(P = 0.15)的亚组中,NLR的值对生存的影响的差异没有统计学意义。在肝转移组患者中,高NLR亚组的中位OS为6.7个月,而低NLR亚组中位OS为17.47个月(P = 0.002)。
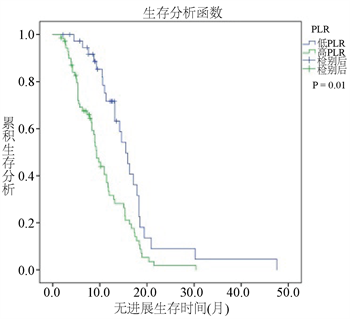
Figure 4. Kaplan-Meier survival curves of progression free surviva according to the platelet-to-lymphocyte ratio (PLR)
图4. PLR与患者PFS之间的K-M生存曲线

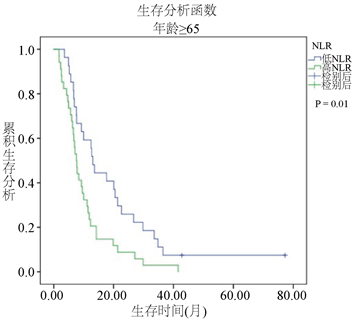

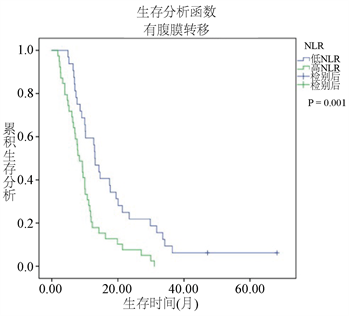


Figure 5. Kaplan-Meier survival curves of overall survival according to the significant variables based on overall survival univariate analysis
图5. 与OS有相关性的单因素的各变量亚组的OS生存曲线
4. 讨论
尽管由于化疗药物的发现,胃癌患者接受化学治疗后,生存期有一定的改善,但是由于晚期胃癌易出现远处转移,其预后仍然不容乐观 [8]。因此,确定一个准确预测预后的指标具有重要意义。
炎症反应是肿瘤细胞微环境中的一个重要因素,对肿瘤组织损伤的修复具有重要意义。NLR和PLR是肿瘤微环境炎症反应的两个替代标记。升高的NLR代表的是中性粒细胞增多和/或淋巴细胞数量减少的炎症状态;高PLR意味着血小板增多、淋巴细胞减少或两者兼而有之。NLR和PLR值的升高可通过多种机制影响肿瘤患者的预后。Hirashima报道,NLR升高的早期胃癌患者通过活化的中性粒细胞产生大量的细胞因子,如CD10和CD35,对胃癌的发展有不良影响 [9]。Spicer等指出,中性粒细胞是循环肿瘤细胞和转移部位两者的纽带 [10]。
淋巴细胞是免疫监视和免疫编辑的关键媒介,淋巴细胞渗入肿瘤微环境是免疫抗肿瘤反应的先决条件 [11]。越来越多的观察表明,T淋巴细胞可以通过诱导抗肿瘤反应来消除癌细胞并阻止肿瘤进展。肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes: TILs)数量的增加具有一定的抗肿瘤作用 [12] [13]。相反,淋巴细胞数量减少和未能浸润肿瘤导致肿瘤患者生存率降低。此外,已有实验证明CD 8+和CD 4+T淋巴细胞相互作用通过诱导肿瘤细胞凋亡是免疫系统抗肿瘤反应的关键 [14]。一般来说,淋巴细胞数量低可能是肿瘤对免疫反应弱、反应不足的原因。然而,在炎症前肿瘤状态下,中性粒细胞可抑制淋巴细胞介导的有效免疫反应。
血小板是另一个预测患者预后的简便参数。正常情况下,血小板的可通过募集炎症细胞来修复受损组织。然而,在慢性炎症条件下,促炎介质细胞因子会增加血小板的形成。血小板活化刺激肿瘤生长、播散和血管生成。血小板和肿瘤细胞之间涉及肿瘤微环境的多种成分的复杂相互作用 [15]。普遍认为血小板增多症(PLT ≥ 400 × 109/L)是生存率降低的独立危险因素 [16]。据报道,肿瘤细胞可以分泌血小板生成素,如白细胞介素-6 (IL-6)可刺激肿瘤患者血小板生成 [15]。以往的研究表明,一些血小板受体,如GP1b/IX/V和P-选择素,与肿瘤的生长相关,并通过细胞因子、血管内皮生长因子(VEGF)促进血管生成,从而促进肿瘤的进展 [17]。血小板聚集和脱颗粒以及肿瘤微血管内血小板源性血管生成介质的释放也可能是促进肿瘤生长的重要决定因素 [18]。
已有充分的证据支持NLR和PLR在一些实体瘤中的预后价值。Mori等人研究分析了100名II-III期胃癌患者,已NLR的中位数定义临界值,结果提示高NLR预示着OS (P < 0.001)和RFS (P < 0.001)较差 [19]。Diema等人研究了nivolumab治疗的52例非小细胞肺癌患者治疗前NLR的作用,使用NLR和PLR的三分位数将病人分为3组,结果提示高NLR和高PLR与更短的OS (P < 0.001)和PFS (P = 0.114)显著相关 [4]。在Wang等人回顾性分析了273例接受一线化疗的转移性胃癌患者,根据单变量和多变量分析,低PLR与较长OS相关 [20]。
综上所述,肿瘤的进展与治疗前外周血中的NLR和PLR密切相关,并具有一定的预测价值。我们希望这一经济实用的指标能够成为不能手术切除的晚期胃癌治疗策略的可靠的生物标志物。
基金项目
国家自然科学基金项目(编号:81602338,81602068)。
文章引用
赵光辉,丁爱萍,于国红,李 晖,马英骥,梁志威,邱文生. 血常规参数对转移性胃癌患者的预后分析
Prognostic Significance of the Bloodcell Parameters in Patients with Metastatic Gastric Cancer[J]. 临床医学进展, 2020, 10(07): 1312-1323. https://doi.org/10.12677/ACM.2020.107199
参考文献
- 1. Bray, F., Ferlay, J., Soerjomataram, I., et al. (2018) Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 68, 394-424. https://doi.org/10.3322/caac.21492
- 2. Balkwill, F. and Mantovani, A. (2001) Inflammation and Cancer: Back to Virchow? The Lancet, 357, 539-545. https://doi.org/10.1016/S0140-6736(00)04046-0
- 3. Liu, G., Ke, L.C. and Sun, S.R. (2018) Prognostic Value of Pretreatment Neutrophil-to-Lymphocyte Ratio in Patients with Soft Tissue Sarcoma: A Meta-Analysis. Medicine (Baltimore), 97, e12176. https://doi.org/10.1097/MD.0000000000012176
- 4. Diem, S., Schmid, S., Krapf, M., et al. (2017) Neutrophil-to-Lymphocyte Ratio (NLR) and Platelet-to-Lymphocyte Ratio (PLR) as Prognostic Markers in Patients with Non-Small Cell Lung Cancer (NSCLC) Treated with Nivolumab. Lung Cancer, 111, 176-181. https://doi.org/10.1016/j.lungcan.2017.07.024
- 5. Cha, Y.J., Park, E.J., Baik, S.H., et al. (2019) Clinical Significance of Tumor-Infiltrating Lymphocytes and Neutrophil-to-Lymphocyte Ratio in Patients with Stage III Colon Cancer Who Underwent Surgery Followed by FOLFOX Chemotherapy. Scientific Reports, 9, Article No. 11617. https://doi.org/10.1038/s41598-019-48140-1
- 6. Ozer-Stillman, I., Strand, L., Chang, J., et al. (2014) Meta-Analysis for the Association between Overall Survival and Progression-Free Survival in Gastrointestinal Stromal Tumor. Clinical Cancer Research, 21, 295-302. https://doi.org/10.1158/1078-0432.CCR-14-1779
- 7. Schwartz, L.H., Litière, S., de Vries, E., et al. (2016) RECIST 1.1—Update and Clarification: From the RECIST Committee. European Journal of Cancer, 62, 132-137. https://doi.org/10.1016/j.ejca.2016.03.081
- 8. Kim, Y.J., Chung, W.C., Youn, G.J., et al. (2019) The Predictive Factors of Gastric Cancer Recurrence after the Completion of Adjuvant Chemotherapy in Advanced Gastric Cancer. Revista Espanola de Enfermedades Digestivas, 111, 537-542. https://doi.org/10.17235/reed.2019.6041/2018
- 9. Jin, H., Zhang, G., Liu, X., et al. (2013) Blood Neutrophil-Lymphocyte Ratio Predicts Survival for Stages III-IV Gastric Cancer Treated with Neoadjuvant Chemotherapy. World Journal of Surgical Oncology, 11, 112. https://doi.org/10.1186/1477-7819-11-112
- 10. Shaul, M.E. and Fridlender, Z.G. (2017) Neutrophils as Active Regulators of the Immune System in the Tumor Microenvironment. Journal of Leukocyte Biology, 102, 343-349. https://doi.org/10.1189/jlb.5MR1216-508R
- 11. Hoffmann, T.K., Dworacki, G., Tsukihiro, T., et al. (2002) Spontaneous Apoptosis of Circulating T Lymphocytes in Patients with Head and Neck Cancer and Its Clinical Importance. Clinical Cancer Research, 8, 2553-2562.
- 12. Zheng, X., et al. (2017) Prognostic Role of Tumor-Infiltrating Lymphocytes in Gastric Cancer: A Meta-Analysis. Oncotarget, 8, 57386-57398. https://doi.org/10.18632/oncotarget.18065
- 13. Yu, X., Zhang, Z., Wang, Z., et al. (2016) Prognostic and Predictive Value of Tumor-Infiltrating Lymphocytes in Breast Cancer: A Systematic Review and Meta-Analysis. Clinical and Translational Oncology, 18, 497-506. https://doi.org/10.1007/s12094-015-1391-y
- 14. Sa, R. (2001) Progress in Human Tumour Immunology and Immunotherapy. Nature, 411, 380-384. https://doi.org/10.1038/35077246
- 15. Bambace, N.M. and Holmes, C.E. (2011) The Platelet Contribution to Cancer Progression. Journal of Thrombosis and Haemostasis, 9, 237-249. https://doi.org/10.1111/j.1538-7836.2010.04131.x
- 16. Ma, X., Wang, Y., Sheng, H., et al. (2014) Prognostic Significance of Thrombocytosis, Platelet Parameters and Aggregation Rates in Epithelial Ovarian Cancer. Journal of Obstetrics and Gynaecology Research, 40, 178-183. https://doi.org/10.1111/jog.12151
- 17. Menter, D.G., Tucker, S.C., Kopetz, S., et al. (2014) Platelets and Cancer: A Casual or Causal Relationship: Revisited. Cancer and Metastasis Reviews, 33, 231-269. https://doi.org/10.1007/s10555-014-9498-0
- 18. Sierko, E. and Wojtukiewicz, M.Z. (2004) Platelets and Angiogenesis in Malignancy. Seminars in Thrombosis and Hemostasis, 30, 95-108. https://doi.org/10.1055/s-2004-822974
- 19. Pw, S. and Fr, B. (2003) Tumour Necrosis Factor Alpha: A Potential Target for the Therapy of Solid Tumours. The Lancet Oncology, 4, 565-573. https://doi.org/10.1016/S1470-2045(03)01196-3
- 20. Wang, J., Qu, J.L., Li, Z., et al. (2018) Pretreatment Platelet-to-Lymphocyte Ratio Is Associated with the Response to First-Line Chemotherapy and Survival in Patients with Metastatic Gastric Cancer. Journal of Clinical Laboratory Analysis, 32. https://doi.org/10.1002/jcla.22185
NOTES
*通讯作者。
