Advances in Clinical Medicine
Vol.
14
No.
02
(
2024
), Article ID:
80479
,
7
pages
10.12677/ACM.2024.142343
血清LYVE1与类风湿性关节炎的相关性分析
李骁瀚1,张小钰2,王洪星1,张义1*
1山东大学齐鲁医院检验科,山东 济南
2中国人民解放军联勤保障部队第九六〇医院检验科,山东 济南
收稿日期:2024年1月5日;录用日期:2024年1月31日;发布日期:2024年2月5日

摘要
目的:探究血清中淋巴管内皮透明质酸受体-1 (LYVE1)与类风湿性关节炎(RA)红细胞沉降率(ESR)以及RA相关血清标志物的相关性。方法:收集类风湿性关节炎、骨关节炎(OA)与健康体检者全血各10例,分别检测全血标本的红细胞沉降率以及血清中类风湿因子(RF)、抗循环瓜氨酸肽(Anti-CCP)抗体、C-反应蛋白(CRP)、LYVE1含量。通过泊松分布(Poisson distribution)模型分析血清中的LYVE1与其余血清学指标的相关性。结果:RA患者血清中LYVE1含量明显低于OA患者与健康体检者,差异具有统计学意义(p < 0.05)。RA患者血清中的LYVE1与ESR、RF、Anti-CCP抗体、CRP呈负相关。结论:LYVE1或许可以作为一种全新的血清标志物用于临床诊断RA与评估RA的进展。
关键词
类风湿性关节炎,LYVE1,血清标志物

Correlation Analysis between Serum LYVE1 and Rheumatoid Arthritis
Xiaohan Li1, Xiaoyu Zhang2, Hongxing Wang1, Yi Zhang1*
1Department of Clinical Laboratory, Qilu Hospital of Shandong University, Jinan Shandong
2Department of Clinical Laboratory, The 960th Hospital of PLA Joint Logistics Support Force, Jinan Shandong
Received: Jan. 5th, 2024; accepted: Jan. 31st, 2024; published: Feb. 5th, 2024

ABSTRACT
Objective: To explore the correlation between serum lymphatic endothelial hyaluronic acid receptor-1 (LYVE1) and rheumatoid arthritis (RA) erythrocyte sedimentation rate (ESR) and RA-related serum markers. Methods: Whole blood samples were collected from 10 cases, each of rheumatoid arthritis, osteoarthritis (OA), and healthy subjects. The ESR was measured for each sample. Subsequently, serum was collected and the levels of rheumatoid factor (RF), anti-circulating citrullinated peptide (Anti-CCP) antibodies, C-reactive protein (CRP), and LYVE1 were measured. The correlation between LYVE1 in serum and other serological indicators was analyzed through the Poisson distribution model. Results: The serum LYVE1 content of RA patients was significantly lower than that of OA patients and healthy subjects, and the difference was statistically significant (p < 0.05). LYVE1 in the serum of RA patients was negatively correlated with ESR, RF, Anti-CCP antibodies and CRP. Conclusion: LYVE1 may serve as a novel serum biomarker for clinical diagnosis and evaluation of RA progression.
Keywords:Rheumatoid Arthritis, LYVE1, Serum Biomarkers

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
类风湿性关节炎(RA)是一种慢性自身免疫性疾病,其特征是严重的组织损伤和慢性滑膜炎,最终导致关节破坏和残疾 [1] 。罹患RA会导致患者免疫系统出现众多改变,尤其是患者的血清学检查中,类风湿因子(RF) [2] 、抗循环瓜氨酸肽(Anti-CCP)抗体 [3] 、C-反应蛋白(CRP) [4] 等血清标志物的异常增高,这些血清标志物的改变同时也是目前临床诊断RA患者的有力证据。然而,在其它的免疫性疾病,例如系统性红斑狼疮(SLE)中,RF与Anti-CCP抗体等血清学指标同样会有不同程度的表达上升。在一项对467例单一风湿病科室就诊的SLE患者进行回顾性研究中,约25%的患者血清检测RF为阳性结果 [5] ,且在另一项研究中,SLE患者血清中Anti-CCP抗体的阳性率显著高于健康对照组 [6] 。同样的,一些非免疫性疾病引起的关节炎症,例如骨关节炎(OA)中,CRP的血清学指标同样有所上升 [7] 。正因如此,目前RA的确诊还需要临床医生通过患者全血红细胞沉降率(ESR)检查结果并结合患者具体症状评估(DAS 28评分) [8] ,然而无论是免疫性与非免疫性炎症均会引起ESR的上升 [9] ,这为RA的诊断带来了诸多不便。因此,能够发现全新的确诊RA的血清标志物是目前临床亟待解决的问题。
淋巴管内皮透明质酸受体-1 (LYVE1)被认为是淋巴管生成的标志物,广泛分布在淋巴管内皮细胞与巨噬细胞中 [10] 。在一项近期的研究中,研究人员在人类关节滑膜中发现了一种LYVE1高度表达的巨噬细胞,称为LYVE1hi巨噬细胞,且这种巨噬细胞LYVE1的表达量与RA的进展相关。与健康人以及OA患者的关节滑膜中相比,LYVE1hi巨噬细胞在RA患者关节滑膜中明显降低,且缓解期RA患者相对于非缓解期RA患者,关节滑膜中的LYVE1hi巨噬细胞有所回升 [11] 。因此,我们认为LYVE1hi巨噬细胞在RA的发病机制中非常重要。LYVE1拥有可以被血管内皮生长因子A (VEGF-A)诱导胞外域脱落释放入血的特性 [12] ,Nishida-Fukuda等人发现VEGF-A可以通过细胞外信号调节激酶(ERK)和分解素和金属蛋白酶(ADAM)的诱导LYVE-1胞外结构域脱落 [13] 。因此,我们猜测LYVE1或许可以作为一种全新的血清学指标帮助临床用于确诊RA。
在本研究中,我们分别收集了临床确诊RA、OA患者全血各10例,另随机选取健康体检者(healthy)全血10例作为对照组,使用魏氏法检测全血ESR,通过离心收集血清,荧光标记抗体法检测RF、荧光微球法检测Anti-CCP抗体、免疫比浊法检测CRP与ELISA法检测LYVE1的含量。使用泊松分布(Poisson distribution)模型分析患者血清中的LYVE1与ESR、RF、Anti-CCP抗体和CRP的相关性,评估LYVE1作为一种全新的血清学标志物用于诊断RA与评估RA进展的可能性。
2. 标本收集和方法
2.1. 全血与血清收集
RA、OA患者以及健康体检者全血标本均来2023年10月至2023年11月于山东大学齐鲁医院临床确诊相应疾病的住院患者及健康体检者,使用EDTA抗凝管收集全血标本用于检测ESR,全血标本 × 12,000 g离心10 min即可收集上层血清,将血清置于−80℃冰箱保存。贡献受检全血的RA、OA患者与健康体检者在参与该研究之前都签署了知情同意书,本研究获得了山东大学齐鲁医院伦理委员会的审批(伦理批件号:KYLL-202210-069-1)。
2.2. 魏氏法检测全血ESR
配置3.8%柠檬酸钠溶液作为稀释液–从收集到的全血标本中吸取2 ml与稀释液1:4均匀混合后注入魏氏管中–确保管内无气泡,并将管口用胶片密封–将魏氏管垂直置于魏氏管支架上–保持水平稳定使红细胞自由沉降–1 h后,使用标尺测量红细胞柱的高度,以mm/h表示。
2.3. 荧光标记抗体法检测血清RF
选择特异性针对RF的单克隆抗体–使用荧光染料标记选定的抗体,确保标记高效且无损伤性–对标记后的抗体进行离心纯化和蛋白质纯度测定–使用微孔板,设定标准品、质控样本及待测样本反应孔–向每个反应孔中分别加入标记抗RF-孵育反应孔,促使抗体与待测RF结合–按照说明书设定温度、时间–用洗涤缓冲液清洗反应孔,去除未结合物质–使用荧光光谱仪,测定每个孔的荧光信号,记录荧光强度值–利用标准品制作RF浓度–荧光强度曲线–通过荧光强度值和标准曲线,计算待测样本中RF的浓度,以IU/ml表示。
2.4. 荧光微球法检测血清Anti-CCP抗体
选择特异性对Anti-CCP抗体反应的微球–使用激活剂处理微球,以增加其结合能力–使用荧光染料标记微球表面,形成荧光标记的Anti-CCP抗体检测试剂–将标记的荧光微球与血清样本混合–使Anti-CCP抗体与荧光微球表面特异性结合,形成复合物–使用流式细胞仪检测并分析荧光微球的信号,量化Anti-CCP抗体,并确定其浓度水平–利用标准品制作Anti-CCP抗体浓度/荧光信号曲线–通过荧光信号与标准曲线对比,计算出样本中Anti-CCP抗体的浓度,以U/ml表示。
2.5. 免疫比浊法检测血清CRP
准备CRP检测试剂盒,包括标准品和试剂–用于制备标准曲线的CRP标准品按照说明书中的方法配制不同浓度的标准品–对血清样本进行稀释或处理,确保在检测范围内进行测量–将稀释后的样本和标准品与试剂混合,在设定的温度下进行特异性结合反应孵育–使用比色计测量吸光度,记录样本和标准品的吸光度值–使用标准品的吸光度值绘制标准曲线,根据吸光度值和标准曲线确定样本中CRP的浓度–使用标准曲线中CRP浓度和样本吸光度值进行计算,确定样本中CRP的浓度,以mg/L表示。
2.6. ELISA法检测血清LYVE1
准备LYVE1检测试剂盒,包括标准品、抗体和试剂–使用LYVE1标准品按照说明书中的方法配制不同浓度的标准品–将LYVE1抗体吸附在ELISA板的孔内,形成固定的抗体层–加入不同浓度的LYVE1标准品和待测血清样本到各个孔中–在设定的温度下,使样本中的LYVE1与固定的抗体发生特异性结合反应–对各孔进行多次洗涤步骤,去除未结合的物质,减少非特异性信号干扰–加入与LYVE1结合的检测抗体,形成夹心式结合,抗体与LYVE1形成特异性结合物–重复洗涤步骤,去除未结合的检测抗体–向各孔中加入底物,引发酶反应–加入停止液,终止酶反应–使用ELISA阅读器测量各孔的吸光度值–利用标准品的吸光度值绘制标准曲线,根据吸光度值和标准曲线确定样本中LYVE1的浓度,以ng/ml表示。
2.7. 数据统计
使用GraphPad Prism 9软件对数据进行了分析。计量资料用中位数和四分位数(M (P25, P75))表示,运用Student’s t检验评估两组之间的变量差异,Tukey多重比较检验法比较多组之间的差异,p < 0.05作为统计学意义的判断标准。
3. 结果
3.1. RA患者血清LYVE1含量明显降低
结果如图1所示:通过魏氏法对检测全血ESR,RA患者全血ESR (36 (41.0, 31.0))明显高于健康体检者(11.0 (8.5, 14.5))与OA患者(19.5 (16.5, 21.5)) (图1(A))。通过荧光标记抗体法检测血清RF,RA患者血清RF (57.55 (50.40, 64.15))明显高于健康体检者(6.40 (5.05, 6.85))与OA患者(5.70 (4.60, 6.85)) (图1(B))。通过荧光微球法检测血清Anti-CCP抗体,RA患者血清Anti-CCP抗体(141.45 (121.70, 158.85))明显高于健康体检者(1.75 (1.35, 2.65))与OA患者(1.80 (1.40, 2.05)) (图1(C))。通过免疫比浊法检测血清CRP,RA患者血清CRP (62.60 (47.65, 81.20))明显高于健康体检者(0.87 (0.65, 1.05))与OA患者(28.00 (19.95, 30.35)) (图1(D))。以上结果均符合RA患者血清学表现。通过ELISA法检测血清LYVE1,RA患者血清LYVE1 (789.75 (593.22, 1004.09))明显低于健康体检者(1324.52 (1084.88, 1677.01))与OA患者(1689.345 (1343.47, 2229.41)) (图1(E))。

Figure 1. A: ESR results of whole blood detected by Westergren method. B: Results of serum RF content detection using fluorescently labeled antibody method. C: The results of detecting serum Anti-CCP antibody content by fluorescent microsphere method. D: Result of serum CRP content detected by immunoturbidimetric method. E: ELISA method to detect serum LYVE1 content results. Healthy control group: healthy, Osteoarthritis patient group: OA, Rheumatoid arthritis patient group: RA. ***p < 0.001,nsp > 0.05
图1. A:魏氏法检测全血ESR结果。B:荧光标记抗体法检测血清RF含量结果。C:荧光微球法检测血清Anti-CCP抗体含量结果。D:免疫比浊法检测血清CRP含量结果。E:ELISA法检测血清LYVE1含量结果。健康对照组:healthy,骨关节炎患者组:OA,类风湿性关节炎患者组:RA。***p < 0.001,nsp > 0.05
3.2. 血清LYVE1含量与ESR和RA相关血清标志物具有相关性
结果如图2所示:通过泊松分布模型分析RA患者、OA患者与健康体检者血清LYVE1与全血ESR、血清RF、血清Anti-CCP抗体与血清CRP的相关性。结果可得:LVYE1 VS ESR:“R squared = 0.276”(图2(A));LYVE1 VS RF:“R squared = 0.450”(图2(B));LYVE1 VS Anti-CCP抗体:“R squared = 0.492”(图2(C));LYVE1 VS CRP:“R squared = 0.253”(图2(D))。LYVE1与ESR、RF、Anti-CCP抗体、CRP均表现为负相关性。
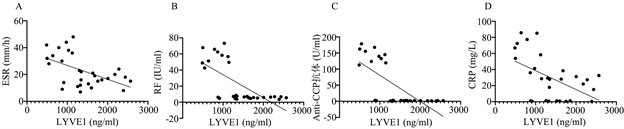
Figure 2. A: Poisson distribution of serum LYVE1 and whole blood ESR. B: Poisson distribution of serum LYVE1 and serum RF. C: Poisson distribution of serum LYVE1 and serum Anti-CCP antibodies. D: Poisson distribution of serum LYVE1 and serum CRP
图2. A:血清LYVE1与全血ESR的泊松分布。B:血清LYVE1与血清RF的泊松分布。C:血清LYVE1与血清Anti-CCP抗体的泊松分布。D:血清LYVE1与血清CRP的泊松分布
4. 讨论
RA可导致患者机体出现一系列异常变化,其引起的血液变化特别是血清学变化尤为特殊 [14] 。ESR是一种炎症指标,通常用于评估机体中是否存在炎症。在RA患者中,由于关节炎的炎症反应,通常会引起ESR的上升 [15] ,但ESR上升并不是RA的特异性指标,也可能出现在其他炎症性疾病或情况中。RF是一种免疫球蛋白抗体,常在RA患者血清学中表达升高,RF的产生可能与免疫系统对自身组织的攻击有关,导致关节的炎症和损害。尽管类风湿因子在许多类风湿性关节炎患者中可以检测到,但它并不是该病的特异性标志,在一些其他的免疫性疾病中,患者血清中的RF有时也会被检测到上升 [16] 。同时,在极少数健康人群血清中,RF也可以被检测到呈阳性 [17] 。Anti-CCP抗体是与RA密切相关的自身免疫抗体,常被用作于RA的辅助诊断和评估指标。Anti-CCP抗体的检测在RA的早期诊断中非常重要。由于Anti-CCP抗体相对于RF具有更高的特异性,因此其在RA诊断中更加可靠 [18] 。然而血清Anti-CCP抗体升高并不一定代表患者确诊RA,在某些其他自身免疫性疾病以及非类风湿性关节炎性关节病变中,血清Anti-CCP抗体也可能表现出不同程度的升高。另外,在一些感染性疾病患者的血清中,Anti-CCP抗体也可能呈阳性表现,尽管这种情况十分罕见 [19] 。CRP是一种急性相蛋白,通常在炎症或感染发生时迅速上升 [20] 。在RA患者中,关节炎引起的炎症可以导致CRP水平升高。CRP水平通常与RA的疾病活动度相关,较高的CRP水平可能反映出更严重的疾病活动和更强烈的炎症。然而除了RA之外,其他炎症性疾病、感染、创伤等也可以导致血清CRP水平升高。因此,CRP并不能够被看作是RA的特异性标志物,但是可以作为一个比较敏感的炎症指标用于评估RA进展 [21] 。OA是一种与年龄相关的退行性关节疾病,通常是由于长时间的关节使用、关节损伤、过度负荷或其他因素导致的关节软骨的磨损,其病理生理过程涉及关节软骨的逐渐磨损、关节间隙的狭窄、骨质增生和关节周围骨的生长 [22] 。尽管OA与RA均引起关节损伤,但不同的是,OA致病过程中不涉及免疫系统损害关节组织 [23] 。因此,以往的研究中,OA常被用于作为一组对照组用于研究RA的发病机制与治疗 [24] 。在本研究中,我们分别检测验证了RA、OA患者与健康体检者的全血ESR以及血清中RF、Anti-CCP抗体、CRP的含量,其具体结果与先前的研究基本一致。
巨噬细胞是免疫系统中的一类重要细胞,其功能包括吞噬和清除异物、死亡细胞和病原体、参与炎症反应等 [25] 。在RA中,巨噬细胞可以在关节内聚集,释放炎性细胞因子,导致关节内的炎症反应,引起滑膜炎、关节软骨和骨骼破坏 [26] 。同时,巨噬细胞还可以参与调控T细胞和B细胞活化、分化和增殖,参与RA关节的修复 [27] 。研究显示 [11] ,LYVE1hi巨噬细胞拥有独特的缓解RA的功能,尽管其具体的作用机制尚未明确,但我们猜测LYVE1hi巨噬细胞在关节滑膜中的表达情况或许可以通过其胞外域脱落后释放血的过程中检测出来。在本研究中,我们通过ELISA法检测RA、OA患者与健康体检者血清LYVE1含量,证明了LYVE1在RA患者血清中明显降低。
泊松分布是一种描述稀有事件发生次数的概率分布模型,其特点分别为平均发生率、独立性、稀有事件、无记忆性。常被用于医学研究中的相关性分析 [28] 。在本研究中,我们通过将RA、OA患者与健康体检者全血ESR与血清中RF、Anti-CCP抗体、CRP的含量分别与血清中的LYVE1含量利用泊松分布模型进行相关性研究,证明了血清LYVE1与它们具有负相关性。然而,由于临床标本量有限,这一结果仍需进行验证,在后续的研究中,我们还需进一步增加标本数量与临床分组,并通过LYVE1进行深入研究,进一步验证血清LYVE1与RA的关系。
本研究中,我们通过对RA、OA患者与健康体检者共30例血液标本ESR及血清中RF、Anti-CCP抗体、CRP、LYVE1的含量进行检测,并利用泊松分布模型分析的方法,证明了血清LYVE1含量在RA中明显下降且与其他检测结果具有负相关性的表现。通过这一研究,我们猜测LYVE1或许可以成为一种确诊RA与评估RA进展的一项全新的血清标志物。
基金项目
国家自然科学基金项目(项目编号:82272410,81972005)。
文章引用
李骁瀚,张小钰,王洪星,张 义. 血清LYVE1与类风湿性关节炎的相关性分析
Correlation Analysis between Serum LYVE1 and Rheumatoid Arthritis[J]. 临床医学进展, 2024, 14(02): 2446-2452. https://doi.org/10.12677/ACM.2024.142343
参考文献
- 1. Radu, A.F. and Bungau, S.G. (2021) Management of Rheumatoid Arthritis: An Overview. Cells, 10, Article No. 2857. https://doi.org/10.3390/cells10112857
- 2. Scherer, H.U., Haupl, T. and Burmester, G.R. (2020) The Etiology of Rheumatoid Arthritis. Journal of Autoimmunity, 110, Article ID: 102400. https://doi.org/10.1016/j.jaut.2019.102400
- 3. Akiyama, M. and Kaneko, Y. (2022) Pathogenesis, Clinical Fea-tures, and Treatment Strategy for Rheumatoid Arthritis-Associated Interstitial Lung Disease. Autoimmunity Reviews, 21, Article ID: 103056. https://doi.org/10.1016/j.autrev.2022.103056
- 4. Figus, F.A., Piga, M., Azzolin, I., McConnell, R. and Iagnocco, A. (2021) Rheumatoid Arthritis: Extra-Articular Manifestations and Comorbidities. Autoimmunity Reviews, 20, Article ID: 102776. https://doi.org/10.1016/j.autrev.2021.102776
- 5. Fedrigo, A., dos Santos, T.A.F.G., Nisihara, R. and Skare, T. (2018) The Lupus Patient with Positive Rheumatoid Factor. Lupus, 27, 1368-1373. https://doi.org/10.1177/0961203318759607
- 6. Skare, T.L., Nisihara, R., Barbosa, B.B., da Luz, A.R., Utiyama, S. and Picceli, V. (2013) Anti-CCP in Systemic Lupus Erythematosus Patients: A Cross Sectional Study in Brazilian Pa-tients. Clinical Rheumatology, 32, 1065-1070. https://doi.org/10.1007/s10067-013-2213-7
- 7. Singhal, S., et al. (2021) Bioavailable Turmeric Extract for Knee Osteoarthritis: A Randomized, Non-Inferiority Trial Versus Paracetamol. Trials, 22, Article No. 105. https://doi.org/10.1186/s13063-021-05053-7
- 8. Vadell, A.K.E., et al. (2020) Anti-Inflammatory Diet in Rheu-matoid Arthritis (ADIRA)—A Randomized, Controlled Crossover Trial Indicating Effects on Disease Activity. The American Journal of Clinical Nutrition, 111, 1203-1213. https://doi.org/10.1093/ajcn/nqaa019
- 9. Bray, C., et al. (2016) Erythrocyte Sedimentation Rate and C-Reactive Protein Measurements and Their Relevance in Clinical Medicine. WMJ, 115, 317-321.
- 10. Chakarov, S., et al. (2019) Two Distinct Interstitial Macrophage Populations Coexist across Tissues in Specific Subtissular Niches. Science, 363, eaau0964. https://doi.org/10.1126/science.aau0964
- 11. Alivernini, S., et al. (2020) Distinct Synovial Tissue Mac-rophage Subsets Regulate Inflammation and Remission in Rheumatoid Arthritis. Nature Medicine, 26, 1295-1306. https://doi.org/10.1038/s41591-020-0939-8
- 12. Wada, I., et al. (2021) Retinal VEGF-A Overexpression Is Not Sufficient to Induce Lymphangiogenesis Regardless of VEGF-C Upregulation and Lyve1+ Macrophage Infiltration. In-vestigative Ophthalmology & Visual Science, 62, 17. https://doi.org/10.1167/iovs.62.13.17
- 13. Nishida-Fukuda, H., et al. (2016) Ectodomain Shedding of Lymphatic Vessel Endothelial Hyaluronan Receptor 1 (LYVE-1) Is Induced by Vascular Endothelial Growth Factor A (VEGF-A). Journal of Biological Chemistry, 291, 10490-10500. https://doi.org/10.1074/jbc.M115.683201
- 14. Escal, J., Neel, T., Hodin, S., Boussoualim, K., et al. (2023) Proteomics Analyses of Human Plasma Reveal Triosephosphate Isomerase as a Potential Blood Marker of Methotrexate Resistance in Rheumatoid Arthritis. Rheumatology (Oxford), kead390. https://doi.org/10.1093/rheumatology/kead390
- 15. Watanabe, R., Hashimoto, M., Murata, K., Murakami, K., et al. (2022) Prevalence and Predictive Factors of Difficult-to-Treat Rheumatoid Arthritis: The KURAMA Cohort. Immuno-logical Medicine, 45, 35-44. https://doi.org/10.1080/25785826.2021.1928383
- 16. Tiwari, V., Jandu, J.S. and Bergman, M.J. (2023) Rheuma-toid Factor. StatPearls, Treasure Island.
- 17. Lisse, J.R. (1993) Does Rheumatoid Factor Always Mean Arthritis? Post-graduate Medicine, 94, 133-134, 139. https://doi.org/10.1080/00325481.1993.11945749
- 18. Ronnelid, J., Turesson, C. and Kastbom, A. (2021) Auto-antibodies in Rheumatoid Arthritis—Laboratory and Clinical Perspectives. Frontiers in Immunology, 12, Article ID: 685312. https://doi.org/10.3389/fimmu.2021.685312
- 19. Niewold, T.B., Harrison, M.J. and Paget, S.A. (2007) Anti-CCP Antibody Testing as a Diagnostic and Prognostic Tool in Rheumatoid Arthritis. QJM, 100, 193-201. https://doi.org/10.1093/qjmed/hcm015
- 20. Pathak, A. and Agrawal, A. (2019) Evolution of C-Reactive Protein. Frontiers in Immunology, 10, Article No. 943. https://doi.org/10.3389/fimmu.2019.00943
- 21. Pope, J.E. and Choy, E.H. (2021) C-Reactive Protein and Implica-tions in Rheumatoid Arthritis and Associated Comorbidities. Seminars in Arthritis and Rheumatism, 51, 219-229. https://doi.org/10.1016/j.semarthrit.2020.11.005
- 22. Abramoff, B. and Caldera, F.E. (2020) Osteoarthritis: Pa-thology, Diagnosis, and Treatment Options. Medical Clinics of North America, 104, 293-311. https://doi.org/10.1016/j.mcna.2019.10.007
- 23. Ouyang, Z., Dong, L., Yao, F., et al. (2023) Cartilage-Related Collagens in Osteoarthritis and Rheumatoid Arthritis: From Pathogenesis to Therapeutics. International Journal of Mo-lecular Sciences, 24, Article No. 9841. https://doi.org/10.3390/ijms24129841
- 24. Mehta, B., Goodman, S., Di Carlo, E., et al. (2023) Machine Learning Identification of Thresholds to Discriminate Osteoarthritis and Rheumatoid Arthritis Synovial Inflammation. Arthritis Research & Therapy, 25, Article No. 31. https://doi.org/10.1186/s13075-023-03008-8
- 25. Kadomoto, S., Izumi, K. and Mizokami, A. (2021) Macrophage Polarity and Disease Control. International Journal of Molecular Sciences, 23, Article No. 144. https://doi.org/10.3390/ijms23010144
- 26. Yao, Y., et al. (2021) The Macrophage-Osteoclast Axis in Osteoim-munity and Osteo-Related Diseases. Frontiers in Immunology, 12, Article ID: 664871. https://doi.org/10.3389/fimmu.2021.664871
- 27. Kurowska-Stolarska, M. and Alivernini, S. (2022) Synovial Tis-sue Macrophages in Joint Homeostasis, Rheumatoid Arthritis and Disease Remission. Nature Reviews Rheumatology, 18, 384-397. https://doi.org/10.1038/s41584-022-00790-8
- 28. Pan, Y., Landis, J.T., Moorad, R., Wu, D., Marron, J.S. and Dittmer, D.P. (2023) The Poisson Distribution Model Fits UMI-Based Single-Cell RNA-Sequencing Data. BMC Bioin-formatics, 24, Article No. 256. https://doi.org/10.1186/s12859-023-05349-2
NOTES
*通讯作者。