Advances in Clinical Medicine
Vol.
10
No.
04
(
2020
), Article ID:
35361
,
6
pages
10.12677/ACM.2020.104102
Aquaporin 1 Promotes the Migration and Invasion of Nasopharyngeal Carcinoma Cell in Vitro
Yunying Qin, Ningbin Luo*
Guangxi Medical University Affiliated Cancer Hospital, Nanning Guangxi

Received: Apr. 5th, 2020; accepted: Apr. 22nd, 2020; published: Apr. 29th, 2020

ABSTRACT
Objective: To investigate the effects of AQP1 on nasopharyngeal carcinoma cell migration and invasion. Methods: Nasopharyngeal carcinoma cell 5-8F was transfected with short hairpin RNA (shRNA) targeting AQP1. And then, Western blot was used to detect the AQP1 protein expression, and Transwell assay was used to detect cell migration and invasion. Results: The expression of AQP1 was effectively downregulated in nasopharyngeal carcinoma cell by shRNA targeting AQP1. Knockdown of AQP1 inhibited nasopharyngeal carcinoma cell migration and invasion in vitro (P < 0.01). Conclusion: Aquaporin 1 can promote the migration and invasionin nasopharyngeal carcinoma cell. Thus, AQP1 may serve as a potential therapeutic target for the treatment of TNBC.
Keywords:Aquaporin 1, Nasopharyngeal Carcinoma, Migration, Invasion

AQP1促进鼻咽癌细胞的迁移和侵袭
覃云英,罗宁斌*
广西医科大学附属肿瘤医院,广西 南宁

收稿日期:2020年4月5日;录用日期:2020年4月22日;发布日期:2020年4月29日

摘 要
目的:探讨水通道蛋白1 (AQP1)对人鼻咽癌细胞迁移及侵袭能力的影响。方法:采用shRNA转染人鼻咽癌细胞5-8F后,用Western blot检测AQP1蛋白的表达量,Transwell实验检测细胞的迁移及侵袭能力。结果:shRNA质粒转染细胞能显著降低人鼻咽癌细胞5-8F中AQP1的蛋白表达水平(P < 0.05)。Transwell实验发现抑制AQP1的表达可降低鼻咽癌细胞的迁移侵袭能力(P < 0.05)。结论:AQP1可促进鼻咽癌细胞的迁移和侵袭,可成为鼻咽癌治疗后潜在靶点。
关键词 :水通道蛋白1,鼻咽癌,迁移,侵袭

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
鼻咽癌在中国南方发病率较高,特别是在广西,其鼻咽癌的发病率及死亡率明显高于其他地区 [1]。鼻咽癌经过规范的治疗后,多数患者可以得到临床缓解,但远处转移常常是鼻咽癌治疗失败的主要原因 [2]。因此,进一步明确肿瘤转移相关子并加以干预,是提高鼻咽癌患者生存率的关键环节。
我们前期研究发现水通道蛋白1 (AQP1)在高转移潜能鼻咽癌细胞株中的表达高于低转移潜能的细胞株,提示AQP1的表达水平可能与人鼻咽癌细胞的转移潜能密切相关 [3]。为了进一步明确AQP1在鼻咽癌浸润转移中的作用,本研究拟通过慢病毒干扰载体特异性沉默高AQP1表达的鼻咽癌细胞5-8F的AQP1基因,检测AQP1干扰后癌细胞迁移、侵袭能力变化的情况。
2. 材料与方法
2.1. 材料
鼻咽癌细胞株5-8F购自中国科学院上海细胞库。RPMI1640培养基、胎牛血清和胰蛋白酶购自BI公司。双抗(链霉素、青霉素)购自上海翊圣生物科技公司。LipofectamineTM 2000及Trizol均购自Invitrogen公司。鼠抗人AQP1单克隆抗体购自Santa Cruz公司,鼠/兔通用二抗检测试剂盒购自福州迈新生物技术有限公司。兔抗人β-actin抗体购自Abcam公司。
2.2. 鼻咽癌细胞培养及shRNA质粒转染
鼻咽癌细胞培养于含小牛血清(10%)的RPMI 1640培养基中,并在其内加入青霉素(100 U/mL)和链霉素(100 μg/mL)。细胞在于温育箱(37℃、5% CO2)中培养,当细胞处于对数生长期时,可用于实验。质粒转染步骤按照Invitrogen公司LipofectamineTM2000试剂的使用说明书施行。将转染了靶向AQP1的shRNA (AQP1-shRNA)的5-8F细胞作为AQP1干扰组,而未转染的5-8F细胞设置为空白对照组。AQP1-shRNA参考李卓等 [4] 报道构建,核心序列为:CCATTATGCTGGTGTATGT。
2.3. Western Blot法分析鼻咽癌细胞转染前后AQP1蛋白表达的差异
将处于对数生长期的5-8F细胞裂解离心(1000 rpm 5分钟)后,得到对照组及AQP1干扰组细胞的总蛋白,并对两组细胞的蛋白含量进行测定(bradford比色法)。两组细胞的蛋白通过SDS PAGE电泳法各自分离出40 μL样本,并将蛋白样本转移至PvDF膜上(电转印法)。将蛋白封闭后置于4℃冰箱并过夜,再加入一抗孵育2小时,然后用TBST洗涤3次,加入辣根过氧化物酶标记的二抗进行孵育(37℃, 1 h),孵育结束后TBST再次洗涤3次,最后曝光显影。将两组AQP1蛋白光密度值比上相应内参β-actin光密度值,得到各组细胞的AQP1蛋白相对表达量。
2.4. Transwell实验分析鼻咽癌细胞转染前后垂直迁移及侵袭能力的差异
迁移实验:
将空白对照组与AQP1干扰组的鼻咽癌细胞5-8F消化,制成细胞悬液。将200 µL细胞悬液(内含1 × 105细胞)加入上室,下室加入1640培养基(含10% FBS)共750 µL,空白对照组与AQP1干扰组均设3个复孔,置于温育箱中培养,培养环境设定为37℃、5% CO2。细胞培养48 h后取出小室,将上室的培养基用吸管吸取弃除,再用棉签将上室细胞轻轻拭去,后用4%多聚甲醛固定15分钟,再用结晶紫染色10 分钟,最后PBS洗涤3次,于100倍倒置显微镜下随机选取5个视野进行拍照计数。
侵袭实验:
将50 mg/L的Matrigel预先用无血清的1640培养基以1:4比例稀释后,包被Transwell小室的底部膜,置于4℃温度下风干,水化基底膜。其余步骤同迁移实验。
2.5. 统计学分析
图片数据的采集及处理用Graphpad + Prism 5和Image J软件进行。应用SPSS 22.0统计软件进行统计学检验,组间比较用两样本t检验,以P < 0.05认为差异有统计学意义。柱形图用Excel软件描绘,误差线为各个复孔的标准偏差SD。3次以上独立重复实验。
3. 结果
3.1. 鼻咽癌细胞AQP1-shRNA干扰后AQP1蛋白表达水平的变化
Western blot分析显示,与未进行AQP1-shRNA干扰的对照组细胞对比,干扰组鼻咽癌5-8F细胞的AQP1蛋白表达水平明显降低(P < 0.05),见图1。
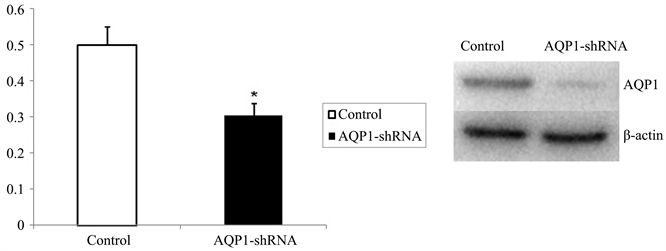
Figure 1. AQP1 expression in nasopharyngeal carcinoma cell is inhibited by sh-AQP1 (*P < 0.05)
图1. 鼻咽癌细胞经sh-AQP1干扰后AQP1表达下降(*P < 0.05)
3.2. 鼻咽癌细胞AQP1-shRNA干扰后迁移能力的变化
Transwell迁移实验显示,鼻咽癌细胞5-8F经AQP1-shRNA干扰后(干扰组),其细胞迁移个数明显低于空白对照组(P < 0.05),见图2。
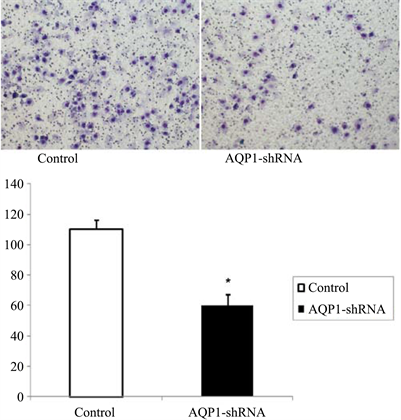
Figure 2. Downregulation of AQP1 inhibits cell migration in nasopharyngeal carcinoma cells
图2. 下调AQP1表达抑制鼻咽癌细胞迁移能力(×100). *P < 0.05
3.3. 鼻咽癌细胞AQP1-shRNA干扰后迁移能力的变化干扰AQP1对鼻咽癌细胞侵袭能力 的影响
Transwell侵袭实验显示,鼻咽癌细胞5-8F经AQP1-shRNA干扰后(干扰组),其细胞侵袭个数明显低于空白对照组(P < 0.05),见图3。
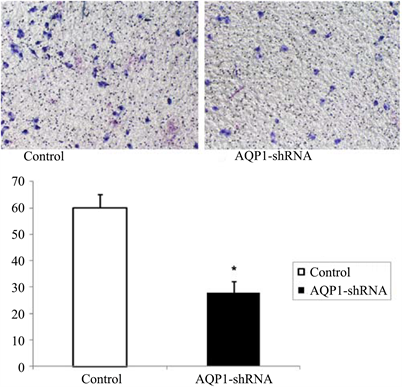
Figure 3. Downregulation of AQP1 inhibits cell invasion in nasopharyngeal carcinoma cells
图3. 下调AQP1表达抑制鼻咽癌细胞侵袭能力(×100). *P < 0.05
4. 讨论
AQP1是介导组织内水的被动跨膜转运的重要工具,对维持细胞内环境的稳定平衡具有重要作用。除了维持人体的正常生命活动外,AQP1与恶性肿瘤的生长及转移可能也有着密切的联系。研究发现恶性肿瘤(如乳腺癌、宫颈癌、肺癌、结肠癌等 [5] [6] [7] [8])中AQP1的表达水平高于正常组织或其他良性病变。在鼻咽癌的研究中也发现了类似的结果 [9],而且AQP1与肿瘤血管生成存在相关性,提示其可以通过倡导肿瘤血管生成促进鼻咽癌的生长和转移 [9]。
转移是恶性肿瘤的一个重要特征,也是恶性肿瘤患者死亡的主要原因。转移的建立是一个多步骤的过程 [10] [11],其中肿瘤细胞的迁移侵袭能力是影响肿瘤转移的重要影响因素。下调肿瘤细胞AQP1的表达,可以显著减少肿瘤细胞迁移的能力,从而降低其转移的风险 [12] [13]。本研究利用AQP1干扰慢病毒载体转染高AQP1表达鼻咽癌细胞株5-8F,使细胞株的AQP1表达降低,结果发现细胞株的迁移侵袭能力也随之降低,提示AQP1是促进鼻咽癌细胞迁移的重要影响因素。研究表明AQP1促进肿瘤细胞迁移的能力,是驱动依赖AQP1的水分子渗透到细胞突起中,为迁移的肿瘤细胞前缘为肌动蛋白聚合创造更多空间 [14] [15] [16]。
5. 结论
综上所述,本研究结果提示AQP1除了通过影响组织血管生成促进鼻咽癌转移外,还可以直接影响鼻咽癌细胞本身的迁移侵袭能力。下调鼻咽癌的AQP1可以降低其转移风险,AQP1可能成为鼻咽癌治疗的潜在靶点。
基金项目
广西高校中青年教师基础能力提升项目(2017KY0129)。
文章引用
覃云英,罗宁斌. AQP1促进鼻咽癌细胞的迁移和侵袭
Aquaporin 1 Promotes the Migration and Invasion of Nasopharyngeal Carcinoma Cell in Vitro[J]. 临床医学进展, 2020, 10(04): 652-657. https://doi.org/10.12677/ACM.2020.104102
参考文献
- 1. 曹骥, 李秋林, 容敏华, 葛莲英, 余家华. 2015年广西肿瘤登记地区恶性肿瘤发病和死亡分析[J]. 中国癌症防治杂志, 2019, 11(1): 43-51.
- 2. 中国抗癌协会鼻咽癌专业委员会, 陈晓钟, 李金高, 等. 转移性鼻咽癌治疗专家共识[J]. 中华放射肿瘤学杂志, 2018, 27(1): 23-28.
- 3. 覃云英, 罗宁斌, 王鹏, 等. AQP1在不同转移潜能的人鼻咽癌细胞株中的表达[J]. 临床医学进展, 2018, 8(10): 948-952.
- 4. 李卓, 康炜, 辛娜, 等. AQP1-shRN A 表达质粒载体的构建与筛选[J]. 重庆医学, 2015(30): 4183-4186.
- 5. 张珺, 于世英, 殷铁军. AQP1、HPA和VEGF在非小细胞肺癌组织中的表达和临床意义[J]. 中国现代医学杂志, 2009, 19(18): 2750-2753+2756.
- 6. 张斌, 刘芳芳, 马勇杰, 等. 水通道蛋白1在乳腺癌细胞质中的表达及其与患者临床病理特征和预后的关系[J]. 中华肿瘤杂志, 2013, 35(12): 904-909.
- 7. Kang, B.W., Kim, J.G., Lee, S.J., et al. (2015) Expression of Aquaporin-1, Aqua-porin-3, and Aquaporin-5 Correlates with Nodal Metastasis in Colon Cancer. Oncology, 88, 369-376. https://doi.org/10.1159/000369073
- 8. Chetry, M., Li, S., Liu, H., et al. (2018) Prognostic Values of Aquaporins mRNA Expression in Human Ovarian Cancer. Bioscience Reports, 38. https://doi.org/10.1042/BSR20180108
- 9. 李琦, 张威, 张宝. 鼻咽癌中水通道蛋白1表达与血管生成能力的相关性研究[J]. 临床耳鼻咽喉头颈外科杂志, 2010, 24(24): 1115-1118.
- 10. Steeg, P.S. (2006) Tumor Metastasis: Mechanistic Insights and Clinical Challenges. Nature Medicine, 12, 895-904. https://doi.org/10.1038/nm1469
- 11. Nguyen, D.X., Bos, P.D. and Massagué, J. (2009) Metastasis: From Dis-semination to Organ-Specific Colonization. Nature Reviews Cancer, 9, 274-284. https://doi.org/10.1038/nrc2622
- 12. Wei, X. and Dong, J. (2015) Aquaporin 1 Promotes the Proliferation and Migration of Lung Cancer Cell in Vitro. Oncology Reports, 34, 1440-1448. https://doi.org/10.3892/or.2015.4107
- 13. Wang, Y., Fan, Y., Zheng, C., et al. (2017) Knockdown of AQP1 In-hibits Growth and Invasion of Human Ovarian Cancer Cells. Molecular Medicine Reports, 16, 5499-5504. https://doi.org/10.3892/mmr.2017.7282
- 14. Verkman, A.S. (2002) Aquaporin Water Channels and Endothelial Cell Function. Journal of Anatomy, 200, 617-627. https://doi.org/10.1046/j.1469-7580.2002.00058.x
- 15. Verkman, A.S., Hara-Chikuma, M. and Papadopoulos, M.C. (2008) Aquaporins-New Players in Cancer Biology. Journal of Molecular Medicine, 86, 523-529. https://doi.org/10.1007/s00109-008-0303-9
- 16. Verkman, A.S. (2009) Knock-out Models Reveal New Aquaporin Functions. Handbook of Experimental Pharmacology, 190, 359-381. https://doi.org/10.1007/978-3-540-79885-9_18
NOTES
*通讯作者。