Metallurgical Engineering
Vol.03 No.02(2016), Article ID:17771,8
pages
10.12677/MEng.2016.32010
Effect of Tellurium on Copper Electrodeposition in Copper Sulfate-Sulfuric Acid System
Chaochao Li, Liankui Wu, Huazhen Cao, Guoqu Zheng
College of Materials Science and Engineering, Zhejiang University of Technology, Hangzhou Zhejiang

Received: May 14th, 2016; accepted: Jun. 6th, 2016; published: Jun. 9th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The influence of tellurium as an impurity during electrodeposition of copper from sulfate solution was investigated. The effect of tellurium concentration on the current efficiency, chemical structure and morphology at macro and micro level was systematically studied. XRD patterns show that the introduction of tellurium can change the preferential orientation of the deposits from (220) plane to (111) plane. And optical images exhibit that tellurium will reduce the tenacity of the electrodeposited copper. The eliminating experiment shows that the concentration of tellurium will reduce from 1 g/L to 20 mg/L after reacting 1 h under 95˚C, and bright copper can be obtained from the electrolyte.
Keywords:Copper, Tellurium, Electrodeposition, Cyclic Voltammetry, Eliminate

碲对硫酸铜体系中铜电解的影响
李超超,伍廉奎,曹华珍,郑国渠
浙江工业大学材料科学与工程学院,浙江 杭州

收稿日期:2016年5月14日;录用日期:2016年6月6日;发布日期:2016年6月9日

摘 要
本文系统研究了碲对硫酸铜体系中电解铜电流效率、结构组成和微观形貌的影响,同时提出一种去除碲的有效方法。研究结果表明,电解液中含有碲离子对铜的结晶取向和形核生长有明显影响。XRD测试结果表明,碲离子的存在使铜的最优生长取向从(220)晶面转变为(111)晶面。光学照片表明碲的存在可显著降低电沉积铜的韧性。扫描电镜照片表明沉积层的晶粒随碲浓度增加而逐渐减小。除碲实验表明,利用铜屑在95℃条件下反应一个小时,可将碲浓度由1 g/L降至20 mg/L,净化后的电解液电解可获得光亮阴极铜。
关键词 :铜,碲,电沉积,循环伏安,除杂

1. 引言
作为一种极为重要的常用金属材料,铜被广泛应用在各行各业,如:基础制造业、建筑业、电气业、信息业及电磁业等 [1] 。近年来,全世界范围内对铜材的需求量一直在明显增加,这也导致了铜矿消耗加剧。从铜业废料或废水中回收铜是一种很好的满足未来全球对铜材需求不断增加这一现状的有效措施。实际上,现在全球铜使用量中,有近40%的铜就是回收于二级资源中 [2] 。到目前为止,已经开发了许多从二次废料中回收铜的方法,如:熔解黄铜和青铜料、汽车散热器、发动机、电器零件、电路板 [3] [4] 、矿渣 [5] [6] 和阳极泥 [7] [8] 。阳极泥是铜电解精炼过程中,处在阳极底部的副产品,是一种非常重要的铜二次资源来源。
通过硫酸焙烧浸出过程,包括碲在内的许多杂质元素都会进入到浸出液中。然而,这些杂质对铜的电解有很大的负面影响。因此,在从阳极泥中回收铜的工艺中,净化电解液这一步骤非常重要。值得注意的是,有部分杂质非常难以去除。这导致工业生产过程中,这类杂质将会逐渐富集。到目前为止,部分杂质,如:铁 [9] 、锰 [10] 、钴 [11] [12] 和硒 [1] [13] 对硫酸铜体系中电解铜的影响已经研究过了。然而,却鲜有关于碲作为杂质对铜在硫酸铜溶液中电解行为影响的研究。
本文研究了碲对铜电解中电流效率、晶体结构、晶体生长方向及表面形貌的影响,并尝试了一种有效去除电解液中碲的方法。
2. 实验方法
2.1. 药品准备
CuSO4 (99%),H2SO4 (98.5%)和碲粒(Aladdin, 99.99%)为实验所用药品原料,所有溶液均为蒸馏水现配。
硫酸铜溶液由计算量的硫酸铜、硫酸加蒸馏水配制而成。为了研究不同碲浓度含量对铜电解过程和沉积层的影响,配制一定浓度的硫酸碲溶液(2 g/L)来完成不同碲浓度溶液的配制。硫酸碲溶液配制方法:称取计算量的碲粒,在5 mL浓硫酸中加热溶解,再用蒸馏水定容至指定浓度。
2.2. 铜的电解
铜的电解以不锈钢(316 L)和铅板分别作为电解的阴、阳极。其中阴极的有效面积为7 cm × 34 cm。阴阳极之间的平均距离保持在2 cm,电解的电流密度为300 A/m2,电流由直流稳压提供(King sunny SMA30V10A. P. S)。
电解过程中阴极的电流效率根据下式计算得到:
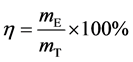 (1)
(1)
式中,η为电流效率(%),mE (g)和mT (g)分别为实验所得铜片质量和理论所得铜片质量。
沉积层中碲含量测定:将一定量的铜片溶解在硫酸中,通过原子吸收法测定。(CAAM-2001 Beijing China HANSHI)。
2.3. 表征与分析
循环伏安曲线在传统三电极电解槽中进行。实验仪器为CHI630b电化学工作站。(CH Instrument,上海)。工作电极、对电极、参比电极分别为玻碳电极(直径0.6 cm)、铂电极(2.0 cm2)和饱和甘汞电极。循环伏安测试溶液成分为Cu2+:30 g/L;H2SO4:150 g/L;Te:0~2 g/L,扫描速率为0.01 V/s。如未特殊说明,实验均在室温下进行。
XRD测试仪器为RIGAKU D/Max 2550 PC,Cu Kα radiation (λ = 1.54059 Å),40 KV,30 mA。表面形貌由电镜(VEGA3, operated at 15 kV)拍摄所得。
3. 结果与讨论
3.1. 阴极电流效率
图1给出了碲对硫酸铜溶液中电解铜电流效率的影响规律。从图中可以看出,当溶液中不存在碲杂质时(纯硫酸铜体系),铜沉积的电流效率为94.8%。而电解液中碲的存在导致电流效率发生了小幅度上升,且当碲达到一定浓度时,电流效率超过100%。这一现象可能是碲在阴极也参与了沉积,或者是铜、碲发生了共沉积。溶解部分电解产物,对其进行AAS测试,可以发现,当碲浓度为0.5 g/L时,沉积层中碲含量为0.98%;当碲浓度升高至1.0 g/L和2.0 g/L时,碲含量分别提高至1.38%,2.27%。沉积层中碲含量的增加说明电流效率的增加与碲的电沉积有关。
3.2. 电化学测试表征
为研究碲的电化学行为表现,在含有1 g/L的碲离子(以硫酸碲形式存在)的溶液中进行了循环伏安测试。如图2所示,在−0.15 V和−0.64 V的电位下,出现两个阴极峰。这两个峰分别代表了如下(2)、(3)反应 [14] 。
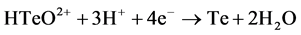 (2)
(2)
 (3)
(3)
阳极峰电位为0.54 V,代表此时反应为Te转变为HTeO2+。
图3展示了碲离子浓度对铜电解的影响。从图中可以看出,不含碲离子时(纯硫酸铜溶液),在−0.19 V电位下,出现了Cu2+转变为Cu单质的峰。同时,在0.28 V和0.44 V出现了2个氧化峰,分别代表Cu到Cu+ (A1)和Cu+到Cu2+ (A2)两个反应。从对照实验来看,容易发现,碲的加入对于铜离子的阴极还原过程并没有产生太大的影响,反而对铜在阳极的氧化过程影响较为显著。随着溶液中碲离子浓度升高,氧化峰A1的峰电位往正方向移动,峰电流明显增大,同时,氧化峰A2 (Cu+到Cu2+)几近消失。这个变化表明,碲的存在使得Cu到Cu+的峰和Cu+到Cu2+的峰合并成为了一个氧化峰。同时在电位0.53 V处出现了一个新的氧化峰A3。根据图2可以推测,A3为Te氧化至Te3+时所产生的氧化峰,并且A3的峰电流最大

Figure 1. Effect of tellurium concentration on current efficiency during electrodeposition of copper
图1. 铜电沉积过程中,碲浓度–电流效率关系图

Figure 2. CV curve recorded from solution containing 1.0 g∙L−1 TeSO4. The scan rate was 100 mV∙s−1
图2. 碲浓度为1.0 g/L时的循环伏安曲线(扫速为100 mV/s)

 (a) (b)
(a) (b)
Figure 3. (a) Effect of tellurium concentration on the CV curves: blank (0 g∙L−1, 1), 0.5 g∙L−1 (2), 1.0 g∙L−1 (3) and 2.0 g∙L−1 (4); (b) Enlargement of the curves in (a) at the potential range from 0.4 V to 0.8 V
图3. (a) 不同碲浓度对铜电解循环伏安曲线的影响,碲浓度分别为0、0.5、1.0、2.0 g/L;(b) 为(a)中0.4 V~0.8 V部分局部放大图
值也随碲离子浓度升高而升高(图3(b))。这也从另一方面证明了随着碲离子浓度的提高,有更多的碲在阴极进行了沉积。CV曲线均具有电流环,这是典型的形核生长过程,说明铜的形核过程为扩散控制过程 [15] [16] 。
3.3. 组合结构
不同沉积层的XRD图谱如图4所示。在纯硫酸铜中电解所得的铜片,其XRD图谱在43.5˚,50.7˚,74.1˚和90.9˚处有典型的Cu的特征衍射峰(JCPDS:70-3039),晶面取向分别为(111),(200),(220)和(311)。其中最优生长晶面取向为(220)晶面,其衍射峰强度最大。各晶面衍射峰强度顺序为(220) > (111) > (200) > (311)。当碲加入到溶液中后,铜的最优生长晶面取向从(220)晶面变为(111)晶面,并且衍射峰峰强顺序从(220) > (111) > (200) > (311)变为(111) > (200) > (220) > (311)。晶面(220)和(311)的峰强随碲离子浓度增加而逐渐变小,甚至消失,这表明碲离子的存在对铜电结晶过程具有重大影响。但是在XRD图谱中,即使在碲浓度高达2 g/L的情况下也没有发现有关碲或者铜碲合金的特征衍射峰,这可能是因为碲在沉积层的含量过低,检测不到的缘故。
3.4. 表面形貌
碲对铜电沉积层表面形貌的宏观与微观影响可分别从扫描电镜照片与光学照片中观察获得。如图5(a)所示,当电解液中不存在碲离子时,铜片表面覆盖有形状规则的颗粒。碲的引入可明显细化沉积颗粒,使颗粒愈加细小(如图5(b)~(d)所示)。当碲在电解液中的浓度低于1 g/L时,沉积层仍然是由许多的颗粒组成。而当碲浓度达到2 g/L时,沉积层表面颗粒消失,变得非常平滑,如图5(e)所示。
沉积层的光学照片同样能够很直观地反应出碲对铜沉积层表面形貌的影响。从纯硫酸铜溶液中电解得到的铜片表面明亮,光滑,具有铜金属的色泽,具有极好的韧性,能够轻易地从阴极表面完整地成片剥离下来,如图6(a)所示。而在电解液中加入碲离子后,铜片表面发生了很大变化。如图6(b)~(d)所示,当碲浓度为0.5 g/L时,电解得到的铜片表面开始发黑并且开始出现细微的固体粉末。当碲浓度提高到1 g/L时,铜片表面发黑愈发严重,粉末数量更多。但这两个浓度下电解得到的铜片仍然具备一定的韧性,能够完整从阴极剥离,韧性随碲浓度的增加而逐渐降低。当碲的浓度达到2 g/L时,铜片完全发黑,几乎没有韧性,铜片脆且易碎,无法从阴极表面剥离。铜片表面十分光滑,未见固体粉末生成。
3.5. 除碲实验
通过以上测试可以看出碲的存在对硫酸铜的电解将产生极大的负面影响。因此,本文尝试通过特定的方法去除碲杂质,从而达到直接电解的目的。实验装置简图如图7。
图7中①为加热装置,保证实验温度为要求温度±2℃;②为循环磁力水泵,额定流量为5 L/min;③为自制玻璃管,规格为d = 30 mm,l = 400 mm,容积为282.6 cm−3,装填铜屑约200 g/次;④为2 L烧杯改装而成的储液罐,每次处理溶液体积为2 L。
图8为碲离子浓度为1 g/L的硫酸铜溶液,在95℃下,反应除碲效率与反应时间的关系曲线图。由图中可知,在反应时间为1 h的时候,溶液中的碲离子浓度已经降低到20 mg/L以下,除碲率达到了98%以上。当反应持续进行到2 h至6 h后,溶液中的碲离子浓度进一步降低为5 mg/L左右,除碲率达到了99.5%以上。
图9(a)、图9(b)分别为电解液除碲后直接电解1 h得到铜片的SEM图片与光学照片。除碲后电解得到的铜片,其微观形貌由小晶粒(图5(c))变成了较大的晶粒(图9(a)),形貌与不含碲杂质时极为类似(图5(a))。而宏观上,铜片的色泽鲜艳,光亮,无任何发黑(图9(b))。由此可以推断,该方法可有效地去除电解液中的碲离子,使净化液能够直接电解,获得合格的阴极铜。
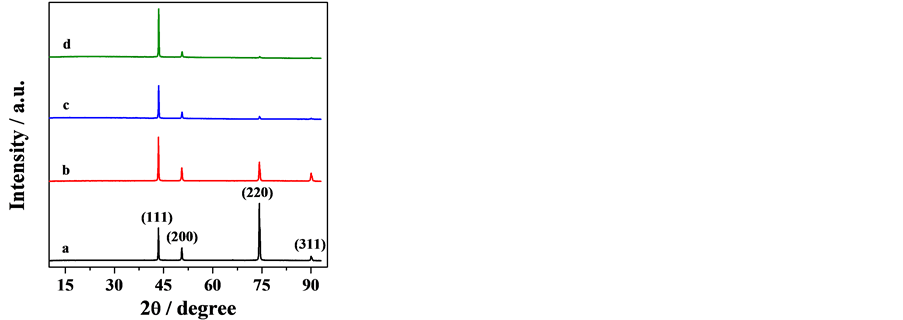
Figure 4. X-ray diffraction patterns of the deposits obtained from solution with various concentrations of tellurium: blank, 0 g∙L−1 (a), 0.5 g∙L−1 (b), 1.0 g∙L−1 (c) and 2.0 g∙L−1 (d)
图4. 不同碲浓度条件下得到铜片的XRD曲线,0 g∙L−1 (a),0.5 g∙L−1 (b),1.0 g∙L−1 (c),2.0 g∙L−1 (d)

Figure 5. SEM images of the deposits obtained from solution with various concentrations of tellurium: blank, 0 g∙L−1 (a), 0.5 g∙L−1 (b), 1.0 g∙L−1 (c) and 2.0 g∙L−1 (d)
图5. 不同碲浓度条件下得到铜片的扫描电镜照片,0 g∙L−1 (a),0.5 g∙L−1 (b),1.0 g∙L−1 (c),2.0 g∙L−1 (d)



 (a) (b) (c) (d)
(a) (b) (c) (d)
Figure 6. Digital photographs of the deposits obtained from solution with various concentrations of tellurium: blank, 0 g∙L−1 (a), 0.5 g∙L−1 (b), 1.0 g∙L−1 (c) and 2.0 g∙L−1 (d)
图6. 不同碲浓度条件下得到铜片的光学照片,0 g∙L−1 (a),0.5 g∙L−1 (b),1.0 g∙L−1 (c),2.0 g∙L−1 (d)
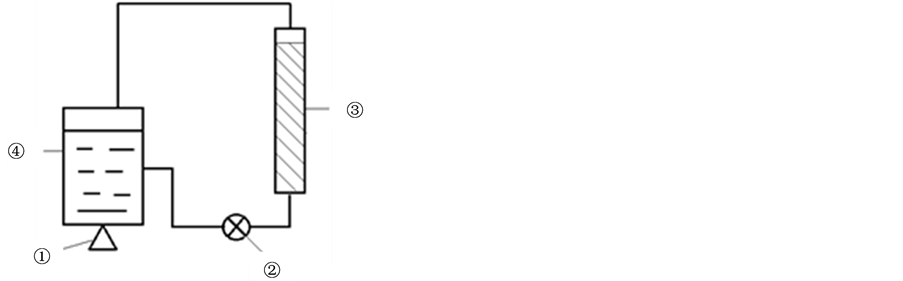
Figure 7. Experimental apparatus for measurement of reaction rate of tellurium
图7. 自制除碲装置图
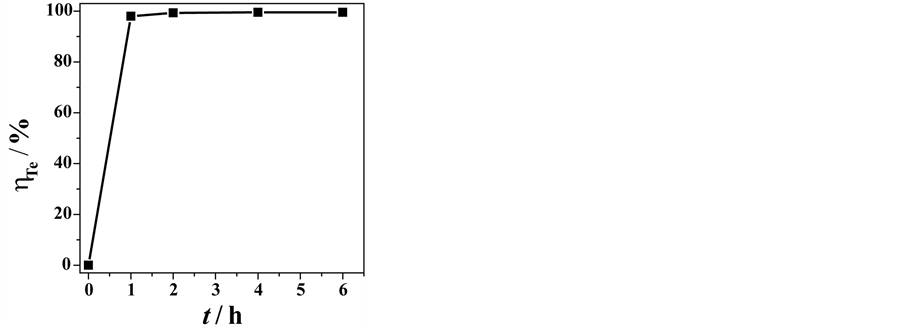
Figure 8. Rate of tellurium elimination under different time, temperature = 95˚C
图8. 除碲效率与时间关系曲线,反应温度95℃

 (a) (b)
(a) (b)
Figure 9. The images of SEM (a) and digital (b) of the copper deposit which obtained from the eliminated electrolyte
图9. 除碲后直接电解所得铜片SEM照片(a),宏观照片(b)
4. 结论
本论文研究了碲作为杂质元素,在浓度范围为0~2 g/L时对硫酸铜体系中电解铜行为的影响。研究表明,碲可在阴极参与还原反应,从而使电流效率升高。循环伏安曲线表明碲的存在对阴极反应影响较小,但是对阳极氧化过程有明显的影响。XRD表征显示,碲的存在可使铜的优先生长晶面从(222)向(111)转变。扫描电镜图片表明碲使铜电结晶的颗粒变小,同时光学照片显示碲的存在可使铜片表面变黑,韧性变差,甚至破裂。采用高温铜屑除碲法,可以在1 h内,将碲浓度从1 g/L降至20 mg/L,4 h后最高除碲率可达99.5%。电解液除碲后可直接电解得到合格阴极铜。
文章引用
李超超,伍廉奎,曹华珍,郑国渠. 碲对硫酸铜体系中铜电解的影响
Effect of Tellurium on Copper Electrodeposition in Copper Sulfate-Sulfuric Acid System[J]. 冶金工程, 2016, 03(02): 64-71. http://dx.doi.org/10.12677/MEng.2016.32010
参考文献 (References)
- 1. Baral, A., Sarangi, C.K., Tripathy, B.C., et al. (2014) Copper Electrodeposition from Sulfate Solutions—Effects of Se-lenium. Hydrometallurgy, 146, 8-14. http://dx.doi.org/10.1016/j.hydromet.2014.03.001
- 2. Agrawal, A. and Sahu, K.K. (2010) Problems, Prospects and Current Trends of Copper Recycling in India: An Overview. Resources Conservation & Recycling, 54, 401-416. http://dx.doi.org/10.1016/j.resconrec.2009.09.005
- 3. Choubey, P.K., Panda, R., Jha, M.K., et al. (2015) Recovery of Copper and Recycling of Acid from the Leach Liquor of Discarded Printed Circuit Boards (PCBs). Separation and Purification Technology, 156, 269-275. http://dx.doi.org/10.1016/j.seppur.2015.10.012
- 4. Fogarasi, S., Imre-Lucaci, F., Egedy, A., et al. (2015) Eco-Friendly Copper Recovery Process from Waste Printed Circuit Boards Using Fe3+/Fe2+ Redox System. Waste Management, 40, 136-143. http://dx.doi.org/10.1016/j.wasman.2015.02.030
- 5. Dimitrijevic, M.D., Urosevic, D.M., Jankovic, Z.D., et al. (2016) Recovery of Copper from Melting Slag by Sulphation Roasting and Water Leaching. Fizykochemiczne Problemy Mineralurgii—Physicochemical Problems of Mineral Pro- cessing, 52, 409-421.
- 6. 文燕. 铜闪速熔炼烟灰浸出试验研究[J]. 冶金工程, 2015, 2(3): 151-157.
- 7. Hait, J. (2009) Processing of Copper Electrorefining Anode Slime: A Review. Mineral Processing & Extractive Metallurgy, 118, 240-252. http://dx.doi.org/10.1179/174328509X431463
- 8. Amer, A.M. (2002) Processing of Copper Anode Slimes for Extraction of Metal Values. Physicochemical Problems of Mineral Processing, 123-134.
- 9. Das, S.C. and Krishna, P.G. (1996) Effect of Fe(III) during Copper Electrowinning at Higher Current Density. International Journal of Mineral Processing, 46, 91-105. http://dx.doi.org/10.1016/0301-7516(95)00056-9
- 10. Cheng, C.Y., Hughes, C.A., Barnard, K.R., et al. (2000) Manganese in Copper Solvent Extraction and Electrowinning. Hydrometallurgy, 58, 135-150. http://dx.doi.org/10.1016/s0304-386x(00)00120-1
- 11. Panda, B., Das, S.C. and Panda, R.K. (2009) Effect of Added Cobalt Ion on Electro-Deposition of Copper from Sulfate Bath Using Graphite and Pb-Sb Anodes. Hydrometallurgy, 95, 87-91. http://dx.doi.org/10.1016/j.hydromet.2008.04.018
- 12. Huang, H., Zhou, J.Y. and Guo, Z.C. (2010) Effect of Added Cobalt Ion on Copper Electrowinning from Sulfate Bath Using Doped Polyaniline and Pb-Ag Anodes. Transac-tions of Nonferrous Metals Society of China, 20, s55-s59. http://dx.doi.org/10.1016/s1003-6326(10)60012-x
- 13. Safizadeh, F., Lafront, A.-M., Ghali, E., et al. (2012) An Investigation of the Influence of Selenium on Copper Deposition during Electrorefining Using Electrochemical Noise Analysis. Hydrometallurgy, 111, 29-34. http://dx.doi.org/10.1016/j.hydromet.2011.09.008
- 14. Wen, S., Corderman, R.R., Seker, F., et al. (2006) Kinetics and Initial Stages of Bismuth Telluride Electrodeposition. Journal of the Electrochemical Society, 153, C595-C602. http://dx.doi.org/10.1149/1.2212053
- 15. Cao, H.Z., Yang, D., Zhu, S.L., Dong, L. and Zheng, G.Q. (2012) Preparation, Characterization, and Electrochemical Studies of Sulfur-Bearing Nickel in an Ammoniacal Electrolyte: The Influence of Thiourea. Journal of Solid State Electrochemistry, 16, 3115-3122. http://dx.doi.org/10.1007/s10008-012-1753-0
- 16. Fletcher, S., Halliday, C.S., Gates, D., et al. (1983) The Re-sponse of Some Nucleation/Growth Processes to Triangular Scans of Potential. Journal of Electroanalytical Chemistry, 159, 267-285. http://dx.doi.org/10.1016/S0022-0728(83)80627-5