Hans Journal of Biomedicine
Vol.07 No.03(2017), Article ID:21339,8
pages
10.12677/HJBM.2017.73008
Preparation and Characterization of Glioma Targeted Liposomes
Wei Han, Ao Hu, Dajing Yao, Guangfu Yin*
College of Materials Science and Engineering, Sichuan University, Chengdu Sichuan

Received: Jun. 22nd, 2017; accepted: Jul. 9th, 2017; published: Jul. 12th, 2017

ABSTRACT
Glioma was one of the most common encephaloma. The development of targeted drug release system was critical for the safe and efficient treatment of glioma. Angiopep-2 and TAT dual-modified and glioma-targeted liposomes were prepared (Ang-TAT-LIP). Orthogonal tests were used to study the optimum preparation conditions of liposomes. 1H-NMR spectra was utilized to verify the modification effect of peptides. Particle sizer and TEM were used to analyze the size distribution and morphology, and characterized the serum stability of liposomes. Finally, the in-vitrocell uptake experiment was used to study the effect of liposome targeting into cells. The main results were summarized as follows: DSPE-PEG2000-Ang/TAT was confirmed successfully synthesized by 1H-NMR spectra. The optimum conditions combination was below: 50˚C water bath, rotate speed 120 rpm, ultrasonic time 16 min, filters 0.22 μm and 0.10 μm. The liposomes were about 110 nm in diameter, with uniform particle size, spherical shape, good dispersity and fine serum stability. In conclusion, the Ang-TAT-LIP was a potential drugs carrier material of glioma targeting.
Keywords:Glioma, Liposomes, Angiopep-2
脑胶质瘤靶向脂质体的制备和表征
韩伟,胡傲,姚大靖,尹光福*
四川大学材料科学与工程学院,四川 成都

收稿日期:2017年6月22日;录用日期:2017年7月9日;发布日期:2017年7月12日

摘 要
脑胶质瘤是最常见的颅内恶性肿瘤,能特异性靶向脑胶质瘤细胞的药物载体是脑胶质瘤安全高效治疗的关键。本研究制备了Angiopep-2和TAT双配体修饰的脑胶质瘤靶向脂质体(Ang-TAT-LIP),通过正交试验探究脂质体的优化制备条件,并用核磁共振氢谱表征多肽修饰的效果,通过纳米粒度仪和TEM电镜表征脂质体的粒径分布和形貌,并表征脂质体的血清稳定性,最后用体外细胞摄取实验,研究脂质体靶向进入细胞的效果。具体结论如下:1H-NMR证实DSPE-PEG2000-Ang/TAT的成功合成;脂质体的优化制备条件如下,50˚C水浴、旋蒸转速为120 rpm、探头超声16 min、并依次过0.22 μm及0.10 μm的滤膜;脂质体的平均粒径约为110 nm,径分布均匀、且粒形为圆球状,分散性和血清稳定性良好;Ang-TAT-LIP脂质体具有亲合–穿膜协同效应,可靶向脑胶质瘤细胞,进而被细胞摄取。综上所述,Ang-TAT-LIP是一种具有应用前景的脑胶质瘤靶向药物载体材料。
关键词 :脑胶质瘤,脂质体,Angiopep-2

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脑胶质瘤约占颅内肿瘤的45%,具有生长速度快、高侵袭性等特点 [1] ,并且由于血脑屏障(BBB)的存在,用手术、放化疗等传统治疗手段很难治愈 [2] 。脂质体具有无毒性、低免疫原性等特性,用亲水性的聚乙二醇长链修饰脂质体,可显著提高其体内循环时间 [3] 。在脑靶向药物递送系统中,低密度脂蛋白受体相关蛋白1 (LRP1)常被用于促进受体介导的转胞吞作用 [4] ,LRP1在脑毛细血管内皮细胞和脑胶质瘤细胞上高表达 [5] [6] 。Angiopep-2 (Ang)肽对LRP1具有高度亲和性、TAT肽是一种公认的高效细胞穿膜肽 [7] ,Angiopep-2和TAT双配体修饰的脂质体(Ang-TAT-LIP),可高效地穿透BBB并进一步靶向脑胶质瘤细胞 [8] 。
本课题通过正交试验研究脂质体的优化制备条件,并用透射电镜(TEM)和纳米粒度仪测试其颗粒形貌、平均粒径和Zeta电位等参数。用核磁共振氢谱(1H-NMR)研究Ang/TAT与脂质体的偶联情况。最后用高表达LRP1的人脑星形胶质母细胞U87和大鼠脑毛细血管内皮细胞bEnd.3 [9] ,进行香豆素6荧光脂质体的细胞摄取实验,以表征脂质体对BBB和脑胶质瘤细胞的体外靶向入胞效果。
2. 材料与方法
2.1. 试剂与仪器
Ang和TAT由吉尔生化有限公司合成;大豆磷脂(SPC)购自Lipoid GmbH;胆固醇(CHO)购自Avanti Polar Lipids;PEG修饰的和马来酰亚胺接枝的二硬脂酰磷脂酰乙醇胺(DSPE-PEG2000和DSPE-PEG2000-Ma)买于Nanocs;香豆素6购自于Sigma-Aldrich;Dulbecco改良的Eagle培养基(DMEM)和胎牛血清(FBS)买于Gibco;其它相关的化学药品都为分析纯。
旋转蒸发仪:SY-2000,中国上海亚荣;PVDF针头式过滤器:0.22 μm/0.10μm,Millipore;马尔文纳米粒度仪:Nano ZS90,马尔文仪器有限公司;超声波细胞破碎仪:scientz-IID,新芝生物科技有限公司;TEM:JEM-100CX,日本电子株式会社;核磁共振波谱仪:600 MHz,Unity Inova光谱仪;荧光倒置显微镜(IFM):IX-71,Olympus公司。
2.2. DSPE-PEG2000-Ang/TAT的合成
如图1所示,通过Ang中半胱氨酸的巯基和DSPE-PEG2000-Mal的马来酰亚胺(Mal)之间的共价反应合成DSPE-PEG2000-Ang。简而言之,把DSPE-PEG2000-Mal、Cys-Ang和催化剂三乙胺(摩尔比= 1:1:3)共混于三氯甲烷中,室温避光反应20 h,用氮气防止氧化,用旋转蒸发仪真空干燥混合物。以CDCl3作为溶剂,通过1H-NMR鉴定最终产物。用TAT-Cys替代Cys-Ang,并使用同样的方法合成DSPE-PEG2000-TAT。
2.3. 脂质体的制备
用薄膜分散法制备脂质体 [10] ,如表1所示,将脂质体原材料溶解到三氯甲烷中,旋转蒸发并真空干燥2 h,彻底除去有机溶剂后得到多室脂质体薄膜。将薄膜在50˚C的条件下水化30 min,随后用100 W的功率探头超声(5 s超声,5 s间隔),最后将脂质体溶液挤压通过PVDF滤器。
制备聚乙二醇脂质体(PEG-LIP)是制备其它功能化脂质体的基础,因此用L9(34)正交试验来探究脂质体的优化制备条件,其中旋转蒸发的温度、转速,超声时间和PVDF滤器的孔径被选为影响因素。
基于上述的操作和优化制备条件,制备了四种香豆素6(C6)包载的荧光脂质体(C6:磷脂= 1:80, w/w),包括C6包载的脂质体(C6-LIP)、单配体修饰的C6脂质体(C6-TAT-LIP、C6-Ang-LIP)和双配体修饰的C6脂质体(C6-Ang-TAT-LIP)。
2.4. 脂质体粒径和形貌的表征
分别将脂质体稀释到质量分数为1%和0.1%,用马尔文纳米粒度仪测量脂质体的平均粒径和Zeta电位。将脂质体用超纯水稀释到约1.6 mg/mL,磷钨酸负染脂质体后,用TEM表征脂质体的形貌。
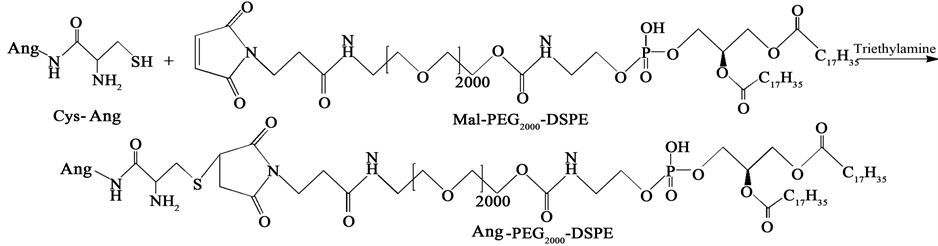
Figure 1. Synthesis of DSPE-PEG2000-Ang
图1. DSPE-PEG2000-Ang的合成
Table 1. Composition of Liposomes (mol%)
表1. 各种脂质体的组成
2.5. 脂质体稳定性的表征
为了研究脂质体的稳定性,可以在FBS中检测脂质体的平均粒径和透光率的变化 [11] 。简而言之,把50 μL各种配方的脂质体加入到1 mL的含有10% FBS的培养基中,然后在37˚C、30 rpm的振荡条件下,置于水浴摇床中温育0~24 h。通过脂质体在不同时间的透光率和平均粒径的变化,反映脂质体的稳定性高低。用酶标仪在750 nm的波长下测试脂质体的透光率变化,用纳米粒度仪表征粒径的变化。
2.6. 体外细胞摄取实验
用DMEM培养基,在37˚C、5% CO2的条件下培养U87细胞和bEnd.3细胞。以2.5 × 104细胞/孔的密度,把细胞接种在24孔板中。培养24 h之后,将不同配方的C6脂质体与细胞共培养4 h,其中C6的浓度为3 μg/mL。再用PBS溶液将细胞清洗三遍,4%的多聚甲醛固定20 min后用荧光倒置显微镜对细胞成像。所有培养基中含有10% FBS、100 U/mL青霉素和0.1 mg/mL链霉素。
2.7. 统计分析
所有的数据都来自三个独立样本,表示成平均值±标准差的形式。用SPSS 22软件单因素方差分析对结果进行分析,p值<0.05和<0.01分别被认为是有统计学差异和有显著性差异。
3. 结果与讨论
3.1. DSPE-PEG2000-Ang/TAT的合成
通过巯基和马来酰亚胺之间的共价连合成DSPE-PEG2000-Ang/TAT。图2(a)为DSPE-PEG2000-TAT的1H-NMR图(溶剂为CDCl3)。4.67 ppm处的特征吸收峰为溶剂残留峰,3.59 ppm处的峰值为PEG的吸收峰,表明亲水性PEG长链的存在,Mal基团的特征吸收峰位于6.72 ppm处。从DSPE-PEG2000-TAT的谱图中可以发现Mal特征吸收峰的消失,这说明DSPE-PEG2000-Mal的Mal官能团和TAT的巯基发生了化学反应,因此在2.2~3.65 ppm处可以发现反应后的重叠峰。核磁共振氢谱表明DSPE-PEG2000-TAT被成功的合成了。同理如图2(b)所示,也可以说明DSPE-PEG2000-Ang的成功合成。
3.2. PEG-LIP的优化制备条件
第一组实验的平均粒径最高,为177.63 nm,同时第五组实验的平均粒径最低,为113.86 nm。极差
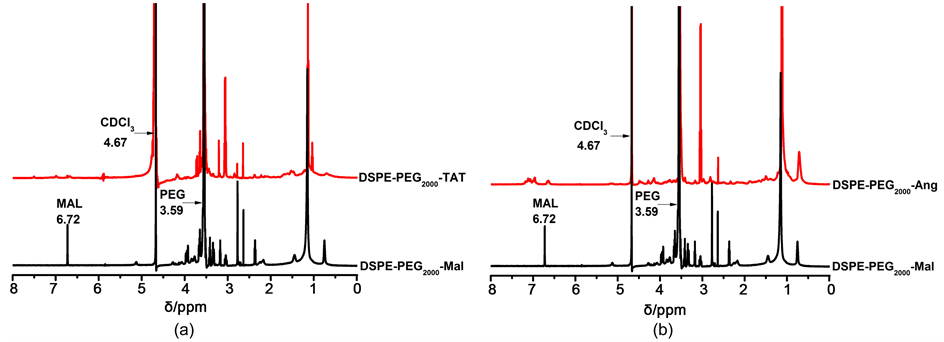
Figure 2. 1H-NMR spectra (inCDCl3) of DSPE-PEG2000-Mal and DSPE-PEG2000-Ang/TAT
图2. DSPE-PEG2000-Mal和DSPE-PEG2000-Ang/TAT的1H-NMR图(溶剂为CDCl3)
越大说明影响因素对系统表现的影响越大 [12] ,由表2可知温度、转速、超声时间和过滤的极差依次为:5.22、5.06、53.49和9.2,因此四个因素对平均粒径的影响高低为:超声时间 > 过滤 > 温度 > 旋转速度。说明探头超声可以有效地分散团聚的小单室脂质体;同时过滤可以除去少量粒径较大的大单室脂质体,减少平均粒径。脂质体在旋蒸时转速的高低,会改变脂质体颗粒的分散程度,影响颗粒周围接触到原子和悬空键的数量、改变脂质体自组装过程中的表面能,从而影响脂质体的粒径,但实验结果说明其影响作用最不显著。
三个水平之间的比较(K1, K2, K3)表明脂质体的优化制备条件为:旋蒸水浴温度为50˚C、旋蒸转速度为120 rpm、探头超声时间为16 min、并且依次过0.22 μm和0.10 μm的滤膜。L9(34)正交试验符合最优化平均粒径的需求,优化制备条件将用于其它脂质体的制备。
3.3. 脂质体的粒径分布和形貌
根据上述优化制备条件,得到PEG-LIP的平均粒径约为99.83 nm,四种C6包载的荧光脂质体的平均粒径为103.66~110.72 nm。脂质体的多分散系数(PDI)均在0.2以内,表明脂质体的粒径分布较均匀、分散性好。PEG-LIP的Zeta电位最小,为−8.65 mV,当其表面偶联了带正电荷的TAT肽(等电点12.13)和Ang肽((等电点9.31)后,Zeta电位值增加,因此C6-Ang-TAT-LIP的Zeta电位最大,为−4.80 mV。
图3(a)和图3(b)为C6-Ang-TAT-LIP脂质体的粒径和Zeta电位的分布,可见其粒径分布较集中,Zeta电位接近于0,表面略带负电。图3(c)为C6-Ang-TAT-LIP脂质体的TEM图,脂质体大小较均匀、为球形的小单室脂质体、没有粘连现象。说明本研究所采用的脂质体制备条件和方法可行。
3.4. 脂质体的血清稳定性
脂质体的表面通常会用PEG修饰以提高稳定性,FBS经常被用于进行生理条件的模拟 [13] 。如图4(a)
Table 2. Orthogonal test results of PEG-LIP preparation
表2. PEG-LIP制备正交实验的结果
和图4(b)所示,24 h内四种脂质体在FBS溶液中透光率和粒径都没有显著的变化,说明脂质体的稳定性良好,在血流中不会有明显的集聚。
3.5. 体外细胞摄取实验
图5为U87细胞和bEnd.3细胞与C6脂质体细胞共培养4 h后的细胞摄取情况,用荧光倒置显微镜进行观察结果,绿色为脂质体中C6的荧光。可见C6-Ang-TAT-LIP的荧光强度比C6-LIP和单配体脂质体(C6-Ang-LIP或C6-TAT-LIP)都要高很多,表明双配体修饰脂质体可以更高效地与U251细胞及bEnd.3细胞结合并被细胞摄取。但通过对比图5(a)和图5(b),可以发现每组脂质体中,U251细胞的荧光强度高于bEnd.3细胞,说明U251细胞对各种脂质体的摄入量大于bEnd.3细胞的摄取量。
实际上,由于LRP1受体在U251和bEnd.3中都高表达,在Ang与受体LRP1特异性靶向结合后,保持了C6-Ang-TAT-LIP与U251及bEnd.3细胞的紧密接触,有利于发挥TAT肽的穿膜作用,进而增强细胞的摄取 [14] ,这也表明Ang与TAT双配体修饰的脂质体具有亲合–穿膜的协同效应。
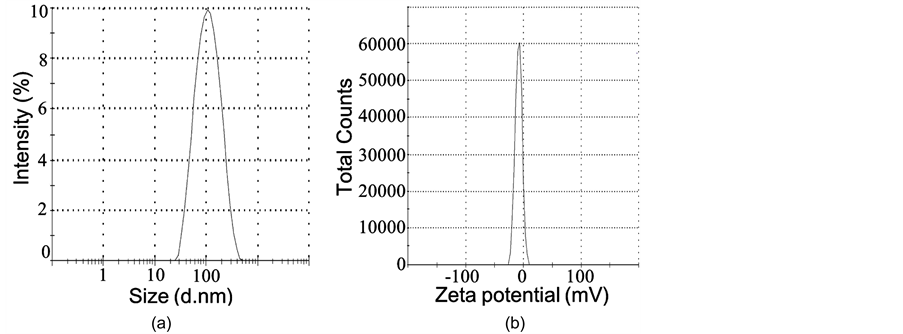
Figure 3. Size (a) and Zeta potential (b) distribution, and TEM graph of C6- Ang-TAT-LIP
图3. C6-Ang-TAT-LIP脂质体的粒径(a)、Zeta电位(b)分布和TEM图(c)
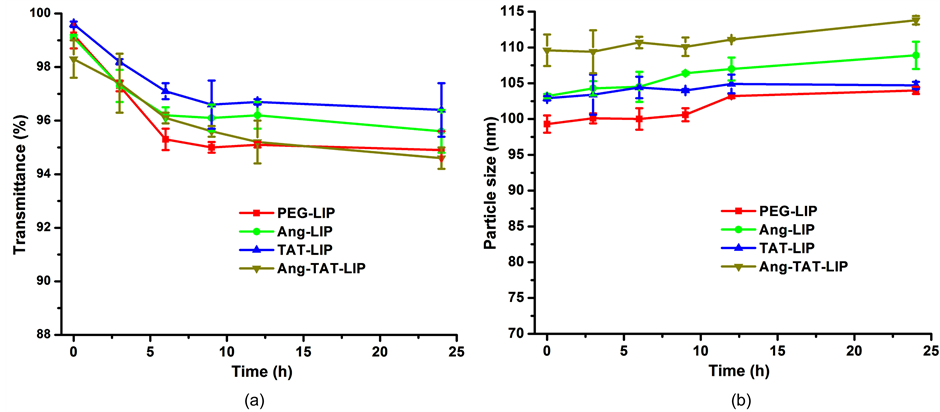
Figure 4. Variations in particle size (a) and transmittance (b) of liposomes in 10% FBS (n = 3)
图4. 脂质体在10% FBS中粒径(a)和透光率(b)的变化(n = 3)

Figure 5. Fluorescent images of C6-loaded liposomes on cells, U87 cells (a), bEnd.3 cells (b). I: C6-LIP, II: C6-Ang-LIP, III: C6-TAT-LIP, IV: C6-Ang-TAT-LIP
图5. C6脂质体的细胞荧光图像,U87细胞(a)、bEnd.3细胞(b);I:C6-LIP,II:C6-Ang-LIP,III:C6-TAT-LIP,IV:C6-Ang-TAT-LIP
4. 结论
本课题通过正交试验研究了脂质体的优化制备条件,用旋转蒸发法制备了双配体修饰的脂质体(Ang-TAT-LIP),并通过1H-NMR证实多肽的成功偶联。脂质体平均粒径约为110 nm,颗粒大小均匀、分散性和血清稳定性较好。体外细胞摄取实验表明Ang-TAT-LIP可以在体外特异性靶向LRP1高表达的脑胶质瘤细胞,并高效地进入细胞内部,是一种具有应用潜力的脑胶质瘤靶向脂质体药物载体。
基金项目
国家自然科学基金项目(No. 51372157)。
文章引用
韩 伟,胡 傲,姚大靖,尹光福. 脑胶质瘤靶向脂质体的制备和表征
Preparation and Characterization of Glioma Targeted Liposomes[J]. 生物医学, 2017, 07(03): 46-53. http://dx.doi.org/10.12677/HJBM.2017.73008
参考文献 (References)
- 1. Omuro, A. and Deangelis, L.M. (2013) Glioblastoma and Other Malignant Gliomas: A Clinical Review. Journal of the American Medical Association, 310, 1842-1850. https://doi.org/10.1001/jama.2013.280319
- 2. Hamza, M.A. and Gilbert, M. (2014) Targeted Therapy in Gliomas. Current Oncology Reports, 16, 1-14. https://doi.org/10.1007/s11912-014-0379-z
- 3. Yoo, J.W., Chambers, E. and Mitragotri, S. (2010) Factors that Control the Circulation Time of Nanoparticles in Blood: Challenges, Solutions and Future Prospects. Current Pharmaceutical Design, 16, 2298-2307. https://doi.org/10.2174/138161210791920496
- 4. Wei, X., Zhan, C., Chen, X., Hou, J., Cao, X. and Lu, W. (2014) Re-tro-Inverso Isomer of Angiopep-2: A Stable D-Peptide Ligand Inspires Brain-Targeted Drug Delivery. Molecular Pharmaceutics, 11, 3261-3268. https://doi.org/10.1021/mp500086e
- 5. Shen, J., Zhan, C., Xie, C., Meng, Q., Gu, B., Li, C., et al. (2011) Poly (Ethylene Glycol)-Block-Poly (d,l-Lactide Acid) Micelles Anchored with Angiopep-2 for Brain-Targeting Delivery. Journal of Drug Targeting, 19, 197-203. https://doi.org/10.3109/1061186X.2010.483517
- 6. Ke, W., Shao, K., Huang, R., Han, L., Liu, Y. and Li, J. (2009) Gene Delivery Targeted to the Brain Using an Angiopep-Conjugated Polyethyleneglycol-Modified Polyamidoamine Dendrimer. Biomaterials, 30, 6976-6985. https://doi.org/10.1016/j.biomaterials.2009.08.049
- 7. Zong, T., Mei, L., Gao, H., Shi, K., Chen, J., Wang, Y., et al. (2014) Enhanced Glioma Targeting and Penetration by Dual-Targeting Liposome Co-Modified with T7 and TAT. Journal of Pharmaceutical Sciences, 103, 3891-3901. https://doi.org/10.1002/jps.24186
- 8. Xin, H., Jiang, X., Gu, J., Sha, X., Chen, L., Law, K., et al. (2011) Angiopep-Conjugated Poly (Ethylene Glycol)-Co-Poly (Ε-Caprolactone) Nanoparticles as Dual-Targeting Drug Delivery System for Brain Glioma. Biomaterials, 32, 4293-4305. https://doi.org/10.1016/j.biomaterials.2011.02.044
- 9. Yang, Z.Z., Li, J.Q., Wang, Z.Z., Dong, D.W. and Qi, X.R. (2014) Tumor-Targeting Dual Peptides-Modified Cationic Liposomes for Delivery of siRNA and Docetaxel to Gliomas. Biomaterials, 35, 5226-5239. https://doi.org/10.1016/j.biomaterials.2014.03.017
- 10. Song, S., Liu, D., Peng, J., Sun, Y., Li, Z., Gu, J.R., et al. (2008) Peptide Ligand-Mediated Liposome Distribution and Targeting to EGFR Expressing Tumor In Vivo. International Journal of Pharmaceutics, 363, 155-161. https://doi.org/10.1016/j.ijpharm.2008.07.012
- 11. Maeda, N., Takeuchi, Y., Takada, M., Sadzuka, Y., Namba, Y. and Oku, N. (2004) Anti-Neovascular Therapy by Use of Tumor Neovasculature-Targeted Long-Circulating Liposome. Journal of Controlled Release, 100, 41-52. https://doi.org/10.1016/j.jconrel.2004.07.033
- 12. Zhu, J. and Chen, W. (2014) Energy and Energy Performance Analysis of a Marine Rotary Desiccant Air-Conditioning System Based on Orthogonal Experiment. Energy, 77, 953-962. https://doi.org/10.1016/j.energy.2014.10.014
- 13. Sharma, G., Modgil, A., Layek, B., Arora, K., Sun, C., Law, B., et al. (2013) Cell Penetrating Peptide Tethered Bi-Ligand Liposomes for Delivery to Brain In Vivo: Biodistribution and Transfection. Journal of Controlled Release, 167, 1-10. https://doi.org/10.1016/j.jconrel.2013.01.016
- 14. Kibria, G., Hatakeyama, H., Ohga, N., Hida, K. and Harashima, H. (2011) Dual-Ligand Modification of PEGylated Liposomes Shows Better Cell Selectivity and Efficient Gene Delivery. Journal of Controlled Release, 153, 141-148. https://doi.org/10.1016/j.jconrel.2011.03.012
NOTES
*通讯作者。
