Hans Journal of Chemical Engineering and Technology
Vol.06 No.03(2016), Article ID:17636,9
pages
10.12677/HJCET.2016.63007
Modification and Application of Niobic Acid Catalysis in Synthesis of Tebelon
Jiance Jin1, Panpan Wu1, Qing Wang1, Dingfeng Jin1,2*, Ming Zhang3, Hongliang Ge1, Xinqing Wang1, Zhengbao Wang2, Hui Lou4
1College of Materials Science and Engineering, China Jiliang University, Hangzhou Zhejiang
2Department of Chemical and Biological Engineering, Zhejiang University, Hangzhou Zhejiang
3Department of Environmental Engineering, China Jiliang University, Hangzhou Zhejiang
4Department of Chemical, Zhejiang University, Hangzhou Zhejiang

Received: May 2nd, 2016; accepted: May 22nd, 2016; published: May 25th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Four kinds of modified niobic acids were synthesized by potassium hydroxide melting method using different inorganic acid treatments. The structure and surface acidity of this niobic acid were studied by XRD, N2 adsorption-desorption and NH3-TPD. The catalytic activity of modified niobic acid in the synthesis of tebelon had been studied. The experimental results indicated that H2SO4-Nb2O5 has the better performance and stability. The optimal conditions of etherification reaction are as follows: catalyst amount used for raw material 1.0% (weight ratio), reaction temperature 110˚C, mole ratio of alcohol to acid 2:1 and reaction time 8 h.
Keywords:Tebelon, Modified Niobic Acid, Pour Depressant, Catalyst

铌酸改性及催化合成油酸异丁酯
金建策1,吴盼盼1,王晴1,金顶峰1,2*,张明3,葛洪良1,王新庆1,王正宝2,楼辉4
1中国计量大学,材料科学与工程学院,浙江 杭州
2浙江大学,化学工程和生物工程学院,浙江 杭州
3中国计量大学,环境工程系,浙江 杭州
4浙江大学,化学系,浙江 杭州

收稿日期:2016年5月2日;录用日期:2016年5月22日;发布日期:2016年5月25日

摘 要
本文采用氢氧化钾熔融酸化法合成了四种改性铌酸,利用XRD、氮气吸脱附曲线和NH3-TPD等考察了改性铌酸的结构特征和表面酸性,同时考察其在油酸和异丁醇催化合成油酸异丁酯中的催化反应活性,对合成条件进行了优化。试验结果表明,硫酸改性后的铌酸具有较好的催化反应性能和良好的稳定性。适宜酯化反应条件为硫酸改性铌酸催化剂,催化剂用量为原料质量的1.0%,反应温度110℃,异丁醇与油酸摩尔比2:1和反应时间8小时。
关键词 :油酸异丁酯,改性铌酸,降凝剂,催化剂

1. 引言
生物柴油(Biodiesel)是以油料作物、野生油料植物和工程藻类等水生植物油脂,以及动物油脂、废餐饮油等为原料制成的一种可再生的清洁燃料,可以直接用作柴油机的燃料 [1] - [3] 。生物柴油与石化柴油性能相近,同时因其不含芳香族烃类成份而不具致癌性,并且不含硫、铅、卤素等有害物质。相比于石化柴油,生物柴油的燃烧尾气对人体的损害更小,同时具有良好的生物降解特性。使用生物柴油后汽车尾气排放中有毒有机物仅为使用石化柴油的10%,颗粒物为20%,二氧化碳和一氧化碳的排放量仅为10%,排放尾气可达标。其不仅可以缓解对石油的依赖状况,而且可以提高燃烧热效率,更重要的是在减少环境污染方面做出重大贡献 [4] 。
但在实际的使用中发现生物柴油作汽车燃料时NOx的排放量比石油柴油略有增加;热值也比石油柴油略低;由于其具有较高的溶解性,作燃料时易于溶胀发动机的橡塑部分,需要定期更换;而且原料对生物柴油的性质有很大影响,若多元不饱和脂肪酸含量高,则生物柴油的氧化安定性可能较差;若原料中饱和脂肪酸含量高,则生物柴油的低温流动性可能较差 [5] 。
通常采用混合降凝法、冷冻过滤降凝法和降凝剂添加法 [6] [7] 等来改善生物柴油的低温流动性。其中降凝剂添加法操作简单,不会改变生物柴油的其它性能,能降低生物柴油的生产成本。
油酸异丁酯作为常用的降凝剂在工业上使用稀硫酸作为催化剂进行合成,存在设备腐蚀和废液处理的困扰 [8] 。李法社等采用吡啶硫酸氢盐离子液体和正丁基三乙胺硫酸氢盐离子液体为催化剂研究其对油酸和异丁醇催化酯化合成油酸异丁酯的反应过程,具有较高活性 [9] [10] 。但是离子液体的合成步骤较复杂,成本高,且不容易回收利用。因此需要开发新的具有低腐蚀性能、易于产品分离、高反应活性和稳定性的催化剂。
本文采用一种独特的固体酸催化材料铌酸作为催化剂对油酸异丁酯催化合成进行了研究。铌酸是不溶于水的聚合氧化物,分子式为Nb2O5∙nH2O,由Nb(OH)5或NbO(OH)3通过分子间脱水形成 [11] 。铌酸的独特性质体现在不管其水含量多少,其表面上总是保有强的酸性,在含水体系中仍具有较高的酸性和稳定的催化活性,这是任何其他酸性金属氧化物催化剂所没法比拟的 [12] 。但普通的铌酸比表面积低,在一般的酸碱溶液中难溶解,较难通过共沉淀等方法制备作为催化剂或者载体进行应用 [13] 。本文通过采用氢氧化钾熔融酸化法对铌酸进行了改性得到具有高比表面和大酸量的固体酸催化剂,并研究其在油酸和异丁醇酯化合成油酸异丁酯中的催化性能。
2. 实验部分
2.1. 实验原料、催化剂样品制备与表征
五氧化二铌、氢氧化钾、硫酸、硝酸、磷酸、醋酸、油酸和异丁醇购自国药集团化学试剂上海有限公司,均为分析纯,未进一步纯化。
氢氧化钾熔融酸化法:将五氧化二铌和氢氧化钾于玛瑙研钵中充分混合研磨后置于镍坩埚中,然后在马弗炉中于450℃焙烧3小时得熔体;降温后向熔体中加入去离子水,抽滤,将滤液转入烧杯后,搅拌条件下分别滴加硫酸、硝酸和磷酸调节体系pH为1或加冰醋酸调节体系pH为5,静置1小时后抽滤,并用热水多次洗涤滤饼,120℃烘干制得改性铌酸。
采用Philips PW 1830型X射线衍射仪来分析样品的晶体结构和物相成份。测试条件为Cu-Ka靶,波长为1.54056 Å;管压为40 KV,管电流40I;扫描步长0.02˚,扫描范围10˚~80˚,速率:0.1 s/step。
样品的氮气吸脱附测试采用麦克ASAP2020物理吸附仪进行,样品测试前在250℃下脱气3小时。
样品的酸量采用日本BEL公司的化学吸附仪进行表征,取0.05克样品在100℃下用氦气吹扫一个小时后以升温速度10℃/min升温至500℃并保温1个小时,降温至50℃后通入氨气1小时使样品被饱和吸附,随后以升温速度10℃/min线性升温至800℃,通过脱附氨气的质谱峰面积对其酸量进行了计算。
2.2. 催化剂活性测试
采用油酸与异丁醇的反应来考察改性铌酸的催化性能。在装有温度计、搅拌器、冷凝回流装置的三口烧瓶中加入一定比例的油酸、异丁醇及催化剂,油浴加热到110℃回流反应一定时间。反应式如下所示:

反应结束后,过滤分离催化剂,将溶液转入旋转蒸发器中进行减压蒸馏,未反应的异丁醇进行回收,反应产物真空干燥得油酸异丁酯。
催化剂活性通过油酸转化率来评价,具体可通过测定反应前原料和反应后产物的酸值来计算:
转化率 = 。
。
式中,AV0——反应前原料的酸值,mg/g;
AV——反应后产物的酸值(包含未反应油酸和产物),mg/g。
催化剂的重复实验:在第一次反应结束后对催化剂和反应混合物抽滤,用乙醇洗涤三次除去催化剂表面的吸附物,然后在真空(10−7 Kpa)、100℃下烘干,再在相同的反应条件下进行第二次试验,并对产物进行分析。重复此过程得到多次重复试验的结果,用以考察催化剂的稳定性。
3. 结果与讨论
3.1. X射线衍射分析
未改性五氧化二铌和四种改性铌酸(醋酸改性铌酸、硝酸改性铌酸、磷酸改性铌酸和硫酸改性铌酸)样品的XRD结果如图1所示。
由图1可见,未改性五氧化二铌在2θ为16.97˚、22.60˚、28.87˚、29.06˚、36.49˚、36.99˚、37.12˚、46.06˚、49.72˚、50.88˚、54.97˚、55.29˚、55.33˚、56.22˚、58.56˚、63.38˚、70.12˚和71.02˚处存在许多的尖锐衍射峰,同五氧化二铌的斜方晶系衍射峰完全对应,对应编号为PDF#27-1003。而改性铌酸均只在20˚~40˚之间和45˚~60˚间存在馒头峰,说明这四组样品的结晶度都很差,为无定形态。
3.2. 比表面积和孔结构分析
四种改性铌酸的氮气吸脱附测试结果如图2所示。由图2可知,四种改性铌酸均呈现出III型等温线,在相对压力较低的地方没有出现突跃,在P/P0 = 0.4 − 0.8之间也没有明显的滞后环,说明催化剂既没有微孔也没有规整的有序介孔。在P/P0 = 0.8 − 1.0之间出现部分的滞后环,为酸处理过程中无定形五氧化二铌相互堆叠而成,不同酸处理后差别较大。
将四种改性铌酸的比表面积、孔体积和孔径汇总后总结于表1。从表中可知,醋酸改性铌酸具有最大的比表面积(200.95 m2∙g−1),比原料五氧化二铌比表面积(10.28 m2∙g−1)有较大的提高。硝酸改性铌酸和硫酸改性铌酸的比表面积差别不大,分别为81.47和65.46 m2∙g−1;而磷酸改性铌酸的比表面积仅有38.53 m2∙g−1。同时,磷酸改性铌酸比其他三种改性铌酸的孔容要小很多,仅有0.07 cm3∙g−1。从催化剂孔径数据可知四种催化剂均是无定形五氧化二铌的堆叠孔,没有规则孔道。
3.3. NH3-TPD分析
五氧化二铌和改性铌酸的NH3-TPD结果如图3所示。从图中可以看到五氧化二铌的弱酸中心(200℃~400℃)和强酸中心(400℃~700℃)均不多,总酸量也很少(具体数据总结于表2中)。醋酸改性铌酸

Figure 1. XRD pattern of Nb2O5 and modified niobic acid (A: Nb2O5; B: HAC-Nb2O5; C: HNO3-Nb2O5; D: H3PO4-Nb2O5; E: H2SO4-Nb2O5)
图1. 五氧化二铌和改性铌酸的XRD图(A:五氧化二铌;B:HAC-Nb2O5;C:HNO3-Nb2O5;D:H3PO4-Nb2O5;E:H2SO4-Nb2O5)
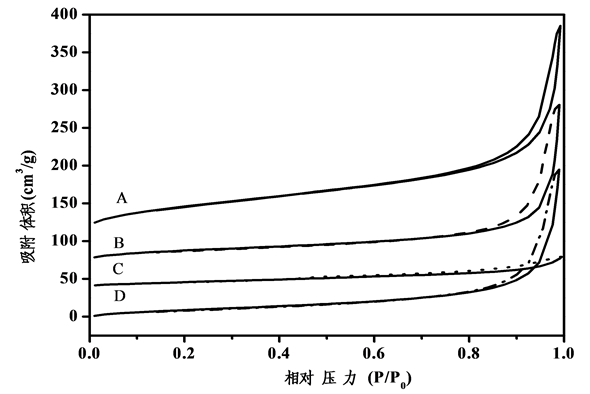
Figure 2. N2 adsorption-desorption isotherms of modified niobic acid (A: HAC-Nb2O5; B: HNO3-Nb2O5; C: H3PO4-Nb2O5; D: H2SO4-Nb2O5)
图2. 改性铌酸的氮气吸脱附结果图(A:HAC-Nb2O5;B:HNO3-Nb2O5;C:H3PO4-Nb2O5;D:H2SO4-Nb2O5)
Table 1. The textural properties of samples
表1. 不同酸改性铌酸的物理性质
Table 2. Amount of acid in different samples
表2. 不同催化剂的酸量结果
的酸中心总数也很少。硝酸改性铌酸的弱酸中心有所提高,其在520℃左右有较大的强酸中心,强酸酸量达到0.143 mmol∙g−1。磷酸改性铌酸的弱酸中心和强酸中心都较多,弱酸和强酸酸量分别为0.105和0.325 mmol∙g−1。硫酸改性铌酸弱酸中心要比硝酸改性铌酸略少,但其具有更多的强酸中心,其强酸酸量达到0.818 mmol∙g−1。
3.4. 不同催化剂所得酯化反应转化率
五氧化二铌和改性铌酸催化油酸和异丁醇酯化制备油酸异丁酯的性能如图4所示。从图中可以看出,当以五氧化二铌为催化剂时油酸转化率随时间增加变化不大,8小时反应后转化率为8.2%;醋酸改性铌酸、磷酸改性铌酸和硝酸改性铌酸的催化效果也不是特别明显,8小时反应后油酸转化率分别为23.4%、18.2%和25.6%,说明酸改性对催化活性有一定的提高;硫酸改性铌酸为催化剂是油酸转化率随时间增加较快,在8小时反应后达到92.8%。结合改性铌酸的比表面积、孔容和氨气程序升温脱附结果可知,五氧化二铌比表面积小,同时酸中心也不多,转化率最小(8.2%);醋酸改性铌酸具有高的比表面积,但是酸中心数量和强度都不够,转化率不高(23.4%);磷酸改性铌酸比表面积较小,虽然具有较高的酸量,但是反应物能够接触到的酸性中心较少,活性不高(18.5%);硝酸改性铌酸比表面积较大,酸中心数量不多,转化率较低(25.6%);硫酸改性铌酸的比表面积较大,同时具有大量的强酸中心,表现出优良的催化性能。
3.5. 反应时间的影响
采用硫酸改性铌酸作为催化剂,保留催化剂加入量(1.0%)、反应温度(110℃)和醇酸比(2:1不变的情况下,考察反应时间对酯化反应的影响如图5所示。由图可见,随着反应时间的增加油酸转化率增加。在反应初期,由于反应体系中异丁醇与油酸的比例高,正反应速率很快;当反应进行8小时后,产物浓度增加,可逆反应速率加快,总反应逐步达到平衡,继续增加反应时间到10小时,油酸的转化率变化不明显。因此选取反应时间8小时为最佳反应时间。
3.6. 催化剂用量的影响
采用硫酸改性铌酸作为催化剂,在反应温度(110℃)、醇酸比不变(2:1)的情况下考察催化剂加入量对酯化反应的影响如图6所示。由图可知,不同催化剂用量(催化剂占反应原料质量为0.5%、1.0%和2.0%)随着反应时间的增加,油酸的转化率均逐步增加,1.0%和2%的用量下在8小时已经接近反应平衡。而0.5%时需要10小时才达到平衡。因此,选取催化剂用量为反应物质量的1.0%为最佳用量。
3.7. 醇酸比的影响
采用硫酸改性铌酸作为催化剂,在反应温度(110℃)和催化剂加入量不变(1.0%)的情况下,考察醇酸比对酯化反应的影响如图7所示。从图中可以看出油酸转化率在醇酸比不同的时候有较大的差别,

Figure 3. NH3-TPD pattern of Nb2O5 and modified niobic acid (A: Nb2O5; B: HAC-Nb2O5; C: HNO3-Nb2O5; D: H3PO4-Nb2O5; E: H2SO4-Nb2O5)
图3. 五氧化二铌和改性铌酸的NH3-TPD谱图(A:五氧化二铌;B:HAC-Nb2O5;C:HNO3-Nb2O5;D:H3PO4-Nb2O5;E:H2SO4-Nb2O5)

Figure 4. Conversion of oleic acid catalyzed by Nb2O5 and modified niobic acid (reaction conditions:alcohol/acid = 2:1, 110˚C, 1% catalyst; ■: Nb2O5; ▲: HAC-Nb2O5; ●: H3PO4-Nb2O5; ▼: HNO3-Nb2O5; ◆: H2SO4-Nb2O5)
图4. 五氧化二铌和改性铌酸的催化性能结果图(反应条件:醇酸比为2:1,反应温度110℃,催化剂用量为1%;■:五氧化二铌;▲:HAC-Nb2O5;●:H3PO4-Nb2O5;▼:HNO3-Nb2O5;●:H2SO4-Nb2O5)

Figure 5. Effect of the reaction time (reaction conditions: 1% H2SO4-Nb2O5, 110˚C, alcohol/acid = 2:1)
图5. 反应时间对催化性能的影响(反应条件:硫酸改性铌酸催化剂,醇酸比为2:1,反应温度110℃,催化剂用量为1%)
其中醇酸比为3:1时转化率较低,随着反应时间增加到8~10小时才达到反应平衡。可能是当异丁醇含量过高时油酸被稀释造成转化率降低所致。而在醇酸比为2:1或者1:1时,6小时反应即达到平衡。同时醇酸比为2:1时反应液具有较好的流动性,容易搅拌。因此,优选异丁醇和油酸的原料配比为2:1。
3.8. 催化剂的稳定性
采用硫酸改性铌酸作为催化剂,在反应时间(8小时)、反应温度(110℃)、催化剂用量(1.0%)和醇酸比不变(2:1)的情况下,考察催化剂在酯化反应中的重复利用性能如图8所示。

Figure 6. Effect of the amount of catalysis (reaction conditions: H2SO4-Nb2O5, 110˚C, alcohol/acid = 2:1) ■: 0.5%; ●: 1.0%; ▲: 2.0%
图6. 催化剂用量对催化性能的影响(反应条件:硫酸改性铌酸催化剂,醇酸比为2:1,反应温度110℃)■:0.5%;●:1.0%;▲:2.0%
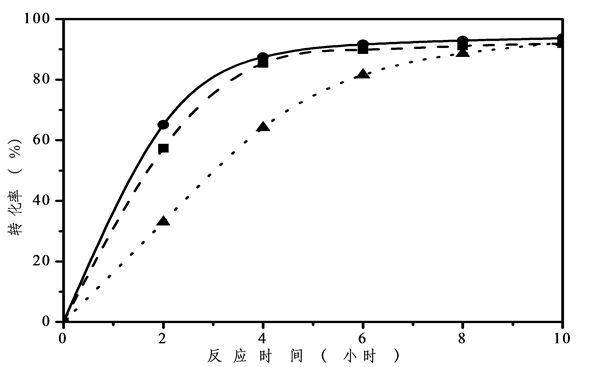
Figure 7. Effect of the ratio of alcohol to acid (reaction conditions: 1.0% H2SO4-Nb2O5, 110oC) ●: 1:1; ■: 2:1; ▲: 3:1
图7. 醇酸比对催化性能的影响(反应条件:硫酸改性铌酸催化剂,用量为1.0%,反应温度110℃) ●:1:1;■:2:1;▲:3:1
由图中可以看出,催化剂使用后进行活化,再重新进行反应,催化剂的活性有略微下降(转化率分别为92.90%、91.69%、92.86%、87.65%和86.12%)。在重复使用5次后,催化剂仍具有良好的催化活性,具有良好的稳定性。
4. 结论
通过对改性铌酸的合成、表征及应用于油酸和异丁醇合成油酸异丁酯的催化反应,得到以下结论:
1) 五氧化二铌经氢氧化钾熔融酸化得到的改性铌酸为无定形态,其中醋酸改性铌酸具有最高比表面积(200.95 m2∙g−1),硫酸改性铌酸具有最大的酸量(0.901 mmol∙g−1);
2) 改性铌酸相较五氧化二铌在油酸异丁酯合成中体现出更好的活性,其中尤以硫酸改性铌酸的催化效果最佳;
3) 油酸异丁酯最佳合成工艺条件为:反应温度110℃,异丁醇和油酸物质的量为2:1,催化剂用量为

Figure 8. Conversion of oleic acid after different reaction times
图8. 催化剂的稳定性测试结果
原料质量的1.0%,经过8小时反应后油酸的转化率能达到93.0%;同时该催化剂具有较好的稳定性,是用于酯化反应性能优良的固体酸催化剂。
基金项目
感谢国家自然科学基金(21103154),浙江省自然科学基金(LY16B030006),浙江省钱江人才计划项目(2012R10065),中国博士后科学基金(2013M531449),浙江省大学生科研创新活动新苗人才(2014R409024)。
文章引用
金建策,吴盼盼,王 晴,金顶峰,张 明,葛洪良,王新庆,王正宝,楼 辉. 铌酸改性及催化合成油酸异丁酯
Modification and Application of Niobic Acid Catalysis in Synthesis of Tebelon[J]. 化学工程与技术, 2016, 06(03): 55-63. http://dx.doi.org/10.12677/HJCET.2016.63007
参考文献 (References)
- 1. Fazal, M.A., Jaceria, M.R. and Haseeb, A.S.M.A. (2014) Effect of Copper and Mild Steel on the Stability of Palm Biodiesel Properties: A Comparative Study. Industrial Crops and Products, 58, 8-14. http://dx.doi.org/10.1016/j.indcrop.2014.03.019
- 2. Zhang, Y., Dube, M.A., Mclean, D.D., et al. (2003) Biodiesel Production from Waste Cooking Oil: 1. Process Design and Technological Assessment. Bioresource Technology, 89, 1-16.
- 3. Mabus, R. (2010) Department of the Navy’s Energy Program for Security and Independence. Darby.
- 4. 蒋剑春, 杨凯华, 聂小安. 生物柴油研究与利用[J]. 能源研究与利用, 2004(5): 22-25.
- 5. 施佳佳, 吕涯. 生物柴油降凝剂的研究进展[J]. 化学世界, 2009, 20(3): 182-185.
- 6. 陈秀, 袁银男, 来永斌. 生物柴油的低温流动特性及其改善[J]. 农业工程学报, 2010, 26(3): 277-280.
- 7. 张明森, 主编. 精细有机化工中间体全书[M]. 化学工业出版社, 2008.
- 8. Jain, S. and Sharma, M.P. (2011) Correlation Development for Effect of Metal Contaminants on the Stability of Jatropha Curcas Biodiesel. Fuel, 90, 2045-2050. http://dx.doi.org/10.1016/j.fuel.2011.02.002
- 9. 徐娟, 李法社, 李靖. 油酸异丁酯的合成及其对生物柴油降凝效果研究[J]. 应用化工, 2011, 40(4): 582-588.
- 10. 李法社, 倪梓皓, 袁瑞峰, 等. 正丁基三乙胺硫酸氢盐离子液体催化制备油酸异丁酯[J]. 中国油脂, 2015, 40(5): 60-64.
- 11. Tanabe, K. and Okazaki, S (1995) Various Reactions Catalyzed by Niobium Compounds and Materials. Applied Catalysis A: General, 133, 191-218.
- 12. Nowak, I. and Ziolek, M. (1999) Niobium Compounds: Preparation, Characterization, and Application in Hetero- geneous Catalysis. Chemical Review, 99, 3603-3624. http://dx.doi.org/10.1021/cr9800208
- 13. Tanabe, K. (2003) Catalytic Application of Niobium Compounds. Catalysis Today, 78, 65-77. http://dx.doi.org/10.1016/S0920-5861(02)00343-7
NOTES
*通讯作者。
