Hans Journal of Chemical Engineering and Technology
Vol.
10
No.
02
(
2020
), Article ID:
34134
,
13
pages
10.12677/HJCET.2020.102008
Study on the Fluorescence Properties of Cys/Hcy Based on Formyl Coumarin
Hantao Zhang, Luping Hu, Shengtao Xia, Hongqi Li*, Chunying Xian, Tingting Xia, Hongyu Zhang, Hao Li, Lin Yang
College of Chemistry, Chemical Engineering & Biological Engineering, Donghua University, Shanghai

Received: Jan. 16th, 2020; accepted: Jan. 30th, 2020; published: Feb. 7th, 2020

ABSTRACT
A coumarin fluorescent probe based on formyl recogniting L-cysteine (Cys) and L-homocysteine (Hcy) was designed and synthesized. The probe has good selectivity and high sensitivity to Cys and Hcy in HEPES buffer (EtOH:H2O = 8:2 (v:v), pH = 7.1). The probe is resistant to acids and alkalis, and still shows good recogniting effect on Cys and Hcy in a wide pH range of 2~10. After adding equivalent Cys or Hcy to the probe solution, the fluorescence intensity of the system enhances 2~3 times, responsing time is 30 min, 20 min. 10 equivalents of other common amino acids have no interference on the detection. The lowest detection limits are 5.7 × 10−7 mol/L and 5.2 × 10−7 mol/L.
Keywords:Formyl, Coumarin, Fluorescent Probe, Cys/Hcy

一种基于甲酰基香豆素识别Cys/Hcy的荧光性能研究
张汉涛,胡路平,夏胜涛,李洪启*,咸春颖,夏婷婷,张洪雨,李颢,杨琳
东华大学化学化工与生物工程学院,上海

收稿日期:2020年1月16日;录用日期:2020年1月30日;发布日期:2020年2月7日

摘 要
设计、合成了一种基于甲酰基识别L-半胱氨酸(Cys)和L-高半胱氨酸(Hcy)的香豆素荧光探针。该探针在HEPES缓冲液(EtOH:H2O = 8:2 (v:v), pH = 7.1)中,对Cys和Hcy具有良好的选择性和较高的灵敏度。探针耐酸碱,在2~10的广泛pH区域内,对Cys和Hcy仍表现出良好的识别效果。在探针溶液中加入等当量的Cys或Hcy后,体系荧光强度增强2~3倍,响应时间分别为30 min、20 min。10当量其它常见氨基酸对其检测无干扰,对Cys和Hcy的最低检测限分别达到5.7 × 10−7 mol/L和5.2 × 10−7 mol/L。
关键词 :甲酰基,香豆素,荧光探针,Cys/Hcy

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
半胱氨酸(Cysteine,简称Cys)、高半胱氨酸(Homocysteine,简称Hcy)是生物体内的两种含巯基的重要氨基酸,参与生命代谢过程,对细胞生长和组织分化起着至关重要的作用 [1] [2] [3],其在细胞中含量的异常与许多疾病密不可分。Cys存在于多种蛋白质和多肽中,具有淡化黑色素、延缓衰老、促进体制生长等作用 [4] [5],人体缺乏Cys,会导致生长缓慢 [6] 、毛发褪色、组织水肿 [7] 、肝功能损伤 [8] 、皮肤损伤 [9] 等。Hcy与Cys分子结构相似,在体内含量较高,同样是生物体中不可或缺的一种氨基酸,血液中Hcy含量过高,会导致肾功能受损、认知功能障碍 [10],严重时甚至会出现阿尔茨海默病和精神分裂症 [11] [12]。此外,Cys和Hcy的含量异常也是诱发心脑血管疾病的重要因素 [13] [14]。因此,对这两种氨基酸的分析检测具有重要的生理和病理意义。目前,检测这两种氨基酸的主要分析技术包括高效液相色谱法(HPLC) [15] 、毛细管电泳(CE) [16] 、电化学检测(ECD) [17] 等,但这些分析方法普遍存在实验条件苛刻、操作繁琐、区分不明显、实验成本高等缺点,荧光探针检测法因其操作简单(样品无需预处理)、区分明显、检测快捷有效、成本低等优点,而受到广大研究者的青睐。几种主要检测Cys/Hcy的分析技术具体性能对比如表1所示。
Table 1. Comparison of several major technologies of Cys/Hcy
表1. 几种主要检测Cys/Hcy技术对比
基于荧光探针检测法的以上突出优点,本文设计开发了一种结构简单、可快速检测Cys和Hcy的香豆素荧光探针(即探针A),该探针对Cys和Hcy具有良好的选择性和抗干扰性,响应灵敏。
2. 实验部分
2.1. 实验仪器与试剂
仪器:85-2A型磁力搅拌器,分析天平,SHZ-D (III)型真空泵,RV 10 basic V型蒸发仪,ZF-I型三用紫外分析仪,B-4型pH计,真空隔膜泵,PY-1型熔点仪,Fluoromax-4荧光光谱仪,7600CRT紫外分光光度仪,Bruker AM400核磁共振仪。
试剂:所用试剂均为分析纯,其中无水乙醇、乙酸乙酯、石油醚、二氯甲烷、间苯二酚、三氟乙酰乙酸乙酯和氘代氯仿购自上海泰坦科技股份有限公司;甲苯、乌洛托品、浓盐酸、无水硫酸镁和L-半胱氨酸购自国药集团化学试剂有限公司;HEPES和L-同型高胱氨酸购自阿拉丁生化科技股份有限公司。
2.2. 探针A的合成
探针A的合成路线如图1所示,以间苯二酚和三氟乙酰乙酸乙酯为原料合成4-三氟甲基-7-羟基香豆素,再通过Duff反应制备4-三氟甲基-7-羟基-8-甲酰基香豆素,即探针A。

Figure 1. Synthesis route of probe A
图1. 探针A的合成路线
2.2.1. 4-三氟甲基-7-羟基香豆素(化合物1)的合成
向100 mL三口烧瓶中加入甲苯(20 mL)、间苯二酚(2.21 g, 20 mmol)和三氟乙酰乙酸乙酯(3.57 g, 20 mmol),再加入碘(0.51 g, 2 mmol)作为引发剂以及2 mL浓盐酸,60℃下搅拌溶解,升温至85℃,继续搅拌6 h。反应完毕后,加入冰水,固体析出,抽滤,得到产物4-三氟甲基-7-羟基香豆素3.64 g (粉色固体),产率为79.1%。Mp:177℃~179℃ (文献值 [18] :178.4℃~179.3℃)。
2.2.2. 4-三氟甲基-7-羟基-8-甲酰基香豆素(探针A)的合成
在100 mL三颈瓶中加入4-三氟甲基-7-羟基香豆素(2.31 g, 10 mmol)和乌洛托品(7.01 g, 50 mmol),倒入20 mL冰乙酸。升温至90℃,继续搅拌7 h,之后用质量分数为10%的盐酸调节溶液的pH至2~3,继续反应40 min。反应结束后冷却至室温,加入冰水,之后用二氯甲烷萃取3次(20 mL × 3次),干燥,柱层析纯化,洗脱剂PE:EA = 12:1,得到探针A的淡黄绿色固体0.68 g,产率为26.4%。Mp: 109℃~112℃. 1H NMR (400 MHz, CDCl3) δ 12.39 (s, 1H), 10.63 (s, 1H), 7.86 (dd, J = 9.2, 1.6 Hz, 1H), 7.01 (d, J = 9.2 Hz, 1H), 6.73 (s, 1H). 13C NMR (101 MHz, CDCl3) δ 192.82, 166.19, 157.39, 141.78, 133.16, 122.65, 119.91, 115.68, 112.53, 108.96, 105.59. 19F NMR (377 MHz, CDCl3) δ-64.72. ESI-MS: m/z 257.0 (M+ − 1)。
3. 结果与讨论
3.1. 探针A的结构表征
3.1.1. 1H NMR表征
化合物经Bruker AM400核磁共振仪测试,得到1H NMR图(图2)。如图2所示,化合物有5个H,符合探针A的结构。δ 12.39 (s, 1H)为香豆素7位酚羟基的H;10.63 (s, 1H)为香豆素8位-CHO的H;7.86 (dd, J = 9.2, 1.6 Hz, 1H)为香豆素5位苯环的H,因受到6位H和4位-CF3的F影响,裂分为四重峰;7.01 (d, 1H)为香豆素6位苯环的H,受到5位H的影响,裂分为二重峰;6.73 (s, 1H)为香豆素3位上的H。
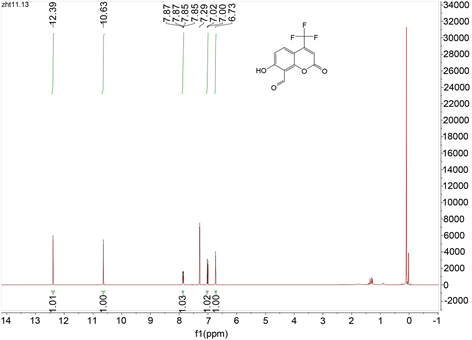
Figure 2. 1HNMR chart of Compound A
图2. 化合物A 1H NMR图
3.1.2. 13C NMR表征
化合物经Bruker AM400核磁共振仪测试,得到13C NMR图(图3)。如图3所示,化合物有11个C,符合探针A的结构。δ 192.82为香豆素8位相连-CHO的C;166.19为香豆素2位-C=O的C;157.39为香豆素7位的C;141.78为香豆素4位的C;133.16为香豆素9位上的C;122.65为香豆素5位上的C;119.91为-CF3的C;115.68为香豆素8位上的C;112.53为香豆素10位上的C;108.96为香豆素6位上的C;105.59为香豆素3位上的C。
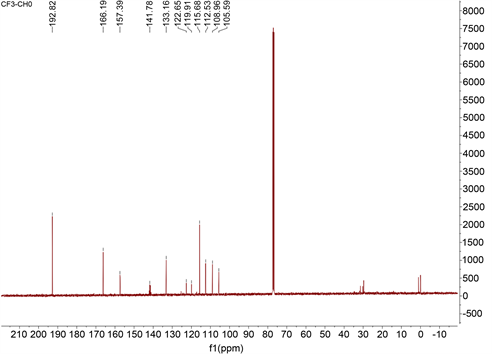
Figure 3. 13C NMR chart of Compound A
图3. 化合物A 13C NMR图
3.1.3. MS表征
化合物经HPLC-MS测试,得到质谱图(图4)。如图4所示,m/z 257.0 (M+ − 1)。
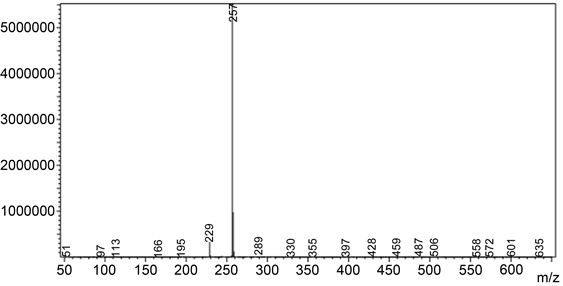
Figure 4. Mass spectrum of Compound A
图4. 化合物A质谱图
3.2. 探针A在不同比例的乙醇与水中的荧光性能
如图5所示,当乙醇与水的体积比为9:1或8:2时,探针A在502 nm处荧光最强,此后随着体系中水含量的升高,荧光强度逐渐降低,比例为1:9时,荧光强度最低。因此,测试溶剂乙醇与水的比例为8:2时最合适。
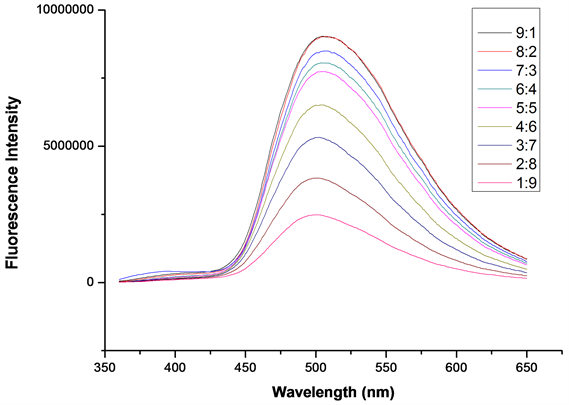
Figure 5. The fluorescence emission spectra of probe A (20 μM) in different ratios of ethanol and water. The volume ratios of EtOH:H2O from top to bottom are 9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9, = 341 nm
图5. 探针A (20 μM)在不同比例的乙醇和水中的荧光发射光谱,从上到下EtOH:H2O体积比分别为9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9, = 341 nm
3.3. 探针A对Cys/Hcy的有效识别
在探针A的HEPES缓冲液(EtOH:H2O = 8:2 (v:v),pH = 7.1,A浓度为20 μmol/L)体系中,分别加入等当量的Cys和Hcy溶液(浓度为20 μmol/L),测试得到紫外吸收光谱图(图6)和荧光发射波谱图(图7)。
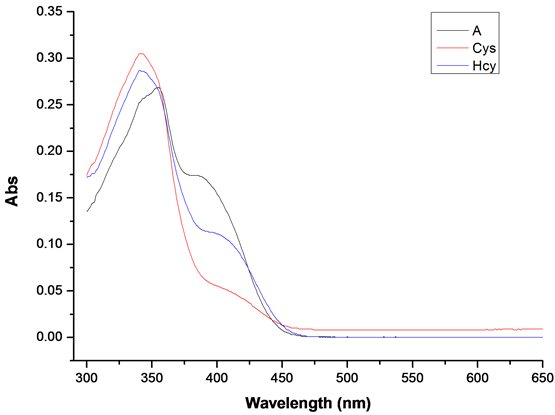
Figure 6. UV absorption spectrum of probe A after adding Cys/Hcy
图6. 加入Cys/Hcy后探针A的紫外吸收光谱
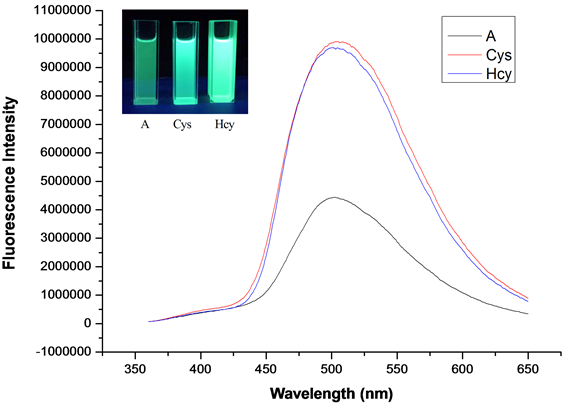
Figure 7. Fluorescence emission spectrum of probe A after adding Cys/Hcy (embedded image is fluorescence change of the system under 365 nm irradiation)
图7. 加入Cys/Hcy后探针A的荧光发射光谱(内嵌图为365 nm紫外灯下,加入Cys/Hcy后体系荧光变化图)
如图7所示,加入Cys/Hcy后,探针的最大吸收峰从365 nm蓝移至341 nm,且吸收峰强度有所增强,在395 nm附近吸收峰强度明显减弱。如图8所示,当激发波长λex = 341 nm,发射波长λem = 502 nm时,加入Cys和Hcy后体系的荧光强度增强了约2.5倍。探针A识别Cys和Hcy效果良好,可作为检测Cys和Hcy的荧光探针。
3.4. 探针A的选择性测试
在探针A的HEPES缓冲液(EtOH:H2O = 8:2 (v:v),pH = 7.1,A浓度为20 μmol/L)体系中,分别加入等当量(浓度为20 μmol/L)的Cys、Hcy、GSH、Gly、Glu、Val、Tyr、Arg、Try、Lys、His、Leu、Phe、Asp、Met 15种氨基酸,测试得到荧光发射波谱图(图8)。
如图8所示,当激发波长λex = 341 nm,发射波长λem = 5502 nm时,加入Cys和Hcy后体系的荧光强度增强了约2.5倍,色氨酸(Try)和赖氨酸(Lys)荧光强度稍有降低,降低约30%,其他氨基酸无变化。
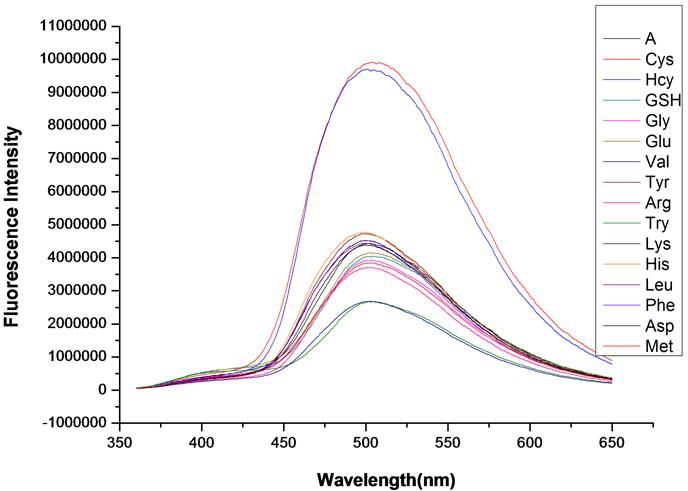
Figure 8. Fluorescence emission spectrum of probe A after adding different amino acids
图8. 加入不同氨基酸后探针A的荧光发射光谱
3.5. 探针A检测Cys/Hcy的抗干扰性测试
在探针A的HEPES缓冲液(EtOH:H2O = 8:2 (v:v),pH = 7.1,A浓度为20 μmol/L)体系中,加入等当量的Cys或Hcy(浓度均为20 μmol/L),再分别加入10当量(浓度为200 μmol/L)的GSH、Gly、Glu、Val、Tyr、Arg、Try、Lys、His、Leu、Phe、Asp、Met 13种干扰性氨基酸,测试得到探针A检测Cys/Hcy的抗干扰性荧光波谱图(图9、图10)。如图9所示,其它13种氨基酸均不干扰探针A对Cys的检测,说明探针A检测Cys的抗干扰性良好。如图10所示,其它13种氨基酸均不干扰探针A对Hcy的检测,说明探针A检测Hcy的抗干扰性也良好。
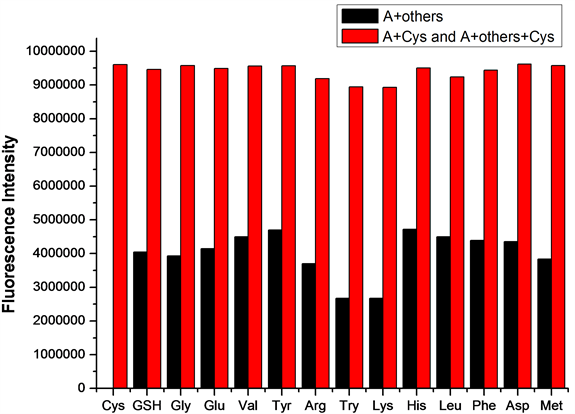
Figure 9. Effect of different amino acids on detection of Cys by probe A
图9. 不同氨基酸对探针A检测Cys的影响
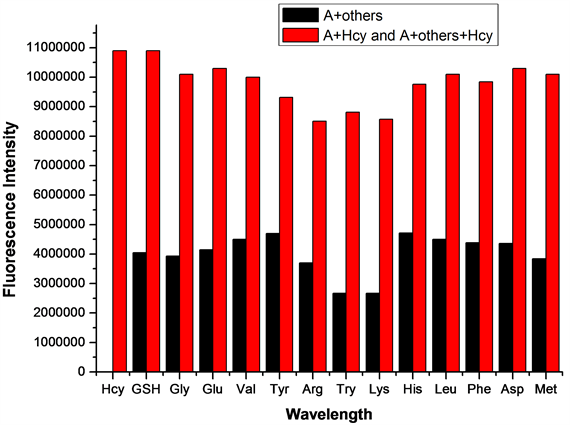
Figure 10. Effect of different amino acids on the detection of Hcy by probe A
图10. 不同氨基酸对探针A检测Hcy的影响
3.6. 探针A对Cys/Hcy的响应时间测试
在探针A的HEPES缓冲液(EtOH:H2O = 8:2 (v:v),pH = 7.1,A浓度为20 μmol/L)体系中,加入等当量的Cys或Hcy (浓度为20 μmol/L),每隔3分钟检测一次体系荧光强度,得到探针A对Cys/Hcy的响应时间曲线图(图11、图12)。如图11所示,在加入Cys 30 min后,体系荧光基本达到饱和,说明等当量探针A对Cys的响应时间约30 min。如图12所示,在加入Hcy 20 min后,体系荧光基本达到饱和,表明等当量探针A对Hcy的响应时间约20 min。说明探针A对Hcy的检测较Cys更灵敏。
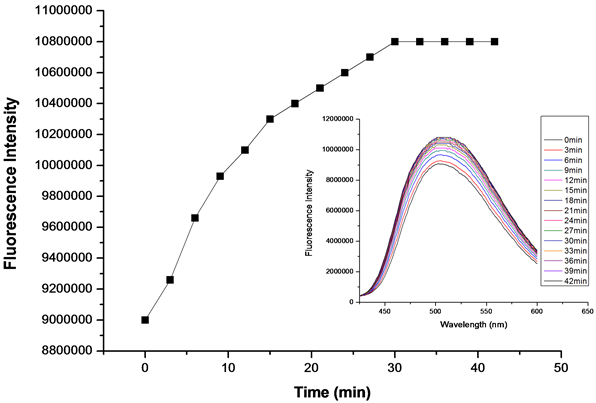
Figure 11. Responsing time curve of detection of Cys by probe A (embedded image is the fluorescence emission spectrum of responsing time of detection of Cys by probe A, λex = 341 nm)
图11. 探针A对Cys响应时间曲线(内嵌图为A对Cys响应时间荧光发射谱图,λex = 341 nm)
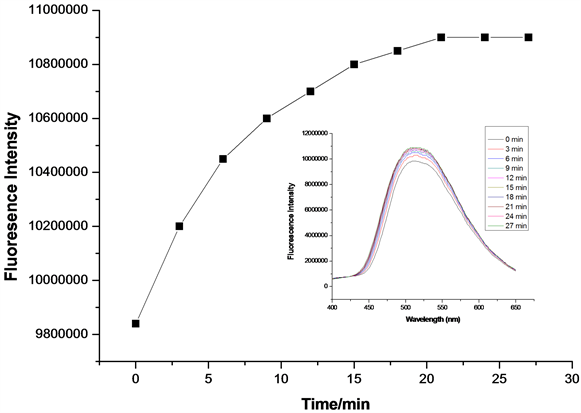
Figure 12. Responsing time curve of detection of Hcy by probe A (embedded image is the fluorescence emission spectrum of responsing time of detection of Hcy by probe A, λex = 341 nm)
图12. 探针A对Hcy响应时间曲线(内嵌图为A对Hcy响应时间荧光发射谱图,λex = 341 nm)
3.7. pH对探针A识别Cys/Hcy的性能影响
在探针A的HEPES缓冲液(EtOH:H2O = 8:2 (v:v),pH = 7.1,A浓度为20 μmol/L)体系中,加入等当量的Cys或Hcy (浓度均为20 μmol/L),测定了pH从1~13时探针A对Cys或Hcy的识别性能影响,得到pH对探针A识别Cys/Hcy的性能影响图(图13、图14)。如图13所示,当pH = 2~10时,探针A对Cys具有良好的识别效果,最佳pH为6;当pH = 1或11时,探针A对Cys基本没有识别效果;当pH ≥ 12时,荧光猝灭,推测可能是探针在此条件下分子结构已遭到破坏。如图14所示,当pH = 2~10时,探针A对Hcy具有良好的识别效果,最佳pH为5;当pH = 1时,探针A对Hcy基本没有识别效果;当pH = 11时,荧光强度减弱约50%,无识别效果;当pH ≥ 12时,荧光猝灭,推测可能是探针的分子结构已被破坏。所以,探针A识别Cys/Hcy的适宜pH范围为2~10,在弱酸性体系(pH约5~6)下,测试效果最佳,探针的耐酸碱能力较强,稳定性较好。
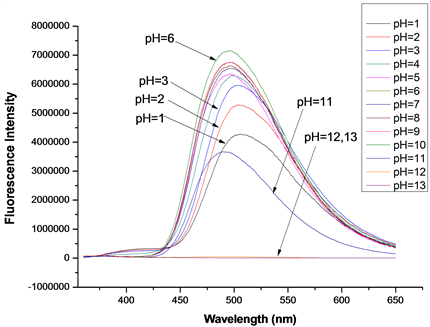
Figure 13. Effect of pH on the performance of probe A in identifying Cys
图13. pH对探针A识别Cys的性能影响
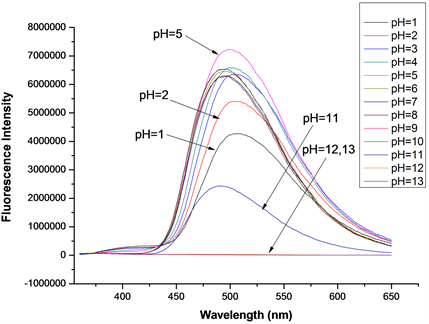
Figure 14. Effect of pH on the performance of probe A in identifying Hcy
图14. pH对探针A识别Hcy的性能影响
3.8. Cys/Hcy浓度对探针A荧光强度的影响
3.8.1. Cys浓度对探针A荧光强度的影响
在探针A的HEPES缓冲液(EtOH:H2O = 8:2 (v:v),pH = 7.1,A浓度为20 μmol/L)体系中,加入浓度分别为2、4、6、8、10、12、14、16、18、20 μmol/L的Cys溶液,测得Cys浓度梯度对探针A荧光强度的影响图(图15)。如图15所示,随着Cys浓度的增加,体系荧光强度逐渐增大。将混合溶液体系在502 nm处的荧光强度对Cys的浓度作图,并进行线性拟合,得探针A随Cys浓度增大的荧光强度线形图(图16)。如图16所示,在加入2~20 μmol/L Cys后,荧光强度与浓度呈良好的线性增长关系,线性方程为y = 143272.72727x + 5482000 (相关系数R2 = 0.99221)。根据最低检测限浓度计算公式C = 3S/K得,最低检测浓度为5.7 × 10−7 mol/L,说明该探针对Cys的检测较灵敏。
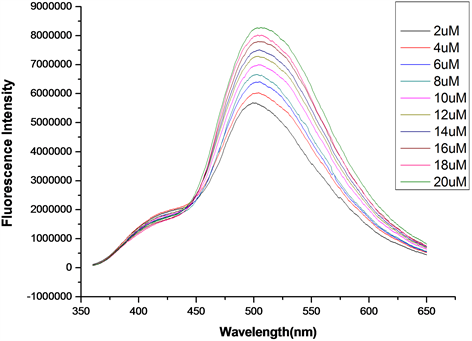
Figure 15. Change of fluorescence intensity of probe A with increasing Cys
图15. 探针A随Cys浓度增大的荧光强度变化图
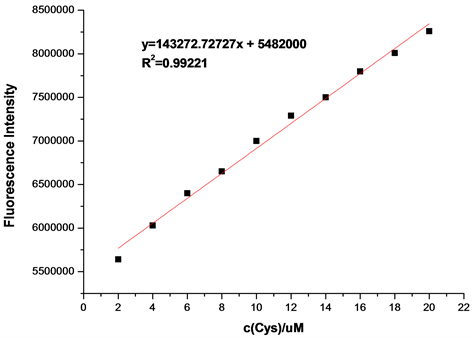
Figure 16. Line graph of fluorescence intensity of probe A with increasing Cys
图16. 探针A随Cys浓度增大的荧光强度线形图
3.8.2. Hcy浓度对探针A荧光强度的影响
在探针A的HEPES缓冲液(EtOH:H2O = 8:2 (v:v),pH = 7.1,A4浓度为20 μmol/L)体系中,加入浓度分别为2、4、6、8、10、12、14、16、18、20 μmol/L的Hcy溶液,测得Hcy浓度梯度对探针A荧光强度的影响图(图17)。如图17所示,随着Hcy浓度的增加,体系的荧光强度逐渐增大。将混合溶液体系在502 nm处的荧光强度对Hcy的浓度作图,并进行线性拟合,得探针A随Hcy浓度增大的荧光强度线形图(图18)。如图18所示,在加入2~20 μmol/LHcy后,荧光强度与浓度呈良好的线性增长关系,线性方程为y = 157212.12x + 6150670 (相关系数R2 = 0.99898)。根据最低检测限浓度计算公式C = 3S/K得,最低检测浓度为5.2 × 10−7 mol/L,说明该探针对Hcy的检测较Cys更灵敏。
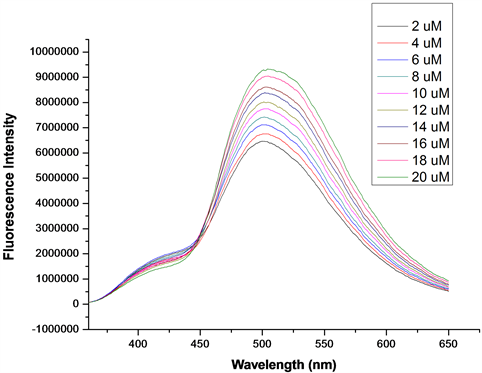
Figure 17. Change of fluorescence intensity of probe A with increasing Hcy
图17. 探针A随Hcy浓度增大的荧光强度变化图
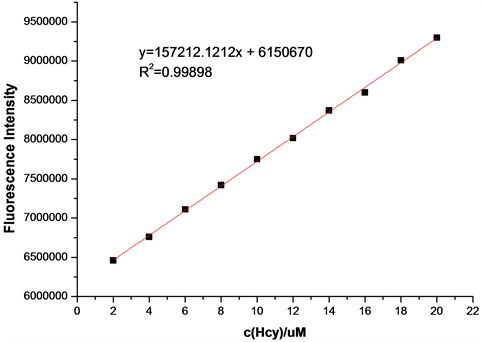
Figure 18. Line graph of fluorescence intensity of probe A with increasing Hcy
图18. 探针A随Hcy浓度增大的荧光强度线形图
4. 结论
本文设计并合成了一种基于甲酰基识别Cys和Hcy的香豆素荧光探针A。该探针合成路线简捷、结构简单,在HEPES缓冲液(EtOH:H2O =8:2 (v:v),pH = 7.1)中对Cys和Hcy具有良好的选择性和抗干扰性。探针耐酸碱,在2~10的广泛pH区域内,对Cys和Hcy仍表现出良好的识别效果。响应时间分别为30 min、20 min,且检测限分别为5.7 × 10−7 mol/L、5.2 × 10−7 mol/L,可用于快速检测Cys和Hcy。
文章引用
张汉涛,胡路平,夏胜涛,李洪启,咸春颖,夏婷婷,张洪雨,李 颢,杨 琳. 一种基于甲酰基香豆素识别Cys/Hcy的荧光性能研究
Study on the Fluorescence Properties of Cys/Hcy Based on Formyl Coumarin[J]. 化学工程与技术, 2020, 10(02): 48-60. https://doi.org/10.12677/HJCET.2020.102008
参考文献
- 1. Kusmierek, K., Chwatko, G., Glowacki, R. and Bald, E. (2009) Determination of Endogenous Thiols and Thiol Drugs in Urine by HPLC with Ultraviolet Detection. Journal of Chromatography B, 877, 3300-3308. https://doi.org/10.1016/j.jchromb.2009.03.038
- 2. Liu, J. and Lu, Y. (2007) A DNA Zyme Catalytic Beacon Sensor for Paramagnetic Cu2+ Ions in Aqueous Solution with High Sensitivity and Selectivity. Journal of American Chemical Society, 129, 9838-9839. https://doi.org/10.1021/ja0717358
- 3. Persichilli, S., Gervasoni, J., Di Napoli, A., et al. (2015) Plasma Thiols Levels in Alzheimer’s Disease Mice under Diet-Induced Hyperhomocysteinemia: Effect of Sad-Enosylmethionine and Superoxide-Dismutase Supplementation. Journal of Alzheimer’s Disease, 44, 1323-1331. https://doi.org/10.3233/JAD-142391
- 4. Benathan, M.,Virador, V., Furumura, M., et al. (1999) Coregulation of Melanin Precursors and Tyrosinase in Human Pigment Cells: Roles of Cysteine and Glutathione. Cellular & Molecular Biology, 45, 981-990.
- 5. Zhang, Z.X., Geng, D.Y., Han, Q., Liang, S.-D. and Guo, H.-R. (2013) The Cterminal Cysteine of Turbot Scophthalmus Maximus Translationally Controlled Tumour Protein Plays a Key Role in Antioxidation and Growth-Promoting Functions. Journal of Fish Biology, 83, 1287-1301. https://doi.org/10.1111/jfb.12231
- 6. Uchida, E., Uemura, H., Tanaka, T., et al. (1991) Activity of Artificial Mutant Variants of Human Growth Hormone Deficient in a Disulfide Bond between Cys53 and Cys165. Chemical & Pharmaceutical Bulletin, 39, 150-153. https://doi.org/10.1248/cpb.39.150
- 7. Wang, W., Rusin, O., Xu, X., et al. (2005) Detection of Homocysteine and Cysteine. Journal of the American Chemical Society, 127, 15949-15958. https://doi.org/10.1021/ja054962n
- 8. Badawy, A.H., Abdel Aal, S.F. and Samour, S.A. (1989) Liver Injury Associated with N-Acetylcysteine Administration. Journal of the Egyptian Society of Parasitology, 19, 563-571.
- 9. Shahrokhian, S. (2001) Lead Phthalocyanine as a Selective Carrier for Preparation of a Cyste-ine-Selective Electrode. Analytical Chemistry, 73, 5972-5978. https://doi.org/10.1021/ac010541m
- 10. Tan, B.,Venketa, N.,Vrooman, H., et al. (2018) Homocysteine and Cerebral Atrophy: The Epidemiology of Dementia in Singapore Study. Journal of Alzheimer’s Disease, 62, 877-885. https://doi.org/10.3233/JAD-170796
- 11. Chen, X., Zhou, Y., Peng, X. and Yoon, J. (2010) Fluorescent and Colorimetric Probes for Detection of Thiols. Chemical Society Reviews, 39, 2120-2135. https://doi.org/10.1039/b925092a
- 12. Dietrichmuszalska, A., Malinowska, J., Olas, B., et al. (2012) Substance Abuse and Suicide Risk among Adolescents. European Psychiatry, 262, 469-485.
- 13. Elkhairy, L., Ueland, P.M., Refsum, H., et al. (2012) Plasma Total Cysteine as a Risk Factor for Vascular Disease. The European Concerted Action Project, 103, 2544-2549. https://doi.org/10.1161/01.CIR.103.21.2544
- 14. Watanabe, H.L., David, C.W., Guyn, H.L. and Wong, N.L.M. (1991) Effect of Progesterone Therapy on Arginine Vasopressin and Atrial Natriuretic Factor in Premenstrual Syndrome. Clinical and Investigative Medicine, 20, 211-223.
- 15. Lv, Z., Sun, Z., Song, C., et al. (2016) Sensitive and Background Free Determination of Thiols from Wastewater Samples by MOF-5 Extraction Coupled with High Performance Liquid Chromatography with Fluorescence Detection Using a Novel Fluorescence Probe of Carbazole-9-Ethyl-2-Maleimide. Talanta, 161, 228-237. https://doi.org/10.1016/j.talanta.2016.08.040
- 16. Zhao, X., Zhu, S., Yang, H., You, J., Song, F., Liu, Z. and Liu, S. (2015) Simultaneous Determination of Amino Acid and Monoamine Neurotransmitters in PC12 Cells and Rats Models of Parkinson’s Disease Using a Sensitizing Derivatization Reagent by HPLC-MS/MS. Biomedical Chromatography, 995-996, 15-23. https://doi.org/10.1016/j.jchromb.2015.05.017
- 17. Baron, M. and Sochor, J. (2013) Estimation of Thiol Compounds Cysteine and Homocysteine in Sources of Protein by Means of Electrochemical Techniques. Interna-tional Journal of Electrochemical Science, 8, 11072-11086.
- 18. Lin, W.Y., Long, L.L. and Tan, W. (2010) A Highly Sensitive Fluorescent Probe for Detection of Benzenethiols in Environmental Samples and Living Cells. Chemical Communications, 46, 1503-1505. https://doi.org/10.1039/B922478E
NOTES
*通讯作者。
