Hans Journal of Chemical Engineering and Technology
Vol.
10
No.
05
(
2020
), Article ID:
37421
,
11
pages
10.12677/HJCET.2020.105044
脂肪酸甲酯环氧化反应机理及动力学研究
俞佳娜,黄晓蕾
常州大学化工设计研究院有限公司,江苏 常州

收稿日期:2020年8月11日;录用日期:2020年8月25日;发布日期:2020年9月1日

摘要
以脂肪酸甲酯为原料,对甲酸/过氧酸法制备环氧脂肪酸甲酯过程中的环氧化反应动力学进行了研究,建立了表观总包反应动力学模型,并揭示了脂肪酸甲酯环氧化反应机理。结果表明,此环氧化反应由双键环氧化、酸性条件环氧键开环以及环氧键水解三个基元反应耦合而成。通过对比各基元反应的动力学参数发现,双键环氧化和环氧键开环反应同步发生,双键环氧化反应速率为总包反应控速步骤,环氧键水解并未产生明显开环作用。此外,对最优工况进行了探究,可为工艺优化设计提供一定的指导意义。
关键词
环氧化反应,环氧脂肪酸甲酯,环氧值,反应动力学,反应机理

Mechanism and Kinetic Research of Fatty Acid Methyl Ester Epoxidation
Jiana Yu, Xiaolei Huang
Changzhou University Chemical Design & Research Institute Co., Ltd., Changzhou Jiangsu

Received: Aug. 11th, 2020; accepted: Aug. 25th, 2020; published: Sep. 1st, 2020

ABSTRACT
In this paper, fatty acid methyl esters are used as raw materials to study the epoxidation reaction kinetics during the preparation of epoxy fatty acid methyl esters by the formic acid/peroxy acid method. The apparent total package reaction kinetic model was established, and the mechanism of fatty acid methyl ester epoxidation reaction was revealed. The results show that the epoxidation reaction is composed of three elementary reactions, namely, double bond epoxidation, epoxy bond ring opening under acidic conditions, and epoxy bond hydrolysis. By comparing the kinetic parameters of each elementary reaction, it is found that the double bond epoxidation and the epoxy bond ring-opening reaction occur simultaneously. The double bond epoxidation reaction rate is the rate-controlling step of the total package reaction, and the epoxy bond hydrolysis does not produce significant open-loop effect. In addition, the optimal working conditions are explored, which can provide certain guiding significance for process optimization design.
Keywords:Epoxidation, Epoxidized Fatty Acid Methyl Esters, Epoxide Value, Reaction Kinetics, Reaction Mechanism

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
脂肪酸甲酯作为生物柴油的原料,具有存储、价格低廉、加工简单方便等优点 [1]。其中脂肪族C6~C11醇用作增塑剂,常用于塑料制品、润滑油及农用化学品的生产中,即本文中生产环氧脂肪酸甲酯的原料。
本文采用的环氧脂肪酸甲酯制备方法,是传统的甲酸/双氧水法 [2]。该方法具有反应稳定和反应条件温和的优点但反应产物环氧值不高,且采用常用的环氧值提升方法效果并不显著,例如加催化剂、延长反应时间等。因此探究该反应动力学及机理,进一步掌握整个反应体系的反应规律特性就显得尤为重要 [3]。
本次对甲酸/过氧酸法制备环氧脂肪酸甲酯过程中的环氧化反应动力学进行研究,目的是建立表观总包反应动力学模型,并揭示脂肪酸甲酯环氧化的反应机理 [4]。
2. 实验部分
2.1. 实验材料及仪器
脂肪酸甲酯(碘值
四口烧瓶;恒温水浴槽;分液漏斗;温度计;恒压滴液漏斗;滴定管等玻璃仪器。
2.2. 分析方法
环氧值分析采用GB1677-81盐酸丙酮法测定。
酸值分析采用GB/T1668-2008《增塑剂酸值及酸度的测定》法测定。
碘值分析采用GBT 5532-2008 动植物油脂碘值的测定。
2.3. 实验原理
脂肪酸甲酯由多个不同直链脂肪酸与甲酯发生反应而生成的,其中直链不饱和脂肪酸甲酯的碳一般是16~18个,结构式为:R1-CH=CH-R2-COOCH3 (R1 + R2一般为14~16左右)。由于H+的作用,甲酸与过氧化氢发生反应,生成过氧甲酸,过氧甲酸再进入到有机相中与脂肪酸甲酯的不饱和双键发生反应,最终生成环氧脂肪酸甲酯。
整个合成的过程中,除主反应以外,还存在一系列副反应。本文将通过分别研究脂肪酸甲酯的环氧化反应、环氧脂肪酸甲酯与甲酸以及与水的副反应,这三个基元反应的动力学方程,最后求得整个复杂反应的动力学方程。
2.4. 实验方法
具体实验装置请见图1。在三口烧瓶内加入一定量的大豆油(或环氧大豆油),加热至所需温度,加入所需浓度的过氧甲酸(或甲酸)进行反应,每隔一定时间取样,取出样品经中和,水洗,分离后,依国标测定碘值,环氧值。
 1-恒温水浴锅,2-三口烧瓶,3-恒压滴液漏斗,4-增力电动搅拌器,5-冷凝管,6-温度计
1-恒温水浴锅,2-三口烧瓶,3-恒压滴液漏斗,4-增力电动搅拌器,5-冷凝管,6-温度计
Figure 1. Flask experiment of fatty acid methyl ester epoxidation
图1. 脂肪酸甲酯环氧化烧瓶实验装置简图
3. 结果与讨论
3.1. 脂肪酸甲酯环氧化
环氧化反应如下:
(R1)
简化为:
可得反应(R1)反应速率方程为:
(1)
当加入的过氧甲酸的浓度远大于脂肪酸甲酯的浓度时,可以将式(1)改写成式(2),如下所示,其中 。
(2)
故 (3)
反应温度
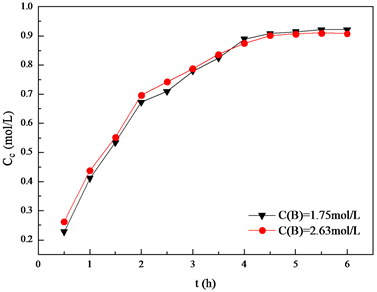
Figure 2. Epoxy group concentration change over time
图2. 环氧基浓度随时间变化曲线
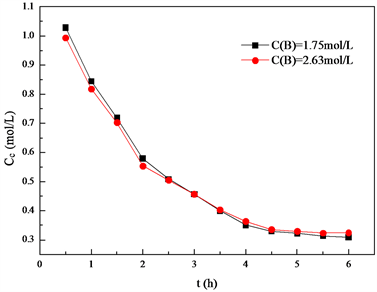
Figure 3. Double bond concentration change over time
图3. 双键浓度随时间变化曲线
根据以上数据,采用求导法,得到环氧键生成速率与反应时间的变化如图4所示。
由式(3)可知,以 对 作图,直线斜率即为双键的反应级数 ,以 为例, 见图5。
所得直线斜率 ,同理,对 拟合的结果, ,因此可知反应(I)中,双键的反应级数为二级。
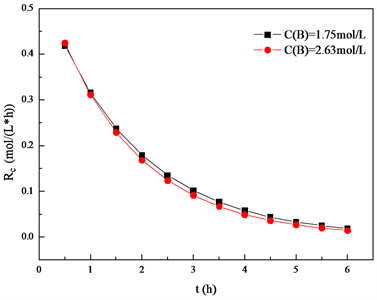
Figure 4. Epoxy bond generation rate change over time
图4. 环氧键浓度随时间变化

Figure 5. lnRc-lnCA
图5. lnRc与lnCA的线性关系
对于二级反应来说,
,对 积分得:
(4)
过氧甲酸浓度为 、 条件下,以 对时间t作图,所得直线的斜率分别为K1、K2。结果见图6。
所得图中斜率分别为 ,。
由式(2)可知, ,带入K1、K2可得, 。由此可以得到反应(I)的反应速率方程为:
(5)
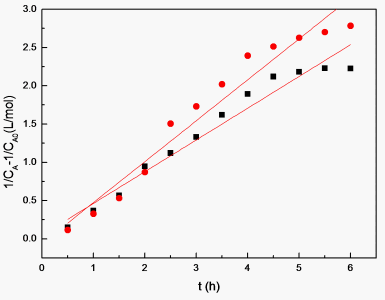
Figure 6. (1/CA-1/CA0) change about reaction time
图6. (1/CA-1/CA0)关于时间的变化
以反应温度
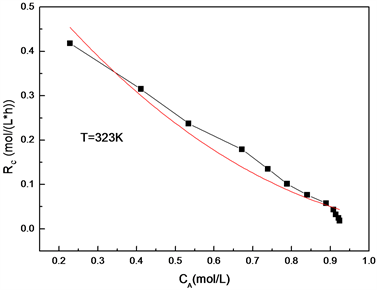
Figure 7. The curve of the concentration of the reaction rate on CA
图7. 反应速率关于双键浓度的曲线
拟合结果反应(I)的速率常数 。
同理,对反应温度分别为
根据阿累尼乌斯公式 ,通过作反应速率常数k与反应温度T的图,见图8,拟合可得反应指前因子k0及活化能E,结果见表2。
Table 1. Fitting results of kinetic parameters
表1. 动力学参数拟合结果
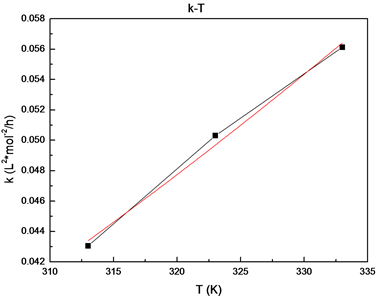
Figure 8. The relationships of reaction rate constant k and temperature T
图8. 反应速率常数与温度的关系
Table 2. Fitting results of kinetic parameters
表2. 活化能及之前因子
将反应(I)的反应方程改写成:
(6)
3.2. 环氧脂肪酸甲酯与甲酸开环反应
(R2)
反应(R2)可以简化成
可得(R2)反应速率方程为:
(7)
在
(8)
通过实验测得不同时间下环氧基团的浓度,以 对 作图,得到的曲线如图9所示。
所得的直线斜率 ,故可知反应(II)中,环氧键的反应级数为1级,则式(8)可写成:
(9)
对环氧键浓度CC积分可以得到:
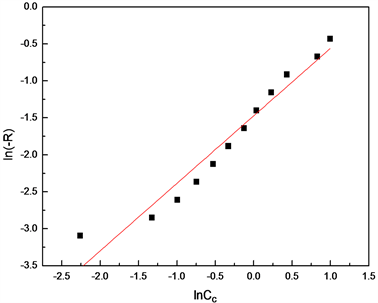
Figure 9. The curve of ln(-RF) and lnCC
图9. ln(-RF)关于lnCC的曲线
(10)
在甲酸浓度分别为4.71 mol/L和2.63 mol/L时,以 对时间作图,所得的直线斜率为 和 ,如图10。再由式(10)可知, 。
于是得知,反应(II)中,甲酸的反应级数也为1级。
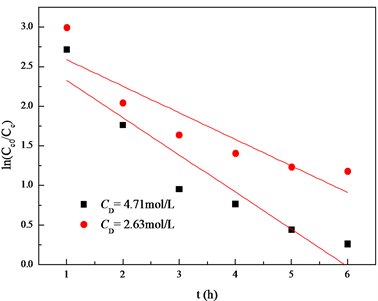
Figure 10. The curve of ln(CC0/CC) and t
图10. ln(CC0/CC)关于时间t的曲线
于是,可以得到反应(II)的反应速率方程为:
(11)
以反应温度
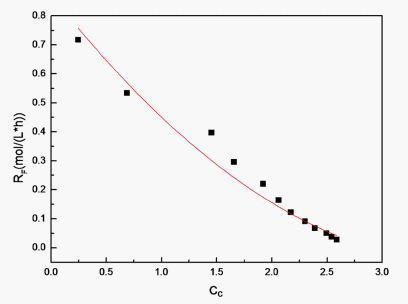
Figure 11. The curve of the concentration of the reaction rate on CC
图11. 反应速率关于环氧键浓度的曲线
根据式(11),拟合出反应速率常数
。同理,拟合出温度
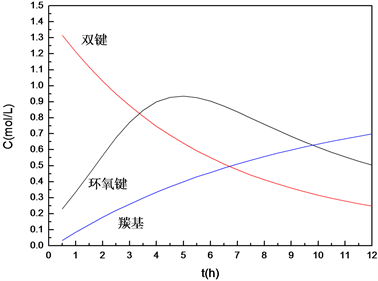
Figure 12. The relationships of reaction rate constant k and temperature T
图12. 反应速率常数与温度的关系
Table 3. E and k0
表3. 活化能及指前因子
故反应(II)的反应方程也可以写成:
(12)
3.3. 环氧脂肪酸甲酯与水的反应
水解反应如下:
(III)
用环氧脂肪酸甲酯(环氧值5.5%)作为原料与过量的水反应,
3.4. 结果验证
将原料双键浓度、主要产物环氧键浓度以及副产物羰基浓度拟合,得到曲线图13,对环氧键曲线求导,计算得出在无催化剂反应条件下,反应时间达到4.8 h时,产品的环氧值取得最大值,反应效果最佳。这与无催化剂条件下的反应工艺考察 [5] 所得最优反应时间5 h的数据基本吻合。表明该模型是显著可信的,可为脂肪酸甲酯环氧化反应器的设计以及工业化放大等工作提供参考依据。
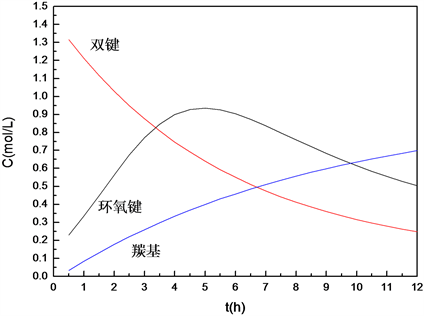
Figure 13. Components change over time of epoxidation reaction
图13. 环氧化反应各组分随时间变化
4. 结论
1) 综上所述,脂肪酸甲酯环氧化反应的总速率方程为:
2) 从动力学方程上可以看出,对于脂肪酸甲酯的环氧化反应,其环氧化正反应与开环副反应是同时进行的,并且正反应(R1)与副反应(R2)的反应活化能分别为11.37 kJ∙mol−1和6.342 kJ∙mol−1。
3) 对脂肪酸甲酯环氧化反应的总速率方程进行验证,模型计算值和实验值吻合较好。表明该模型是显著可信的,可为脂肪酸甲酯环氧化反应器的设计提供参考依据。
4) 本实验所得到的关于环氧化动力学方程的研究,适用于无催化剂一般条件下的脂肪酸甲酯,甲酸/过氧酸法环氧化制备环氧脂肪酸甲酯的反应研究,对反应工业条件优化具有一定的研究意义。
文章引用
俞佳娜,黄晓蕾. 脂肪酸甲酯环氧化反应机理及动力学研究
Mechanism and Kinetic Research of Fatty Acid Methyl Ester Epoxidation[J]. 化学工程与技术, 2020, 10(05): 344-354. https://doi.org/10.12677/HJCET.2020.105044
参考文献
- 1. 周明东, 白雪. 钼多金属氧酸盐催化脂肪酸甲酯环氧化研究[J]. 辽宁石油化工大学学报, 2019, 39(6): 10-14.
- 2. 李祥庆, 沈凯华, 严秋钫. 环氧脂肪酸甲酯的合成研究进展及应用[J]. 塑料助剂, 2016(4): 23-27.
- 3. 周洋, 蒲霄等. 乙酸乙酯废水催化氧化工艺及宏观反应动力学研究[J]. 高校化学工程学报, 2020, 34(1): 157-162.
- 4. 李科, 蒋剑春, 聂小安, 陈洁, 黄金瑞, 孙凡.桐油脂肪酸甲酯合成工艺与动力学研究[J]. 精细化工中间体, 2016, 46(4): 48-51.
- 5. 张跃, 俞佳娜, 严生虎, 刘建武, 沈介发. 微通道反应器中合成环氧脂肪酸甲酯[J]. 精细化工, 2013, 30(1): 85-88.
