Advances in Clinical Medicine
Vol.06 No.03(2016), Article ID:18479,6
pages
10.12677/ACM.2016.63022
Hydrodynamic Transfection of Double Reporter Genes into Mouse Liver
Junshuang Jia1, Xia Lin1, Bingmin Luo1, Li Chen2, Yu Liu1, Dong Xiao1,3, Xiaolin Lin1*
1Cancer Research Institute, Southern Medical University, Guangzhou Guangdong
2The Second Affiliated Hospital, Guangzhou Medical University, Guangzhou Guangdong
3Laboratory Animal Center and Institute of Comparative Medicine, Southern Medical University, Guangzhou Guangdong

Received: Aug. 11th, 2016; accepted: Sep. 2nd, 2016; published: Sep. 5th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: Set up the system for hydrodynamic transfection of double reporter genes [green fluorescent protein (GFP) and firefly luciferase (Luc)] into mouse liver. Methods: To in vitro verify the functionality of pcEF.luc-IRES-GFP, human hepatocellular carcinoma 7721 cells were transiently transfected with pcEF.luc-IRES-GFP, followed by GFP and Luc assay. Hydrodynamic transfection was employed to deliver pcEF.luc-IRES-GFP into mice via tail-vein injection, followed by in vivo and ex vivo imaging to detect Luc and GFP. Moreover, immunohistochemistry (IHC) were performed to detect GFP expression in mouse liver cells. Results: The expression of GFP and Luc was detected in 7721 cell transiently transfected by pcEF.luc-IRES-GFP. Luc signals were detected in liver by in vivo bioluminescence imaging, and both Luc and GFP were detected in isolated liver by in vivo bioluminescence and fluorescence imaging. IHC revealed the GFP-positive liver cells of mice hydrodynamically transfected via tail-vein injection of pcEF.luc-IRES-GFP. Conclusions: We successfully deliver double reporter genes (GFP and luciferase) into mouse liver by hydrodynamic transfection, which lays a solid foundation for further research.
Keywords:Hydrodynamic Transfection, Tail-Vein Injection, Liver, Double Reporter Gene

利用高压水枪法将双报告基因导入小鼠肝脏
贾俊双1,林霞1,罗冰敏1,陈丽2,刘宇1,肖东1,3,林晓琳1*
1南方医科大学肿瘤研究所,广东 广州
2广州医科大学附属第二医院,广东 广州
3南方医科大学实验动物中心暨比较医学研究所,广东 广州

收稿日期:2016年8月11日;录用日期:2016年9月2日;发布日期:2016年9月5日

摘 要
目的:通过高压水枪法将双报告基因[即绿色荧光蛋白(GFP)和萤火虫荧光素酶(Luc)]导入小鼠肝脏,以熟练掌握高压水枪法,其将为后续相关研究奠定方法学基础。方法:将质粒pcEF.luc-IRES-GFP瞬时转染入人肝癌细胞SMMC-7721以进行载体体外功能验证,并利用高压水枪法将质粒pcEF.luc-IRES-GFP经尾静脉注射入小鼠肝脏内,经小动物活体成像系统活体检测GFP和Luc信号,同时免疫组化检测GFP在肝组织中的表达情况。结果:瞬转结果显示,7721细胞上可检测到GFP和Luc表达;利用高压水枪法将pcEF.luc-IRES-GFP导入小鼠肝脏后,利用小动物活体成像仪成功在肝内检测到GFP和Luc信号;免疫组化结果显示部分肝细胞表达GFP。结论:成功掌握了将目的基因导入小鼠肝脏的高压水枪法,这为相关后续研究打下良好基础。
关键词 :高压水枪法,尾静脉,肝脏,双报告基因

1. 前言
目前,CRISPR/Cas9基因编辑技术广泛应用于生物治疗和疾病动物模型 [1] - [3] ;该技术与尾静脉高压水枪 [4] 相结合,在基因治疗和肿瘤动物模型等相关领域已取得重要成果,如治疗肝脏代谢性疾病 [5] 和诱导小鼠肝癌 [6] 。应用高压水枪的方法造模与基于转基因或敲除小鼠构建模型的方法相比有着许多优势 [7] - [9] :1) 相比传统的动物造模方式,该方法操作简单、周期短和成本低;2) 导入肝脏的基因仅在少数肝细胞中表达,更能模拟肿瘤在人体中的发生发展过程;3) 利用高压水枪的方式,能同时导入几种不同基因,更有利于研究肝脏肿瘤的发生发展过程。为此,我们拟利用高压水枪法将双报告基因[即绿色荧光蛋白(GFP)和萤火虫荧光素酶(Luc)]导入小鼠肝脏,观察小鼠肝脏中双报告基因的表达情况,以熟练掌握该方法,这将为后续相关实验奠定坚实的方法学基础。
2. 材料与方法
2.1. 材料与试剂
2.1.1. 载体
双报告基因载体pcEF.luc-IRES-GFP由约翰·霍普金斯大学的Linzhao Cheng [10] 惠赠。
2.1.2. 主要试剂
萤火虫荧光素酶底物(D-luciferin)和兔抗鼠GFP多克隆抗体购自Bioworld 公司;DMEM培养基、胎牛血清、脂质体Lipofectamine2000TM和Opti-MEM等购自Invitrogen公司;质粒提取试剂盒购自Magen公司。通用型S-P9000免疫组织化学试剂盒、枸橼酸盐缓冲液以及DAB显色剂和抗体稀释液等均购自北京中杉金桥公司;其余常规生物化学试剂均为国产分析纯,购自北京鼎国生物公司。
2.1.3. 细胞
人肝癌细胞株SMMC-7721由南方医科大学肿瘤研究所保存,细胞培养所用培养基为含10%胎牛血清的DMEM。
2.1.4. 动物
SPF级性成熟BALB/c小鼠购自南方医科大学实验动物中心;所有实验用小鼠均在屏障动物房中饲养和繁殖,温度控制在22℃,自动光控(12 h明12 h暗)。
2.2. 方法
2.2.1. pcEF.luc-IRES-GFP载体体外功能验证
借助LipofectamineTM 2000将pcEF.luc-IRES-GFP载体在24孔板内瞬时转染入SMMC-7721细胞,方法参见文献 [11] 。转染48 h后在倒置荧光显微镜下观察细胞发荧光情况,同时利用小动物成像仪检测Luc信号。
2.2.2. 小鼠尾静脉高压水枪注射及双报告基因表达检测
1) 小鼠尾静脉高压水枪注射
分别将10、15、20、30和40 μg的质粒溶于2 ml生理盐水中,于7秒(s)内将质粒溶液通过小鼠尾静脉快速打入小鼠体内,注射生理盐水作为对照。
2) 活体检测双报告基因表达
小鼠尾静脉高压水枪注射pcEF.luc-IRES-GFP质粒24小时后,腹腔注射D-luciferin (150 mg/kg),1%戊巴比妥钠麻醉,利用小动物活体成像仪(Xenogen Corp., Alameda, CA)活体检测小鼠肝脏中Luc和GFP表达。
3) 离体小鼠肝脏检测双报告基因表达
小鼠活体检测到Luc和GFP表达后,将小鼠处死,取出肝脏,利用小动物活体成像仪检测离体肝脏中Luc和GFP表达。
4) 免疫组化检测小鼠肝脏GFP表达
收取离体检测后的小鼠肝脏,置于4%福尔马林固定,梯度酒精脱水,二甲苯透明,浸蜡,常规石蜡包埋,3~4 μm连续切片。通过免疫组化检测小鼠肝脏GFP基因表达。
3. 结果
3.1. pcEF.luc-IRES-GFP瞬时转染人SMMC-7721细胞
pcEF.luc-IRES-GFP质粒瞬时转染SMMC-7721细胞24小时后,倒置荧光显微镜下可见绿色荧光(见图1),利用小动物活体成像仪可检测到Luc信号(见图1),这些数据表明载体中Luc和GFP能够正常表达。
3.2. 利用高压水枪将pcEF.luc-IRES-GFP经尾静脉注射进小鼠体内后,小动物成像仪检测肝脏部位Luc表达
利用高压水枪将质粒pcEF.luc-IRES-GFP经尾静脉注射进小鼠体内,24 h后腹腔注射D-luciferin (150 mg/kg),并麻醉小鼠,借助小动物活体成像系统可检测到小鼠肝脏出现Luc信号,且信号强度随着注射质粒浓度的增加而增强(见图2),48 h后荧光强度较24 h的弱,提示质粒在肝脏内逐渐丢失,而7天后Luc信号几乎完全消失(见图2)。
3.3. 小鼠离体肝脏GFP和Luc表达
导入质粒24 h,利用小动物成像系统检测到小鼠肝脏出现Luc信号后,随即处死小鼠,取出肝脏,利用小动物活体成像系统仍可在离体小鼠肝脏上检测到GFP和Luc信号(见图3),这提示通过高压水枪法成功将质粒pcEF.luc-IRES-GFP转入小鼠肝细胞内。
3.4. 免疫组化检测小鼠肝脏GFP基因表达
将导入不同浓度质粒的小鼠肝脏经固定、脱水、包埋、切片后,通过免疫组化检测GFP基因在肝细胞中的表达。结果显示,与生理盐水对照组比,不同质粒浓度的小鼠肝脏中均有GFP阳性细胞,其中10 μg、15 μg和20 μg组的肝脏GFP阳性细胞数逐渐增加,20 μg、30 μg和40 μg组的肝脏GFP阳性细胞数无明显差别,且小鼠肝脏出现明显的细胞损伤(见图4)。以上这些数据提示通过高压水枪法将质粒导入肝脏后,其转染效率会随着质粒浓度的增加而增强,但也会出现平台期,不会无限制的增强下去。

Figure 1. SMMC-7721 cells were transiently transfected with pcEF.luc-IRES-GFP
图1. pcEF.luc-IRES-GFP瞬时转染SMMC-7721细胞
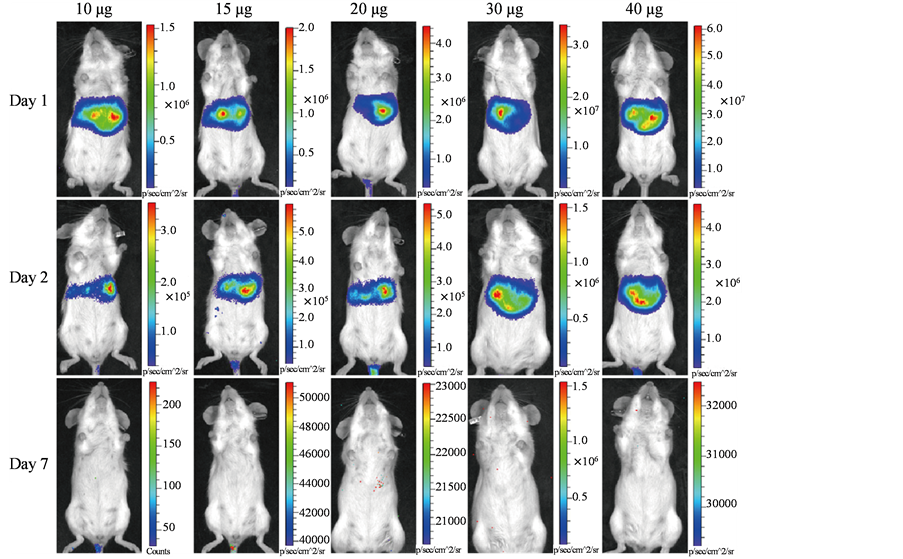
Figure 2. Detection of Luc expression in liver of mice at different time points
图2. 小动物成像仪检测不同时间点小鼠肝脏Luc信号

Figure 3. Detection of GFP and Luc expression in isolated liver
图3. 小动物成像仪检测离体肝脏中GFP和Luc表达

Figure 4. Detection of GFP expression in liver by IHC
图4. 免疫组化检测肝脏中GFP表达
4. 讨论
实验选用的质粒pcEF.luc-IRES-GFP携带两个报告基因(即Luc和GFP),这有助于我们更直接的观察质粒DNA的导入部位及表达情况,同时利用Luc在活体情况下也能实时监测转入基因的表达部位、表达水平和消退情况等。理论上讲,所转入基因的浓度在一定程度上与所检测到的Luc信号强度成正相关;而我们的实验结果表明,随着质粒浓度的增加,Luc信号也随之增强,但会出现平台期,维持10%~20%的转染效率,这与之前已有的文献报道一致 [8] 。尽管应用高压水枪的方法造模与基于转基因或敲除小鼠构建模型的方法相比有着许多优势,但是这项技术仍有其局限性,其中一个主要的局限性在于转染的基因会被肝脏快速的降解,注射后基因的表达水平大约在8~24小时达到峰值,此后在7天内会迅速下降,不能用于耗时较长的实验研究。另一局限性在于高压水枪主要转染中心区域的肝细胞,因此,这种方法不能用于研究来源于肝脏干细胞或者胆管上皮细胞的肿瘤 [12] 。
本实验通过将pcEF.luc-IRES-GFP质粒瞬时转染SMMC-7721细胞,在倒置荧光显微镜和小动物活体成像仪分别检测到GFP和Luc表达;再利用高压水枪法将质粒经尾静脉注射入小鼠肝脏,通过小动物活体成像仪成功在肝脏中检测GFP和Luc信号;免疫组化结果表明部分肝细胞表达GFP,以上这些提示我们利用高压水枪技术成功将双报告基因导入小鼠肝脏,这为相关后续研究打下了良好的方法学基础。
基金项目
广东省科技计划项目(2013B060300013),构筑制作遗传工程小型猪的社会化服务支撑平台。
文章引用
贾俊双,林 霞,罗冰敏,陈 丽,刘 宇,肖 东,林晓琳. 利用高压水枪法将双报告基因导入小鼠肝脏
Hydrodynamic Transfection of Double Reporter Genes into Mouse Liver[J]. 临床医学进展, 2016, 06(03): 122-127. http://dx.doi.org/10.12677/ACM.2016.63022
参考文献 (References)
- 1. Sternberg, S.H., La France, B., Kaplan, M., et al. (2015) Conformational Control of DNA Target Cleavage by CRISPR- Cas9. Nature, 527, 110-113. http://dx.doi.org/10.1038/nature15544
- 2. Hsu, P.D., Lander, E.S. and Zhang, F. (2014) Development and Ap-plications of CRISPR-Cas9 for Genome Engineering. Cell, 157, 1262-1278. http://dx.doi.org/10.1016/j.cell.2014.05.010
- 3. Cong, L. and Zhang, F. (2015) Genome Engineering Using CRISPR-Cas9 System. Methods in Molecular Biology, 1239, 197-217. http://dx.doi.org/10.1007/978-1-4939-1862-1_10
- 4. Chen, X. and Calvisi, D.F. (2014) Hydrodynamic Transfection for Generation of Novel Mouse Models for Liver Cancer Research. American Journal of Pathology, 184, 912-923. http://dx.doi.org/10.1016/j.ajpath.2013.12.002
- 5. Yin, H., Xue, W., Chen, S., et al. (2014) Genome Editing with Cas9 in Adult Mice Corrects a Disease Mutation and Phenotype. Nature Biotechnology, 32, 551-553. http://dx.doi.org/10.1038/nbt.2884
- 6. Xue, W., Chen, S., Yin, H., et al. (2014) CRISPR-Mediated Direct Mutation of Cancer Genes in the Mouse Liver. Nature, 514, 380-384. http://dx.doi.org/10.1038/nature13589
- 7. Van Dyke, T. and Jacks, T. (2002) Cancer Modeling in the Modern Era: Progress and Challenges. Cell, 108, 135-144. http://dx.doi.org/10.1016/S0092-8674(02)00621-9
- 8. Liu, F., Song, Y. and Liu, D. (1999) Hydrodynamics-Based Transfection in Animals by Systemic Administration of Plasmid DNA. Gene Therapy, 6, 1258-1266. http://dx.doi.org/10.1038/sj.gt.3300947
- 9. Tward, A.D., Jones, K.D., Yant, S., et al. (2007) Distinct Pathways of Genomic Progression to Benign and Malignant Tumors of the Liver. Proceedings of the National Academy of Sciences of the USA, 104, 14771-14776. http://dx.doi.org/10.1073/pnas.0706578104
- 10. Pomper, M.G., Hammond, H., Yu, X., et al. (2009) Serial Imaging of Human Embryonic Stem-Cell Engraftment and Teratoma Formation in Live Mouse Models. Cell Research, 19, 370-379. http://dx.doi.org/10.1038/cr.2008.329
- 11. 陈琳, 陈燕, 肖东. Eμ-VH启动子调控c-Myc表达慢病毒载体的构建及其体外功能[J]. 山东医药, 2016, 56(21): 1-3.
- 12. Suda, T. and Liu, D. (2015) Hydrodynamic Delivery. Advances in Genetics, 89, 89-111. http://dx.doi.org/10.1016/bs.adgen.2014.10.002
*通讯作者。