Advances in Clinical Medicine
Vol.
09
No.
12
(
2019
), Article ID:
33247
,
8
pages
10.12677/ACM.2019.912211
Primary Biliary Cirrhosis with Tubulointerstitial Nephritis Manifested as Renal Tubular Acidosis, Nephrolithiasis, and Nephrogenic Diabetes Insipidus: A Case Report
Shaohan Huang, Shuiya Sun, Yingzi He, Fenping Zheng*
Zhejiang University School of Medicine, Hangzhou Zhejiang

Received: Nov. 12th, 2019; accepted: Nov. 25th, 2019; published: Dec. 2nd, 2019

ABSTRACT
Tubulointerstitial nephritis (TIN) is sometimes found in patients with Primary biliary cirrhosis (PBC), but it can easily be overlooked. In our manuscript, a 55-year-old woman was hospitalized with complaints of thirst, polydipsia, and polyuria. She had been diagnosed with PBC 3 years prior. During this hospitalization, she was diagnosed with renal tubular acidosis, nephrolithiasis, hydronephrosis, diabetes insipidus, and chronic kidney disease. Kidney damage associated with PBC should be considered. The patient showed a good response to ursodeoxycholic acid, hydrochlorothiazide, indomethacin, and potassium citrate. We report a case of PBC with severe renal impairment to raise awareness of PBC with kidney involvement. The case report has obtained the informed consent of the patient.
Keywords:Primary Biliary Cirrhosis, Renal Tubular Acidosis, Nephrolithiasis, Diabetes Insipidus, Citrate
以肾小管酸中毒、肾结石、肾源性尿崩症为表现的原发性胆汁性肝硬化伴肾小管间质性肾炎1例
黄绍含,孙水雅,何樱子,郑芬萍*
浙江大学医学院,浙江 杭州
收稿日期:2019年11月12日;录用日期:2019年11月25日;发布日期:2019年12月2日

摘 要
原发性胆汁性肝硬化(PBC)的患者有时会发生肾小管间质性肾炎(TIN),但很容易被忽视。本研究回顾性报道1位55岁的女性因持续加重口干、多饮和多尿而住院,她住院前3年被诊断为PBC。本次住院期间,被诊断为肾小管酸中毒、肾结石、肾积水、尿崩症和慢性肾病,考虑PBC相关的肾损伤。患者服用熊去氧胆酸、氢氯噻嗪、吲哚美辛和枸橼酸钾治疗后症状明显改善。由此来提高人们对肾损伤的PBC的认识。该病例报道已获得病人的知情同意。
关键词 :原发性胆汁性肝硬化,肾小管酸中毒,肾结石,尿崩症,枸橼酸盐

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
原发性胆汁性肝硬化(PBC)是一种慢性自身免疫性疾病,其特征是小叶间胆管的进行性损伤,导致胆管减少、慢性胆汁淤积和胆汁酸潴留。它主要影响5~70岁的女性 [1]。肾小管间质性肾炎(TIN)有时见于PBC患者,但很容易被忽视。肾小管性酸中毒(RTA)和肾源性尿崩症(NDI)是TIN的主要特征。RTA是一类由各种类型的肾性酸中毒功能障碍引起的代谢紊乱。I型RTA是我国最常见的RTA类型,又称远端RTA。长期酸中毒导致骨溶解,以及肾小管对钙离子(Ca2+)的再吸收受阻,这导致骨质疏松。此外,游离钙可导致肾钙质沉着症或肾结石,这可能导致肾酸化功能障碍,形成RTA [2]。最后,低钾血症也是典型的远端RTA的一个特征。NDI由肾脏对加压素的抵抗引起。与中枢性尿崩症(CDI)相比,NDI患者血浆加压素水平通常正常或升高。获得性NDI更为常见,并可由多种因素引起,包括锂毒性、尿梗阻、低钾血症和高钙血症 [3]。肾功能不全是PBC少见的并发症。我们报道1例严重肾损害的PBC病例,以提高人们对肾损害的PBC的认识。
2. 临床资料
患者,女性,52岁患者因口干、多饮、夜尿增多和乏力等症状2012年7月至浙江大学附属邵逸夫医院住院。3年前诊断为2型糖尿病。体格检查示双下肢轻度水肿,但未发现肝脏肿大或黄疸。肌酐清除率为44.694 mL/min (正常范围:女:75~115 mL/min),血清肌酐为98~153 μmol/L (正常范围:62~115 μmol/L),24小时尿蛋白为479.25 mg (正常范围:0~150 mg),二氧化碳结合力为19.2~22.9 mmol/L (正常范围:23~33 mmol/L),血清氯为108~119 mmol/L (正常范围:98~109 mmol/L),血钾(K+)为3.3~4.35 mmol/L (正常范围:3.5~5.3 mmol/L)。她的肝功能结果如下:丙氨酸转氨酶为22~158 IU/L (正常范围:5~45 IU/L),谷氨酸草酸盐转氨酶为22~76 IU/L (正常范围:5~35 IU/L),g-谷氨酰转移酶为38~107 IU/L (正常范围:5~40 IU/L),碱性磷酸酶(ALP)高于正常值(135~232 IU/L),正常范围:30~110 iu/L,总胆红素5.1~7.8 μmol/L (正常范围:10~20.5 μmol/L),直接胆红素2~3.9 μmol/L (正常范围:0~6.8 μmol/L),间接胆红素3.1~3.9 μmol/L (正常范围:0~13.7 μmol/L),白蛋白45.8 g/L,球蛋白42.3 g/L,白蛋白/球蛋白比值1.08。常规尿样的比重为1.010 (正常范围:1.015~1.025);她的尿pH值为6.5~7 (正常范围:5~8)。观察到血清免疫球蛋白M的浓度略有增加(310 mg/dL),λ轻链的浓度也增加。血常规和血生化显示白细胞、中性粒细胞百分比、CRP和血沉升高。泌尿系统超声显示肾实质回声改变。肝脏超声检查未见明显异常。骨密度检查显示腰椎骨质疏松(T: −2.7)。眼底检查无糖尿病视网膜病变。抗核抗体(滴度1:1000)、抗线粒体抗体(AMA)、AMA-M2-3E和抗gp210抗体免阳性。抗Ro (SSA)和抗La (SSB)抗体检测均为阴性。病人被诊断为PBC。虽然当时我们不考虑患者有糖尿病肾病,但血清肌酐升高的原因尚未阐明。病人拒绝了我们的肾活检建议。出院后,她口服熊去氧胆酸(UDCA)和胰岛素来控制胆汁淤积和血糖。
出院后,她仍有口渴和乏力,实验室检查显示糖化血红蛋白(HbA1c)在5.60%到6.3%,血清K+水平逐渐下降,波动在2.54 mmol/至3.3 mmol/L。间歇性补充氯化钾缓释片,但低钾血症仍存在。在随访期间评估包括血清肌酐(图1)、氯化物(Cl−) (图2)、K+ (图3)、Ca2+ (图4)和碱性磷酸酶(图5)在内的参数。
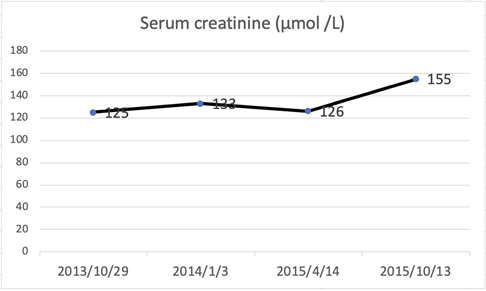
Figure 1. Serum creatinine
图1. 血肌酐随访结果
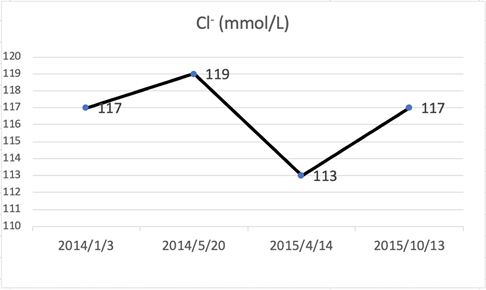
Figure 2. Serum chloride
图2. 血氯的随访结果

Figure 3. Serum potassium
图3. 血钾的随访结果

Figure 4. Serum calcium ions
图4. 血钙的随访结果

Figure 5. Serum alkaline
图5. 血碱性磷酸酶的随访结果
患者55岁时因持续加重的口干、多饮和多尿20天于2015年10月再次入住我院。入院查体未见明显异常。实验室检查:K+水平下降,而氯、尿素氮和血清肌酐水平上升;肾小球滤过率(eGFR,CKD-EPI法)下降到29.2 ml/min,HbA1c 6.30%。尿液分析:常规尿比重较低(重复检查后 < 1.005),pH值在7~8之间,尿β-2微球蛋白升高。血气分析显示代谢性酸中毒失代偿,阴离子间隙正常(表1)。患者被诊断为1型RTA,并且通过禁水加压试验进一步确定了NDI (表2)。
骨密度检查显示腰椎骨质疏松(T: −3.4)。泌尿系统超声显示右肾实质回声改变,左上段输尿管结石伴左肾严重积水,右肾囊肿及右肾结晶(图6),腹部及盆腔CT:双侧肾结石,左肾盂输尿管移行处的结石,伴有严重的肾积水、左肾萎缩和右肾囊肿(图7)。

Figure 6. Ultrasound of the urinary system showed echoic changes in the right renal parenchyma consistent with the clinical findings, left upper ureteral calculi with severe hydronephrosis of the left kidney, a right renal cyst and crystallization of the right kidney
图6. 泌尿系统超声:右肾实质回声改变,左上段输尿管结石伴左肾严重积水,右肾囊肿及右肾结晶

Figure 7. Imaging findings. Abdominal and pelvic computed tomography (CT): (a) Right renal calculi, severe hydronephrosis and atrophy of the left kidney; (b) Cysts in the right kidney; (c) Calculus at the left ureteropelvic transitional site; (d) Left renal calculi. (arrow)
图7. 腹部和盆腔CT平扫:(a) 右肾结石,严重肾积水和左肾萎缩;(b) 右肾囊肿;(c)左肾盂输尿管移行处结石;(d) 左肾结石。(箭头)
Table 1. Laboratory data
表1. 实验室数据
Table 2. Water deprivation test and desmopressin trial
表2. 禁水加压试验
入院后予15 ml枸橼酸钾水化物口服每天3次治疗RTA;500 mg UDCA治疗PBC。对于NDI的治疗,予25 mg氢氯噻嗪和25 mg吲哚美辛的片剂分别每天给药3次和2次,同时限制钠的摄入量。
出院后,她的尿崩症症状明显好转。随访3年,常规尿比重增加到1.014左右,EGFR维持在29~33 mL/min,血肌酐在139~167 mol/L,纠正低钾血症和代谢性酸中毒。目前持续随访中。
3. 讨论
PBC是一种慢性进展性疾病,最常见于女性;其特点是肝内小胆管的进展性破坏伴门静脉炎症,导致纤维化和肝硬化。尽管我们的患者没有进行肝活检,但根据血清ALP持续升高和血清AMA的存在,患者被诊断为PBC [1]。由于患者没有典型症状,SSA和SSB检查均为阴性,因此排除了Sjégren综合征。
肾功能不全是PBC少见的并发症 [4],但该患者应该考虑到这一并发症。尽管患者在2012年第一次住院时血清肌酸水平升高、轻度蛋白尿和eGFR降低,但基于其相对较短的糖尿病病程和阴性的眼底病变,最初并未考虑糖尿病肾病。TIN和不完全远端RTA根据反复低钾血症、血氯升高和尿pH > 5.5 [5] [6] 来考虑。不幸的是,该患者拒绝肾活检,使我们当时未作出正确的诊断。
在这个病例中,我们不能排除TIN可能与PBC的致病性有关。首先,由CD4+和CD8+淋巴细胞组成的肝内自身反应性T淋巴细胞浸润可能是由肝细胞异常抗原表达(如肝细胞膜表面线粒体抗原)驱动的。这种异常的抗原表达也可能发生在肾小管细胞中,导致肾间质中的自身反应性T细胞浸润。其次,抗线粒体抗体,特别是抗线粒体M2抗体,可能在肾小管间质性肾炎的发生中起作用,可显著降低PDH、α-KDH和支链酮酸脱羧酶三种线粒体酶的活性。此外,体外研究表明,从PBC患者中纯化的IgA可能通过内吞作用转移到肾小管细胞中,并与PDH复合物共定位。不能排除这些抗体在某些情况下可能干扰肾内线粒体机制,从而导致TIN [7] [8]。
多种因素可导致远端RTA与肾钙质沉着症的关系。然而,在大多数情况下,RTA是初始条件;随后的酸血症促进了结石的形成,既通过在保留酸的骨缓冲过程中增加骨中磷酸钙的释放,又通过直接减少这些离子在肾小管再吸收 [9] [10] [11]。另外两个因素也有助于结石形成:持续高的尿液pH通过在酸性条件下增强近柠檬酸盐再吸收降低柠檬酸排泄,这有利于磷酸钙沉淀 [12] [13]。尿中的柠檬酸盐通常是钙结石形成(草酸和磷酸盐)的有效抑制剂,因为它与钙形成可溶性复合物,并通过钙晶体的聚集抑制结石的生长。在肾脏中,柠檬酸盐在肾小球处被完全过滤,从10%~40%的肾小管吸收。肾功能不全、早期代谢性酸中毒和钾缺乏可导致低碳酸血症 [14]。
NDI是由于晚期远端小管和集合管对加压素无反应所致。不能集中尿液会导致多尿和多饮。继发性NDI与电解质异常、梗阻性尿路病或某些药物的使用有关 [15]。我们考虑病人在第一次住院时有TIN和不完全的远端RTA,但我们忽略了该诊断,当时没有给她及时服用枸橼酸盐,导致肾结石逐渐形成。肾积水和NDI最有可能是由于梗阻性尿路病和持续低钾血症引起。
此外,当糖尿病患者出现多尿和多饮时,首先要考虑的病因是血糖控制不佳。然而,我们的患者尿常规提示尿比重低,尿糖呈阴性,血糖基本控制良好,因此暂不考虑;她通过禁水加压试验证实患有NDI。
综上所诉,当PBC患者出现多尿或多饮,包括反复低钾血症、尿酸化功能障碍和肌酐清除率降低时,应考虑PBC引起肾损害的可能性。RTA是PBC罕见的重要肝外并发症,及时应用枸橼酸盐可预防肾结石的发生。
文章引用
黄绍含,孙水雅,何樱子,郑芬萍. 以肾小管酸中毒、肾结石、肾源性尿崩症为表现的原发性胆汁性肝硬化伴肾小管间质性肾炎1例
Primary Biliary Cirrhosis with Tubulointerstitial Nephritis Manifested as Renal Tubular Acidosis, Nephrolithiasis, and Nephrogenic Diabetes Insipidus: A Case Report[J]. 临床医学进展, 2019, 09(12): 1360-1367. https://doi.org/10.12677/ACM.2019.912211
参考文献
- 1. Invernizzi, P., Floreani, A., Carbone, M., et al. (2017) Primary Biliary Cholangitis: Advances in Management and Treatment of the Disease. Digestive and Liver Disease, 49, 841-846. https://doi.org/10.1016/j.dld.2017.05.001
- 2. Dong, K.-H., Fang, Y.-N., Wen, X.-Y. and Jin, Q.-L. (2018) Primary Biliary Cirrhosis with Refractory Hypokalemia. Medicine, 97, e13172. https://doi.org/10.1097/MD.0000000000013172
- 3. Jenny Lu, H.A. (2017) Diabetes Insipidus.
- 4. Komatsuda, A., Wakui, H., Ohtani, H., et al. (2010) Tubulointerstitial Nephritis and Renal Tubular Acidosis of Different Types Are Rare But Important Complications of Primary Biliary Cirrhosis. Nephrology Dialysis Transplantation, 25, 3575-3579. https://doi.org/10.1093/ndt/gfq232
- 5. Soriano, J.R. (2002) Renal Tubular Acidosis: The Clinical Entity. Journal of the American Society of Nephrology, 13, 2160-2170. https://doi.org/10.1097/01.ASN.0000023430.92674.E5
- 6. Santos, F., Gil-Peña, H. and Alvarez-Alvarez, S. (2017) Renal Tubular Acidosis. Current Opinion in Pediatrics, 29, 206-210. https://doi.org/10.1097/MOP.0000000000000460
- 7. Iwakura, T., Fujigaki, Y., Matsuyama, T., et al. (2013) Tubulointerstitial Nephritis and Primary Biliary Cirrhosis with a T Cell-dominant Profile of Infiltrating Cells and Granulomas in Both Organs. Internal Medicine, 52, 467-471. https://doi.org/10.2169/internalmedicine.52.9003
- 8. Lino, M., Binaut, R., Laure-Hélène, N., et al. (2005) Tubulointerstitial Nephritis and Fanconi Syndrome in Primary Biliary Cirrhosis. American Journal of Kidney Diseases, 46, e41-e46. https://doi.org/10.1053/j.ajkd.2005.05.021
- 9. Rose, B.D. and Post, T.W. (2001) Clinical Physiology of Acid-Base and Electrolyte Disorders. 5th ed, McGraw-Hill, New York, 616.
- 10. Bleich, H.L., Moore, M.J. and Lemann Jr., J. (1979) Urinary Calcium Excretion in Human Beings. The New England Journal of Medicine, 301, 535-541. https://doi.org/10.1056/NEJM197909063011008
- 11. Nijenhuis, T., Renkema, K.Y., Hoenderop, J.G. and Bindels, R.J. (2006) Acid-Base Status Determines the Renal Expression of Ca2+ and Mg2+ Transport Proteins. Journal of the American Society of Nephrology, 17, 617. https://doi.org/10.1681/ASN.2005070732
- 12. Norman, M.E., Feldman, N.I., Cohn, R.M., et al. (1978) Urinary Citrate Excretion in the Diagnosis of Distal Renal Tubular Acidosis. The Journal of Pediatrics, 92, 394-400. https://doi.org/10.1016/S0022-3476(78)80426-0
- 13. Hamm, L.L. (1990) Renal Handling of Citrate. Kidney International, 38, 728-735. https://doi.org/10.1038/ki.1990.265
- 14. Marangella, M. (2017) Use of Citrate in Patients with Nephrolithiasis. Giornale italiano di nefrologia, 34, 51-60.
- 15. Kavanagh, C. and Natalie, S.U. (2019) Nephrogenic Diabetes Insipidus. Pediatric Clinics of North America, 66, 227-234. https://doi.org/10.1016/j.pcl.2018.09.006
NOTES
*通讯作者。
