Hans Journal of Food and Nutrition Science
Vol.
09
No.
01
(
2020
), Article ID:
33861
,
11
pages
10.12677/HJFNS.2020.91003
Evaluation of Immunomodulatory Effect of Powdered Antrodia cinnamomea in Submerged Culture
Ting-Wei Lin1, Jun-Ren Lin2, Shiow-Wen Chen2, Hsiao-Ling Chang1, Chin-Chu Chen1,3,4*
1Bioengineering Center, Grape King Bio Ltd., Taoyua Taiwan
2Food Industry Research & Development Institute, Hsinchu Taiwan
3Department of Food Science, Nutrition, and Nutraceutical Biotechnology, Shih Chien University, Taipei Taiwan
4Bioscience Technology, Chung Yuan Christian University, Taoyuan Taiwan

Received: Dec. 19th, 2019; accepted: Jan. 1st, 2020; published: Jan. 8th, 2020

ABSTRACT
The aim of this study is to evaluate the immunomodulatory effect of powdered Antrodia cinnamomea in submerged culture. The experiment followed the “Evaluation method for ingredients with immunomodulation effect” published by the Taiwan Ministry of Health and Welfare. In brief, the immunomodulatory effect of powdered Antrodia cinnamomea in submerged culture was evaluated through various parameters including body weights, serum immunoglobulin, cytokine value, phagocytic activities of phagocytes, and natural killer cell activity. A total of forty BALB/c mice were randomly divided into four groups including the control group, and three groups administrated different doses of powdered Antrodia cinnamomea mycelia equivalent to the recommended daily doses for adults (0.5XAc, 1890 mg/day/kg, 1XAc, 3780 mg/day/kg and 2XAc, 7560 mg/day/kg). After powdered Antrodia cinnamomeamycelia was orally administered, the BALB/c mice were immunized with ovalbumin. Results showed that no significant differences in the body weights were observed between control and test groups. Moreover, there was no overall effect on the distribution of lymphocyte subpopulations; the ratio of splenic MHC I, MHC II, T cells and B cells in powdered Antrodia cinnamomea mycelia treated animals was the same as controls, suggesting that powdered Antrodia cinnamomea mycelia does not have any obvious toxic effect. However, in non-specific immune response, powdered Antrodia cinnamomea mycelia can significantly activate natural killer cells, promote the early production of IgM antibodies, and enhance the proliferation of splenic T lymphocytes, which lead to spontaneous secretion of IL-2 and IFN-γ. In specific immune responses, powdered Antrodia cinnamomea mycelia can stimulate the proliferation of OVA-specific lymphocytes, which can significantly increase the secretion of IL-2 and IFN-γ, but inhibit the production of IL-4. Based on these findings, it is suggested that powdered Antrodia cinnamomea mycelia in submerged culture has the ability to activate natural killer cells, promotes lymphocyte proliferation, regulates cytokine secretion, and hence increases Th1 immune response.
Keywords:Antrodia cinnamomea, Mycelia, Submerged Fermentation, Non-Specific Immune Responses, Specific Immune Responses, Ovalbumin

评估液态发酵樟芝菌丝体粉末之免疫调节功能
林定威1,林俊仁2,陈秀雯2,张晓苓1,陈劲初1,3,4*
1葡萄王生技股份有限公司,台湾 中坜
2食品发展工业研究所,台湾 新竹
3实践大学食品营养与保健生技学系,台湾 台北
4中原大学生物科技学系,台湾 桃园

收稿日期:2019年12月19日;录用日期:2020年1月1日;发布日期:2020年1月8日

摘 要
本试验目的在评估液态发酵樟芝菌丝体粉末之免疫调节功能,依照卫生福利部公告的《健康食品免疫调节功能评估方法》,以喂管喂食BALB/c小鼠模式,藉由小鼠体重、抗体、细胞激素、吞噬细胞活性、自然杀手活性等等测试与分析,以进行评估。将雌性BALB/c小鼠随机分成4组,分为控制组及三液态发酵樟芝菌丝体粉末剂量组;三剂量组分别相当于成人每日液态发酵樟芝菌丝体粉末建议剂量的0.5倍(0.5XAc, 1890 mg/day/kg)、1倍(1XAc, 3780 mg/day/kg)和2倍(2XAc, 7560 mg/day/kg)。并使用卵白蛋白(ovalbumin, ova)诱发特异性免疫反应。结果显示,对照组与各剂量组小鼠的体重没有显著差异,显示液态发酵樟芝菌丝体粉末对于小鼠生长均无不良的影响。观察脾脏中淋巴细胞数目消长,发现三测试剂量均不影响MHC I、MHC II、T及B细胞次群之比率,显示在测试剂量范围内,液态发酵樟芝菌丝体粉末对于小鼠脾脏淋巴细胞次群无异常的影响。在非特异性免疫反应方面,液态发酵樟芝菌丝体粉末可显著活化自然杀手细胞,促进IgM抗体早期生成,提升脾脏T淋巴细胞的增生,同时能促进脾脏细胞自发性IL-2及IFN-γ的分泌。至于特异免疫反应方面,液态发酵樟芝菌丝体粉末对ova特异淋巴细胞之增生有提升的作用,以及明显的提升脾脏ova特异性淋巴细胞分泌IL-2和IFN-γ的分泌,并可显著的抑制脾脏ova特异性淋巴细胞分泌IL-4。综上所述,液态发酵樟芝菌丝体粉末具有活化自然杀手细胞,促进淋巴细胞增生,调节细胞激素分泌,倾向于增加Th1免疫反应的表现。
关键词 :樟芝,菌丝体,液态发酵,非特异性免疫,特异性免疫,卵白蛋白

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
樟芝(Antrodia cinnamomea)是台湾特有的真菌之一,被认为具有调节免疫、保护肝脏的功能 [1]。樟芝主要寄生在牛樟树,而牛樟树是台湾特有的树木之一,因此樟芝被认为是台湾国宝级的真菌。但牛樟树生长速度缓慢,且遭遇人工滥伐,进而造成野生樟芝子实体面临被灭绝的危险之中 [2]。近年来已发展出人工培育樟芝的方法,其中深层发酵是一种快速、清洁卫生、可控制质量的生产方法,并可透过调控发酵条件以产生特定活性物质。樟芝所含的生理活性也逐渐明朗,包括抗发炎、抗癌、增强免疫能力及保护肝脏等功能,深具研究及商业开发价值 [3]。免疫系统为生物体重要的防御系统,当外来病菌突破皮肤、消化道和呼吸道黏膜部份等第一道防线而进入人体时 [4],免疫系统随即启动,包括分泌细胞激素、吞噬作用(phagocytosis)、自然杀手细胞毒杀作用(cytotoxity)及发炎反应(inflammation)等 [5],此即为先天性免疫(innate immunity)。由于其并非针对特定致病微生物的,故又称为一般性、非特异性的免疫(nonspecific immunity)。身体的第二道免疫防御机制是以T细胞为主的细胞性免疫反应(cell-mediated immunity)及以B细胞为主的体液性免疫,为后天性免疫反应(adaptive immune response)或特异性免疫(specific immunity) [6]。靠免疫系统抵御外来病菌侵入,是维持健康的第一道防线,免疫功能失调不仅会降低体内对外界之抵抗力,也容易导致疾病的发生,或是推迟罹病痊愈的时间。本研究依照卫生福利部公告的《健康食品免疫调节功能评估方法》 [7],针对樟芝液态发酵菌丝体粉末(简称樟芝菌丝体,Ac)的特异性及非特异性免疫功能进行免疫调节功能的评估。
2. 材料与方法
2.1. 液态发酵菌丝体发酵条件
樟芝(A. cinnamomea) (BCRC 35398)菌种购自台湾新竹市食品工业发展研究所生物资源保存及研究中心。在生物安全柜中,将PDA平板上长好的樟芝菌丝,取0.5 cm大小正方的菌块,接种入2 L三角瓶中(内含1 L液体培养基),于25℃、100 rpm中震荡培养2周,后接种入500公升级发酵槽,在90 rpm的搅拌,0.5 vvm的通气量、25℃中培养7天,再接种入50吨级发酵槽,以50 rpm的搅拌,0.5 vvm的通气量、25℃中继续培养14天后,得樟芝菌丝体发酵液;经冷冻干燥、磨粉后得樟芝菌丝体发酵全液冻干粉。液体培养基组成:1.0%葡萄糖、0.5%黄豆粉、0.5%蛋白胨、0.3% (NH4)2SO4、0.1% MgSO4∙7H2O。
2.2. 试验动物
七周龄、雌性BALB/c小鼠 [8] [9] [10] 购自乐斯科生物科技(BioLASCO Taiwan Co., Ltd. Taipei, Taiwan);饲养条件为23 ± 2℃、50 ± 10%相对湿度、12小时光照/黑暗交替、饲料饮水不限制;本实验设计经食品工业发展研究所(新竹,台湾)动物实验管理小组审核通过(动管字第93-033号),并根据动物使用方案进行研究。
2.3. 分组与剂量
使用同一组小鼠进行非特异性免疫反应与特异性免疫反应试验。将动物随机分成4组,并根据给予物质种类或剂量,分为一个对照组(n = 10),及三组樟芝菌丝体剂量组(n = 12);三剂量组分别相当于成人每日樟芝菌丝体建议剂量的0.5倍(0.5XAc, 1890 mg/day/kg)、1倍(1XAc, 3780 mg/day/kg)和2倍(2XAc, 7560 mg/day/kg)。采用胃管口服给予喂食。以卵白蛋白(ovalbumin, ova)作为特异性免疫反应用之抗原,采皮下注射抗原的模式进行,以Freund’s adjuvant作为佐剂:第一次使用complete adjuvant,其后使用incomplete adjuvant。在管喂1周后以腹腔注射方式给予2 μg ova诱导小鼠;在第6及第8周时,施以皮下注射10 μg ova刺激小鼠。在第3、7及9周时进行尾部采血收集血清,第10周牺牲,采血、取腹水及脾脏已进行免疫反应相关指标之检测。
2.4. 脾脏免疫细胞之数量消长分析
每管加入1 × 106个脾脏细胞,分别加入不同的荧光抗体,(FITC/PEisotype controls, α-H2Kd FITC, α-I-A FITC, α-CD3 FITC/α-CD19 PE)结合到细胞表面分子后,以流式细胞仪对淋巴细胞亚群(MHC I/II,T与B)做进一步的分析。
2.5. 吞噬细胞活性分析
利用Phagotest kit (ORPENGEN Pharma, Heidelberg, Germany, catalog number: 3884)检测血液中吞噬细胞的吞噬活性。将上述100 ml抗凝之全血与20 ml opsonized FITC-labelled E. coli混合,置于37℃水浴槽(实验组)或冰上(阴性对照组)作用10分钟,然后置于冰上以终止吞噬作用,加入100 ml ice-cold quenching solution,混合均匀。离心、清洗。加入200 ml之DNA staining solution,置于冰上,避光反应10分钟,而后在60分钟内以流式细胞仪进行分析。吞噬作用活性(%) = 实验组之吞噬作用(%) − 阴性对照组之吞噬作用(%)。
2.6. 自然杀手细胞毒杀试验 [11]
用10 ml RPMI 1640培养基冲洗腹膜腔,并将流洗液以300×g离心10分钟。将制备的细胞重新悬浮于RPMI 1640培养基中,铺板,37℃培养1小时,洗涤3次,除去未贴附之细胞。再透过LIVE/DEAD Cell-Mediated Cytotoxicity Kit (Molecular Probes, USA)测定分离于腹腔巨噬细胞的自然杀手细胞毒杀目标细胞(Yac-1)的能力。
2.7. 总抗体及OVA特异性抗体分泌试验
抗凝之全血保存于4℃,以sandwich ELISA kits (Bethyl, Montgomery, USA)测定其中所含IgM、IgG总抗体及ova特异性IgM、IgG抗体的浓度。
2.8. 淋巴细胞增生反应
取约4 × 106 cells/ml脾脏细胞悬浮液,加入96孔盘(0.1 ml/well)中,再分别依据非特异性免疫反应或特异性免疫反应,在含有添加10% FBS、2 mM L-glutamine和抗生素的RPMI 1640培养液中,分别加入最终浓度为10 μg/ml的洋刀豆血球凝集素(concanavalin A, ConA)、或50 μg/ml的脂多醣(lipopolysaccharide, LPS)、100或200 μg/ml的ova,以5% CO2、37℃培养72小时;之后,在各孔盘中加入20 μl过滤后的MTT溶剂(5 mg/ml),于37℃下放置4小时;再加入DMSO萃取,测定O.D. 570 nm吸光值。增生指数(stimulation index)计算公式 [12] 为(A570nm treatment − A570nm medium control)/(A570nm cell only − A570nm medium control)。
2.9. 细胞激素分泌试验
取约4 × 105 cells/well从脾脏分离得的淋巴细胞,分别依据非特异性免疫反应或特异性免疫反应,在1 ml培养基中分别加入ConA (5 μg/mL)或ova (100及200 μg/mL),培养24小时至48小时;收集细胞上清液并保存于−20℃,以供测定细胞激素使用。利用sandwich-ELISA法测试lL-2、IFN-γ、IL-4及IL-5的含量。
2.10. 数据整理与分析 [13]
试验结果是以平均值 ± 标准误差(Mean ± SD)表示。数据以One-way ANOVA单因子变异数进行检定,再以Dunnett’s t-test来检定各组组间之差异性比较,*表示组间具有显著性的差异(p < 0.05)。
3. 结果
本研究旨在评估液态发酵所得之樟芝菌丝体粉末对于免疫系统的影响。参考卫生福利部公告的《健康食品免疫调节功能评估方法》,利用管喂方式喂食BALB/c小鼠樟芝菌丝体,藉由分析脾脏细胞增生反应、脾脏细胞细胞激素分泌量、自然杀手细胞活性、吞噬细胞活性及抗体分泌量,评估非特异性免疫反应之影响;并以皮下注射ova致敏小鼠,藉由分析ova特异性抗体、ova特异性脾脏细胞增生反应及ova特异性细胞激素的分泌,评估特异性免疫反应的影响。
3.1. 对小鼠生长的影响
在试验期间,经8周的管喂,在小鼠生长情况方面,对照组及樟芝菌丝体各剂量组小鼠的体重无显著差异(图1),显示樟芝菌丝体具安全可食用性。
 Results are presented as mean ± SD (n = 10 for control, and 12 for the other groups).
Results are presented as mean ± SD (n = 10 for control, and 12 for the other groups).
Figure 1. Effects of Ac mycelium on body weight (gm) of female BALB/c mice
图1. 试验期间对BALB/c小鼠平均体重之影响
3.2. 对脾脏淋巴细胞次群的影响
以细胞表面特定抗原分析,观察脾脏中淋巴细胞次群所占百分比的影响,于喂食樟芝菌丝体的各剂量组的期间,对于小鼠脾脏中MHC I、MHC II、T及B淋巴数量之比率皆无明显差异(图2),显示喂食樟芝菌丝体对于ova致敏BALB/c小鼠脾脏中各类淋巴细胞次群所占百分比无影响。
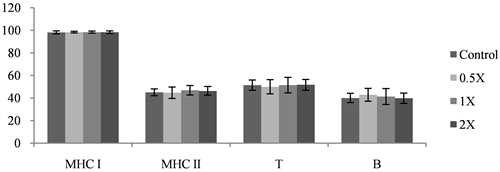 Results are presented as mean ± SD (n = 8 - 10).
Results are presented as mean ± SD (n = 8 - 10).
Figure 2. Effects of Ac mycelium on proportions of lymphocyte subsets of spleen cells
图2. 试验期间樟芝菌丝体对BALB/c小鼠脾脏淋巴细胞分型的影响
3.3. 血液吞噬细胞吞噬能力的影响
取全血以ORPENGEN Pharma之Phagotest Kit,利用吞噬荧光标示之大肠杆菌的能力,进行血液中吞噬细胞之活性分析(图3);结果显示(图4),实验组与对照组间无差异。
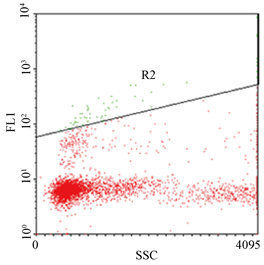
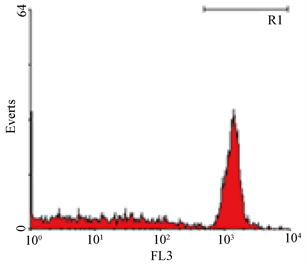 (a) 为吞噬细胞与FITC标帜大肠杆菌于4℃ (阴性对照组)
(a) 为吞噬细胞与FITC标帜大肠杆菌于4℃ (阴性对照组)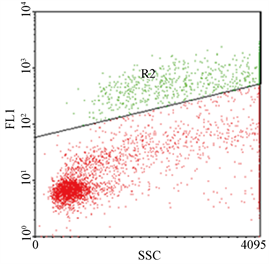
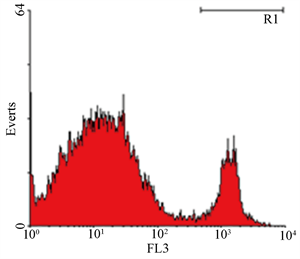 (b) 为于37℃ (实验组)作用10分钟。左边为吞噬活性之散点图,右边为其直方图
(b) 为于37℃ (实验组)作用10分钟。左边为吞噬活性之散点图,右边为其直方图
Figure 3. Phagocytosis determined by flow cytometry
图3. 吞噬试验结果示意图
 Results are presented as mean ± SD (n = 8~10)
Results are presented as mean ± SD (n = 8~10)
Figure 4. Effects of Ac mycelium on Phagocytosis activities of female BALB/c mice
图4. 试验期间樟芝菌丝体对BALB/c小鼠血液吞噬细胞吞噬作用的影响
3.4. 自然杀手细胞毒杀能力的影响
利用DIOC18标示之Yac-1细胞作为目标细胞,以目标细胞:腹腔细胞 = 1:200之比率混合,作用4小时,以流式细胞仪进行分析,检测腹腔细胞中自然杀手细胞毒杀Yac-1的能力;由(图5)可知喂食2XAc剂量的小鼠,其腹腔中自然杀手细胞之活性非常显着地高于对照组(p < 0.01)。
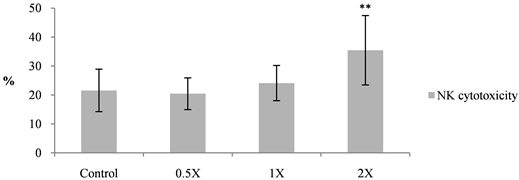 Results are presented as mean ± SD (n = 8 - 10).**represents p < 0.01 (Student’s t-test).
Results are presented as mean ± SD (n = 8 - 10).**represents p < 0.01 (Student’s t-test).
Figure 5. Effects of Ac mycelium on natural killer cell cytotoxicity activities of female BALB/c mice
图5. 试验期间樟芝菌丝体对BALB/c小鼠自然杀手细胞毒杀作用的影响
3.5. 樟芝菌丝体对小鼠抗体量的影响
于第一次免疫后,三剂量组均可非常显着地提升小鼠血中非特异性抗体IgM含量(p < 0.01) (表1);不过,随着追加免疫,各组间之total IgM或total IgG含量及无明显差异。
Table 1. Effect of Ac mycelium on serum antibodies of female BALB/c mice
表1. 试验期间樟芝菌丝体对BALB/c小鼠血清抗体含量的影响
Results are presented as mean ± SD (n = 8 - 10); 1st, 2nd, and 3rd indicated after first ova immunization and second and third boost, respectively; *and **represent p < 0.05 and p < 0.01, respectively (Student’s t-test).
3.6. 脾脏淋巴细胞增生反应的影响
以MTT法进行分析小鼠脾脏淋巴细胞增生反应的影响,结果显示,于ConA刺激下,0.5XAc可显着地促进脾脏T淋巴细胞的增生(图6),较高剂量的1XAc和2XAc则可能因变异较大,因此与对照组间无统计上的差异性。三剂量组间彼此无显着差异。而以特异性抗原ova作为刺激物,与脾脏细胞共同培养,发现1XAc和2XAc剂量可使小鼠脾脏中对ova抗原具有特异性的免疫细胞明显增生。
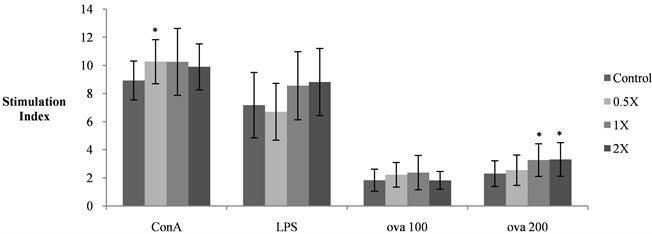 Results are presented as mean ± SD (n = 8 - 10).Ova 100 and ova 200 indicated final concentration of ova (100 or 200 μg/ml) present in culture medium.*and **represent p < 0.05 and <0.01, respectively (Student’s t-test).
Results are presented as mean ± SD (n = 8 - 10).Ova 100 and ova 200 indicated final concentration of ova (100 or 200 μg/ml) present in culture medium.*and **represent p < 0.05 and <0.01, respectively (Student’s t-test).
Figure 6. Effect of Ac mycelium on proliferation of splenocytes of female BALB/c mice
图6. 试验期间樟芝菌丝体对BALB/c小鼠脾脏淋巴细胞增生的影响
3.7. 脾脏细胞分泌细胞激素的影响
脾脏细胞于自发状况、ConA、LPS或特异性抗原ova刺激下,于5% CO2、37℃下培养24或48小时后,收集上清液,分别检测Th1细胞激素IL-2、INF-γ,及Th2细胞激素IL-4、IL-5之分泌量。由表2可知,喂食0.5XAc、1XAc或2XAc剂量之小鼠可显著地提升自发性IL-2及INF-γ的分泌,1XAc及2XAc剂量皆可促进ova特异性IL-2、INF-γ的分泌,2XAc剂量并可促进于ConA刺激下之IL-2、INF-γ的分泌。喂食0.5XAc、1XAc或2XAc剂量之小鼠可使特异性IL-4之分泌量显著降低,对于其他自发性或ConA刺激下Th2细胞激素的分泌量则无影响。
4. 讨论
本试验参照卫生福利部《健康食品免疫调节功能评估方法》,以ova免疫BALB/c小鼠,藉由小鼠体重、抗体、细胞激素、吞噬细胞活性、自然杀手活性等等测试与分析,评估液态发酵所得之樟芝菌丝体粉末对于免疫系统的影响。
4.1. 对非特异性免疫反应的影响
在非特异性免疫功能方面,主要测试颗粒性球与单核球的吞噬能力或是自然杀手细胞的活性,在免疫反应中,吞噬细胞的活化是人体防御系统的第一防线,而对于肿瘤与受病毒感染的细胞,主要还是由自然杀手细胞透过非特异性免疫的结合来对抗 [14],在先前的研究中指出,饮食的改变可以显著的影响自然杀手细胞的活性 [15] ;结果显示,如图5,2XAc剂量组之自然杀手细胞毒杀活性显著高于对照组(p < 0.01),对于血液吞噬细胞吞噬能力则无作用(图4);虽然对吞噬细胞能力的活化并无显着差异,但在2XAc剂量组可以显着增加自然杀手细胞的活性。血清抗体的生成影响方面,喂食樟芝菌丝体可以明显地提升
Table 2. Effects of Ac mycelium on cytokine production of female BALB/c mice
表2. 试验期间樟芝菌丝体对BALB/c小鼠脾脏细胞激素分泌量的影响
Results are presented as mean ± SD (n = 8 - 10); 1X stands for 1-fold dose of Ac which was set at 180 g/pack/day/60-kg person, or 9.675 mg/20-g mouse; * and ** represent p < 0.05 and <0.01, respectively (Student’s t-test).
早期阶段的非特异性血清IgM抗体生成量(p < 0.01) (表1);在初期即显著性的增加IgM的含量,但在中后期则未达到明显差异,推测樟芝菌丝体能够快速地提升血清中抗体,并增加其数量,以抵御外来抗原入侵。在脾脏细胞增生能力方面,低剂量(0.5X)的樟芝菌丝体可以促进脾脏细胞T淋巴细胞在ConA刺激下的增生能力(p < 0.05),高剂量(1XAc及2XAc)则未达统计上的显著差异(图6)。使用裂殖素LPS刺激时,并无显著性差异,表示对脾脏细胞中的B淋巴细胞没有增生作用,但在ConA的刺激下,0.5XAc剂量组相对于对照组具有显著性的差异,表示具有提升脾脏细胞中T淋巴细胞的增生能力。T淋巴细胞具有多种形态及功能,Th1 (cell-mediated immunity)可与单核吞噬细胞交互作用并帮助消灭病原,Th2 (cell-mediated immunity)可协助B细胞分裂、分化及制造抗体;过去研究指出,当身体处于压力状态下,体内的免疫反应会从Th1转成以Th2为主 [16],而过度抑制Th1细胞免疫功能,将造成致死率徒增 [17] [18],唯有身体内Th1及Th2相互作用维持平衡,才能共同维护身体免外来者的入侵 [19]。在脾脏细胞细胞激素之分泌量,测试Th1细胞激素IFN-γ & IL-2,Th2细胞激素IL-4 & IL-5 [20],如表2所示,当未添加任何裂殖素时,喂食樟芝菌丝体可显著增加了Th1细胞激素IL-2和IFN-γ的量,2XAc剂量并可提升ConA刺激下的IL-2和IFN-γ的分泌量(p < 0.05)。由非特异性免疫反应细胞激素分泌量之结果可知,樟芝菌丝体可促进Th1细胞激素IFN-γ & IL-2的分泌,IFN-γ & IL-2具有活化毒杀型T细胞、自然杀手细胞和B细胞的作用 [21] [22],推测喂食樟芝菌丝体的小鼠,其脾脏细胞IFN-γ & IL-2分泌量升高可能因此进而影响自然杀手细胞的活性。
4.2. 对特异性免疫反应的影响
特异性免疫反应是以ova作为特定的抗原,仿真病毒、微生物或外来物质感染的模式,在血清抗体生成的影响方面,特异性血清抗体anti-ova IgG的量在第二次致敏之后大幅的增加,不过喂食樟芝菌丝体并无法进一步促进雌性BALB/c小鼠之特异性血清抗体生成(表1)。在脾脏细胞增生能力方面,ova主要是刺激抗原专一性T细胞的活性,试验结果发现,如图6所示,在ova刺激脾脏细胞增生能力的影响中,在1XAc及2XAc剂量组具有显著性的提升(p < 0.05),说明樟芝菌丝体具有刺激特异性免疫细胞的增生作用。在脾脏细胞ova特异性细胞激素之分泌量,测试Th1细胞激素IFN-γ &IL-2,Th2细胞激素IL-4 &IL-5;结果显示,1XAc及2XAc剂量组的IL-2和IFN-γ生成量皆显著地增加,而其IL-4量则是减少的(p < 0.05) (表2)。
5. 结论
综合以上,皆证实樟芝菌丝体具有免疫调节功能。BALB/c小鼠经过8周喂食0.5倍、1倍及2倍剂量的樟芝菌丝体后,在非特异性免疫方面可增加自然杀手细胞活性及抗原IgM初期含量,以ConA刺激后可提升脾脏细胞的增生能力,并促进Th1细胞激素IFN-γ & IL-2的分泌;特异性免疫方面则是在ova的刺激下,可使Th1细胞激素中IFN-γ &IL-2的分泌量显著提高,且可降低Th2细胞激素IL-4的含量。先前研究显示,当生物体受到了病毒、微生物或外来物质侵害感染时,抗原呈现细胞及巨噬细胞等免疫细胞就会被活化,并使体内的免疫反应倾向于Th1免疫反应 [23] [24],本研究在经过非特异性及特异性的免疫反应结果中得知,樟芝菌丝体是倾向于增加Th1免疫反应的表现。
文章引用
林定威,林俊仁,陈秀雯,张晓苓,陈劲初. 评估液态发酵樟芝菌丝体粉末之免疫调节功能
Evaluation of Immunomodulatory Effect of Powdered Antrodia cinnamomea in Submerged Culture[J]. 食品与营养科学, 2020, 09(01): 17-27. https://doi.org/10.12677/HJFNS.2020.91003
参考文献
- 1. Chang, T.T. and Chou, W.N. (1995) Antrodia cinnamomea sp. nov. on Cinnamomum kanehirai in Taiwan. Mycological Research, 99, 756-758.
https://doi.org/10.1016/S0953-7562(09)80541-8 - 2. 陈劲初. 樟芝为元气之宝最新版[M]. 台北: 元气斋出版社有限公司, 2010.
- 3. Lu, M.C., El-Shazly, M., Wu, T.Y., Du, Y.C., Chang, T.T., Chen, C.F., Hsu, Y.M., Lai, K.H., Chiu, C.P., Chang, F.R. and Wu, Y.C. (2013) Recent Research and Development of Antro-dia cinnamomea. Pharmacology & Therapeutics, 139, 124-156.
https://doi.org/10.1016/j.pharmthera.2013.04.001 - 4. Roilides, E., Kontoyiannis, D.P. and Walsh, T.J. (2012) Host Defenses against Zygomycetes. Clinical Infectious Diseases, 54, S61-S66.
https://doi.org/10.1093/cid/cir869 - 5. Calder, P.C. and Kew, S. (2002) The Immune System: A Target for Functional Foods? British Journal of Nutrition, 88, S165-S176.
https://doi.org/10.1079/BJN2002682 - 6. Kuroda, E., Coban, C. and Ishii, K.J. (2013) Particulate Adjuvant and Innate Immunity: Past Achievements, Present Findings, and Future Prospects. International Reviews of Immunology, 32, 209-220.
https://doi.org/10.3109/08830185.2013.773326 - 7. 行政院卫生福利部. 健康食品之免疫调节功能评估方法. 1999.
- 8. Krzych, U., Thurman, G.B., Goldstein, A.L., Bressler, J.P. and Strausser, H.R. (1979) Sex-Related Immu-nocompetence of BALB/c Mice. I. Study of Immunologic Responsiveness of Neonatal, Weanling, and Young Adult Mice. The Journal of Immunology, 123, 2568-2574.
- 9. Belisle, E.H. and Strausser, H.R. (1981) Sex-Related Immu-nocompetence of BALB/C Mice: II. Study of Immunologic Responsiveness of Young, Adult and Aged Mice. Deve-lopmental & Comparative Immunology, 5, 661-670.
https://doi.org/10.1016/S0145-305X(81)80040-7 - 10. Melgert, B.N., Postma, D.S., Kuipers, I., Geerlings, M., Luinge, M.A., van der Strate, B.W., Kerstjens, H.A., Timens, W. and Hylkema, M.N. (2005) Female Mice Are More Susceptible to the Development of Allergic Airway Inflammation than Male Mice. Clinical & Experimental Allergy, 35, 496-503.
https://doi.org/10.1111/j.1365-2222.2005.02362.x - 11. Chen, M.L. (2000) Methodology of Evaluating the Immunomodulation of Ganoderma tsuga by Peritoneal Exudate Cell from BALB/c Mice. Master Thesis, Department of Agriculture Chemistry, National Taiwan University, Taipei.
- 12. Yoshimura, T., Kurita, C., Hayata, M. and Nagai, H. (1993) Diagnosis of Drug Allergy by the Lymphocyte Stimulation Test with the MTT [3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyl tetrazolium bromide] Assay. Biological and Pharmaceutical Bulletin, 16, 686-689.
https://doi.org/10.1248/bpb.16.686 - 13. 劉昌孝, 孙瑞元. 药物评价实验设计与统计学基础[M]. 北京: 军事医学科学出版社, 1999: 19-20.
- 14. Chen, M.L., Lin, J.Y. and Lin, B.F. (2006) The Immunomodulatory Effects of Ganoderma tsugae Supplementation on Immune Responses of BALB/c Mice. Taiwan Journal of Agricultural Chemistry and Food Science, 44, 243-249.
- 15. Wu, W.M., Chiang, B.L., Chang, S.C. and Lin, B.F. (2001) Dietary Fish Oil Increases CD8+ T-Cells and Decreases Autoreactive T-Cell Activity in Autoimmune NZB/W F1 Mice. Journal of Mi-crobiology, Immunology and Infection, 34, 41-49.
- 16. Decker, D., Schondorf, M., Bildingmaier, F., Himer, A. and Von, R.A.A. (1996) Surgical Stress Induces a Shift in the Type-1/Type-2 T-Helper Cell Balance, Suggesting Down-Regulation of Cell-Mediated and Up-Regulation of Antibody-Mediated Immunity Commensurate to the Trauma. Surgery, 119, 316-325.
https://doi.org/10.1016/S0039-6060(96)80118-8 - 17. Ayala, A., Deol, Z.K., Lehman, D.L., Herdon, C.D. and Chaudry, I.H. (1994) Polymicrobial Sepsis But Not Low-Dose Endotoxin Infusion Causes Decreased Splenocyte IL-2/IFN-Gamma Release While Increasing IL-4/IL-10 Production. Journal of Surgical Research, 56, 579-585.
https://doi.org/10.1006/jsre.1994.1092 - 18. O’sullivan, S.T., Lederer, J.A., Horgan, A.F., Chin, D.H., Mannick, J.A. and Rodrick, M.L. (1995) Major Injury Leads to Predominance of the T Helper-2 Lymphocyte Phenotype and Diminished Interleukin-12 Production Associated with Decreased Resistance to Infection. Annals of Surgery, 222, 482-490.
https://doi.org/10.1097/00000658-199522240-00006 - 19. DiPiro, J.T. (1997) Cytokine Networks with Infection: Mycobacterial Infections, Leishmaniasis, Human Immunodeficiency Virus Infection, and Sepsis. Pharmacotherapy, 17, 205-223.
- 20. Minato, N., Reid, L. and Bloom, B.R. (1981) On the Heterogeneity of Murine Natural Killer Cells. Journal of Experimental Medicine, 154, 750-762.
https://doi.org/10.1084/jem.154.3.750 - 21. Henny, C.S., Ku-ribayashi, K., Kern, D.E. and Gillis, S. (1981) Interleukin-2 Augments Natural Killer Cell Activity. Nature, 291, 335-338.
https://doi.org/10.1038/291335a0 - 22. Taniguchi, T., Matsui, H., Fujita, T., Hatakeyama, M., Kashima, N., Fuse, A., Hamuro, J., Nishi-Takaoka, C. and Yamada, G. (1986) Molecular Analysis of the Interleukin-2 System. Immunological Reviews, 92, 121-133.
https://doi.org/10.1111/j.1600-065X.1986.tb01497.x - 23. Romagnani, S. (1992) Induction of TH1 and TH2 Responses: A Key Role for the “Natural” Immune Response? Immunology Today, 13, 379-381.
https://doi.org/10.1016/0167-5699(92)90083-J - 24. Kar, S., Sharma, G. and Das, P.K. (2011) Fucoidan Cures Infection with Both Antimony-Susceptible and Resistant Strains of Leishmania donovani through Th1 Response and Macrophage-Derived Oxidants. Journal of Antimicrobial Chemotherapy, 66, 618-625.
https://doi.org/10.1093/jac/dkq502
NOTES
*通讯作者。
