Bioprocess
Vol.06 No.01(2016), Article ID:17112,7
pages
10.12677/BP.2016.61003
Determination of DHA-ME in Seaweed Oil by HPLC
Fengshan Cai1, Lin Zhang1,2, Shikai Wu1,2*
1Guangdong Key Laboratory of Membrane Materials and Membrane Separation, Guangzhou Institute of Advanced Technology, Chinese Academy of Science, Guangzhou Guangdong
2Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen Guangdong

Received: Feb. 19th, 2016; accepted: Mar. 6th, 2016; published: Mar. 11th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
A method was developed for the determination of methyl-DHA in seaweed oil by high performance liquid chromatography (HPLC). The HPLC separation conditions were as follows: an Agilent Eclipse XDB-C18 column (150 mm × 4.6 mm, 5 μm) and elution with acetonitrile-water (v:v = 92:8), UV dection wavelength at 205 nm, 1.0 mL/min of flow rate for mobile phases. On the above conditions, good linearity was found over a concentration range of 10 - 500 μg/mL for methyl-DHA. Linear regression equation was y = 2.586 × 103x + 5.927 × 103 (r2 = 1). The average recovery rate was 94.23% (RSD = 7.01%). The average detection of methyl-DHA in seaweed oil was 7.3876 mg/g. This method was simple, rapid and high reproducibility; it can be used for the detection of methyl-DHA in seaweed oil.
Keywords:DHA-ME, Seaweed Oil, HPLC

高效液相色谱法测定海藻油中的DHA甲酯
蔡凤珊1,张 琳1,2,吴世凯1,2*
1广州中国科学院先进技术研究所,广东省膜材料与膜分离重点实验室,广东 广州
2中国科学院深圳先进技术研究院,广东 深圳

收稿日期:2016年2月19日;录用日期:2016年3月6日;发布日期:2016年3月11日

摘 要
目的:建立高效液相色谱法分离测定海藻油样品中的二十二碳六烯酸甲酯(DHA甲酯)含量的方法。方法:采用Agilent Eclipse XDB-C18色谱柱(150 mm × 4.6 mm, 5 μm),以乙腈-水(92:8)溶液为流动相,流速为1.0 mL/min,检测波长205 nm。结果:DHA甲酯在10~500 μg/mL的范围内呈良好线性,线性回归方程为y = 2.586 × 103x + 5.927 × 103 (r2 = 1),平均回收率为94.23%,相对标准偏差为7.01%,海藻油中DHA-甲酯的平均含量为7.3876 mg/g。结论:本检测方法简便、快速、重现性好,可用于海藻油样品中DHA甲酯含量的测定。
关键词 :DHA甲酯,海藻油,高效液相色谱

1. 引言
海藻油是一种从海洋藻类脂肪中精炼而成的纯植物保健食品,多以不饱和脂肪酸为主[1] -[3] 。研究表明,海藻油中含有较多的ω-3系多烯不饱和脂肪酸(PUFA),包括二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA) [3] - [8] 。DHA是哺乳动物生长、发育和繁殖的必须脂肪酸,但是难以在体内合成,主要依赖于鱼油和海藻油的补充摄食 [9] - [14] 。Ryan和Symington发现海藻油可代替鱼油作为DHA的补充来源 [14] 。与鱼油相比,海藻油含有的大量植物性DHA [7] ,抗氧化能力强,结构较稳定,并且容易被吸收 [4] - [6] [10] ,是大众喜爱的保健品和营养品。近年来,随着大众保健意识的增强和对海藻油的进一步认识,海藻油中EPA和DHA的开发和应用受到广泛最关注。
目前有关测定油脂中EPA和DHA的方法较多,Ryan和Symington采用气相色谱法分析样品中人体血液样品中的脂肪酸 [14] 。许艳萍等采用气相色谱-质谱法测定分析鱼卵鱼油中的脂肪酸组成 [15] 。蒋跃辉则用毛细管气相色谱法测定鱼油脂肪乳注射液中DHA和EPA含量 [16] 。DHA属于长链脂肪酸,不易气化,高温条件对DHA的稳定性有很大影响 [9] [17] ,且气相色谱法稳定性差,灵敏度欠佳,衍生重现性略差 [15] 。高效液相色谱法(HPLC)可以在温和的条件下检测样品DHA的含量 [18] 。晋文慧等采用超高效液相色谱法分析测定了藻油中的DPA和DHA [8] 。赵玉生等采用超高效液相色谱法测定油脂中脂肪酸的组成 [19] 。本试验建立了HPLC检测分析海藻油中DHA甲酯的方法,该方法操作简便、分离度良好,准确度、精密度均符合要求,可用于油脂样品的DHA含量的测定。
2. 仪器与材料
2.1. 仪器
Agilent 1260高效液相色谱仪,AR2140电子分析天平,RE52CS旋转蒸发仪,KQ2200超声波清洗仪,HH-4数显恒温水浴锅。
2.2. 试剂
DHA-甲酯标准品购自美国Sigma公司;甲醇、乙腈、正己烷等均为色谱纯;其它试剂均为分析纯。
3. 方法
3.1. 色谱条件
色谱柱:Agilent Eclipse XDB-C18 (150 mm × 4.6mm, 5 μm);流动性:乙腈-水(92:8);检测波长:205 nm;流速:1.0 mL/min,柱温:30℃,进样量:5 μL。
3.2. 标准样品制备
准确称取10 mg DHA甲酯标准样品于10 mL容量瓶中,甲醇定容,摇匀备用,所得标准品浓度为1 mg/mL。
3.3. 样品处理和甲酯化 [17]
碱处理:准确称取海藻油样品0.2 g于50 mL具塞比色管中,加入10 mL 0.5 mol/mL的KOH-甲醇溶液振摇,在60℃水浴上加热回流40 min至油滴消失,冷却至室温,然后加入10 mL正己烷,超声萃取40 min,加入10 mL去离子水,摇匀,静置分层,取上清液于3000 r/min下离心5 min,取上清液挥干溶剂,微孔滤膜过滤后,取续滤液作为供试品溶液。
酸碱结合处理:称取海藻油样品0.2 g,加入2 mL 20%的KOH-甲醇溶液,在70℃水浴加热30 min,取出加入适量的去离子水,再加入盐酸中和。加2 mL正己烷提取,取出上清液后再用1 mL正己烷洗涤一次,上清液合并、蒸干。再加入2 mL 1%硫酸–甲醇于70℃水浴30 min,取出后加入2 mL正己烷,再加蒸馏水至瓶颈,取出上清液,再加入1 mL正已烷,洗一次,合并上清液待测。
酸处理:称取海藻油样品0.2 g加入2.5 mol/L硫酸-甲醇10 mL,于70℃水浴加热30 min,加入2 mL正己烷提取甲酯化产物,取出上清,下层再用1 mL正己烷洗涤摇匀,静置分层,上清液合并于3000 r/min下离心5 min,取上清液挥发溶剂,微孔滤膜过滤后,取续滤液作为供试品溶液。
4. 结果与分析
4.1. 样品前处理的选择
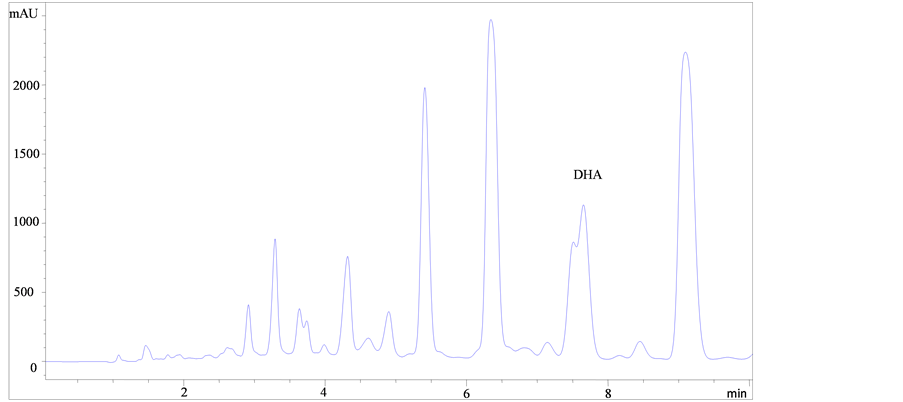
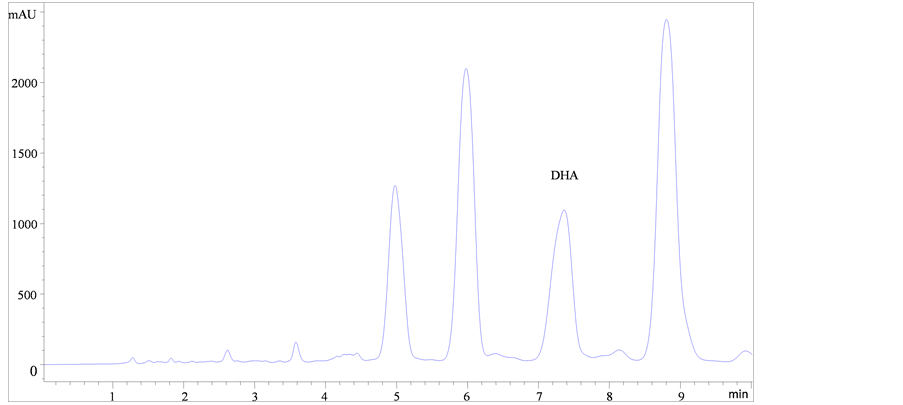
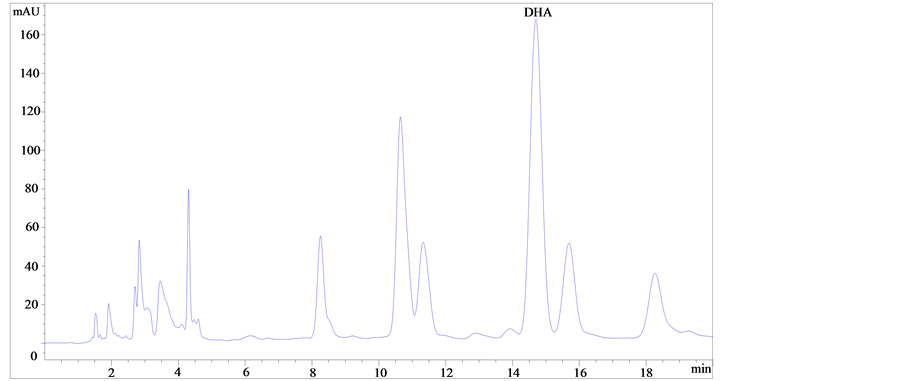
海藻油样品甲酯化后结果如图1所示。
如图1所示,比较图(a)、(b)和(c)可知,图(a)和图(b)中DHA甲酯峰中均有未完全分离的杂质峰;而图(c),酸处理后DHA甲酯峰与杂质峰能达到基线分离、峰形美观对称,表明酸处理时DHA甲酯的分离度以及响应值的效果最好。由图(c)、(d)和(e)可知,酸处理条件下改变不同的流动相时发现,当流动相甲醇-水为85:15 (V/V)时,峰形对称美观,但与杂质峰分离不完全;当流动相乙腈–水为90:10 (V/V)时DHA甲酯峰与杂质峰不能完全分离;当流动相乙腈-水为92:8 (V/V)时DHA甲酯的分离效果最好,可获得理想的DHA甲酯与杂质达到完全分离的图谱。
4.2. 标准曲线的绘制
取含DHA甲酯不同浓度的标准溶液,按照3.1色谱条件进样,测定峰面积响应值,以DHA甲酯浓度为横坐标,峰面积为纵坐标,得到DHA甲酯的线性方程。结果表明:y = 2.586 × 103x + 5.927 × 103 (r2 = 1),线性范围为10~500 μg/ mL。
4.3. 精密度试验
取同一供试品溶液,按3.1色谱条件连续进样6次。如表1所示,DHA甲酯峰面积的相对标准偏差为0.43%,表明仪器精密度良好。
 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)
(d)
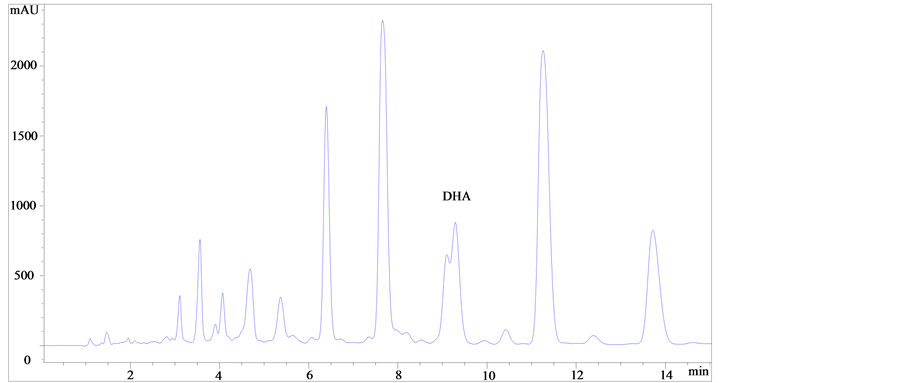 (e)注:(a):乙腈–水(92:8, V/V),碱处理;(b):乙腈–水(92:8, V/V),酸碱结合处理;(c):乙腈–水(92:8, V/V),酸处理;(d):甲醇–水(85:15, V/V),酸处理;(e):乙腈–水(90:10, V/V),酸处理。 Note: (a): Acetonitrile-Water (92:8,V/V), Alkali treatment; (b): Acetonitrile-Water (92:8, V/V), Acid-alkali treatment; (c): Acetonitrile-Water (92:8, V/V), Acid treatment; (d): Methanol-Water (85:15, V/V), Acid treatment; (e): Acetonitrile-Water (90:10, V/V), Acid treatment.
(e)注:(a):乙腈–水(92:8, V/V),碱处理;(b):乙腈–水(92:8, V/V),酸碱结合处理;(c):乙腈–水(92:8, V/V),酸处理;(d):甲醇–水(85:15, V/V),酸处理;(e):乙腈–水(90:10, V/V),酸处理。 Note: (a): Acetonitrile-Water (92:8,V/V), Alkali treatment; (b): Acetonitrile-Water (92:8, V/V), Acid-alkali treatment; (c): Acetonitrile-Water (92:8, V/V), Acid treatment; (d): Methanol-Water (85:15, V/V), Acid treatment; (e): Acetonitrile-Water (90:10, V/V), Acid treatment.
Figure 1. Chromatogram of some samples.
图1. 部分样品色谱图
Table 1. The accuracy, stability and repeatability of HPLC
表1. 仪器精密度、稳定性和重复性试验
Table 2. Result of sample recoveries
表2. 样品回收率测定结果
4.4. 稳定性试验
取同一新鲜制备的供试品溶液,按照3.1色谱条件,分别在0、4、8、12、16、24 h进样分析,记录各自峰面积,计算DHA甲酯的峰面积,如表1所示,DHA甲酯峰面积的RSD为0.23%,表明供试品溶液在24 h内稳定。
4.5. 重复性试验
取同一供试品溶液6份,按照3.1色谱条件,计算含量,如表1所示,DHA甲酯峰面积的RSD为0.93%,表明此方法重复性较好。
4.6. 加样回收率试验
如表2所示,取不同含量的海藻油样品6份,加入一定量的DHA甲酯后测试,结果表明DHA甲酯的加标回收率为94.23%,RSD为7.01%,表明加标回收率良好。与晋文慧等 [16] 人的结果相比DHA甲酯的回收率偏低,可能是因为海藻油样品为粗提样,杂质较多干扰了测试结果。
4.7. 样品测定
取3份海藻油样品,分别按照3.1色谱条件进行测定,测得海藻油样品的DHA甲酯平均含量为7.3876 mg/g。
5. 结论
本试验采用高效液相色谱法对海藻油中的DHA进行分离,使用外标法准确测定DHA甲酯的含量。本方法快速准确,分离效果理想,并有较好重现性,为海藻油研究与开发提供一种快速有效的测试方法。
基金项目
深圳市技术创新计划技术开发项目[20140424111431];广东省产学研重点项目[2013B091300015]。
文章引用
蔡凤珊,张琳,吴世凯. 高效液相色谱法测定海藻油中的DHA甲酯
Determination of DHA-ME in Seaweed Oil by HPLC[J]. 生物过程, 2016, 06(01): 17-23. http://dx.doi.org/10.12677/BP.2016.61003
参考文献 (References)
- 1. 蒋晓菲, 周红茹, 金青哲, 等. 微藻油脂制取技术的研究进展[J]. 中国油脂, 2012, 37(10): 62-66.
- 2. 刘圣臣, 邹宁, 孙杰, 等. 小球藻中海藻油的提取工艺研究[J]. 食品科学, 2009, 30(8): 120-123.
- 3. Wang, S., Wang, Q., Jiang, X.M., et al. (2013) Compositional Analysis of Bio-Oil Derived from Pyrolysis of Seaweed. Energy Conversion and Management, 68, 273-280. http://dx.doi.org/10.1016/j.enconman.2013.01.014
- 4. 王嵩. 海藻油中分离纯化多烯脂肪酸的研究[D]: [硕士学位论文]. 天津: 天津大学, 2008.
- 5. López-González, D., Puig-Gamero, M., Acién, F.G., García-Cuadra, F., Valverde, J.L. and Sanchez-Silva, L. (2015) Energetic, Economic and Environmental Assessment of the Pyrolysis and Combustion of Microalgae and Their Oils. Renewable and Sustainable Energy Reviews, 51, 1752-1770. http://dx.doi.org/10.1016/j.rser.2015.07.022
- 6. Xie, Q.L., Addy, M., Liu, S.Y., et al. (2015) Fast Microwave-Assisted Catalytic Co-Pyrolysis of Microalgae and Scum for Bio-Oil Production. Fuel, 160, 577-582. http://dx.doi.org/10.1016/j.fuel.2015.08.020
- 7. 陈殊贤, 郑晓辉. 微藻油和鱼油中DHA的特性及应用研究进展[J]. 食品科学, 2013, 34(21): 439-444.
- 8. 晋文慧, 陈伟珠, 洪专, 等. 超高效液相色谱法测定藻油中的DPA和DHA[J]. 食品工业科技, 2014, 35(9): 278-281.
- 9. 曹万新, 孟橘, 田玉霞. DHA 的生理功能及应用研究进展[J]. 中国油脂, 2011, 36(3): 1-4.
- 10. 牟志春, 张建武. 毛细管气相色谱法测定进口鱼油保健品中EPA、DHA含量[J]. 中国国境卫生检疫杂志, 2008, 21(16): 332-333.
- 11. 洪滨, 刘会洲. 国内EPA及DHA研究现状和发展趋势[J]. 过程工程学报, 2006, 19(21): 380-381.
- 12. 刘爱琴, 罗超杰, 孙晓霞, 等. 气相色谱法测定鱼油微胶囊中EPA和DHA的含量[J]. 中国食品添加剂, 2010(4) : 273-276.
- 13. 李庆民, 陈桂范, 高实, 等. 气相色谱外标法测定鱼油中EPA和DHA的含量[J]. 沈阳药科大学学报, 2006, 13(14): 259-260.
- 14. Ryan, L. and Symington, A.M. (2015) Algal-Oil Supplements Are a Viable Alternative to Fish-Oil Supplements in Terms of Docosahexaenoic Acid (22: 6n-3; DHA). Journal of Functional Foods, 19B, 852-858.
- 15. 许艳萍, 梁鹏, 陈丽娇, 等. 超临界萃取鱼卵鱼油及其脂肪酸组成的研究[J]. 食品科技, 2015, 40(10): 270-274.
- 16. 蒋跃辉. 毛细管气相色谱法测定鱼油脂肪乳注射液中DHA和EPA的含量[J]. 中国当代医药, 2012, 19(13): 71-72.
- 17. 寇秀颖, 于国萍. 脂肪和脂肪酸甲酯化方法的研究[J]. 食品研究与开发, 2005, 26(2): 46-47.
- 18. 袁美娟, 薛文通. 高效液相色谱在分析油脂成分方面的应用[J]. 食品科技, 2012, 37(1): 260-263.
- 19. 赵玉生, 陈翔, 王瑛瑶, 等. 超高效液相色谱法测定油脂中脂肪酸的组成与分布[J]. 中国油脂, 2009, 34(5): 64-68.
*通讯作者。
