Medical Diagnosis
Vol.
13
No.
04
(
2023
), Article ID:
77248
,
10
pages
10.12677/MD.2023.134061
2型糖尿病患者腹腔内脂肪组织中Rev-erbα 表达的变化
胡月梅
扬州大学校医院,江苏 扬州
收稿日期:2023年10月20日;录用日期:2023年12月8日;发布日期:2023年12月15日

摘要
研究背景及目的:Rev-erbα是以血红素为生理配体的核受体超家族之一。研究表明,Rev-erbα可调节机体的生物钟节律、糖脂代谢及炎症反应等,从而对生物体多种代谢性疾患及炎症性疾病的发生发展有重要影响。结合Rev-erbα在大鼠脂肪组织中的表达变化,本实验将结合临床研究Rev-erbα在2型糖尿病患者腹腔内脂肪组织中的表达水平,从而进一步探索并证实Rev-erbα对2型糖尿病发生发展的影响。方法:将受试者分为3组:对照组(非超重/肥胖非2型糖尿病)、超重/肥胖组(BMI ≥ 25 kg/m2的非2型糖尿病者)及2型糖尿病组。记录并测量三组受试者的人体学参数和生化学指标,包括性别、年龄、体重指数(BMI)、颈围(NC)、腰围(WC)、臀围(HC)、腰臀比(WHR)、谷丙转氨酶(ALT)、谷草转氨酶(ASL)、肌酐(SCr)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)。通过实时定量PCR (RT-PCR)和Western blot分别检测腹腔内脂肪组织中Rev-erbα的mRNA和蛋白表达水平,并采用ANOVA统计方法分析三组受试者Rev-erbα表达水平的差异。结果:1) 对照组、超重/肥胖组、2型糖尿病组三组受试者一般情况对比结果。三组受试者性别、年龄及ALT、ASL、SCr、HDL-C、LDL-C、TG实验室检查指标对比无明显统计学差异;三组受试者FPG对比,2型糖尿病组明显高于超重/肥胖组及对照组(p < 0.05);而对照组与超重/肥胖组对比无明显统计学差异;三组受试者BMI、NC、WC、WHR对比,超重/肥胖组明显高于其他两组(p < 0.05);超重/肥胖组的HC明显高于对照组(p < 0.05),但与2型糖尿病组对比无明显统计学差异;2型糖尿病组受试者BMI、NC、WC、HC、WHR与对照组对比无明显统计学差异。2) 对照组、超重/肥胖组、2型糖尿病组三组受试者腹腔内脂肪组织中Rev-erbα的mRNA转录水平及蛋白表达水平对比结果。三组受试者对比,2型糖尿病组腹腔内脂肪组织中Rev-erbα的mRNA转录水平明显高于对照组(p < 0.05),而Rev-erbα的蛋白表达水平也显著高于对照组(p < 0.01);而对照组和超重/肥胖组之间,以及超重/肥胖组与2型糖尿病组之间mRNA转录水平和Rev-erbα的蛋白表达水平均无明显统计学差异。结论:Rev-erbα在2型糖尿病患者腹腔内脂肪组织中表达增加,提示Rev-erbα可能与2型糖尿病的发生发展相关。
关键词
Rev-erbα,2型糖尿病,脂肪组织

Expression Change of Rev-erbα in the Intraperitoneal Adipose Tissue of Patients with Type 2 Diabetes
Yuemei Hu
Yangzhou University Hospital, Yangzhou Jiangsu
Received: Oct. 20th, 2023; accepted: Dec. 8th, 2023; published: Dec. 15th, 2023

ABSTRACT
Background and Objective: Rev-erbα is one of the nuclear receptor superfamily with heme as its physiologic ligand. Studies reveal that Rev-erbα regulates circadian clock, glucolipid metabolism, inflammatory reaction, etc. Therefore, Rev-erbα has a great impact on the occurrence and development of various metabolic diseases and inflammatory diseases. Based on the change of expression of Rev-erbα in adipose tissue of rats, this study will combine with clinical to research expression change of Rev-erbα in intraperitoneal adipose tissue of patients with type 2 diabetes, so as to further explore and prove the influence of Rev-erbα on the occurrence and development of type 2 diabetes. Methods: Subjects were divided into 3 groups: control group (non-overweight/obese non-type 2 diabetes), overweight/obese group (non-type 2 diabetes with BMI ≥ 25 kg/m2) and type 2 diabetes group. Recording and measuring the three groups of subjects of human learning parameters and biochemical indexes, including gender, age, body mass index (BMI), neck circumference (NC), waist circumference (WC), hip circumference (HC), waist-hip ratio (WHR), alanine aminotransferase (ALT), aspartate aminotransferase (ASL), creatinine (SCr), high-density lipoprotein cholesterol (HDL-C), low-density lipoprotein cholesterol (LDL-C), and triglyceride (TG). The mRNA and protein expression levels of Rev-erbα in the intraperitoneal adipose tissue were detected by real-time quantitative PCR (RT-PCR) and Western blot, and ANOVA statistical method was used to analyze the differences in expression levels of Rev-erbα in the three groups. Results: 1) Comparison of the general conditions of the subjects in the control group, the overweight/obese group and the type 2 diabetes group. There was no significant difference in gender, age, ALT, ASL, SCr, HDL-C, LDL-C and TG among the three groups. In the three groups, the FPG of the type 2 diabetes group was significantly higher than that in the overweight/obese group and in the control group (p < 0.05). There was no statistical difference between the control group and the overweight/obese group. BMI, NC, WC, and WHR were significantly higher in the overweight/obese group than the other two groups (p < 0.05). Though HC is higher in the overweight/obese group than the control group (p < 0.05), there was no significant difference between the overweight/obese group and the type 2 diabetes group. There was no statistically significant difference in BMI, NC, WC, HC and WHR between the type 2 diabetes group and the control group. 2) Comparison results of mRNA transcription level and protein expression level of Rev-erbα in the intraperitoneal adipose tissue of subjects in the control group, the overweight/obese group and the type 2 diabetes group. The mRNA transcription level of Rev-erbα in the intraperitoneal adipose tissue of the type 2 diabetes group was higher than the control group (p < 0.05), and the protein expression level of Rev-erbα was highest in the type 2 diabetes group (p < 0.01). However, there was no statistically significant difference in mRNA transcription and protein levels between the control group and the overweight/obese group, or between the overweight/obese group and the type 2 diabetes group. Conclusion: Rev-erbα is highly expressed in the intraperitoneal adipose tissue of the type 2 diabetes group, which suggests that Rev-erbα may be associated with the occurrence and development of type 2 diabetes.
Keywords:Rev-erbα, Type 2 Diabetes, Adipose Tissue

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
糖尿病是一种由多病因引起的以慢性高血糖为特征的代谢性疾病,由于疾病复杂,其病因和发病机理至今尚未完全明确。目前认为 [1] 致使患者出现高血糖的原因主要有两个方面:胰岛素分泌异常和胰岛素作用缺陷。长期血糖代谢异常、高血糖状态终致患者出现心、脑、肾、血管、神经等多器官系统的代谢异常,导致多种代谢性疾病的发生发展,是危害人类健康的重大公共卫生问题 [2] [3] [4] [5] 。
据国际糖尿病联盟(International Diabetes Federation, IDF)统计 [6] ,至2030年,全世界成人2型糖尿病人数将增至5.52亿,其新增糖尿病患者将主要集中于低、中等收入国家。与此相符,世界卫生组织于2011年统计预测 [7] ,至2030年,全球糖尿病患者人数将增至4.39亿,且80%以上患者为低、中等收入国家人群。糖尿病的发病率显著增加。近40年来,随着我国经济的高速发展、肥胖率的上升、人口老龄化以及生活方式逐渐西方化,我国糖尿病的患病率也呈快速增长趋势,据统计 [6] ,目前我国糖尿病患病率已跃居世界第一。2010年,Yang等 [8] 调查显示,我国成年人糖尿病患者率已达9.7%,而糖尿病前期患病率高达15.5%,若以此推算,我国成人糖尿病患者数已达9240万,而糖尿病前期患者数已高达1.482亿,糖尿病俨然已经成为我国重要的公共健康问题,亟待制定有效措施预防及延缓糖尿病的进展。
现国际上通用世界卫生组织WHO糖尿病专家委员会提出的糖尿病分型标准(1990)包括:1型糖尿病(免疫介导性、特发性)、2型糖尿病、其他特殊类型糖尿病(胰岛β细胞功能的基因缺陷、胰岛素作用的基因缺陷、胰腺外分泌疾病、内分泌疾病、药物或化学品所致的糖尿病、感染、不常见的免疫介导性糖尿病、其他与糖尿病相关的遗传综合征)、妊娠糖尿病;其中2型糖尿病发病率最高,达90%~95%,可导致患者并发冠心病、脑卒中、肾衰竭、失明甚至截肢至残。尽管目前临床治疗糖尿病的药物种类众多,但患者治疗依从性差,糖尿病酮症酸中毒、高血糖高渗综合征、感染、糖尿病微血管及大血管病变、糖尿病神经病变、糖尿病足等仍不断发生,故探明并制定针对糖尿病具体病因及发病机制的治疗措施尤为重要。
Rev-erbα是核内受体超家族成员中的一员,由Lazar等 [9] 于1989年首次在大鼠垂体瘤细胞(GH3细胞)内发现,其基因定位于17q21.1,约7.9 kb,血红素(heme)是它的生理性配体。
大量研究显示 [10] ,Rev-erbα在机体多种组织器官内均有表达,其中代谢旺盛的区域如:肝脏、脂肪、骨骼肌、心脏,大脑等含量丰富,其 [11] [12] [13] [14] 尚可调节生物节律、糖脂代谢、炎症反应、胰岛功能、线粒体功能、脂肪细胞分化等,从而与糖尿病、代谢综合征、动脉粥样硬化等代谢性疾患的发生发展相关。生物钟核心基因BMAL1和CLOCK是Rev-erbα的直接靶基因,可上调Rev-erbα的表达;目前Rev-erbα与糖脂代谢相关性的研究甚多,Laitinen等 [15] 就发现Rev-erbα不仅可调节脂质代谢,尚可影响脂肪细胞分化,过氧化物酶增殖物激活受体γ,是调节脂肪细胞分化及胰岛素敏感性的一类核受体,其和维甲酸核内受体α形成的二聚体可与Rev-erbα启动子区的RevDR-2序列特异性结合而上调Rev-erbα的表达,进而促进3T3-L1前脂肪细胞向成熟脂肪细胞的分化;而张蕊 [16] 研究发现,Rev-erbα与大鼠糖尿病的发生发展可能存在相关性。其研究结果证实,随着糖尿病病程的增加,糖尿病大鼠模型(GK大鼠)脂肪组织中Rev-erbα的mRNA转录水平及蛋白表达水平均较正常Wistar大鼠高,且Rev-erbα的表达节律也出现异常,但给予GK大鼠行RYGB手术使得大鼠糖代谢得到改善后,Rev-erbα的异常表达节律也同样改善。为进一步研究Rev-erbα与糖尿病的相关性,本课题将结合临床,研究2型糖尿病患者腹腔内脂肪组织中Rev-erbα的表达变化,进而探索并证实Rev-erbα对2型糖尿病发生发展的影响。
2. 材料和方法
一、实验材料和方法
选取2017年9月至2017年12月在我院(扬州大学附属医院)普外科住院行慢性胆囊炎择期手术的患者30例,其中对照组(非超重/肥胖非2型糖尿病) 10例,超重/肥胖组(BMI ≥ 25 kg/m2的非2型糖尿病者) 10例,2型糖尿病组10例。记录各组受试者的基本信息及相关实验室检查结果,包括性别、年龄(岁)、身高(m)、体重(kg)、腰围(cm)、臀围(cm)、颈围(cm)、血压(mmHg)、谷丙转氨酶(U/L)、谷草转氨酶(U/L)、肌酐(umol/L)、血糖(mmol/L)。同时,给予本实验所有受试者签署知情同意书。
1) 入选标准
① 慢性胆囊炎诊断标准 [17] :经过B超检查及临床病理切片确诊,胆囊壁增厚、胆囊变形或有结石;肝功能检查在A级以上,肾功能检查正常;
② 糖尿病诊断标准 [18] :采用国际上通用的世界卫生组织WHO糖尿病专家委员会(1999)提出的诊断和分类标准;
③ 超重/肥胖诊断标准:采用中华医学会糖尿病学分会(CDS, 2004)建议的MS诊断标准。
2) 排除标准
① 近三月内发生急性感染或其他导致急性反应性白细胞增多的疾病;
② 合并糖尿病急性并发症,如糖尿病酮症酸中毒、高血糖高渗综合征以及心脑肾等重要脏器并发症;
③ 年龄 < 18岁或>65岁。
二、实验方法
1) 组织提取
于术中获取各组受试者腹腔内适量脂肪组织,于冰盒内转移,并迅速放于−80℃冰箱保存直至使用。
2) RT-PCR (Real-Time PCR)
① 总RNA的提取
用Trizol试剂(Invitrogen)提取脂肪组织总RNA。
② cDNA合成
用Thermo的First Strand cDNA Synthesi反转录试剂盒进行逆转录。
③ Real-time PCR
用Thermo的DyNAmo Flash SYBR Green qPCR试剂盒进行样品相对定量检测。
3) Western blot
① 组织蛋白提取
② 蛋白浓度测定
③ Western印迹
4) 统计分析方法
使用Excel收集统计数据,具体的数据统计分析由SPSS 16.0统计软件完成。应用单因素方差分析(ANOVA)及卡方检验进行数值比较,p < 0.05,差异有统计学意义。
3. 结果
一、对照组、超重/肥胖组、2型糖尿病组三组受试者一般情况
1) 三组受试者性别、年龄及ALT、ASL、SCr、HDL-C、LDL-C、TG实验室检查指标对比无明显统计学差异,如表1所示。
2) 三组受试者FPG对比,2型糖尿病组明显高于对照组及超重/超重/肥胖组(p < 0.05);对照组与超重/肥胖组对比无明显统计学差异,如表1所示。
3) 三组受试者BMI、NC、WC、WHR对比,超重/肥胖组明显高于其他两组(p < 0.05);超重/肥胖组HC明显高于对照组(p < 0.05),但与2型糖尿病组对比无明显统计学差异;2型糖尿病组受试者BMI、NC、WC、HC、WHR与对照组对比无明显统计学差异。
Table 1. Comparison of basic parameters and biochemical indexes of subjects in the three groups
表1. 三组受试者人体基本参数及生化学指标的比较
注:*p < 0.05,**p < 0.01,#p < 0.05,##p < 0.01,其中#为肥胖组与2型糖尿病组对比结果。
二、Rev-erbα在对照组、超重/肥胖组、2型糖尿病组三组受试者腹腔内脂肪组织中的mRNA转录水平
通过实时定量PCR (RT-PCR)分别检测对照组、超重/肥胖组及2型糖尿病组三组受试者腹腔内脂肪组织中Rev-erbα的mRNA转录水平。结果显示,2型糖尿病组Rev-erbα的mRNA转录水平明显高于对照组(p < 0.05),而对照组和超重/肥胖组之间,以及超重/肥胖组与2型糖尿病组之间Rev-erbα的mRNA转录水平无明显统计学差异,详见图1。
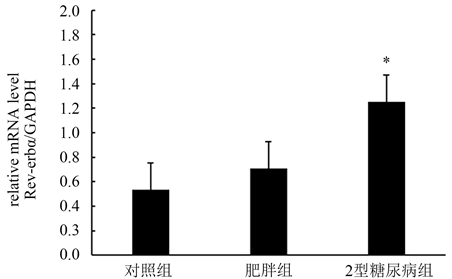
Figure 1. Quantitative analysis of mRNA transcription level of Rev-erbα in intraperitoneal adipose tissue of subjects in normal control group, overweight/obese group and type 2 diabetes group (*p < 0.05, **p < 0.01)
图1. Rev-erbα在正常对照组、超重/肥胖组、2型糖尿病组三组受试者腹腔内脂肪组织中的mRNA转录水平定量分析(*p < 0.05, **p < 0.01)
三、Rev-erbα在对照组、超重/肥胖组、2型糖尿病组三组受试者腹腔内脂肪组织中的蛋白表达水平
我们通过Western blot技术分别对对照组、超重/肥胖组及2型糖尿病组三组受试者腹腔内脂肪组织中Rev-erbα的蛋白表达水平进行检测,并经β-actin标准化后统计分析Rev-erbα在三组受试者腹腔内脂肪组织中的蛋白表达水平,结果显示,2型糖尿病组腹腔内脂肪组织中Rev-erbα的蛋白表达水平明显高于对照组(p < 0.01),而对照组和超重/肥胖组之间,以及超重/肥胖组与2型糖尿病组之间Rev-erbα的蛋白表达水平无明显统计学差异(p > 0.05),如图2所示。
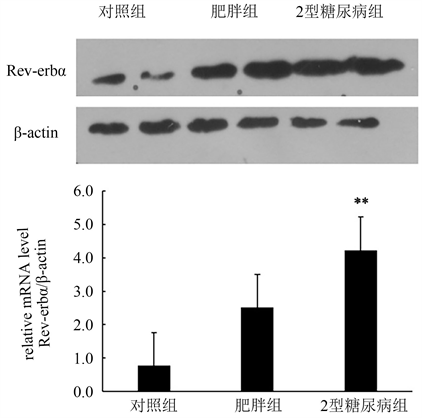
Figure 2. Quantitative analysis of protein expression level of Rev-erbα in intraperitoneal adipose tissue of subjects in normal control group, overweight/obese group and type 2 diabetes group (*p < 0.05, **p < 0.01)
图2. Rev-erbα在正常对照组、超重/肥胖组、2型糖尿病组三组受试者腹腔内脂肪组织中的蛋白表达水平定量分析(*p < 0.05, **p < 0.01)
4. 讨论
糖尿病的患病率呈逐年上升趋势 [19] [20] [21] ,已成为世界性公共卫生问题,给患者、患者家庭及整个社会带来了沉重的经济负担。因而不断探索和研究糖尿病的病因及发病机理,研制针对病因及发病机理的有效治疗措施显得尤为重要。
基于糖尿病大鼠模型(GK大鼠)的动物实验研究初步表明,Rev-erbα与糖尿病的发生发展存在相关性,为进一步探索并验证Rev-erbα与糖尿病的相关性。我们设计临床实验,研究2型糖尿病患者腹腔内脂肪组织中Rev-erbα的表达变化。我们收集了慢性胆囊炎择期手术患者的腹腔内脂肪组织进行研究,分别测定其蛋白和mRNA的表达水平,结果我们发现,2型糖尿病组腹腔内脂肪组织中Rev-erbα的mRNA转录水平明显高于对照组(p < 0.05);蛋白表达水平亦明显高于对照(p < 0.01),而对照组和超重/肥胖组,以及超重/肥胖组与2型糖尿病组之间Rev-erbα的表达水平无明显统计学差异(p > 0.05)。
我们对2型糖尿病患者的实验研究结果基本证实了张蕊等在动物实验中所得到的数据,提示Rev-erbα与2型糖尿病的发生发展相关。而关于Rev-erbα在糖尿病发病机制中的作用,我们查阅国内外文献,发现Rev-erbα与生物节律紊乱、胰岛功能改变、胰岛素抵抗等关系密切,而上述几个因素是导致糖尿病发生发展的重要原因。
昼夜节律紊乱可导致糖尿病的发生发展 [22] [23] [24] 。研究显示 [25] [26] [27] [28] [29] ,生物钟核心基因BMAL1和CLOCK敲除的小鼠发生能量代谢紊乱,小鼠食欲增强,继而引起肥胖、高脂血症、高血糖等的发生;而BMAL11和CLOCK基因变异小鼠,血糖和血甘油三脂水平发生周期性的改变,葡萄糖耐量降低。因而Rev-erbα [30] [31] 作为生物钟系统的钟控基因,也是BMAL1和CLOCK的直接靶基因,其可能通过调节生物节律而影响糖代谢,最终导致糖尿病的发生发展。
Rev-erbα对胰岛功能有重要影响,可通过调节胰岛β细胞的增殖、胰岛素及胰高糖素的分泌而促使糖尿病的发生发展。
胰岛β细胞功能主要受β细胞数目和β细胞胰岛素的合成及分泌过程两方面因素的影响。研究显示 [14] ,在小鼠MIN6中,通过siRNA处理使Rev-erbα的表达下调后,细胞的增殖明显减少。且随着MIN6细胞中Rev-erbα的表达下调,参与胰岛细胞增殖和分化的相关基因如细胞周期蛋白D1、胰腺–十二指肠同源框1以及肝细胞核因子4α的表达也下调。而在小鼠的离体胰岛β细胞中,Rev-erbα的表达下调也降低了细胞增殖。Vieira等 [32] 发现,经Rev-erbα的生理性配体处理后,MIN6胰岛素分泌速率得到提高,而INS-1经Rev-erbα激动剂处理后胰岛素分泌速率同样升高。
胰岛α细胞对维持血糖的稳态也有重要作用 [33] [34] 。研究显示 [14] ,胰岛α细胞系αTC中Rev-erbα在葡萄糖浓度较低时表达增加,当葡萄糖浓度升高至11 mmol/L时,胰岛β细胞中Rev-erbα的表达则减少。随着Rev-erbα表达下调,或通过siRNA方式处理小鼠使Rev-erbα表达下调,低血糖刺激的胰高糖素分泌受到抑制。
另有报道 [35] ,Rev-erbα可直接抑制细胞内的糖代谢。在肝细胞系中,Rev-erbα与它的生理性配体血红素结合后可抑制磷酸烯醇式丙酮酸羧激酶编码基因的表达,后者是糖异生过程中的限速酶,可直接影响糖代谢的发生发展。
Rev-erbα对脂质代谢的影响可能也是其与糖尿病相关的原因。研究发现 [36] [37] ,给予小鼠体外合成的Rev-erbα受体的激动剂或它的特异性配体处理,小鼠的能量消耗增加,血浆三酰甘油、脂肪含量及胆固醇水平下降,起一定减重作用。与之类似,给予Rev-erbα激动剂处理后,饮食诱导的肥胖小鼠脂肪含量减少,血脂、血糖紊乱状态得到改善,体重减轻。Rev-erbα在脂质的代谢和转运过程中发挥重要作用 [38] [39] ,其尚可下调胆固醇的合成 [40] [41] [42] ,与脂肪细胞分化亦相关。有研究显示 [43] [44] ,过氧化物酶增殖物激活受体γ和维甲酸核内受体α形成的二聚体可与Rev-erbα启动子区的RevDR-2序列特异性结合而上调Rev-erbα的表达,进而促进3T3-L1前脂肪细胞向成熟脂肪细胞的分化。
脂质代谢紊乱是导致胰岛素抵抗和2型糖尿病的重要原因之一。研究显示 [45] ,胰岛素抵抗患者肌肉及肝脏组织中出现脂质的特异性中间代谢产物如甘油二酯、神经酰胺等的异常堆积,进而使胰岛素信号通路发生异常导致胰岛素抵抗 [46] [47] [48] 。Rev-erbα可能通过影响脂质的代谢而致胰岛素抵抗的发生,进而导致2型糖尿病的发生发展,具体机制有待研究。
我们此次的临床实验研究纳入了超重/肥胖组受试者,与对照组相比,Rev-erbα的蛋白表达水平和mRNA的转录水平无明显统计学差异,分析其原因,超重/肥胖组BMI、NC、WC等高于对照组,但血脂正常,可能是得到上述结果的原因,也可能与病例数较少有关。另外,对一般情况分析我们发现,NC与BMI、WC、HC、WHR呈正相关,此与文献报道相符,提示颈围与肥胖相关。
综上所述,Rev-erbα对糖尿病的发生发展起一定作用,进一步探讨其在2型糖尿病发病中的具体作用机制有重要临床意义,有望成为治疗2型糖尿病的新药物靶点。
5. 结论
Rev-erbα在2型糖尿病组腹腔内脂肪组织中表达增加,提示Rev-erbα可能与2型糖尿病的发生发展相关。
6. 本研究不足及改进之处
1) 本研究时间相对不足,获取标本较少,且临床检查项目如糖化血红蛋白、C肽等由于医保限制未能获得数据,因而未能进一步做后续相关性分析,在以后的研究中我们会进一步协商并完善。
2) 本实验仅限于定量研究,未能进一步探讨及研究具体作用机制,后续可以通过应用Rev-erbα的激动剂或阻断剂干扰Rev-erbα的表达达到实验目的。
文章引用
胡月梅. 2型糖尿病患者腹腔内脂肪组织中Rev-erbα表达的变化
Expression Change of Rev-erbα in the Intraperitoneal Adipose Tissue of Patients with Type 2 Diabetes[J]. 医学诊断, 2023, 13(04): 399-408. https://doi.org/10.12677/MD.2023.134061
参考文献
- 1. 聂全思慧. 糖尿病的特点与防治措施[J]. 科技风, 2017(23): 232.
- 2. 樊垚, 顾刘宝, 王岚. 老年2型糖尿病患者身体测量指标与心脑血管死亡关联的前瞻性队列研究[J]. 实用预防医学, 2023, 30(8): 902-907.
- 3. 张静. 血糖和血脂指标检测在老年人群5年内心脑血管疾病发病风险评估中的作用[J]. 实用检验医师杂志, 2023, 15(1): 41-44.
- 4. 俞联春, 周君玲. 血糖、血脂在老年人群5年内心脑血管疾病发病风险评估中的作用[J]. 检验医学, 2022, 37(4): 370-373.
- 5. 左颖婷, 吴寿岭, 陈朔华, 等. 糖代谢异常人群中不同高血压亚型的心脑血管疾病风险[J]. 首都医科大学学报, 2023, 44(1): 42-48.
- 6. 颜穗珺, 李会芳. 中国糖尿病的患病概况[J]. 昆明医科大学学报, 2017, 38(3): 1-5.
- 7. 张晓春. 糖尿病发展现状分析[J]. 临床医药实践, 2015, 24(10): 784-786.
- 8. Yang, W., Lu, J., Weng, J., et al. (2010) Prevalence of Di-abetes among Men and Women in China. The New England Journal of Medicine, 362, 1090-1101. https://doi.org/10.1056/NEJMoa0908292
- 9. Lazar, M.A., Hodin, R.A., Darling, D.S., et al. (1989) A Novel Member of the Thyroid/Steroid Hormone Receptor Family Is Encoded by the Opposite Strand of the Rat c-erbA alpha Transcriptional Unit. Molecular and Cellular Biology, 9, 1128-1136.
- 10. Zvonic, S., Ptitsyn, A.A., Conrad, S.A., et al. (2006) Characterization of Peripheral Circadian Clocks in Adipose Tissues. Diabetes, 55, 962-970. https://doi.org/10.2337/diabetes.55.04.06.db05-0873
- 11. Bugge, A., Feng, D., Everett, L.J., et al. (2012) Rev-erbα and Rev-erbβ Coordinately Protect the Circadian Clock and Normal Metabolic Function. Genes Development, 26, 657-667. https://doi.org/10.1101/gad.186858.112
- 12. Brown, S.A., Zumbrunn, G., Fleury-Olela, F., Preitner, N. and Schibler, U. (2002) Rhythms of Mammalian Body Temperature Can Sustain Peripheral Circadian Clocks. Current Biology, 12, 1574-1583. https://doi.org/10.1016/S0960-9822(02)01145-4
- 13. Vieira, E., Merino, B. and Quesada, I. (2015) Role of the Clock Gene Rev-erbα in Metabolism and in the Endocrine Pancreas. Diabetes, Obesity and Metabolism, 17, 106-114. https://doi.org/10.1111/dom.12522
- 14. Vieira, E., Marroqui, L., Figueroa, A.L., et al. (2013) Involvement of the Clock Gene Rev-erb Alpha in the Regulation of Glucagon Secretion in Pancreatic α-Cells. PLOS ONE, 8, e69939. https://doi.org/10.1371/journal.pone.0069939
- 15. Laitinen, S., Fontaine, C., Fruchart, J.C. and Staels, B. (2005) The Role of the Orphan Nuclear Receptor Rev-erbα in Adipocyte Differentiation and Function. Biochimie, 87, 21-25. https://doi.org/10.1016/j.biochi.2004.12.006
- 16. 张蕊. GK大鼠脂肪组织中Rev-erbα和2型糖尿病进展以及胃旁路手术后糖尿病改善的关系[D]: [硕士学位论文]. 扬州: 扬州大学, 2013.
- 17. 林小凤. 慢性胆囊炎患者中性粒细胞、血清瘦素及血脂的变化及其相关性分析[J]. 中国临床医生杂志, 2017, 45(5): 49-51.
- 18. 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版) (下) [J]. 中国实用内科杂志, 2021, 41(9): 757-784. https://doi.org/10.19538/j.nk2021090106
- 19. 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版) (上) [J]. 中国实用内科杂志, 2021, 41(8): 668-695. https://doi.org/10.19538/j.nk2021080106
- 20. 鲜圆圆, 高静, 柏丁兮, 等. 中国老年人糖尿病前期患病率的Meta分析[J]. 军事护理, 2022, 39(12): 62-65, 100.
- 21. 祖丽胡玛尔∙阿布都艾尼, 刘超. 老年糖尿病的流行病学特点[J]. 实用老年医学, 2022, 36(10): 973-977.
- 22. 庞文琪, 钱帅伟, 李春艳, 等. 社会时差与肥胖和糖尿病关系研究进展[J]. 中国糖尿病杂志, 2022, 30(9): 695-699.
- 23. 长期夜间接触人造光更易患糖尿病[J]. 科学大观园, 2023(3): 6.
- 24. 刘梦迪, 刘继文, 王黎, 等. 昼夜紊乱对正常及2型糖尿病小鼠体质量、血糖和肝脏生物节律基因表达的影响[J]. 山西医科大学学报, 2022, 53(12): 1562-1567. https://doi.org/10.13753/j.issn.1007-6611.2022.12.011
- 25. Raghuram, S., Stayrook, K.R., Huang, P., et al. (2007) Iden-tification of Heme as the Ligand for the Orphan Nuclear Receptors REV-ERBα and REV-ERBβ. Nature Structural & Molecular Biology, 14, 1207-1213. https://doi.org/10.1038/nsmb1344
- 26. Marcheva, B., Ramsey, K.M., Buhr, E.D., et al. (2010) Disruption of the Clock Components CLOCK and BMAL1 Leads to Hypoinsulinaemia and Diabetes. Nature, 466, 627-631. https://doi.org/10.1038/nature09253
- 27. Turek, F.W., Joshu, C., Kohsaka, A., et al. (2005) Obesity and Metabolic Syn-drome in Circadian Clock Mutant Mice. Science, 308, 1043-1045. https://doi.org/10.1126/science.1108750
- 28. Ford, E.S., Li, C., Wheaton, A.G., et al. (2014) Sleep Duration and Body Mass Index and Waist Circumference among U.S. Adults. Obe-sity, 22, 598-607. https://doi.org/10.1002/oby.20558
- 29. Karlsson, B., Knutsson, A. and Lindahl, B. (2001) Is There an Association between Shift Work and Having a Metabolic Syndrome? Results from a Population-Based Study of 27,485 People. Occupational & Environmental Medicine, 58, 747-752. https://doi.org/10.1136/oem.58.11.747
- 30. Mohawk, J.A., Green, C.B. and Takahashi, J.S. (2012) Central and Peripheral Circadian Clocks in Mammals. Annual Review of Neuroscience, 35, 445-462. https://doi.org/10.1146/annurev-neuro-060909-153128
- 31. Preitner, N., Damiola, F., Lopez-Molina, L., et al. (2002) The Orphan Nuclear Receptor REV-ERBα Controls Circadian Transcription within the Positive Limb of the Mammalian Circadian Oscillator. Cell, 110, 251-260. https://doi.org/10.1016/S0092-8674(02)00825-5
- 32. Vieira, E., Marroqui, L., Batista, T.M., et al. (2012) The Clock Gene Rev-erbα Regulates Pancreatic β-Cell Function: Modulation by Leptin and High-Fat Diet. Endocrinology, 153, 592-601. https://doi.org/10.1210/en.2011-1595
- 33. Lee, Y.H., Wang, M.Y., Yu, X.X. and Unger, R.H. (2016) Glucagon Is the Key Factor in the Development of Diabetes. Diabetologia, 59, 1372-1375. https://doi.org/10.1007/s00125-016-3965-9
- 34. 高泓, 赵佳迪, 朗瑞娟, 等. 从气精固散探讨胰岛α-β环路在糖尿病血糖稳定中的作用[J]. 中医杂志, 2020, 61(4): 354-356. https://doi.org/10.13288/j.11-2166/r.2020.04.018
- 35. Zhang, E.E., Liu, Y., Dentin, R., et al. (2010) Crypto-chrome Mediates Circadian Regulation of cAMP Signaling and Hepatic Gluconeogenesis. Nature Medicine, 16, 1152-1156. https://doi.org/10.1038/nm.2214
- 36. Solt, L.A., Wang, Y., Banerjee, S., et al. (2012) Regulation of Circadian Behaviour and Metabolism by Synthetic REV-ERB Agonists. Nature, 485, 62-68. https://doi.org/10.1038/nature11030
- 37. Crumbley, C., Wang, Y., Kojetin, D.J., et al. (2010) Characterization of the Core Mammalian Clock Component, NPAS2, as a REV-ERBα/RORα Target Gene. Journal of Biological Chemistry, 285, 35386-35392. https://doi.org/10.1074/jbc.M110.129288
- 38. Coste, H. and Rodriguez, J.C. (2002) Orphan Nuclear Hormone Receptor Rev-erbα Regulates the Human Apolipoprotein CIII Promoter. Journal of Biological Chemistry, 277, 27120-27129. https://doi.org/10.1074/jbc.M203421200
- 39. Jetten, A.M., Kang, H.S. and Takeda, Y. (2013) Retinoic Acid-Related Or-phan Receptors α and γ: Key Regulators of Lipid/Glucose Metabolism, Inflammation, and Insulin Sensitivity. Frontiers in En-docrinology, 4, Article 41643. https://doi.org/10.3389/fendo.2013.00001
- 40. Sitaula, S., Zhang, J., Ruiz, F. and Burris, T.P. (2017) Rev-erb Regulation of Cholesterologenesis. Biochemical Pharmacology, 131, 68-77. https://doi.org/10.1016/j.bcp.2017.02.006
- 41. Delezie, J., Dumont, S., Dardente, H., et al. (2012) The Nuclear Receptor REV-ERBα Is Required for the Daily Balance of Carbohydrate and Lipid Metabolism. FASEB Journal, 26, 3321-3335. https://doi.org/10.1096/fj.12-208751
- 42. Di Paolo, G. and Kim, T.W. (2011) Linking Lipids to Alzheimer’s Disease: Cholesterol and beyond. Nature Reviews Neuroscience, 12, 284-296. https://doi.org/10.1038/nrn3012
- 43. Canaple, L., Rambaud, J., Dkhissi-Benyahya, O., et al. (2006) Reciprocal Regulation of Brain and Muscle Arnt-Like Protein 1 and Peroxisome Proliferator-Activated Receptor α Defines a Novel Positive Feedback Loop in the Rodent Liver Circadian Clock. Molecular Endocrinology, 20, 1715-1727. https://doi.org/10.1210/me.2006-0052
- 44. Fontaine, C., Dubois, G., Duguay, Y., et al. (2003) The Orphan Nuclear Re-ceptor Rev-erbα Is a Peroxisome Proliferator-Activated Receptor (PPAR) γ Target Gene and Promotes PPARγ-Induced Adipo-cyte Differentiation. Journal of Biological Chemistry, 278, 37672-37680. https://doi.org/10.1074/jbc.M304664200
- 45. Paglialunga, S., van Bree, B., Bosma, M., et al. (2012) Targeting of Mito-chondrial Reactive Oxygen Species Production Does Not Avert Lipid-Induced Insulin Resistance in Muscle Tissue from Mice. Diabetologia, 55, 2759-2768. https://doi.org/10.1007/s00125-012-2626-x
- 46. Takeuchi, M., Sakiyama, S., Usuki, T., Sakai, H. and Sakane, F. (2012) Diacylglycerol Kinase δ1 Transiently Translocates to the Plasma Membrane in Response to High Glucose. Biochimica et Bio-physica Acta (BBA)—Molecular Cell Research, 1823, 2210-2216. https://doi.org/10.1016/j.bbamcr.2012.08.019
- 47. Mezghenna, K., Leroy, J., Azay-Milhau, J., et al. (2014) Counteracting Neuronal Nitric Oxide Synthase Proteasomal Degradation Improves Glucose Transport in Insulin-Resistant Skeletal Muscle from Zucker fa/fa Rats. Diabetologia, 57, 177-186. https://doi.org/10.1007/s00125-013-3084-9
- 48. 赵家伟, 李秀钧. 胰岛细胞胰岛素抵抗: 2型糖尿病发病机制的主角? [J]. 中华内分泌代谢杂志, 2004, 20(3): 183-184.
