Hans Journal of Agricultural Sciences
Vol.06 No.04(2016), Article ID:18352,11
pages
10.12677/HJAS.2016.64015
Study on Taiwan Wentan and Miyu Pummeloes Limonoid Glucosyltransferase
Sz-Jie Wu, Yuan-Tay Shyu*
Department of Horticulture, National Taiwan University, Taipei Taiwan

Received: Jul. 23rd, 2016; accepted: Aug. 16th, 2016; published: Aug. 19th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Influence of limonin glusocyltransferease displays much influence on citrus juice bitterness, especially in pumeloes. In this study, we have cloned a 1600 bp lgt from pumeloes limonin glucosyltransferase’s active site, a 44 amino acids open reading frame was determined. This opening reading frame would be useful for genetic construction and cloning in upcoming study for citrus juice enhancement in flavor. This study also investigated Wentan and Miyu lgt during flowering and maturing. The results indicated that type II lgt was found only in Miyu and the gene expression was actively found in fruit. Wentan have both type I and type II lgt but the expression level is much lower than Miyu. These findings were similar to past researches which indicated that matured Wentan had less lgt expression in their fruit thus much bitter compounds appearance during its processing. We also used FPLC to purify LGTase, an approximately 40 kDa protein was then obtained and quantitated at 0.6 and 1 mg/ml. The enzyme can be used to reduce bitterness in pummeloes and further increase utility of peel wastes in processing.
Keywords:Pummelo, Wentan, Miyu Pummelo, Limonin Glucosyltransferase, Processing Waste

台湾文旦柚和蜜柚之柠檬苦素葡萄糖转移酶 研究
吴思节,徐源泰*
台湾大学园艺学系,台湾 台北

收稿日期:2016年7月23日;录用日期:2016年8月16日;发布日期:2016年8月19日

摘 要
柑橘类果汁在加工过程,在风味上受柠檬苦素影响甚巨,本研究针对台湾柚类柠檬苦素葡萄糖转移酶基因(limonin glucosyltransferase gene, lgt),选殖出一1600 bp片段,并对其作用活性位置预测出一段转录的44胺基酸序列,得到一个完整的开放框架(open reading frame),此段功能性基因有助于未来进行构筑与选殖,应用于柑橘类果汁在风味改进的研究。本研究亦探讨台湾的文旦柚和蜜柚lgt在开花至成熟时期的表现情况。结果得知,蜜柚中仅有第二型存在,且果实中含有大量lgt表现,而文旦同时具有两型lgt存在,但表现量相较于蜜柚低,此结果可应证前人之结论,即文旦柚于果实成长后期采收,因 lgt表现量不足,而导致其果实中仍含有大量苦味化合物仍有存在,导至于加工过程中苦味化合物的生成。本研究利用內果皮以快速蛋白纯化系统(FPLC) HiTrap Q管柱进行纯化,得分子量大约40 kDa之LGTase,并以2,2'-二辛可宁酸(bicinchoninic acid)定量蛋白质为0.6,1 mg/ml,此方法有助提高柚类加工过程中果皮废弃物的利用性。
关键词 :柚类,文旦,蜜柚,柠檬苦素葡萄醣转移酶,加工废弃物

1. 引言
柑橘(Citrus spp.)属芸香科常绿果树,为全球产量和销售最大宗之柑橘果汁,因颜色鲜艳和香气浓厚之特性而广受喜爱,然而柑橘果汁中常因具苦味而造成其质量之下降,而在加工过程中加以去除以提高果汁之风味;近年来研究报告指出,苦味化合物包括柠檬苦素类(limonoid)与黄烷酮配糖体(flavonoid glycoside)两大类 [1] [2] 。到目前为止,已发现有36种柠檬苦素化合物 [3] 。柠檬苦素类三帖类化合物,主要存在于芸香科和楝科的植物中,其中柠檬苦素(limonin)为果汁苦味主要来源之一,也是造成果汁制造质量降低的重要原因。90年代,大部份的学者针对如何将引起苦味之化合物以分离的方法去除,或者使用微生物将此些化合物进行代谢分解 [4] [5] ;晚近,由于相继找到此类化合物在抑制癌症的效果 [6] - [9] ,因而研究方向转而希望利用酵素对其进行作用,以达到降低苦味及保留此类化合物之目的,然而纯化酵素之成本高,若将其用于工业生产上可能不符合经济效益。故2000年左右,学者开始将其相关的酵素基因进行转殖,期望可生产出成本低之酵素,以供工业上使用 [10] 。过去学者研究之柑桔果汁去苦味方法主要有几类,如以微生物将苦味物质代谢与分解、以各式管柱对其进行吸附,或以酵素将其作用为不具苦味之化合物 [11] 。柠檬苦素之含量若高于6 ppm则会造成些微苦味的感觉,若是高于18 ppm则苦味会较重 [12] 。此外,如脐橙果实在鲜食时并不具苦味,但若进行果汁加工之后会产生苦味物质,主要是鲜食时多数的柠檬苦素是以不具苦味的前驱物形态存在,如limonoic acid A-ring lactone,但在加工过程中其在酸性环境下被limonin D-ring lactone hydrolase作用,则会形成具苦味之化合物 [13] ,由于柠檬苦素多存在于内果皮,因此在榨汁时亦会进入果汁中造成苦味,在酸性环境下经过酵素作用,则使柑桔果汁呈现具苦味之情况,故又被称为后生苦味。本年度研究重点于建立柠檬苦素葡萄糖转移酶蛋白质纯化及基因选殖系统,并将纯化后之柠檬苦素葡萄糖转移酶之基础物化性狀研究。研究中除寻求最大酵素活性來源外,也将藉由mRNA差異表现探讨其可能之表现情形。
2. 材料与方法
2.1. 材料
样品取得于新竹县柑橘果园,于3月开花期至6月成熟果每隔30天取样一次。取得样品将果办膜分离储藏于−80℃,抽取DNA、RNA与纯化LGTase。
2.2. 方法
2.2.1. DNA萃取
新鲜叶子于液态氮下磨碎,取0.1 g粉末分别装于微量离心管中,以Wizard® Genomic DNA Purification Kit (Promega, USA)进行DNA萃取。
2.2.2. 限制酶之DNA图谱分析
将DNA溶液(0.1~1.0 μg),加入反应缓冲溶液(10×) 1 μL,加入限制酶1 μl,及去离子水依序混合,并调整反应之总体积为10 μl,将混合后之溶液置于37℃下作用两小时,反应完成后以65℃水浴10分钟来终止反应,即可进行电泳分析。
2.2.3. RNA萃取
将样品于液态氮下磨成粉末,取0.1 g装于1.5 ml离心管中,以RNeasy Plant Mini Kit (QIAGEN, Germany)进行RNA萃取。
2.2.4. cDNA合成
将萃取出RNA以Reverse Transcriptases and RT-PCR Kits (Promega, USA)进行cDNA合成。
2.2.5. 实时定量PCR
设计LGTase基因专一性引子(表1)片段大约为208 bp。于罗氏®Light-Cycler系统上机操作,PCR反应条件如下95℃ 3 min;95℃ 3 min,50℃ 30 sec,72℃ 1.5 min,35 cycles;72℃ 7 min。
2.2.6. LGTase纯化
取果实内果皮部位与溶剂(pre-cooled 0.1M saline,含0.5% PVP,1 mM PMSF在0.1M stock solution DMSO) 1:4,于约600 rpm转速均质3 min,将均质后的泥浆物再搅拌2 h,以滤网过滤。于4℃下离心10,000 rpm,30 min,75%(NH4)2SO4使之饱和状态,将蛋白质沉淀物进行离心收集,沉淀物进行溶解使用pre-cooled 10 mM Tris-HC1 buffer,pH 7.8透析12 h,同时置换四次。透析完经过离心去除不溶性物质,上清液为粗酵素萃取物粗萃液进行硫胺划分35%~75%,将硫酸胺饱和蛋白质沉淀物进行透析10 mM Tris–HC1 buffer,pH 7.8,以FPLC HiTrap Q管柱进行纯化。
2.2.7. LGTase活性测定
反应溶液1 mM limonin (withan open D-ring),2 mM UDPG-2Na,5 mM MnCl2,20mM Tris-HC1 buffer混合后于37℃下反应1 hr。反应终止:沸腾加热100℃ 5 min,取上清液并离心10,000 rpm,15 min。HPLC Nucleosil 7C18 reversephase column (4.6 × 250 mm)进行分析,洗提15%~30% methanol线性梯度,35 min,流速0.4 ml/min。比对limonin glucoside标准品,计算单位活性pkat。
2.2.8. 蛋白质定量
以BCA (bicinchoninic acid)方法进行测定,当BCA以水溶性钠盐形式存在时,对cuprous ion (Cu2+)是1种靈敏、稳定性高且具高特異性之试剂。在碱性环境下,蛋白质可还原Cu2+成为Cu+,接着Cu+再和BCA试剂反应形成紫色的生成物,于波长562 nm下测定其吸光値,以已知浓度BSA (bovine serum albumin)
Table 1. Real-time RT-PCR amplification temperatures on type I and II LGTase
表1. 实时定量RT-PCR扩增一型与二型产物引子及其最适链合温度
为蛋白质标准品,绘制标准曲线,即可定量蛋白质。
2.2.9. SDS PAGE测定
SDS-PAGE胶体的制备參考Laemmli (1970)之方法,以10% polyacrylamide gel及Mini-Protein II迷你电泳槽进行电泳,以2比1的比例混合样本和处理液(2.5 ml 1.5 M Tris-HCl, pH 8.8, 4 ml 10% SDS, 2 ml glycerol, 1 ml β-mercaptoethanol, 292 ml 1% bromophenol blue, 2 mL 1 M DTT),进行电泳条件为100 V 2小时。
2.2.10. LGTase生化特性测定
1) 最适pH、温度
将酵素分别加入pH 3.5~10.5反应液(Tris-HCl)作用24小时,利用10 mM Tris-HCl buffer,pH 7.0透析12小时去除盐类,离心后取上清液进行蛋白质活性测定,最适温度测定以10℃~80℃做测定。
2) 最稳定pH、温度
将酵素分别在pH 3.5~pH 10.5反应液中于4℃作用12 h,去除盐类,离心取上清液进行蛋白质活性测定。
3. 结果与讨论
3.1. LGT基因序列比对与功能性分析
将所设计的引子对LGTase1/LGTase2扩增文旦柚、蜜柚LGTase基因,可扩增出长度约为1600 bp (图1)的DNA片段。将LGTase1/LGTase2扩增出的DNA序列与NCBI上的柠檬苦素葡萄糖转移酶mRNA序列进行比对,结果发现序列长度相同,因此可知此基因中并没有内含子(intron)的存在;而后将LGTase1/ LGTase2扩增出的PCR产物使用限制酶Hinc II进行酶切,其共存在两种型态的柠檬苦素葡萄糖转移酶基因,第一型可以被Hinc II作用酶切为四个DNA片段,长度分别为1000 bp、650 bp、600 bp及400 bp,第二型则可以被酶切为长度分别为650 bp和1000 bp的DNA片段,由图1中可以发现仅存在第一型的只有蜜柚,而同时存在此两型的柠檬苦素葡萄糖转移酶基因则为文旦柚。
将文旦柚和蜜柚定序所得柠檬苦素葡萄糖转移酶序列于NCBI数据库与多种柑橘样品(Citrus sinensis ACD14147; Citrus x paradise ACD14144; Citrus maxima ABY27084; Citrus unshiu BAA93039 ; Citrus limettioides
ACD14143; Citrus aurantium ACD14146; Citrus cv. Shiranuhi ABL63751)之柠檬苦素葡萄糖转移酶序列进行比对,此段序列相似性达98%~100% (表2),因此可推论此段序列具高保守性,将其序列转换为胺基酸于motifscan、prosite软件(图2)对其活性位置作预测,由图表结果得知此段序列含有一段44 amion acid UDP-Glycosyltransferase signature (表3,图3),同时具有启动码ATG与终止码TGA为一段完整开放框架(表1)。未来可将此段序列进行选殖与表现,有助解决加工柑橘果汁时产生苦味问题。
3.2. LGT gene于生长阶段表现量分析
针对文旦柚、蜜柚之lgt,分别对开花至成熟果lgt之表现情形作探讨。由cDNA序列设计两型专一性引子利用实时定量PCR技术进行其表现量测定,由图4可知,引子对扩增出片段大小为208 bp,文旦柚于生长阶段同时具有两型lgt存在,文旦柚第一型基因于开花时期有大量表现,根据文献可推测lgt在植物体对植物花色稳定与生长调节皆十分重要,因此在开花期此基因会大量表现,到了果实生长后其150天后又可看到此基因的表现出现,此结果与前人研究相同,第一型基因于果实生长后期阶段表现,而蜜柚于第一型lgt中是不表现的。于第二型基因表现量测定上文旦柚和蜜柚于此型都同时具有表现能力,并且于生长阶段都一直持续表现,文旦柚虽同时具有两型lgt存在,但表现量却相较于蜜柚低,此结果可推测文旦柚于果实成长后期采收后,也会因lgt表现量不足,而使其果实中仍含有大量苦味化合物存在,导至于加工过程中苦味化合物的生成。
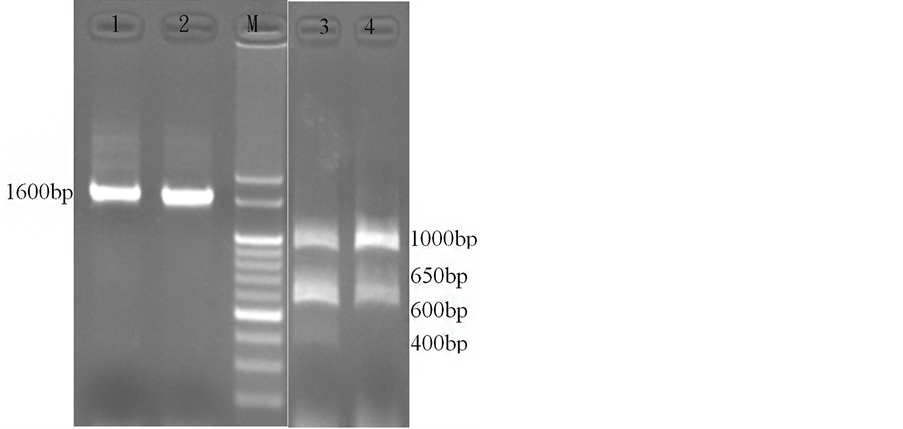 Lane 1—C. grandis (L.) Osbeck var. Wentan, Lane 2—C. grandis (L.) Osbeck var. Miyu, Lane M—100-bp marker, Lane 3—C. grandis (L.) Osbeck var. Wentan, Lane 4—C. grandis (L.) Osbeck var. Miyu
Lane 1—C. grandis (L.) Osbeck var. Wentan, Lane 2—C. grandis (L.) Osbeck var. Miyu, Lane M—100-bp marker, Lane 3—C. grandis (L.) Osbeck var. Wentan, Lane 4—C. grandis (L.) Osbeck var. Miyu
Figure 1. Hinc II restriction sites of LGT after PCR amplification
图1. LGT基因PCR扩增后电泳图及Hinc II酶切切位图
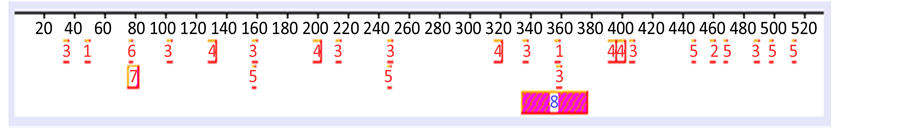 (a)
(a) (b)
(b)
Figure 2. Prediction of lgt functional site by (a) Motifs and (b) Prosite
图2. Motifs (a)和Prosite (b)两系统lgt功能性区域之预测
Table 2. Amino acid sequence of UDP-Glucosyltransferases
表2. 比较UDP-Glucosyltransferases胺基酸序列
Table 3. lgt functional region prediction by Motifscan software
表3. Motifscan分析软件对lgt功能性区域之预测

 (a) (b)
(a) (b)
Figure 3. Glucosyltransferases cDNA and its amino acid of (a) Wentan pummelo and (b) Miyu pummelo
图3. 文旦柚(a)、蜜柚(b) Glucosyltransferases cDNA序列与胺基酸序列之比对

 (a) (b)
(a) (b)
Figure 4. Real-time PCR on the determination of (a) type I and (b) type II lgt expression in different day of ripening
图4. 利用实时定量系统测定LGT gene type I (a)与type II (b)于开花后不同天数表现量
3.3. LGTase纯化分析
将文旦柚、蜜柚两样品之内果皮部位经粗酵素萃取、35%~75% (NH4)2SO4硫酸铵沉淀、FPLC HiTrap Q管柱进行三步骤纯化(图5),以BCA (bicinchoninic acid)定量出纯化蛋白质为0.6、1 mg/ml,并以HPLC分析LGTase作用于受质limonin后产生limonin glucoside的能力换算其酵素活性,HPLC分析条件于0.4 ml/min、207 nm下于13分钟有波峰出现(图6),经酵素活性换算得文旦柚LGTase纯化产率达41%、51% (表4、表5),将纯化酵素进行SDS-PAGE (图5(b)、图6(b))电泳分析得分子量大约40 kDa,与软件预测分子量大小相近,同时将纯化后的酵素作其基本特性测定,文旦柚内果皮纯化出LGTase其最适与最稳定pH为7.8与5.5~8.5 (图7),蜜柚内果皮纯化出LGTase其最适与最稳定pH为7.8与4.5~8.5,文旦柚内果皮纯化出的LGTase最适温度37℃与最稳定温度测得为20℃~40℃ (图8),蜜柚内果皮纯化出的LGTase最适温度37℃与最稳定温度为20℃~45℃,由结果可知文旦柚与蜜柚纯化出的LGTase基本特性测定上没有太大差异,但又以蜜柚较好之。
4. 结论
本研究选殖出台湾文旦柚和蜜柚之柠檬苦素葡萄糖转移酶基因,此1600 bp片段可转录出一含44胺
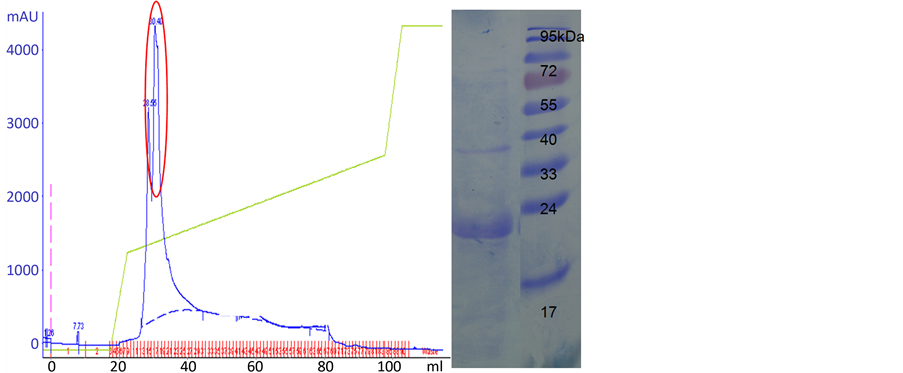
Figure 5. FPLC and SDS-PAGE of wentan pummelo LGTase by hitrap Q purification
图5. 以HiTrap Q管柱纯化文旦LGTase FPLC系统纯画图SDS-PAGE
Table 4. Purification of wentan PUMMELO lgt enzyme
表4. 文旦柚lgt酵素纯化
Table 5. Purification of miyu pummelo lgt enzyme
表5. 蜜柚lgt酵素纯化
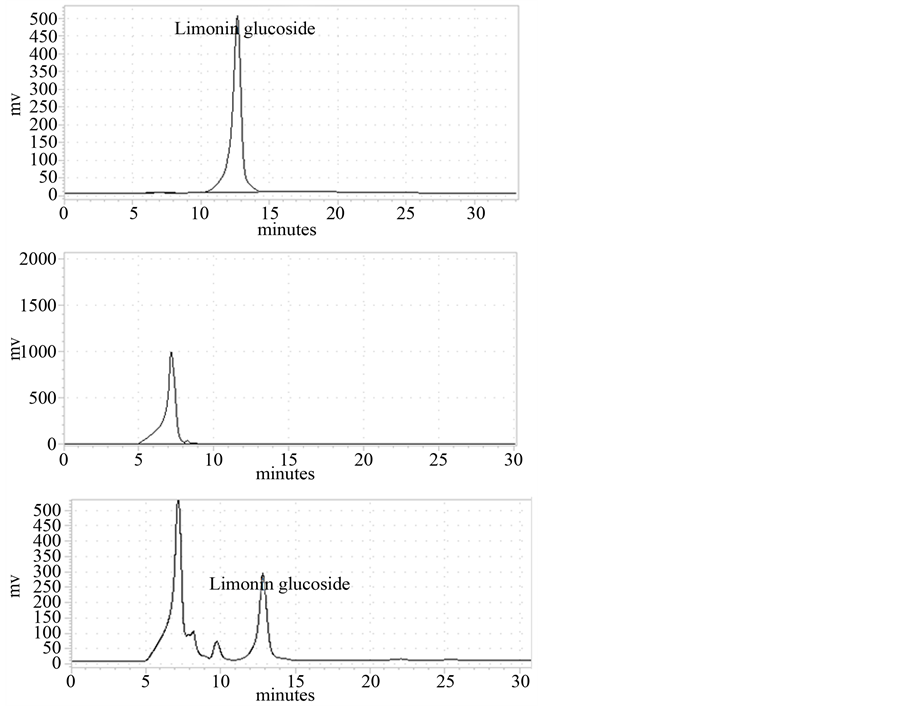
Figure 6. HPLC diagram on enzyme activity of limonin glucoside
图6. HPLC测定酵素活性图谱
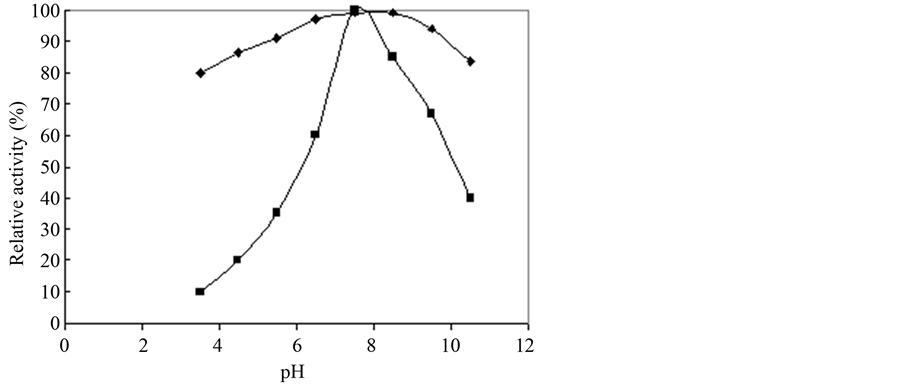
Figure 7. Optimal pH of wentan pummelo LGTase
图7. 文旦柚LGTase最适pH
基酸序列,此段功能性基因有助于未来进行构筑与选殖之用。探讨台湾的文旦柚和蜜柚lgt在开花至成熟时期的表现情况时,蜜柚中仅发现有第二型存在,而文旦柚虽同时具有两型lgt存在,但表现量相较于蜜
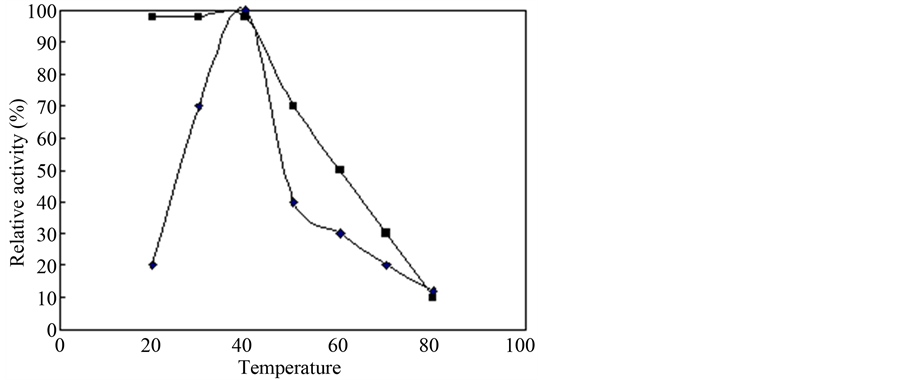
Figure 8. Optimal temperature of wentan pummelo LGTase
图8. 文旦柚LGTase最适温度
柚低,导致其果实中仍含有大量苦味化合物仍有存在,导至于加工过程中苦味化合物的生成。本研究亦以管柱进行进一步纯化,得分子量大约40 kDa之LGTase,经酵素活性换算得文旦柚LGTase纯化产率达41%、51%,电泳分析得分子量大约40 kDa。文旦内果皮纯化出LGTase其最适与最稳定pH为7.8与5.5~8.5,而蜜柚内果皮纯化出LGTase其最适与最稳定pH为7.8与4.5~8.5。
致谢
本研究经费承蒙勇源教育发展基金会支持,谨申谢忱。
文章引用
吴思节,徐源泰. 台湾文旦柚和蜜柚之柠檬苦素葡萄糖转移酶研究
Study on Taiwan Wentan and Miyu Pummeloes Limonoid Glucosyltransferase[J]. 农业科学, 2016, 06(04): 99-109. http://dx.doi.org/10.12677/HJAS.2016.64015
参考文献 (References)
- 1. Kita, M., Hirata, Y., Moriguchi, T., Endo-Inagaki, T., Matsumoto, R., Hasegawa, S., Suhayda, C. and Omura, M. (2000) Molecular Cloning and Characterization of a Novel Gene Encoding Limonid UDP-Glucosyltransferase in Citrus. FEBS Letter, 469, 173-178. http://dx.doi.org/10.1016/S0014-5793(00)01275-8
- 2. Moriguchi, T., Kita, M., Hasegawa, S. and Omura, M. (2003) Molecular Approach to Citrus Flavonoid and Limonoid Biosynthesis. Journal of Food, Agriculture and Environment, 1, 22-25.
- 3. Hasegawa, S., Berhow, M.A. and Fong, C.H. (1996) Analysis of Bitter Principles in Citrus. In: Linskens, H.F. and Jackson, J.F., Eds., Modern Methods of Plant Analysis, Springer-Verlag, Berlin, 59-80. http://dx.doi.org/10.1007/978-3-642-79660-9_4
- 4. 方义明. 椪柑与柳橙果实柠檬苦素类成分之分布与季低椪柑果汁苦味之研究[D]: [硕士学位论文]. 台北: 国立台湾大学园艺学研究所, 1991.
- 5. 徐儁华. 利用超过滤与吸附性树脂处理降低椪柑果汁苦味之研究[D]: [硕士学位论文]. 台北: 国立台湾大学园艺学研究所, 1992.
- 6. Guthrie, N., Hasegawa, S., Manners, G. and Vandenberg, T. (2000) Inhibition of Human Breast Cancer Cells by Citrus Limonoids. In: Berhow, M.S., Hasegawa, S. and Manners, G., Eds., Citrus Limonoids: Functional Chemicals in Agriculture and Foods, ACS Symposium Series, 758, 164-174.
- 7. 杨淑媚, 陈延年, 蔡昆道. 细胞膜上的死亡受体TRAIL-R1 (DR4)在人参皂Rh2 诱导肺腺癌细胞凋亡的过程扮演重要的角色[J]. 中医药杂志, 2004, 15(4): 273-291.
- 8. Amit, R. and Shailendra, S. (2006) Limonoids: Overview of Significant Bioactive Triterpenes Distributed in Plants Kingdom. Biological Pharmaceutical Bulletin, 29, 191-201. http://dx.doi.org/10.1248/bpb.29.191
- 9. Jayaprakasha, G.K., Mandadi, K.K., Poulose, S.M., Jadegoud, Y., Nagana, G. and Patila, B.S. (2007) Inhibition of Colon Cancer Cell Growth and Antioxidant Activity of Bioactive Compounds from Poncirus trifoliata (L.) Raf. Bioorganic and Medicinal Chemistry, 15, 4923-4932. http://dx.doi.org/10.1016/j.bmc.2007.04.044
- 10. Audrius, A.Z., Andrew, P.B. and Gary, D.M. (2004) Isolation and Characterization of Limonoate and Nomilinoate A-Ring Lactones. Phytochemistry, 65, 2705-2709. http://dx.doi.org/10.1016/j.phytochem.2004.08.016
- 11. Johnson, R.L. and Chandler, B.V. (1985) Ion Exchange and Absorbent Resin for Removal of Acid and Bitter Principles from Citrus Juice. Journal of the Science of Food and Agriculture, 36, 480-484. http://dx.doi.org/10.1002/jsfa.2740360609
- 12. Saipetch, K.S. (2004) Separation and Quantitation of Limonoids and Flavonoids in Juice and By-Products of Sweet Orange (Citrus sinensis). Ph.D. Thesis, University of Michigan, USA.
- 13. Maier, V.P. and Beverly, G.D. (1968) Limonin Monolactone, the Nonbitter Precursor Responsible for Delayed Bitterness in Certain Citrus Juices. Journal of Food Science, 33, 488-492. http://dx.doi.org/10.1111/j.1365-2621.1968.tb03661.x
