Hans Journal of Agricultural Sciences
Vol.07 No.05(2017), Article ID:21752,10
pages
10.12677/HJAS.2017.75044
Transgenic Watermelon Plants Transformed with Ovary Injection
Boyang Li1, Limin Shang2, Xuezheng Wang2*
1Harbin Railway Technology School, Harbin Heilongjiang
2College of Horticulture & Landscape Architecture, Harbin Heilongjiang

Received: Jul. 29th, 2017; accepted: Aug. 13th, 2017; published: Aug. 21st, 2017

ABSTRACT
Several fungal pathogens have been identified in the past and have caused serious economic losses in watermelon. The expression of both chitinase and glucanase genes was attempted to achieve higher levels of fungal resistance and to broaden the spectrum of resistance against many fungal pathogens. Chitinase and glucanase genes were successfully transferred into two inbred line of watermelon W1-4 and W1
Keywords:Watermelon, Ovary Injection, Transgenic
利用子房注射法进行西瓜遗传转化
李博洋1,商丽敏2,王学征2*
1哈尔滨铁建工程高级技工学校,黑龙江 哈尔滨
2东北农业大学园艺园林学院,黑龙江 哈尔滨
收稿日期:2017年7月29日;录用日期:2017年8月13日;发布日期:2017年8月21日

摘 要
利用子房注射法,在西瓜自交系W1-4和W1-12自花授粉后的不同时间,分别导入几丁质酶基因和葡聚糖酶基因。果实成熟后对坐果率进行调查,结果显示,在授粉后20 h进行子房注射坐果率最高。对T0代植株进行田间卡那霉素筛选和PCR检测,结果表明,不同西瓜自交系子叶期对卡那霉素敏感性存在显著基因型差异,西瓜自交系W1-4和W1-12卡那霉素临界筛选浓度分别为75 mg∙L−1和50 mg∙L−1;西瓜自交系在自交授粉后20 h进行外源DNA导入有最高的阳性率,几丁质酶基因和葡聚糖酶基因对W1-4的转化率分别为2.15%和3.19%,几丁质酶基因和葡聚糖酶基因对W1-12的转化率分别为5.56%和6.74%。本试验为进一步研究子房注射法转基因技术在西瓜育种中的应用提供了参考依据。
关键词 :西瓜,子房注射,转基因

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
西瓜(Citrullus lanatus)枯萎病是西瓜生产上极为严重的真菌性病害 [1] ,目前在世界各西瓜主产区及西瓜各生长发育阶段均有发生。西瓜枯萎病严重地制约着西瓜生产。但是,西瓜遗传基础十分狭窄,常规的育种方法并不能有效解决这一问题。近年来,随着植物基因工程技术的迅猛发展,采用转基因技术为提高西瓜抗病性、抗逆性和改良西瓜品质提供了一条快捷可行的新途径 [2] [3] 。
许多真菌细胞壁的主要成分是几丁质和葡聚糖,几丁质酶和葡聚糖酶能够降解真菌细胞壁中的几丁质和葡聚糖,抑制病原菌生长。植物体内几丁质酶和葡聚糖酶的大量表达在植物的抗病防御过程中起重要作用,抗真菌作用已广泛应用在水稻 [4] 、亚麻 [5] 、油菜 [6] 等多种作物上。
农杆菌介导法已被广泛应用于许多作物,但由于这种转化系统需要建立受体植物的高效再生体系和遗传转化体系 [7] [8] ,一些作物再生体系难以建立,并且农杆菌介导的遗传转化系统存在宿主局限性遗传转化频率低 [9] 。子房注射法操作简便、价格低廉、不受基因型限制,现已广泛应用于棉花、玉米、甜瓜、南瓜等多种作物上 [10] [11] [12] [13] [14] 。
本文系统地研究了通过子房注射法将分别构建于表达载体上的葡聚糖酶和几丁质酶基因导入西瓜,以期获得抗枯萎病的转基因植株,为创造新的抗真菌病害西瓜品种提供材种质资源。
2. 材料与方法
2.1. 植物材料
受体西瓜材料由东北农业大学西甜瓜分子育种实验室提供,分别是西瓜高代自交系W1-4和W1-12,两材料品质优良但易感枯萎病。
2.2. 质粒
用于转化的质粒为pBI-BG2和pBI-CH5B,结构见图1和图2。其中,葡聚糖酶基因BG2和几丁质

Figure 1. The diagram of pBI121-BG2
图1. 表达载体pBI121-BG2的结构图
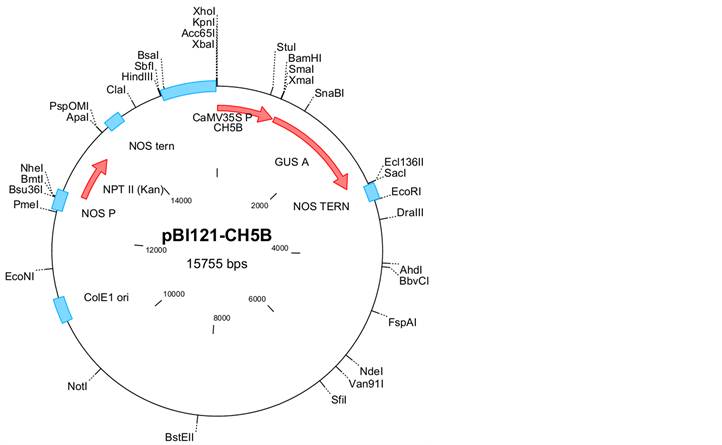
Figure 2. The diagram of pBI-CH5B
图2. 表达载体pBI121-CH5B的结构图
酶基因CH5B由东北农业大学
2.3. 主要生化试剂
TaqDNA聚合酶、dNTP、RNaseA等购自宝生物工程(大连)有限公司;限制性内切酶(XhoI, BamHI)购自Fermentas公司;EasyPureTM Plasmid MiniPrep Kit质粒提取试剂盒购自TransGen Biotech公司;其余试剂均为国产分析纯试剂。
2.4. 质粒DNA的制备
用质粒小量提取试剂盒提取质粒DNA,并进行双酶切鉴定后制备符合要求的质粒DNA导入液,质粒DNA光密度值达到OD260/OD280 > 1.8、OD260/OD230 > 2,用NDI000型微量紫外分光光度计检测并稀释质粒DNA溶液浓度为750~1000 ug/ml,贴标签标明样品的浓度和体积置于−20℃冰箱中保存备用。
2.5. 子房注射转化方法
将W1-4和W1-12种植于东北农业大学设施园艺工程中心1号温室(东农三弦式节能日光温室)中,转化方法参照哈斯阿古拉等 [15] 的方法,在盛花期每天下午对第二天将要开放的雄花和雌花分别进行蕾期套袋隔离。开花当天上午8至10时,进行人工自交授粉,随后套袋再次进行隔离,并挂牌标记授粉日期和时间。将人工授粉花朵分成5组,每组20朵花,分别于授粉后4、12、20和28 h,用70%酒精擦拭消毒后的刀片切去柱头上端1/3部分,用消毒后的20 μL微量注射器注射2 μL DNA溶液,含DNA 1.5~2 μg,并套袋隔离。设立对照,对照不进行任何处理。按常规方法进行田间管理,授粉后约45天果实成熟。果实成熟后,调查各处理坐果率并按单果采收T0代转化种子。
2.6. 叶片涂抹法筛选抗性植株
将西瓜自交系W1-4和W1-12种子各150粒播种于田间,待子叶刚刚展平时,用无菌去离子水配制卡那霉素(Kan)溶液浓度分别为0,25,50,75,100 mg·L−1,用小毛刷蘸取不同浓度梯度的卡那霉素溶液均匀涂抹在子叶上,每组20株,三次重复,连续涂抹三天每天一次共三次。分别于三次涂抹后的第2天、第4天、第6天调查并记录子叶颜色变化情况。
参考祝建波等 [16] 、苏日娜 [17] 方法(略有改动),将西瓜叶片对Kan处理的黄化程度划分为7个等级,进行西瓜叶片卡那霉素的抗性试验。
随机选取各处理收获的T0代种子各100粒播种于田间,用确定出的卡那霉素临界筛选浓度进行筛选,调查并记录苗期卡那霉素抗性个体数。
2.7. 西瓜叶片DNA的提取
将叶片涂抹法筛选出的抗性植株继续培养,当幼苗长至4~5片真叶时,每株取其新鲜嫩叶0.5 g,单株保存。DNA提取方法参照Luan et al. [18] CTAB法,得到的DNA溶液用琼脂糖凝胶电泳和微量紫外分光光度计检测其浓度和纯度,DNA溶液用无菌水稀释浓度为30 ng·μL−1,置于−20℃冰箱中保存备用。
2.8. 转基因植株的PCR检测
根据葡聚糖酶基因BG2和几丁质酶基因CH5B序列设计和合成引物,对T0代植株进行PCR检测。葡聚糖酶基因上游引物为
3. 结果与分析
3.1. 坐果率统计分析
果实成熟后,收获转化的西瓜果实,调查子房注射法不同注入时间的西瓜坐果率(表1)。
由表1可以看出,注入时间对坐果率有明显影响。在授粉后24 h内随着注入时间的延迟,坐果率逐渐增加,最高坐果率出现在授粉后20 h。但是在授粉后28 h当外源DNA注入西瓜子房时,坐果率开始下降并且低于授粉后12 h的坐果率。说明在相同的外界条件下,授粉后20 h是外源基因导入西瓜的最佳时间。在授粉后4 h注入外源基因的坐果率为0,可能是此时刚刚授粉完毕,用微量注射器进行注射时破坏了子房结构,影响了花粉管正常运输。从表1还可以看出W1-12的坐果率高于W1-4,是因为W1-12的花器比W1-4大(图3),用微量注射器进行注射时,不易破坏其子房结构。从表中可以看出,各处理坐果率均明显低于对照组的75%,由此可见,用微量注射器进行子房注射时,不可避免会对子房造成伤害影响坐果率。
Table 1. Survey statistics of harvested rate by ovary injection in different time
表1. 子房注射法不同注入时间西瓜坐果率调查统计表
3.2. 卡那霉素浓度筛选
连续3天对西瓜叶片涂抹卡那霉素,每天1次,共3次。3次涂抹后的第2天进行观察时,处理叶片上并没有明显变化,只是部分叶色变浅。第4天观察时,一半以上的处理叶片都出现了黄色斑点,严重的已经开始枯萎。第6天调查并记录子叶颜色的变化情况(见表2和表3)。由表2和表3可以看出,西

Figure 3. Ovary in different sizes
图3. 供试材料 W1-4 和W1-12的子房大小情况
Table 2. Leaves of W1-4 resistance to kanamycin
表2. 西瓜自交系W1-4叶片对卡那霉素抗性试验
Table 3. Leaves of W1-12 resistance to kanamycin
表3. 西瓜自交系W1-12叶片对卡那霉素抗性试验
瓜自交系W1-4和W1-12叶片卡那霉素临界筛选浓度有显著的基因型差异,分别为75 mg·L−1和50 mg·L−1。W1-4的临界筛选浓度高于W1-12,这与植株自身对卡那霉素的抗性和敏感性有关。
在最佳外源DNA注入条件下,调查统计西瓜对葡聚糖酶的转化率,分别对W1-4和W1-12的94份和89份材料进行了苗期卡那霉素筛选试验,分别得到抗性植株9株和13株;调查西瓜对几丁质酶的转化率,分别对W1-4和W1-12的93份和90份材料进行了苗期卡那霉素筛选试验,分别得到抗性植株6株和9株(表4)。
3.3. 转基因植株的PCR检测
如图4所示,采取CTAB法提取西瓜叶片DNA,在最佳外源DNA注入条件下,研究西瓜对葡聚糖酶的转化率,分别对W1-4和W1-12的94份和89份材料进行PCR扩增,分别得到3株和6株阳性单株,阳性率分别为3.19%和6.74%;研究西瓜对几丁质酶的转化率,分别对W1-4和W1-12的93份和90份材料进行PCR扩增,分别得到2株和5株阳性单株,阳性率分别为2.15%和5.56%。由表4可以看出,无论外源DNA是几丁质酶基因还是葡聚糖酶基因,W1-12的转化率均高于W1-4,由此可见,子房注射法转化率的高低与作物自身花器大小有关,花器大的作物转化率较高。从表4可以看出,通过卡那霉素筛选和PCR检测的西瓜转基因单株,其分析结果并不一致,即卡那霉素筛选表现为抗性的,PCR结果却不一定出现特异性带,卡那霉素筛选没有通过的,PCR结果可能也会表现为阳性。可能是在采用子房注射法导入外源DNA过程中,一些因素(如:植株自身对卡那霉素的抗性、目的基因形成不完整的片段)影响了试验结果和基因的正常表达。
4. 讨论
子房注射法是利用开花植物授粉后所形成的天然花粉管通道,将外源DNA导入受精卵细胞,并被进一步整合到受体细胞的基因组中,以达到遗传转化的目的 [18] 。本实验中发现,西瓜授粉后不同时间导入外源DNA,坐果率和转化率都有很大区别。所以确定适宜的导入时间,是子房注射法获得高转化率转基因材料的关键。由于不同植物受精生物学特性不同,所以最佳导入时间的确定,会因为植物种类不同而
Table 4. The test results of T0 seedlings
表4. T0代植株检测结果
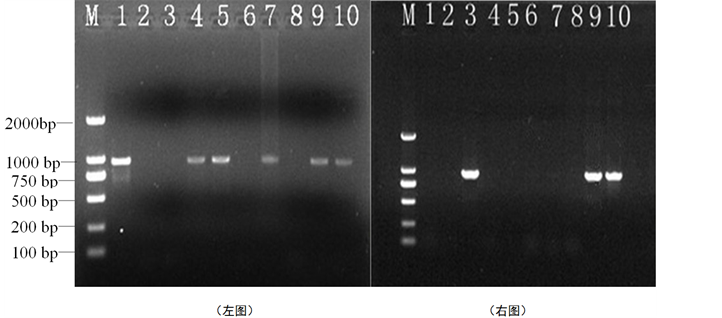
Table 4. The test results of T0 seedlings
图4. T0代部分转基因植株的PCR检测
注:左图为T0代几丁质酶基因(984 bp)的检测,M为DL2000 Marker;1为阳性对照,2为阴性对照,3为空白水对照,4~10为待检植株;右图为T0葡聚糖酶基因(918 bp)的检测。M为DL2000 Marker;1为空白水对照,2为阴性对照,3为阳性对照,4~10为待检植株
有所差异。一些子房注射法转基因研究也表明,植物授粉后导入时间对转化频率影响很大。子房注射法转化成功的关键在于精确掌握受体植物的受精过程和时间规律 [16] [19] 。
实验中,授粉后4 h注入外源基因的坐果率均为0,并且不同时间注入外源DNA的坐果率都显著低于不进行任何处理的对照。说明在进行子房注射时,破坏了子房结构,子房受损伤而导致败育或是不育,此外,子房注射造成伤口易感染病虫并在发育后期霉烂,也影响坐果率和种子数量。所以在进行子房注射时要尽量减少对子房的伤害和污染 [11] 。
本研究进行叶片对卡那霉素抗性摸索时发现,西瓜自交系W1-4和W1-12卡那霉素临界筛选浓度分别为75 mg·L−1和50 mg·L−1,不同西瓜自交系子叶期对卡那霉素的敏感性存在显著基因型差异,这与奚亚军等 [20] 、任鹏等 [21] 报道一致。实验中采用卡那霉素抗性筛选和PCR阳性检测对转基因西瓜单株进行鉴定,其分析结果并不一致,即卡那霉素筛选表现为抗性的,PCR结果却不一定出现特异性带,卡那霉素筛选没有通过的,PCR结果可能也会表现为阳性。这与祝建波等 [16] 、苏日娜 [17] 、徐鹏飞 [22] 等报道一致;但也有报道认为卡那霉素检测与PCR 检测结果完全一致 [23] 。
出现检测结果不一致的原因可能是在DNA提取过程中,植物细胞内酚类物质与DNA形成不可逆的复合物,从而影响实验结果;或者是采用子房注射法导入外源DNA过程中,受到植物体内核酸酶降解,有可能使目的基因或标记基因形成不完整片断,从而影响了基因的正常表达 [15] 。
子房注射法的应用打破了种、属间限制,可以在不同科、属、种的植物中广泛筛选育种资源,克服育种中因远缘杂交所造成的不孕,为改良作物某些性状,培育优良品种或创造新物种提供有效途径 [24] [25] [26] 。
子房注射法也有一定局限性,仅能用于开花植物,且只有在花期可以进行转育。本实验中,W1-12对外源基因的转化率高于W1-4,是因为W1-12的花器较W1-4大,用微量注射器导入外源DNA时,不易破坏其子房结构。由此可见,子房注射法仅适用于花器大的棉花、黄瓜、甜瓜、西瓜等作物。花器较小的小麦、水稻等作物适宜用花粉管通道法进行遗传转化并不适合用子房注射法。
尽管子房注射法有一定局限性,但是克服了西瓜再生体系建立中受基因型限制、再生频率低等困难,并且操作简便,成本低,易为育种者掌握,是一种行之有效的转化途径。
5. 结论
本文用子房注射法成功获得了23株转基因西瓜植株,确定出子房注射法进行西瓜遗传转化的最佳时间是在自交授粉后20 h,并且在表达载体上插入遗传标记基因能有效辅助转基因植株的分子检测。
基金项目
东北农业大学学术骨干项目(15XG05)。
文章引用
李博洋,商丽敏,王学征. 利用子房注射法进行西瓜遗传转化
Transgenic Watermelon Plants Transformed with Ovary Injection[J]. 农业科学, 2017, 07(05): 335-344. http://dx.doi.org/10.12677/HJAS.2017.75044
参考文献 (References)
- 1. 柳李旺, 陈崇顺, 陈锋, 赵丽萍. 生物技术在西瓜遗传育种研究中的应用[J]. 果树学报, 2004, 21(5): 472-476.
- 2. 裴月令, 曾凡云, 彭军, 龙海波, 郭建荣. 西瓜枯萎病菌T-DNA插入转化子库的构建及其质量评价[J]. 热带作物学报, 2015(1): 76-82.
- 3. 李娟, 李万宁, 唐懿, 李焕秀. 根癌农杆菌介导的西瓜遗传转化研究进展[J]. 中国蔬菜, 2010(8): 7-13.
- 4. Sridevi, G., Raghupathy, V. and Veluthambi, K. (2008) Combined Expression of Chitinase and β-1, 3-Glucanase Genes in Indica Rice (Oryza sativa L.) Enhances Resistance against Rhizoctonia Solani. Plant Science, 175, 283-290.
- 5. Wrobelkwiatkowska, M., Lorenckukula, K., Starzycki, M. Oszmianski, J. and Kepczynska, E. (2004) Expression of β-1,3-glucanase in Flax Causes Increased Resistance to Fungi. Physiological and Molecular Plant Pathology, 65, 245- 256.
- 6. 蓝海燕, 王长海, 张丽华, 刘桂珍, 王岚兰, 陈正华, 田颖川. 导入β-1,3-葡聚糖酶及几丁质酶基因转基因可育油菜及其抗菌核病的研究[J]. 生物工程学报, 2000, 16(2): 142-146.
- 7. 赵小强, 牛晓伟, 范敏. 农杆菌遗传转化西瓜的影响因素及应用研究进展[J]. 浙江农业学报, 2016(1): 171-178.
- 8. 任俊杰, 王丽霞, 高洪波, 吕桂云. 农杆菌介导的西瓜枯萎病菌遗传转化[J]. 植物保护, 2015(1): 93-97.
- 9. 张志忠, 吴菁华, 吕柳新. 根癌农杆菌介导的西瓜遗传转化研究[J]. 果树学报, 2005, 22(2): 134-137.
- 10. 彭珍子, 赵燕, 曾潜, 黄丽华, 陈浩东, 李育强, 张学文. 农杆菌子房注射法对棉花的活体转化[J]. 棉花学报, 2011, 23(4): 311-316.
- 11. 李余良, 胡建广, 苏菁, 刘建华. 子房注射法将 Bt基因导入超甜玉米[J]. 玉米科学, 2005, 13(1): 41-43.
- 12. 樊继德, 何启伟, 王秀峰, 于喜艳. 甜瓜反义酸性转化酶基因对甜瓜的遗传转化[J]. 园艺学报, 2007, 34(3): 677- 682.
- 13. 匡政成, 张学文, 肖才升, 陈浩东, 黄丽华, 李庠, 李育强, 匡逢春. 农杆菌与质粒DNA子房注射法在棉花转基因研究中的应用[J]. 湖南农业科学, 2014(4): 31-33
- 14. 张言朝, 葛宇, 于杨, 徐文龙, 白玉娇, 崔崇士, 屈淑平. 南瓜子房注射法遗传转化的研究[J]. 中国蔬菜, 2012, 1(16): 27-31
- 15. 哈斯阿古拉, 牛一丁, 张丽, 包常华, 李建国, 方天祺, 扈廷茂. 花粉管通道法转基因技术在甜瓜品种河套蜜瓜上的应用[J]. 内蒙古大学学报自然科学版, 2007, 38(4): 419-423.
- 16. 祝建波, 王爱英, 吴刚, 崔百明, 朱新霞, 肖璐, 乐锦华. 转基因棉花的田间筛选技术研究[J]. 棉花学报, 2000, 12(5): 230-233.
- 17. 苏日娜. 花粉管通道法转化甜瓜品种河套蜜瓜方法的比较研究[D]: [硕士学位论文]. 呼和浩特: 内蒙古大学, 2010.
- 18. Luan, F.S., Delannay, I. and Staub, J.E. (2008) Melon (Cucumis melo L.) Diversity Analyses Provide Strategies for Genetic Improvement and Evidentiary Support of Domestication Patterns. Euphytica, 164, 445-461. https://doi.org/10.1007/s10681-008-9699-0
- 19. 孔青, 丰震, 刘林, 孔雨光, 张颖. 外源DNA导入花粉管通道技术的发展和应用[J]. 分子植物育种, 2005, 3(1): 113-116.
- 20. 奚亚军, 候文胜, 张启发, 路明. 卡那霉素在转基因小麦后代筛选中的应用研究[J]. 西北农业学报, 2002, 11(3): 17-20.
- 21. 任鹏, 布都会, 奚亚军, 王竹林, 吕晓依, 刘曙东, 王彦民. 卡那霉素对不同小麦品种的效应及其在遗传转化筛选中的应用[J]. 麦类作物学报, 2007, 27(3): 438-441.
- 22. 徐鹏飞, 张淑珍, 吴俊江, 韩英鹏, 张大勇, 李文滨, 杨传平. 利用卡那霉素对花粉管通道法转基因大豆的筛选研究[J]. 大豆科学, 2006, 25(3): 275-278.
- 23. 崔百明, 封玲, 王爱英, 祝建波, 乐锦华. 转基因棉 PCR 与卡那霉素检测的比较[J]. 石河子大学学报(自然科学版), 2000, 4(2): 103-106.
- 24. 王浩波, 林茂, 杨坤, 戴祖云, 程国旺, 余增亮. 导入南瓜DNA选育抗枯萎病西瓜新种质的研究[J]. 西北农业学报, 2001, 11(1): 24-27.
- 25. 黄骏麒, 钱思颖, 刘桂玲, 翁坚, 曾以申, 周光宇. 外源海岛棉DNA导致陆地棉性状变异[J]. 遗传学报, 1981, 8(1): 56-62.
- 26. 陈秀蕙, 何焕新, 曾辉. 菠萝DNA导入黄瓜的初步研究[J]. 海南大学学报自然科学版, 1998, 16(1): 62-68.
