Botanical Research
Vol.
08
No.
01
(
2019
), Article ID:
28246
,
10
pages
10.12677/BR.2019.81003
Different Genotypes of Aquilaria crassna Pierre Responses to Hormone
Xiangyang Li, Bingshan Zeng
Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou Guangdong

Received: Dec. 9th, 2018; accepted: Dec. 20th, 2018; published: Dec. 27th, 2018

ABSTRACT
With tube plantlets of Aquilaria crassna Pierre. five genotypes as the experiment material, the effect of 6-BA (6-benzylaminopurine) and IBA (indole butytic acid) on different genotypes and different reproductive material from the same genotype were studied. The suitable plant hormone combinations of each genotype were selected. The results showed that proliferation rate of different genotype or different reproductive material from the same genotype in Aquilaria crassna Pierre. had obvious differences and interaction between genotypes and plant hormone was significantly different as well (p < 0.01). The optimum medium for bud multiplication of five genotypes with aptical bud was MS medium supplemented with 0.6 mg/L 6-BA and 0.1 mg/L IBA (G1 genotype), MS medium supplemented with 0.4 mg/L 6-BA and 0.1 mg/L IBA (G3 and G8 genotypes), MS medium supplemented with 0.2 mg/L 6-BA and 0.1 mg/L IBA (J1 and Y1 genotypes). The optimum medium for stem section of G3 genotype was MS medium supplemented with 0.2 mg/L 6-BA and 0.1 mg/L IBA.
Keywords:Aquilaria crassna Pierre, Genotype, Hormone, Tissue Culture
不同基因型奇楠沉香试管苗对激素的响应
李湘阳,曾炳山
中国林业科学研究院热带林业研究所,广东 广州

收稿日期:2018年12月9日;录用日期:2018年12月20日;发布日期:2018年12月27日

摘 要
本研究以5种基因型的奇楠沉香试管苗为试验材料,研究不同基因型及同一基因型不同繁殖材料对不同的6-苄氨基嘌呤(6-benzylaminopurine, 6-BA)和吲哚乙酸(indole butytic acid, IBA)激素浓度配比的反应,筛选出适合每种基因型继代增值的最佳激素浓度组合。结果表明:不同基因型及同一基因型不同繁殖材料的奇楠沉香试管苗对激素的反应存在极显著差异(p < 0.01)。5种基因型奇楠沉香有顶芽试管苗的最佳增殖培养基分别为:G1基因型:MS + 6-BA 0.6 mg/L + IBA 0.1 mg/L、G3和G8基因型:MS + 6-BA 0.4 mg/L + IBA 0.1 mg/L、J1和Y1基因型:MS + 6-BA 0.2 mg/L + IBA 0.1 mg/L。G3基因型无顶芽试管苗的最佳增殖培养基为:MS + 6-BA 0.2 mg/L + IBA 0.1 mg/L。
关键词 :奇楠沉香,基因型,激素,组织培养

Copyright © 2019 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
奇楠沉香Aquilaria crassna Pierre.是热带长绿植物,越南、柬埔寨、老挝、泰国等东南亚国家是其天然分布区域。千百年来,由于它能产生价值高昂的沉香木而备受人们的追捧。对奇楠沉香尤其是未成年树种的过度采伐导致种群濒临灭绝的边缘 [1] 。《濒临绝种野生动植物国际贸易公约》 (CITES,Convention on International Trade in Endangered Species of Wild Fauna and Flora)将奇楠沉香列为极危品种。我国最早于西双版纳引进种植,生长良好。近年来在广东部分区域也开始引种栽培 [2] 。由于东南亚各国对本国的奇楠沉香资源控制极严,国内的引种难以获得大量优质种苗,因此,我们针对这种状况开展了奇楠沉香的组织培养研究并初步建立了奇楠沉香工厂化育苗的技术平台 [3] 。我们在进行奇楠沉香无性快繁的研究中发现不同的基因型对植物激素的响应存在较大的差异。本研究结果揭示进行奇楠沉香组培快繁时有必要根据基因型类型调整植物激素的使用浓度。
2. 材料与方法
2.1. 试验材料
所有材料来自热带林业研究所林业生物技术组培室内的奇楠沉香G1、G3、G8、J1、Y1共5个基因型的无菌苗。
2.2. 试验方法
2.2.1. 不同基因型对不同激素配比的反应
取G1、G3、G8、J1、Y1基因型的有顶芽试管苗分别接入6种激素配比的培养基(表1),每个处理组合重复4瓶,每瓶接6株组培芽苗,每株芽苗的高度为2 cm~3 cm。
2.2.2. 不同繁殖芽类型对不同激素配比的反应
取G3、J1基因型无菌试管苗去掉顶端并保留2片叶子,分别接入3种激素配比的培养基(表1),每个处理组合重复4瓶,每瓶接6株组培芽苗。
以上各组实验所用培养基均采用MS基本培养基 [4] 添加卡拉胶7 g/L,蔗糖30 g/L,所有培养基pH值为5.8,培养温度为25℃ ± 2℃,光照12 h/d,光照强度2000 lx。所有处理培养4周后,统计增值倍数(增值苗数/接种苗数)、玻璃化比例(玻璃化苗数/增值苗数)母苗高度(cm)、新增芽高度(cm)。
Table 1. The list of nine tested formulas and five genotypes
表1. 供试的9种处理类型及相应的基因型号
2.3. 数据分析
数据采用SAS软件进行处理,利用三因素方差分析的LSD多重比较检验不同处理间的差异显著性。显著水平为α = 0.05,极显著水平为α = 0.01。
3. 研究结果与分析
3.1. 不同激素配比对不同基因型奇楠沉香试管苗母苗生长的影响
基因型、6-BA和IBA对母苗生长高度的影响都表现出极显著差异(表2),说明基因型、6-BA和IBA对试管母苗的生长高度都极大的影响,根据LSD多重比较分析(表3),G1、G3基因型是较易长高的基因型,G8、J1、Y1基因型的生长高度依次下降。对于任何基因型,随着6-BA浓度的上升,母苗的高度都是下降的。而IBA的作用却相反,少量IBA的加入,能提高母苗生长的高度。6-BA与基因型之间的互作也表现出极显著差异(表2),因此,对于不易长高基因型而言,6-BA的浓度的上升会进一步加剧母苗的矮化。6-BA和IBA的互作差异不显著(表2),但在同一基因型内IBA的加入有助于母苗的长高(图1)。
Table 2. Variance analysis for effects of plant hormone on growth of mother tube plantlets of different genotypes of Aquilaria crassna Pierre
表2. 激素对不同基因型奇楠沉香试管母苗生长影响的方差分析
Table 3. LSD multiple comparisons of influence factors on growth of mother tube plantlets among different treatments
表3. 不同处理间试管母苗高度生长影响因子的LSD多重比较分析
注:不同大写字母表示基质处理间在p < 0.01水平差异显著,反之差异不显著。下同。
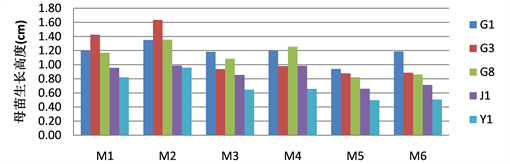
Figure 1. The growth of mother tube plantlets of different genotypes in different plant hormone
图1. 不同激素处理下不同基因型奇楠沉香试管母苗的生长高度
3.2. 不同激素配比对不同基因型奇楠沉香试管苗增值新芽生长的影响
基因型、6-BA、IBA、基因型与6-BA之间的互作、基因型与IBA之间的互作对增值新芽的生长都表现极显著差异(表4),可见新增值芽苗的生长对基因型、激素的配比及浓度比母苗更为敏感。根据LSD多重比较分析(表5),G1基因型增值新芽生长速度最快,其次是G8基因型,J1、Y1基因型增值新芽的生长速度很慢,不足0.5 cm/月(图2)。总体而言,6-BA浓度的上升会导致奇楠沉香试管苗增值新芽高度下降,但基因型不同,苗高下降的激素点不一样,G3、J1、Y1这3个基因型苗高下降的激素点是0.4 mg/L 6-BA,而G1、G8这2个基因型下降的激素点是0.6 mg/L 6-BA (图2)。IBA的加入能明显提高G3和G8基因型新增苗的高度,但在J1和Y1基因型中的作用较弱。
Table 4. Variance analysis for effects of plant hormone on growth of proliferation shoots of different genotypes of Aquilaria crassna Pierre. tube plantlets
表4. 激素对不同基因型奇楠沉香试管苗增值新芽生长影响的方差分析
Table 5. LSD multiple comparisons of influence factors on growth of proliferation shoots among different treatments
表5. 不同处理间增值新芽高度生长影响因子的LSD多重比较分析
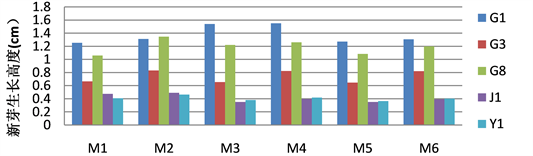
Figure 2. The growth of proliferation shoots of different genotypes of Aquilaria crassna Pierre. tube plantlets in different plant hormone
图2. 不同激素处理下不同基因型奇楠沉香试管增值新芽的生长高度
3.3. 不同激素配比对不同基因型奇楠沉香试管苗增值倍数的影响
奇楠沉香试管苗接种3天后茎段切口处出现组织膨大,7天后在叶腋处开始长出腋芽,根据方差分析,基因型、6-BA、IBA、基因型与6-BA之间的互作、基因型与IBA之间的互作对试管苗的增值倍数的影响都表现极显著差异,基因型与6-BA、IBA的交互作用也有显著差异(表6),所以,不仅基因型、激素的配比及浓度极大影响了奇楠沉香试管苗增值倍数,基因型与激素之间的交互作用也深刻影响了试管苗的增值能力。5种基因型的增值能力明显归为高、中、低3个层次(图3),Y1基因型的增值能力最强,月增值倍数超过3.5倍,其次是J1基因型,也能达到将近3倍,G1、G3、G8的增值能力相对较弱,均值不足2.5倍(表7)。由于基因型与6-BA的互做作用,对于增值能力较弱的基因型,可通过提高6-BA的浓度来提高增值倍数。而基因型与IBA的较互作用也很大,加入IBA后,增值倍数明显下降。考虑到基因型与6-BA、IBA三者之间的交互作用,应根据不同的基因型调整激素的配比及浓度,以达到最佳繁殖效果。
Table 6. Variance analysis for effects of plant hormone on proliferation rate of different genotypes of Aquilaria crassna Pierre. tube plantlets
表6. 激素对不同基因型奇楠沉香试管苗增值倍数影响的方差分析
Table 7. LSD multiple comparisons of influence factors on proliferation rate of Aquilaria crassna Pierre. tube plantlets among different treatments
表7. 不同处理间奇楠沉香试管苗增值倍数影响因子的LSD多重比较分析

Figure 3. The proliferation rate of different genotypes of Aquilaria crassna Pierre. tube plantlets in different plant hormone
图3. 不同激素处理下不同基因型奇楠沉香试管苗的增值倍数
3.4. 不同激素配比对不同基因型奇楠沉香试管苗玻璃化的影响
奇楠沉香试管苗的玻璃化现象在不同基因型之间差异极显著(表8),G3和G8基因型最容易玻璃化,其次是G1基因型,Y1和J1基因型都不容易玻璃化(表9)。6-BA和IBA对各基因型玻璃化的影响都极其显著(表8),高浓度的6-BA能显著增加试管苗玻璃化的程度,而IBA却能减轻试管苗的玻璃化(表9)。基因型与6-BA的互作也极显著(表8),G3、G8基因型在6-BA为0.4 mg/L时,玻璃化率可达近10%,而同样6-BA浓度下的J1、Y1基因型玻璃化率为0 (图4)。
Table 8. Variance analysis for effects of plant hormone on vitrification rate of different genotypes of Aquilaria crassna Pierre. tube plantlets
表8. 激素对不同基因型奇楠沉香试管苗玻璃化影响的方差分析
Table 9. LSD multiple comparisons of influence factors on vitrification rate of Aquilaria crassna Pierre. tube plantlets among different treatments
表9. 不同处理间增值苗玻璃化影响因子的LSD多重比较分析

Figure 4. The vitrification rate of different genotypes of Aquilaria crassna Pierre. tube plantlets in different plant hormone
图4. 不同激素处理下不同基因型奇楠沉香试管苗的玻璃化比例
3.5. 不同基因型及不同繁殖材料对激素的响应
不仅基因型、激素对奇楠沉香试管苗的增值倍数有极显著影响,繁殖材料的差异也极显著影响了试管苗的增值倍数(表10,表11)。基因型和繁殖材料的互作及基因型、6-BA、繁殖材料3者之间的互作都表现出极显著差异(表10)。以去顶芽试管苗为繁殖材料的增值倍数也是随着6-BA浓度的升高而升高(表11,图5),与有顶芽繁殖材料相同。不同基因型的不同繁殖材料增值倍数的变化幅度并不一样,当6-BA浓度相同时,与有顶芽试管苗相比,G3基因型的无顶芽试管苗的增值倍数最高可增加41%,而J1基因型的无顶芽试管苗增值倍数最高只增加7% (图5),因此,当试管苗去顶芽后,G3基因型繁殖新芽的能力会大幅度上升,而J1基因型只是稍有增加。
Table 10. Variance analysis for effects of plant hormone on proliferation rate of different genotypes and different reproductive material of Aquilaria crassna Pierre. tube plantlets
表10. 激素对不同基因型不同繁殖材料奇楠沉香试管苗增值倍数影响的方差分析
Table 11. LSD multiple comparisons of influence factors on proliferation rate of different reproductive material of Aquilaria crassna Pierre. tube plantlets among different treatments
表11. 不同处理间不同繁殖材料试管苗增值倍数影响因子的LSD多重比较分析
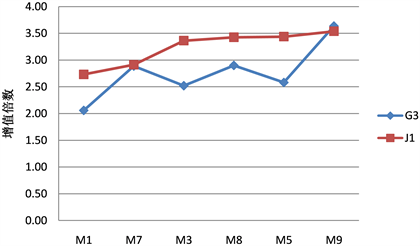
Figure 5. The proliferation rate of different genotypes and different reproductive material of Aquilaria crassna Pierre. tube plantlets in different plant hormone
图5. 不同激素处理下不同基因型不同繁殖材料奇楠沉香试管苗的增值倍数
方差分析显示,就增值新芽的高度而言,繁殖材料、基因型、6-BA及它们之间的互作都表现了极显著差异(表12)。用去顶芽的试管苗做繁殖材料不仅能提高奇楠沉香试管苗的增值倍数(表11),而且增值新芽的高度也明显增加(表13)。不同基因型不同繁殖材料增值新芽变化趋势并不一样。对于J1基因型,以去顶芽试管苗为繁殖材料获得的增值新芽的高度也是随着6-BA浓度的升高而降低(图6),这一特性与以有顶芽试管苗为繁殖材料的情况是一样的。但对于G3基因型,以去顶芽试管苗为繁殖材料的增值新芽的高度会先随着6-BA浓度的升高而升高,当6-BA浓度进一步升高时,增值新芽的高度才下降(图6),而有顶芽繁殖材料的增值新芽的高度是随着6-BA浓度的升高而降低的,说明G3基因型的去顶芽繁殖材料对6-BA的耐受性更高。
Table 12. Variance analysis for effects of plant hormone on growth of proliferation shoots of different genotypes and different reproductive material of Aquilaria crassna Pierre. tube plantlets
表12. 激素对不同基因型不同繁殖材料奇楠沉香试管苗增值新芽生长影响的方差分析
Table 13. LSD multiple comparisons of influence factors on growth of proliferation shoots from different reproductive material among different treatments
表13. 不同处理间不同繁殖材料增值新芽高度生长影响因子的LSD多重比较分析
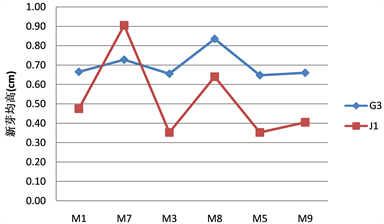
Figure 6. The growth of proliferation shoots of different genotypes and different reproductive material of Aquilaria crassna Pierre. tube plantlets in different plant hormone
图6. 不同激素处理下不同基因型不同繁殖材料奇楠沉香试管苗增值新芽的生长高度
4. 结论与讨论
由于多数植物的基因杂合度较高,导致了同种不同个体基因型的差异性。尽管有些植物不同的基因型对激素不太敏感,可以采用一种激素配比进行组织培养 [5] ,但多数植物不同基因型组织培养所需要的条件不尽相同,有研究表明草莓不同基因型进行组织培养时的最佳增值配方存在显著差异 [6] ,另外葡萄柚 [7] 、小豆 [8] 、凤丹牡丹 [9] 、南瓜 [10] 、樟树 [11] 等植物的组织培养研究中也有不同基因型对激素应答不一致的情况。
从奇楠沉香的研究结果看,无论是带顶芽的繁殖材料还是去顶芽的繁殖材料,不同基因型对激素的反应都有极显著的差异。采用什么样的激素组合进行增值培养取决于3个因素:增值倍数、试管苗生长速度、玻璃化比例。提高6-BA浓度在一定范围内可提高增值倍数 [12] ,但也会导致试管苗玻璃化比例上升 [13] 。马来沉香(Aquilaria malaccensis)和土沉香(Aquilaria sinensis (Lour.) Gilg)的组织培养研究也表明随着6-BA浓度的升高,芽苗有加重玻璃化的趋势 [14] [15] 。在蓝莓的增值培养中可见培养基中加入IBA后,增值倍数会大幅下降,却有提高增值苗株高现象 [5] 。在培养奇楠沉香试管苗培养基中加入IBA都会导致增值倍数下降,也有提高增值苗高度的效果,同时还会减轻增值苗玻璃化的比例,但在不同基因型中,起的作用大小不一。G1基因型的增值苗最容易长高,但增值倍数偏低,单独调高6-BA的浓度至0.6 mg/L,虽然可以将增值倍数提高到2.8倍,同时也导致玻璃化比例提高到11%,而同时加入IBA 0.1 mg/L后,则可将玻璃化比例下降到4%,尽管增值倍数也下调到2.5倍,这也满足了工厂化育苗的技术指标。G3和G8基因型的增值倍数也偏低,又最容易玻璃化,采用6-BA 0.4 mg/L + IBA 0.1 mg/L的激素组合可以保证增值倍数接近2.5倍同时玻璃化比例又控制在5%以下。J1和Y1基因型试管苗最容易增值,又不容易玻璃化,但增值芽过于矮小,为了尽可能缩短生根苗的产出时间,采用6-BA浓度0.2 mg/L + IBA 0.1 mg/L的激素组合是比较合适的。
不同的繁殖材料对激素反应不同在金茶花的组培快繁研究中也有类似的情况,金茶花的顶芽诱导率只有12%,而茎段的诱导率可达到100% [16] 。奇楠沉香J1和G3基因型的去顶芽试管苗都比有顶芽试管苗更容易增值,增值新芽也更容易长高,尤其是G3基因型,在相同激素背景下,去顶芽试管母苗的增值倍数和新增值芽高度都有明显优势且不容易玻璃化,因此,对于G3基因型而言,用去顶芽试管苗做为繁殖材料,采用6-BA 0.2 mg/L + IBA 0.1 mg/L的激素组合是最合适的选择。这种现象是否在所有的基因型中具有普遍性还有待于进一步研究。
基金项目
该研究得到广东省林业科技创新项目“奇楠沉香组培快繁及无性系选育研究”(2015KJCX006)的支持。
文章引用
李湘阳,曾炳山. 不同基因型奇楠沉香试管苗对激素的响应
Different Genotypes of Aquilaria crassna Pierre Responses to Hormone[J]. 植物学研究, 2019, 08(01): 15-24. https://doi.org/10.12677/BR.2019.81003
参考文献
- 1. Zhang, L.X., Brockelman, W.Y., et al. (2008) Matrix Analysis to Evaluate Sustainability: The Tropical Tree Aquilaria crassna, a Heavily Poached Source of Agarwood. Biological Conservation, 1676-1686. https://doi.org/10.1016/j.biocon.2008.04.015
- 2. 张丽君, 张坤洪, 梁远楠. 广东省奇楠沉香引种栽培试验研究[J]. 中南林业调查规划, 2011, 30(3): 65-68.
- 3. 李湘阳, 曾炳山, 裘珍飞, 等. 越南奇楠沉香组培苗不定根诱导研究[J]. 中南林业科技大学学报, 2016, 36(10): 6-11.
- 4. 朱建华, 彭士勇. 植物组织培养实用技术[M]. 北京: 中国计量出版社, 2002: 23.
- 5. 肖海峻, 庞俊兰, 孟利前, 等. 不同基因型蓝莓离体茎段的增殖培养技术[J]. 分子植物育种, 2018, 16(8): 2587-2592.
- 6. 薛其勤, 李美芹, 吕金浮, 等. 不同基因型优质草莓组织培养快繁研究[J]. 北方园艺, 2014(21): 110-113.
- 7. 陶燕蓝, 姚春光, 蓝增全, 等. 葡萄柚组织培养快繁体系的建立[J]. 南方农业学报, 2014, 45(12): 2208-2214.
- 8. 曹劲宏, 牟少萌, 何雪, 等. 不同基因型小豆胚尖再生能力筛选和培养条件优化[J]. 分子植物育种, 2015(13): 106-118.
- 9. 王新, 成仿云, 文书生, 等. 凤丹牡丹鳞芽离体培养与快繁技术[J]. 林业科学, 2016, 52(5): 101-110.
- 10. 张加一, 刘霞, 胡芳芳, 等. 南瓜子叶节再生体系的建立[J]. 中国瓜菜, 2016, 29(5): 5-7, 10.
- 11. 杨柳, 李志辉, 林立彬. 激素对不同种源樟树体胚发生的影响[J]. 中南林业科技大学学报, 2018, 38(12): 115-120, 135.
- 12. 安佰义, 郭才南, 包文慧, 等. 白檀离体快繁技术[J]. 植物学报, 2018, 53(5): 693-699.
- 13. 王艳, 吴丹, 刘立江, 韩义, 等. 五莲杨(Populus wulianensis)再生体系建立及试管苗玻璃化的防治[J]. 分子植物育种. http://kns.cnki.net/kcms/detail/46.1068.S.20181120.1523.006.html
- 14. 张卫华, 许丽萍, 龚峥, 等. 马来沉香组织培养技术研究[J]. 广西植物, 2014, 34(3): 381-386.
- 15. 徐强兴, 吴妃华, 周立赖. 土沉香的组培快繁技术研究[J]. 广东农业科学, 2006(8): 44-46.
- 16. 吴丽君, 高楠, 陈达, 等. 金花茶杂交种子无菌苗的组培快繁研究[J]. 南京林业大学学报(自然科学版), 2018, 42(5): 32-38.
