Asian Case Reports in Oncology
Vol.05 No.04(2016), Article ID:18808,7
pages
10.12677/ACRPO.2016.54008
Research on Association of Genetic Polymorphism of CYP1A1 and CYP2E1, with Susceptibility to Gastric Cancer
Haorui Song1, Jiazhen Zhang2, Shuang Wu1, Lei Cao3
1Tangshan No.1 High School, Tangshan Hebei
2Tangshan Longquan Middle School, Tangshan Hebei
3College of Life Science, North China University of Science and Technology, Tangshan Hebei

Received: Oct. 4th, 2016; accepted: Oct. 18th, 2016; published: Oct. 27th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To investigate the association of CYP1A1 Ile462Val and CYP2E1-1239G>C polymorphisms with gastric cancer (GC) in Chinese population. Methods: The study included 230 cases with GC and 460 frequency-matched controls. The polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) method was used to analyze genotype CYP1A1 Ile462Val and CYP2E1-1239G>C polymorphisms. The odds ratios (OR) and 95% confidence intervals (CI) were calculated using unconditional logistic regression model. Results: Compared with the CYP1A1 462 Ile/Ile genotype carriers, the subjects with 462 Val/Val genotype carriers have decreased risk for gastric cancer, with the 0.31 of OR and 0.16 - 0.60 of 95% CI. When stratified by smoking status, subjects with at least one 462Val allele carrier had a reduced risk of developing GC (OR = 0.29, 95% CI = 0.14 - 0.64) among heavy smokers, but not among non-smokers. There was no significant difference in CYP2E1-1239G>C genotype distribution between gastric cancer cases and the control. Conclusion: CYP1A1 Ile462Val polymorphism is associated with the susceptibility to GC in Chinese population.
Keywords:CYP1A1, CYP2E1, Single Nucleotide Polymorphism, Gastric Cancer, Susceptibility, Cytochrome P450

CYP1A1和CYP2E1基因多态与胃癌易感性关系的研究
宋浩瑞1,张佳桢2,吴双1,曹 蕾3
1河北省唐山市第一中学,河北 唐山
2河北省唐山市龙泉中学,河北 唐山
3华北理工大学生命科学院,河北 唐山

收稿日期:2016年10月4日;录用日期:2016年10月18日;发布日期:2016年10月27日

摘 要
目的:探讨细胞色素P450 (CYP450)基因CYP1A1第7外显子的Ile462Val (rs1048943)以及CYP2E1-1239G>C (rs3813867)单核苷酸多态(SNP)与胃癌遗传易感性的相关关系。方法:采用病例–对照研究,聚合酶链反应–限制性片断长度多态性分析(PCR-RFLP)方法,分析230例胃癌患者和460例正常对照者的CYP1A1基因Ile462Val以及CYP2E1基因-1239G>C位点的基因型。以比值比(OR)及其95%可信区间(CI)比较不同基因型与胃癌发病风险的相关关系。结果:与CYP1A1 462 Ile/Ile基因型携带者相比,462 Val/Val基因型携带者胃癌发病风险显著降低,其OR值分别为0.31 (95% CI: 0.16 − 0.60; P = 0.001)。吸烟分层分析显示,在吸烟人群中,至少携带一个462Val等位基因的基因者与未携带者相比,发生胃癌的风险显著降低了59% (OR = 0.41, 95%CI = 0.24 − 1.43; P = 0.001);且这种保护作用在重度吸烟患者中尤为明显(OR = 0.29, 95% CI = 0.14 − 0.64; P = 0.002)。而CYP2E1-1239G>C各基因型分布在正常人群和胃癌患者中差异无统计学意义(P > 0.05)。CYP1A1基因Ile462Val变异是影响胃癌易感性的重要因素。
关键词 :CYP1A1,CYP2E1,单核苷酸多态,胃癌,易感性,细胞色素P450

1. 引言
胃癌是全球范围内最常见的消化系统恶性肿瘤之一,居于肿瘤死亡原因第二位,被视为国际间重要的健康危机 [1] 。由于胃癌发病年龄广,影响因素多,早期症状不典型,致病机制复杂,治疗效果令人沮丧 [2] 。
细胞色素P450酶系(cytochrome P450,简称CYP或P450)是参与药物与环境等化学物质体内生物转化的主要药物代谢酶。CYP1A1是其家族中重要成员,参与多种环境致癌物、致突变物的代谢 [3] 。现已发现CYP1A1的多个基因多态位点,其中位于第7外显子的Ile462Val多态位点,已有多篇报道其与多种类型肿瘤的易感性相关(如卵巢癌、口腔癌、结直肠癌等) [4] - [6] 。关于该多态位点与胃癌易感性的相关性研究报道在国内外并不多见。
CYP2E1是一种重要的I相代谢酶,它是参与体内亚硝胺类化合物和小分子卤代烃类化合物代谢的主要酶类。烟草中含有的几种重要前致癌物如N-硝基去甲烟碱(NNN)、4-甲基尼古酰基-1-吡啶基1-丁酮(NNK)等的激活都需要CYP2E1代谢酶的参与。CYP2E1存在常见的单核苷酸多态,即由限制性内切酶PstI/RsaІ连锁识别的-1239G>C和-999C>T多态 [7] 。-1239G>C多态位于5’端的基因转录激活区域,是转录因子HNF1的结合区域,可影响基因表达水平 [8] 。研究显示,CYP2E1基因变异与一些复杂疾病的发生风险相关 [9] - [11] 。
本研究通过对230例胃癌患者和460例对照进行研究,探讨细胞色素P450 1A1 (CYP1A1)基因Ile462 Val位点以及CYP2E1基因-1239G>C位点多态和胃癌发病风险的关系。
2. 方法
2.1. 研究对象
本研究的病例来自2008年3月至2012年12月在唐山工人医院和唐山肿瘤医院经病理确诊的230例胃癌患者。健康对照组为460例来自唐山地区健康体检个体,无既往肿瘤史,并按年龄(±5岁)和性别与病例组频数匹配。以查阅病历资料的方法收集研究对象的一般人口学资料及临床病理资料,并获得知情同意和伦理审查通过。以累计吸烟量(吸烟指数,包-年)表示研究对象的吸烟量情况,则吸烟指数(包/年) = 每日吸烟支数 ÷ 20 × 吸烟年数。25包·年为病例组和对照组中所有吸烟者的吸烟指数的中位数。以中位数值来界定轻度和重度吸烟情况,则<25包·年为轻度吸烟者,≥25包·年为重度吸烟者。研究对象均捐献2 ml静脉血,用于基因组DNA提取。
2.2. 基因型检测
以聚合酶链反应—限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)方法对CYP1A1Ile462Val以及CYP2E1-1239G>C基因进行分型。
2.2.1. CYP1A1基因型检测
PCR扩增引物为:PF 5′-CTC ACC CCT GAT GGT GCT AT-3′,PR 5′-TTT GGA AGT GCA CAG CAG-3′。25 mL PCR反应体系含0.1 mg模板DNA、0.5 mmol/L各引物、0.2 mmol/L dNTP、1.5 mmol/L MgCl2、1.5 U TaqDNA聚合酶。反应条件为95℃预变性2 min;94℃ 45 s、60℃ 45 s、72℃ 45 s,共35个循环;72℃延伸10 min。CYP1A1基因PCR扩增产物为281 bp。取4 mL PCR产物与限制性内切酶BsrDI于65℃温育过夜。酶切产物经2%琼脂糖凝胶电泳,EB染色后观察等位基因分型。462Ile等位基因由于含有BsrDI酶切位点,在电泳图谱上可见195 bp、86 bp两个片段,而462Val等位基因由于不含BsrDI酶切位点,在电泳图谱上仅可见281 bp一个片段。
2.2.2. CYP2E1基因型检测
PCR引物分别为CYP2E1 410F:5’-TTC ATT CTG TCT TCT AAC TGG-3’和CYP2E1 410R:5’-CCA GTC GAG TCT ACA TTG TCA -3’。由10 ng模板DNA,0.3 µM引物,2.5 mM MgCl2,1.25 mM dNTPs,1.5U DNA聚合酶组成25 µL PCR反应体系。PCR反应条件为:94oC 预变性3 min后,于94℃ 2 min,55℃ 30 s,72℃ 30 s进行35个循环,最后72℃延伸5 min,得到扩增产物410 bp。产物中分别加入限制性核酸内切酶Pst І (NEB, England) 37℃温育过夜。酶切产物于2%琼脂糖凝胶电泳分析。Pst I酶切产物:-1239GG基因型为410 bp 1个片断;-1239CC基因型产生290 bp和120 bp 2个片断;-1239GC基因型为410 bp、290 bp、120 bp 3个片断(图1)。
为了保证基因分型的准确性,我们随机挑选35例患者(15.3%)和69名健康人(15.0%)进行重复试验,结果与前一次完全一致。
2.3. 统计学分析
采用c2检验分析病例组和对照组的年龄、性别、吸烟状况以及基因型频率的差异。以非条件logistic回归模型计算的比值比(Odds Ratio,OR)及其95%可信区间(95% confidence interval, 95% CI)评价各种基因型与胃癌遗传易感性的相关关系。统计分析用SPSS 17.0进行,所有统计检验均为双侧概率检验,ORs及其95% CI经年龄、性别、吸烟状况校正,P < 0.05表示差异具有显著统计学意义。
 (a)
(a)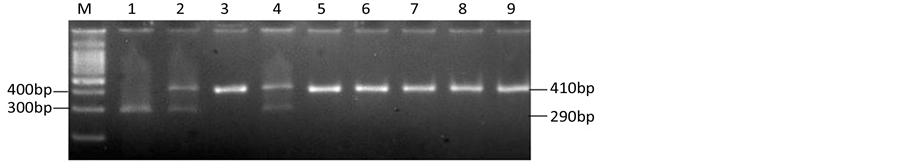 (b)A.测序图谱B.酶切图谱(-1239CC基因型:泳道1;-1239CG基因型:泳道2和4;-1239GG基因型:泳道3、5-9)
(b)A.测序图谱B.酶切图谱(-1239CC基因型:泳道1;-1239CG基因型:泳道2和4;-1239GG基因型:泳道3、5-9)
Figure 1. Genotyping of CYP2E1-1239G>C by PCR-RFLP
图1. CYP2E1-1239G>C遗传变异各基因型测序及酶切图谱
3. 结果
3.1. 研究对象基本资料
表1列出研究对象的基本人口学特征。胃癌病例230例,其中男性170例(73.9%),女性60例(26.1%),平均年龄59岁;460名对照人群中男女分别为337人(73.3%病例组和对照组性别构成和年龄分布配比均衡,无统计学差异(P > 0.05)。病例组和对照组中吸烟者比例分别为33.5%和48.0%,差异具有显著性(P<.001)。吸烟分层分析显示,重度吸烟者(≥25包/年)在病例组和对照组中分别为37例(48.1%)和110例(49.8%),差异无统计学意义(P > 0.05)。
3.2. 遗传变异与胃癌遗传易感性的关系
CYP1A1Ile462Val和CYP2E1-1239G>C多态与GC发病风险的关系如表2所示。对照组中CYP1A1 Ile462Val和CYP2E1-1239G>C各基因型分布均符合Hardy-Weinberg平衡定律(χ2 = 0.085, 0.557; P = 0.96, 0.76)。以性别、年龄和吸烟情况作为校正进行Logistic回归分析显示,与CYP1A1 462 Ile/Ile基因型携带者相比,Val/Val携带者患胃癌风险降低69% (OR = 0.31, 95% CI = 0.16 - 0.60, P = 0.001);与CYP2E1-1239GG基因型相比,-1239CG或CC基因型在胃癌组和对照组中的分布差异无统计学意义(P > 0.05)。
3.3. 吸烟情况对遗传变异与GC发病风险的影响
如表3,将CYP1A1Ile462Val和CYP2E1-1239G>C遗传变异与GC发病风险相关关系进行吸烟分层分析发现,在吸烟人群中,至少携带一个CYP1A1462Val等位基因者与未携带者相比,患GC的风险降低了59% (OR = 0.41; 95% CI = 0.24 - 1.43);且这种保护作用在重度吸烟患者中尤为明显(OR = 0.29; 95% CI = 0.14 - 0.64; P = 0.002)。而在吸烟组中,CYP2E1-1239CG基因型或CC基因型与-1239GG基因型相比,差异均无统计学意义(P > 0.05)。
4. 讨论
细胞色素P450酶(CYP家族)是体内最为重要的致癌物代谢酶,它可将无活性的前致癌物转变为亲电
Table 1. General data of persons
表1. 研究对象的基本资料
Table 2. The association of the genetic variation in CYP1A1, CYP2E1 with the risk of gastric cancer
表2. CYP1A1,CYP2E1遗传变异与胃癌发病风险的关系
子化合物,后者可与DNA或蛋白质形成加合物,并导致突变发生,进而引发癌变 [12] 。CYP1A1起到激活前致癌物的主要作用,具有芳烃羟化酶(arylhyarocarbon hydroxylase, AHH)活性,是PAHs (苯并芘)等前致癌物在体内代谢最重要的酶。该基因存在有多个遗传变异,研究结果表明,其中位于第7外显子的Ile462Val (rs1048943)多态位于血红素结合区,该区域与酶活性密切相关,一级结构上氨基酸残基的改变对于酶的催化功能可能会产生影响,使得不同基因型个体对不同类型肿瘤表现出不同程度的易感性 [13] 。国内外有关于CYP1A1Ile462Val多态与胃癌发病风险相关关系的报道,然而由于种族和地区的不同,样
Table 3. Analysis of the relationship between the genotype of and the risk of gastric cancer by smoking
表3. CYP1A1,CYP2E1基因型与胃癌发病风险关系的吸烟分层分析
本研究例数较少,所得结果也不尽相同。李浩等在包括102例胃癌病例的研究中报道,462Val/Val基因型携带者比462Ile/Ile基因型携带者患胃癌的风险增加13倍 [14] ;而一项关于此遗传变异与胃癌的meta分析研究显示,CYP1A1Ile462Val多态与胃癌发病并无相关关系。本研究则针对230例胃癌患者及其与之频数匹配的正常对照进行了研究,在增加样本量的同时,还特定针对吸烟因素进行了分析。研究发现,携带462Val/Val基因的个体罹患GC的风险较462Ile/Ile基因型携带者降低69%。体内研究证实,CYP1A1462 Ile/Val基因型和462Val/Val基因型较462Ile/Ile基因型改变转化酶的结构与活性 [15] 。这和我们的病例对照研究结果一致,可能是由于该变异减弱了对致癌物前体的转化作用,从而使胃癌的发病风险降低。而吸烟分层结果显示,该遗传变异对于胃癌发病的影响仅限于吸烟个体,尤其是重度吸烟个体,其机制并不十分清楚,可能是烟草中的致癌物质改变了CYP1A1该位点的遗传变异,需进一步实验证实。
CYP2E1基因定位于10q24. 3,由9个外显子和8个内含子共11413个碱基组成,编码493个氨基酸组成的功能蛋白酶 [16] 。目前已经报道的CYP2E1基因多态位点共6种,其中Pst I/Rsa I连锁多态(-1239G>C和-999C>T)位于CYP2E1基因启动子区转录因子HNF1的结合区域,可影响基因表达水平 [8] 。本研究结果显示,CYP2E1-1239G>C变异与胃癌的发病风险无相关关系。
本研究发现中国北方汉族人群中CYP1A1462Val等位基因的携带者罹患胃癌的风险大大降低,而且这种保护作用在重度吸烟人群中更为明显,提示CYP1A1在胃癌发病过程中发挥着重要作用。
文章引用
宋浩瑞,张佳桢,吴 双,曹 蕾. CYP1A1和CYP2E1基因多态与胃癌易感性关系的研究
Research on Association of Genetic Polymorphism of CYP1A1 and CYP2E1, with Susceptibility to Gastric Cancer[J]. 亚洲肿瘤科病例研究, 2016, 05(04): 72-78. http://dx.doi.org/10.12677/ACRPO.2016.54008
参考文献 (References)
- 1. Siegel, R., Naishadham, D. and Jemal, A. (2012) Cancer Statistics, 2012. CA: A Cancer Journal for Clinicians, 62, 10-29. http://dx.doi.org/10.3322/caac.20138
- 2. Crew, K.D. and Neugut, A.I. (2006) Epidemiology of Gastric Cancer. World Journal of Gastroenterology, 12, 354-362. http://dx.doi.org/10.3748/wjg.v12.i3.354
- 3. 庞莉萍, 崔景荣. 细胞色素P450 1A1的研究进展[J]. 国外医学遗传学分册, 2005, 28(2): 80-83.
- 4. Aktas, D., Guney, I., Alikasifoglu, M., Yuce, K., Tuncbilek, E. and Ayhan, A. (2002) Cyp1a1 Gene Polymorphism and Risk of Epithelial Ovarian Neoplasm. Gynecologic Oncology, 86, 124-128. http://dx.doi.org/10.1006/gyno.2002.6720
- 5. Sato, M., Sato, T., Izumo, T. and Amagasa, T. (2000) Genetically High Susceptibility to Oral Squamous Cell Carcinoma in Terms of Combined Genotyping of Cyp1a1 and Gstm1 Genes. Oral Oncology, 36, 267-271. http://dx.doi.org/10.1016/S1368-8375(99)00090-1
- 6. Brasch, R.C. (1992) New Directions in the Development of MR Imaging Contrast Media. Radiology, 183, 1-11. http://dx.doi.org/10.1148/radiology.183.1.1549653
- 7. Zhan, P., Wang, J., Zhang, Y., Qiu, L.X., Zhao, S.F., Qian, Q., Wei, S.Z., Yu, L.K. and Song, Y. (2010) Cyp2e1 Rsa I/Pst I Polymorphism Is Associated with Lung Cancer Risk among Asians. Lung Cancer, 69, 19-25. http://dx.doi.org/10.1016/j.lungcan.2009.09.001
- 8. Bartsch, H., Nair, U., Risch, A., Rojas, M., Wikman, H. and Alexandrov, K. (2000) Genetic Polymorphism of Cyp Genes, Alone or in Combination, as a Risk Modifier of Tobacco-Related Cancers. Cancer Epidemiology, Biomarkers & Prevention, 9, 3-28.
- 9. Cantor, K.P., Villanueva, C.M., Silverman, D.T., Figueroa, J.D., Real, F.X., Garcia-Closas, M., Malats, N., Chanock, S., Yeager, M., Tardon, A., Garcia-Closas, R., Serra, C., Carrato, A., Castano-Vinyals, G., Samanic, C., Rothman, N. and Kogevinas, M. (2010) Polymorphisms in GSTT1, GSTZ1, and CYP2E1, Disinfection By-Products, and Risk of Bladder Cancer in Spain. Environmental Health Perspectives, 118, 1545-1550. http://dx.doi.org/10.1289/ehp.1002206
- 10. Guo, X., Zeng, Y., Deng, H., Liao, J., Zheng, Y., Li, J., Kessing, B. and O’Brien, S.J. (2010) Genetic Polymorphisms of CYP2E1, GSTP1, NQO1 and MPO and the Risk of Nasopharyngeal Carcinoma in a Han Chinese Population of Southern China. BMC Research Notes, 3, 212. http://dx.doi.org/10.1186/1756-0500-3-212
- 11. Wu, R.M., Cheng, C.W., Chen, K.H., Shan, D.E., Kuo, J.W., Ho, Y.F. and Chern, H.D. (2002) Genetic Polymorphism of the CYP2E1 Gene and Susceptibility to Parkinson’s Disease in Taiwanese. Journal of Neural Transmission, 109, 1403-1414. http://dx.doi.org/10.1007/s00702-002-0721-8
- 12. Kawajiri, K., Nakachi, K., Imai, K., Yoshii, A., Shinoda, N. and Watanabe, J. (1990) Identification of Genetically High Risk Individuals to Lung Cancer by DNA Polymorphisms of the Cytochrome P450IA1 Gene. FEBS Letters, 263, 131-133. http://dx.doi.org/10.1016/0014-5793(90)80721-T
- 13. 何冰, 林佳, 曹蕾, 饶娟, 刘英文, 张志. CYP1A1 Ile462Val多态与小细胞肺癌遗传易感性相关[J]. 卫生研究, 2014, 43(3): 393-396.
- 14. Li, H., Chen, X.L. and Li, H.Q. (2005) Polymorphism of Cypia1 and GSTM1 Genes Associated with Susceptibility of Gastric Cancer in Shandong Province of China. World Journal of Gastroenterology, 11, 5757-5762. http://dx.doi.org/10.3748/wjg.v11.i37.5757
- 15. Smith, G.B., Harper, P.A., Wong, J.M., Lam, M.S., Reid, K.R., Petsikas, D. and Massey, T.E. (2001) Human Lung Microsomal Cytochrome P4501A1 (CYP1A1) Activities: Impact of Smoking Status and CYP1A1, Aryl Hydrocarbon Receptor, and Glutathione S-Transferase M1 Genetic Polymorphisms. Cancer Epidemiology, Biomarkers & Prevention, 10, 839-853.
- 16. Raunio, H., Hakkola, J., Hukkanen, J., Lassila, A., Paivarinta, K., Pelkonen, O., Anttila, S., Piipari, R., Boobis, A. and Edwards, R.J. (1999) Expression of Xenobiotic-Metabolizing CYPs in Human Pulmonary Tissue. Experimental and Toxicologic Pathology, 51, 412-417. http://dx.doi.org/10.1016/S0940-2993(99)80031-1
