Advances in Microbiology
Vol.04 No.01(2015), Article ID:14919,8
pages
10.12677/AMB.2015.41003
Diversity of Pathogenic Microbimes Associated with Bovine Mastitis across Different Regions of China
Xininigen Tang1,2, Jingli Yu3,4,5,6*, Ji Zhao3,5,6
1College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot Inner Mongolia
2Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease, Ministry of Agriculture, Hohhot Inner Mongolia
3College of Environment and Resources, Inner Mongolia University, Hohhot Inner Mongolia
4College of Life Sciences, Inner Mongolia University, Hohhot Inner Mongolia
5Inner Mongolia Key Laboratory of Environmental Pollution Control & Waste Resource Reuse, Hohhot Inner Mongolia
6Sino-US Center for Conservation, Energy Science in Inner Mongolia, Hohhot Inner Mongolia
Email: xnng@163.com, *hot-yjl@163.com
Received: Feb. 24th, 2015; accepted: Mar. 7th, 2015; published: Mar. 10th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
It is a prerequisite for clarifying etiological factors and preventing and controlling bovine mastitis effectively to explore diversity of pathogenic microbiomes in mastitis-affected cow milk from different regions. The number of populations/taxonomic groups and diversity of the pathogenic microbimes, gained by traditional culture and conventional identification methods, were statistically analyzed using Excel software. The results showed that S-values for populations/taxonomic groups of the pathogenic microbimes from Beijing, Shenyang, Shihezi, Weinan, Xuzhou, Shanghai were 9, 4, 12, 5, 7, 14, respectively. Among total 21 populations/taxonomic groups, 3 ones shared by six regions, 10 ones shared by two-five regions. The rest 8 populations/taxonomic groups were endemism. 1, 3, 1, 3 ones was/were unique to Beijing, Shihezi, Xuzhou, Shanghai, respectively. The diversity of pathogenic microbiomes from different regions differed greatly, associated with the number of populations/groups (i.e. S-values). With the increase of S-values for populations/ taxonomic groups, Shannon-Wiener richness index (0.29 - 0.75) and Simpson dominance index (0.65 - 0.91) showed the reverse and same trend, respectively, while Pielou evenness index (1.10 - 1.50) had no significant regularity. The regional differences in diversity of pathogenic microbimes of bovine mastitis were caused by many possible factors. It is suggested that the influence of climate and seasonal variations, herd and individual differences, different management regimes (e.g. housing and hygienic measures) on the diversity of pathogenic microbimes should be in-depth study at the unified research scale in future.
Keywords:Different Regions, Bovine Mastitis, Pathogenic Microbimes, Diversity

我国不同地区奶牛乳房炎病原菌群落 多样性特征
唐·希尼尼根1,2,于景丽3,4,5,6*,赵吉3,5,6
1内蒙古农业大学兽医学院,内蒙古 呼和浩特
2农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特
3内蒙古大学环境与资源学院,内蒙古 呼和浩特
4内蒙古大学生命科学学院,内蒙古 呼和浩特
5内蒙古自治区环境污染控制与废物资源化重点实验室,内蒙古 呼和浩特
6中美生态、能源及可持续性科学内蒙古研究中心,内蒙古 呼和浩特
Email: xnng@163.com, *hot-yjl@163.com
收稿日期:2015年2月24日;录用日期:2015年3月7日;发布日期:2015年3月10日

摘 要
探究不同地区奶源病原菌群落多样性特征是搞清发病诱因和有效防控奶牛乳房炎的前提条件。利用Excel统计分析传统培养和常规鉴定获得的病原菌群落种群/类群数及其多样性。结果显示:北京、沈阳、石河子、渭南、徐州、上海病原菌群落种群/类群数S值为9、4、12、5、7、14。总计21个种群/类群中,3个为六地区共享、10个为二至五个地区共享、8个为某个地区独有。8个独有群中北京、石河子、徐州、上海分别占1、3、1、3个。不同地区病原菌群落多样性指数差异大,与种群/类群数S值有关。Shannon-Wiener丰富度指数(0.29~0.75)和Simpson优势度指数(0.65~0.91)随着S值变化分别有相反和相同的变化趋势,Pielou均匀度指数(1.10~1.50)随S值变化无明显规律。不同地区奶牛乳房炎病原菌群落多样性影响因素可能是多重的。建议统一研究尺度,搞清驱动奶牛乳房炎病原菌群落多样性的关键因素(气候与季节、畜群与个体、圈舍条件与卫生措施)。
关键词 :不同地区,奶牛乳房炎,病原菌群,多样性

1. 引言
奶牛乳房炎(bovine mastitis)全球盛行诱因复杂。目前全世界约有2.31亿头奶牛[1] ,每年因乳房炎造成的损失高达350亿美元[2] 。奶牛乳房炎是病原菌感染等多因素共同作用的结果(图1)。为此,奶牛乳房炎病原菌的分离鉴定成为众多领域竞相研究的热点问题[1] [3] -[8] 。目前已分离鉴定的病原菌约150多种[1] [3] [4] ,包括细菌、藻类、酵母菌、真菌、支原体和病毒等[1] [3] -[8] 。我国积累了大量奶牛乳房炎病原菌分离鉴定的资料[1] [3] - [7] ,但缺乏疾病流行和预防相关的病原菌多样性等背景资料。
生物多样性本质是一种具有多重价值且高度综合的资源形式(图2),是人类赖以生存的基础。自地球形成至今,地球上共出现约1亿几千万种的生物,包括37万种植物、150万种动物和1.5亿以上种微生物。早在几个世纪前生态学家们开始对地球上动植物等宏生物多样性进行研究,并积累了大量关于不同时空尺度上生物多样性与生态系统功能等资料[9] ,大大丰富了生态学理论基础。相比而言,微生物多样性时空分布动态及对机体健康的响应研究相对滞后,尽管微生物在全球生物地球化学循环和人类健康中发挥重要作用。研究表明,奶牛乳房炎病原菌因时间、空间、畜间和牛体健康程度差异而有所不同[1] [3] - [7] 。为此,本文基于我国不同地区近三年报道的文献资料[1] [3] - [7] ,解析不同地区奶牛乳房炎病原菌群落的多样性特征,以期为今后奶牛乳房炎的流行病学调查重点和早期防控提供研究思路和导向。
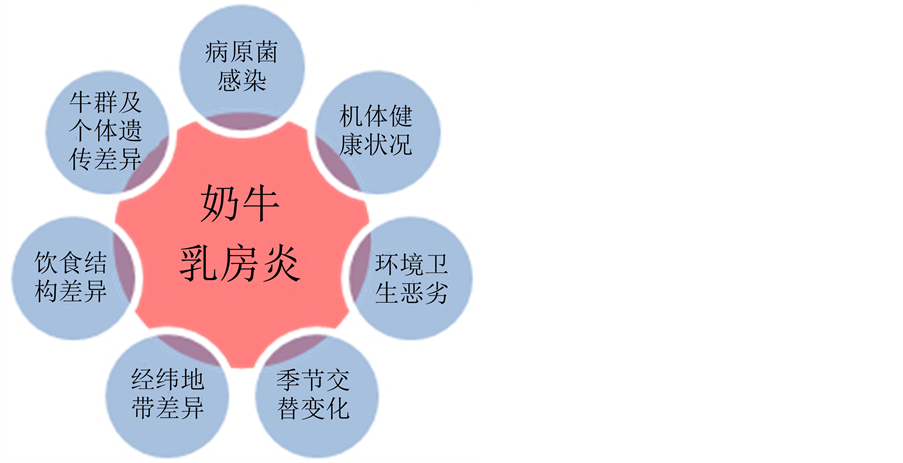
Figure 1. The incidence of cow mastitis associated with etiological factors
图1. 奶牛乳房炎关联的发病因素
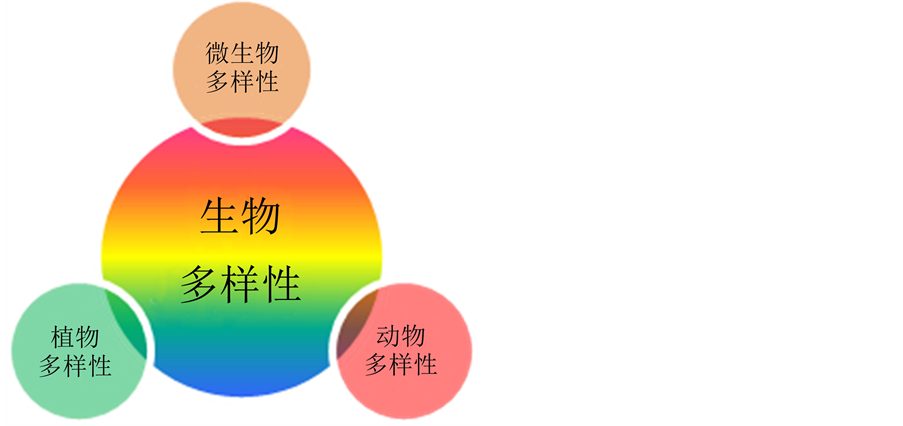
Figure 2. The types of biodiversity
图2. 生物多样性的类型
2. 材料与方法
2.1. 微生物群落多样性的涵义及病原菌的来源
通常生物多样性包括基因多样性、物种→种群→群落多样性和生态系统多样性等层次。由于微生物数目庞大且种类复杂,微生物群落(Microbime)并非宏观生态学中种群(Population)的有规律组合,而是门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)、种(Species)等分类尺度上不同类群(Group)有独特运动规律的有机组合。为此本文所选奶牛乳房炎病原菌群落基本为种属水平上种群/类群的组合或没有明确种属类别的霉菌群及其他群。选择不同地区的奶牛乳房炎病原菌作为研究材料(表1),这些病原菌都通过传统分离培养和常规的形态学及生理生化鉴定方法获得。
2.2. 病原菌的分离培养及常规鉴定方法
2.2.1. 病原菌的分离培养及形态学鉴定
将无菌采集的乳样充分摇匀,分别划线接种于普通营养琼脂、伊红美蓝琼脂、鲜血琼脂、SS 琼脂和麦康凯琼脂等培养基[1] [3] - [7] ,标记好后置37℃恒温箱培养24~48 h,观察病原菌的生长情况及其菌落特征。挑取不同形态的菌落进行纯培养后,涂片染色镜检。根据菌体形态和染色特性,初步判定病原菌类别[1] [3] - [7] 。
2.2.2. 病原菌的生理生化鉴定
将上述初步鉴定的球菌、链球菌或杆菌等分离株进行血浆凝固酶、过氧化氢酶、三糖铁、甘露醇发酵、O/F鉴定试验(葡萄球菌) [1] [3] - [7] ;溶血及美蓝牛乳试验,甘露醇、山梨醇、血清菊糖发酵试验,七叶苷、马栗苷、马尿酸盐的利用试验、CAMP试验(链球菌) [1] [3] - [7] ;尿素酶及过氧化氢酶试验、糖类发酵试验、枸橼酸盐利用试验、明胶液化试验(肠杆菌) [1] [3] - [7] 。根据试验结果判定病原菌种类:① 圆形、金黄色/灰白色/柠檬色菌落,且接触酶、凝固酶和甘露醇发酵试验阳性的细菌鉴定为金黄色葡萄球菌[6] 。② 镜检形态符合链球菌特性,且接触酶试验阴性的细菌鉴定为链球菌属,若细菌CAMP试验阳性,不水解七叶苷和马尿酸钠则为无乳链球菌;若细菌CAMP试验阴性,不水解七叶苷和马尿酸钠则为停乳链球菌;若细菌CAMP试验阴性,水解七叶苷和马尿酸钠则为乳房链球菌[6] 。③ G-杆菌氧化酶试验阴性,麦康凯琼脂培养基上形成红色菌落,伊红美蓝琼脂培养基上形成紫黑色带金属光泽菌落,在三糖铁琼脂培养产酸或产气,不分解尿素,V-P试验阴性的细菌即鉴定为大肠杆菌[6] 。
2.3. 统计方法及分析指标
用Excel2007软件对有明确种属或没有明确种属的病原菌种群/类群进行统计分析。计算不同地区奶牛乳房炎病原菌群落组成及其相对丰度(检出率),并进行基本图形绘制。计算各地区病原菌群落多样性指数。计算方法:(1) Shannon-Wiener丰富度指数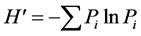 ,(2) Simpson优势度指数
,(2) Simpson优势度指数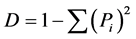 ,(3) Pielou均匀度指数
,(3) Pielou均匀度指数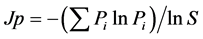 式中:S—所在病原菌群落所有病原菌种群/类群数目;N—所在病原菌群落所有种群/类群中个体数之和;Ni—所在群落具体种群/类群i的个体数;
式中:S—所在病原菌群落所有病原菌种群/类群数目;N—所在病原菌群落所有种群/类群中个体数之和;Ni—所在群落具体种群/类群i的个体数;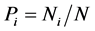 。
。
3. 结果与讨论
3.1. 我国不同地区奶牛乳房炎病原菌群落种群/类群组成
北京、沈阳、石河子、渭南、徐州、上海等地区分离的奶源性奶牛乳房炎病原菌群落种群/类群数(S值)分别为9、4、12、5、7、14个,总计21个种群/类群(图3)。其中,6个地区共享种群有3个(图4),属于相对丰度较高的优势种群,包括5.8%~37.5%的金黄色葡萄球菌(Staphylococcus aureus)、12.2%~19.1%
Table 1. The basic information about pathogenic microbiome of mastitis-affected cow milk
表1. 奶牛乳房炎奶源病原菌基本信息
X*:文献中未提及数据信息;X*:the data information is not mentioned in the literature。
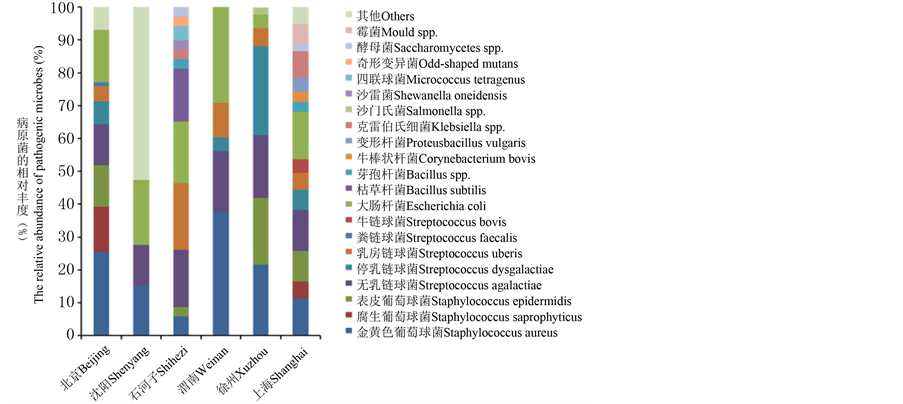
Figure 3. The compositions of pathogenic microbimes isolated from mastitis-affected cow milk in different regions of China
图3. 我国不同地区奶牛乳房炎病原菌群落组成

Figure 4. The compositions of pathogenic microbimes isolated from mastitis-affected cow milk in different regions of China
图4. 我国不同地区奶牛乳房炎病原菌群落组成
无乳链球菌(Streptococcus agalactiae)和4.2%~29.2%大肠杆菌(Escherichia coli)。总计8个种群/类群为某个地区特有,其中北京、石河子、徐州、上海分别占有1、3、1、3个种群/类群(图4),相对丰度较低。其中,北京特有1.1%的粪链球菌(Streptococcus faecalis),石河子特有16%的枯草杆菌(Bacillus subtilis)、2.9%的沙雷菌(Shewanella oneidensis)和4.3%的四联球菌(Micrococcus tetragenus),徐州特有2.2%的沙门氏菌(Salmonella spp.),上海特有4.1%的牛链球菌(Streptococcus bovis)、3.1%的牛棒状杆菌(Corynebacterium bovis)和4.1%的变形杆菌(Proteusbacillus vulgaris)。另外10个种群/类群为2~5个地区共享,芽孢杆菌(2.9%~3.1%)、克雷伯氏菌(2.9%~8.2%)和酵母菌(2.1%~2.9%)相对罕见均为2地区所共有;葡萄球菌属和链球菌属中的种群相对丰富(图3)。值得说明的是,沈阳报道的“其他”微生物实为乳房链球菌、肺炎克雷伯菌、化脓链球菌等16类病原菌[8] 在内的混合菌,因文献中没有逐一计算每类病原菌的相对丰度,视为其他菌群(Others)。
尽管文献报道的奶牛乳房炎病原菌多达150余种[1] [3] [4] ,但本研究所选六个地区奶源性奶牛乳房炎病原菌共21个种群/类群(图3),包括明确到“种”名的葡萄球菌、链球菌和大肠杆菌等共15个种群;明确到“属”名的芽孢杆菌(Bacillus spp.)、克雷伯氏细菌(Klebsiella spp.)、沙门氏菌(Salmonella spp.)3个细菌属和酵母菌(Saccharomycetes spp.)1个真菌属共4个类群;文献报道的1个霉菌类群和1个其他微生物类群并非分类学名称,因无详细说明,推测霉菌可能是一个属或多个属的混合性真菌;其他微生物文献中没做说明[1] [3] [7] 。病原菌种属名称划分模糊大大限制了对病原菌物种多样性的认识,因此明确划分病原菌种属是将来科学认识其物种多样性的前提条件。
引起不同地区病原菌种群/类群数不同的原因可能是多方面的。Deb等[10] 对大量资料分析指出不同地区间奶牛乳房炎病原菌种群/类群差异和区域间气候差异有关;张雪梅等[11] 以新疆乌鲁木齐市的新疆褐牛、荷斯坦牛奶样为研究对象,发现2个品种牛感染病原菌种类稍有差别且新疆褐牛感染葡萄球菌的机率明显高于荷斯坦牛,荷斯坦牛比新疆褐牛更容易患乳房炎,这说明奶牛品种差异对病原菌种群/类群数有影响;曹立亭等[12] 通过体外观察奶牛乳房炎主要病原菌在牛奶中的分布情况,发现上层病原菌菌落数显著高于中、下层(p < 0.001),病原菌经乳头管侵入后可随牛奶中的脂肪滴上浮侵入到乳腺的深层组织,证实了病原菌在乳腺不同部位间的移位现象;邓海平等[13] 研究发现无乳链球菌与金黄色葡萄球菌等传染性病原菌则通过挤奶过程接触传播,而表皮葡萄球菌、乳房链球菌、绿脓杆菌、大肠杆菌、停乳链球菌等环境性致病菌则主要通过牛体、泥土、粪便等介质传播,证实了病原菌种群/类群由体外环境向体内乳腺的空间移位现象。因此,病原菌在机体不同部位间和体外体内环境间的移位现象是造成奶牛乳房炎的关键因素。
迄今尚无直接的资料证实奶牛乳房炎病原菌种群/类群差异和饲料类型密切相关,但细菌移位和基因水平转移现象的普遍存在以及饲料类型对牛粪菌群结构影响的间接证据很多。例如,Shanks等[14] 研究证实牛粪细菌群落组成和饲料中淀粉浓度显著相关,Kim等[15] 研究证实不同日粮影响奶牛粪便细菌多样性。因此,细菌移位(Bacterial Translocation, BT)和基因水平转移(Horizontal Gene Transfer, HGT)的存在以及植物源饲料对牛粪菌群结构的关联性为解释牛粪菌群变化和奶牛乳房炎病原菌种群/类群关联性提供了间接依据。
综上所述,区域间差异、畜群及奶牛物种品系差异、植物源饲料及药物差异可能直接或间接影响不同地区奶牛乳房炎病原菌种群/类群数,本研究所选六地区虽未提及上述因素对病原菌种群/类群数的影响,但不排除上述因素的相关性。另外,微生物对实验条件变化非常敏感,本研究所选六地区奶牛乳房炎奶源性病原菌的采样规模、采样方法、培养和分离鉴定方法有细微区别[1] [3] [7] ,可能对不同地区病原菌种群/类群数有影响。因此,研究时空尺度和技术分析手段等不统一问题也可能是造成不同地区奶牛乳房炎病原种群/类群数量差异的重要方面。
3.2. 我国不同地区奶牛乳房炎致病菌的多样性特征
由图5可知,我国不同地区奶牛乳房炎病原菌多样性不同。Shannon-Wiener丰富度多样性指数在0.29~ 0.75之间,Simpson优势度指数在0.65~0.91之间,Pielou均匀度指数在1.10~1.50之间。其中,沈阳地区奶牛乳房炎病原菌的丰富度指数和均匀度指数最高,优势度指数最低;相反上海地区奶牛乳房炎病原菌的丰富度指数和均匀度指数最低,优势度指数最高。群落多样性本质是物种多样性,本研究发现不同地区奶牛乳房炎优势病原菌种群/类群数及具体种群/类群中个体数量(相对丰度)对多样性指数有重要影响。沈阳地区奶牛乳房炎病原菌群落虽然只有3个种群和1个混合菌组成的其他菌群,但混合菌群的累积相对丰度高达52.7%,因此对多样性指数贡献最大。渭南地区5个病原菌种群中仅金黄色葡萄球菌(Staphylococcus aureus)相对丰度占37.5%、大肠杆菌(Escherichia coli)相对丰度占29.2%,两种优势菌对多样性指数贡献均较大,因此渭南地区Shannon-Wiener丰富度指数和Pielou均匀度指数均较高,位居所选六地区第二位。
3.2.1. Shannon-Wiener丰富度指数的地区分布特征
Shannon-Wiener丰富度指数排序为沈阳0.75 > 渭南0.55 > 徐州 > 北京0.37 > 石河子0.35 > 上海0.29。本研究发现Shannon-Wiener丰富度指数变化趋势恰好和种群或类群数量(S值)相反,即种群或类群数目S值越大(沈阳4 < 渭南5 < 徐州7 < 北京9 < 石河子12 < 上海14,丰富度指数越低。因此,六个地区奶牛乳房炎病原菌种群或类群数目是驱动Shannon-Wiener丰富度指数高低的重要因素。
3.2.2. Simpson优势度指数的地区分布特征
Simpson优势度指数排序为沈阳0.65 < 渭南0.73 < 徐州< 北京0.85 < 石河子0.86 < 上海0.91。本研究发现Simpson优势度指数变化趋势和种群或类群数S值的变化趋势相同,与Shannon-Wiener丰富度指数变化趋势相反。即种群或类群数量S值越大(沈阳4 < 渭南5 < 徐州7 < 北京9 < 石河子12 < 上海
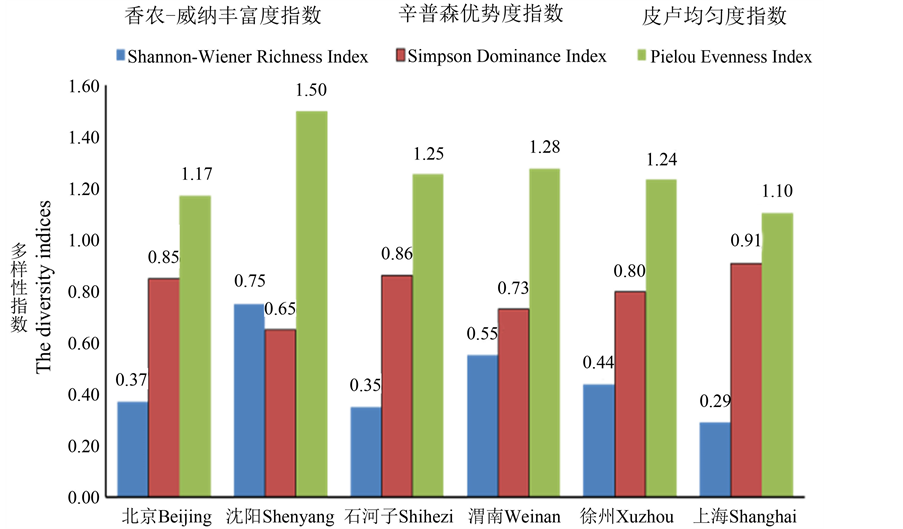
Figure 5. The diversity indices of pathogenic microbimes isolated from mastitis-affected cow milk in different regions of China
图5. 我国不同地区奶牛乳房炎病原菌的多样性指标
14,优势度指数越高;而丰富度指数越高则优势度度指数越低。因此,六个地区奶牛乳房炎病原菌种群或类群数目同样是驱动Simpson优势度指数变化的关键因素。
3.2.3. Pielou均匀度指数的地区分布特征
Pielou均匀度指数排序为沈阳1.50 > 渭南1.28 > 石河子1.25 > 徐州1.24 > 北京1.17 > 上海1.10。本研究发现影响Pielou均匀度指数高低的因素相对复杂,不仅和种群或类群数量有关,还和具体种群或类群间相对丰度差异大小有关。大体上,种群或类群数量越少、具体种群或类群间相对丰度差异越大均匀度指数越高。
病原菌在特定体内外环境下感染乳房是奶牛乳房炎发病的重要原因,因此特定的体内外环境因素对病原菌群落多样性的影响不容忽视(图1)。本研究所选六地区虽未具体研究时间、空间、牛群及个体间变异对病原菌多样性的影响,但不排除不同纬度或经度地区气候及季节变化对病原菌群多样性的影响[1] [16] [17] 。另外,现代集约化养殖中圈舍及卫生条件等可能是影响病原菌群多样性的重要因素[1] [3] [5] [6] [17] -[20] 。
Olde等[21] 研究病原菌发现乳房链球菌及大肠杆菌引起的临床乳腺炎分别和牧场及圈舍条件有关,且优势病原菌受季节差异影响大。Justice-Allen等[22] 认为适宜温度和降雨是促进再生砂垫层支原体诱发奶牛乳房炎的重要环境条件。Gordon等[23] 研究发现圈舍内外环境和管理措施差异均对临床型乳房炎发病率有重要影响。Abera等[24] 和Lakew等[25] 证实环境卫生条件、泌乳阶段及奶牛健康状况是诱发病原菌侵染乳房的重要因素,Roesler等[26] 发现动物自身差异是影响奶牛乳房炎病原菌空间变化的重要因素。
4. 结论
生物群落多样性本质是物种多样性,本研究发现不同地区奶牛乳房炎病原菌群落多样性和种群/类群数及其相对丰度密切相关。不同地区间奶牛乳房炎病原菌群落多样性存在差异,可能与区域气候差异、地理位置、季节更替、畜群及个体差异、不同的管理措施和卫生条件有关,也可能和研究过程中检测或分析方法不同有关。建议统一研究尺度排除人为冗余因素干扰,客观准确寻找驱动奶牛乳房炎病原菌群落多样性的关键因素。
基金项目
感谢国内优秀学者对奶牛乳房炎病原菌分离鉴定提供的文献资料,感谢国家自然科学基金项目(No. 41361053)、内蒙古自然科学基金项目(No. 2011MS0603)和国家科技部“973计划”前期研究项目(No. 2009CB125909)的支持。
文章引用
唐•希尼尼根,于景丽,赵吉, (2015) 我国不同地区奶牛乳房炎病原菌群落多样性特征
Diversity of Pathogenic Microbimes Associated with Bovine Mastitis across Different Regions of China. 微生物前沿,01,11-19. doi: 10.12677/AMB.2015.41003
参考文献 (References)
- 1. 刘长彬, 钟发刚, 卢春霞, 康立超, 李永刚, 姜志涛, 刘岗, 罗小玲 (2014) 新疆石河子地区隐性乳房炎致病菌调查及分离鉴定. 江苏农业科学, 5, 181-184.
- 2. 李克勋 (2012) 奶牛乳房炎的诊断方法与预防措施. 养殖技术顾问, 1, 141-141.
- 3. 曹授俊, 蔡泽川 (2012) 北京某地区奶牛隐性乳房炎病原菌的分离鉴定及药敏试验. 山东畜牧兽医, 4, 7-9.
- 4. 李心海, 王兵, 张林吉, 迟兰 (2014) 奶牛乳房炎病原菌的分离鉴定及药敏试验. 黑龙江畜牧兽医, 5, 68-69.
- 5. 孙芳芳, 何剑斌 (2014) 沈阳地区奶牛乳房炎细菌分离鉴定与优势菌株药敏试验. 现代畜牧兽医, 2, 44-47.
- 6. 李娟娟, 魏恒, 王韦华 (2013) 奶牛乳房炎病原菌的分离鉴定及药敏试验. 中国草食动物科学, 3, 53-56.
- 7. 高潮, 刘国庆, 连英琪, 朱明, 余晓峰, 张克春 (2013) 奶牛隐性乳房炎病原菌的分离鉴定与DGGE追溯. 上海交通大学学报, 3, 88-94.
- 8. Kulkarni, A.G. and Kaliwal, B.B. (2013) Review article bovine mastitis: A review. International Journal of Recent Scientific Research, 4, 543- 548.
- 9. Fierer, N., Leff, J.W., Adams, B.J., Nielsen, U.N., Bates, S.T., Lauber, C.L., Owens, S., Gilbert, J.A., Wall, D.H. and Caporaso, J.G. (2012) Cross-biome metagenomic analyses of soil microbialcommunities and their functional attributes. Proceedings of the National Academy of Sciences of the United States of America, 109, 21390-21395.
- 10. Deb, R., Kumar, A., Chakra-borty, S., Verma, A.K., Tiwari, R., Dhama, K., Singh, U. and Kumar, S. (2013) Trends in diagnosis and control of bo-vine mastitis: A review. Pakistan Journal of Biological Sciences, 16, 1653-1661.
- 11. 张雪梅, 刘明军, 谭立新, 张宁, 玛依拉 (2009) 新疆褐牛与荷斯坦牛隐性乳房炎与体细胞数、病原菌种类的比较. 中国畜牧兽医, 6, 112-115.
- 12. 曹立亭, 胡松华 (2010) 奶牛乳房炎主要致病菌在牛奶中的分布. 安徽农业科学, 34, 19541-19542.
- 13. 邓海平, 俞诗源, 王玲, 蒲万霞 (2008) 呼和浩特及周边地区奶牛乳房炎病原菌的分离鉴定及药敏实验. 中国草食动物, 28, 51-52.
- 14. Shanks, O.C., Kelty, C.A., Archibeque, S., Jenkins, M., Newton, R.J., McLellan, S.L., Huse, S.M. and Sogin, M.L. (2011) Community structures of fecal bacteria in cattle from different animal feeding operations. Applied and Environmental Microbiology, 77, 2992-3001.
- 15. Kim, M., Kim, J., Kuehn, L.A., Bono, J.L., Berry, E.D., Kalchayanand, N., Freetly, H.C., Benson, A.K. and Wells, J.E. (2014) Investigation of bacterial diversity in the feces of cattle fed different diets. Journal of Animal Sciences, 92, 683- 694.
- 16. 王娜, 高学军 (2011) 哈尔滨地区奶牛隐性乳房炎病原菌的分离鉴定. 东北农业大学学报, 2, 29-32.
- 17. 陈礼明, 熊焰 (2004) 成都等地区奶牛临床型乳房炎病原种类及分布. 中国兽医杂志, 3, 18-19.
- 18. 刘朝, 王京仁, 张成栋, 吴波, 韩永佩, 赵波, 余亚, 王建华, 刘友斌, 程贵宝, 冯哲, 田地, 陈焕春, 郭爱珍 (2007) 湖北地区奶牛乳房炎病原菌的分离鉴定与耐药性分析. 中国奶牛, 7, 35-38.
- 19. 杨永新, 程广龙, 赵瑞宏, 陈胜, 赵辉玲 (2009) 安徽部分地区奶牛乳房炎病原菌的分离鉴定和药敏试验. 动物医学进展, 6, 113-115.
- 20. 寨鸿瑞, 田甜, 王开功, 周碧君, 文明 (2008) 奶牛隐性乳房炎病原菌的分离鉴定及药敏试验. 动物医学进展, 11, 40-43.
- 21. Olde, R.G.M., Barkema, H.W. and Stryhn, H. (2007) The effect of season on somatic cell count and the incidence of clinical mastitis. Journal of Dairy Science, 90, 1704-1715.
- 22. Justice-Allen, A., Trujillo, J., Corbett, R., Harding, R., Goodell, G. and Wilson, D. (2010) Survival and replication of Mycoplasma species in recycled bedding sand and association with mastitis on dairy farms in Utah original research article. Journal of Dairy Science, 93, 192-202.
- 23. Gordon, P.F., van den Borne, B.H.P., Reist, M., Kohler, S. and Doherr, M.G. (2013) Questionnaire-based study to assess the association between management practices and mastitis within tie-stall and free-stall dairy housing systems in Switzerland. BMC Veterinary Research, 9, 200.
- 24. Abera, M., Habte, T., Aragaw, K., Asmare, K. and Sheferaw, D. (2012)Major causes of mastitis and associated risk factors in smallholder dairy farms in and around Hawassa, Southern Ethiopia. Tropical Animal Health and Production, 44, 1175-1179.
- 25. Lakew, M., Tolosa, T. and Tigre, W. (2009) Prevalence and major bacterial causes of bovine mastitis in Asella, South Eastern Ethiopia. Tropical Animal Health and Production, 41, 1525-1530.
- 26. Roesler, U., Polleichtner, A., Slavic, D., Leslie, K.E. and Kelton, D.F. (2012) Herd characteristics and cow-level factors associated with Prototheca mastitis on dairy farms in Ontario, Canada. Journal of Dairy Science, 95, 5635-5644.
