Biophysics
Vol.
07
No.
03
(
2019
), Article ID:
31938
,
8
pages
10.12677/BIPHY.2019.73005
Research Advances of the Long Non-Coding RNA RMRP RNA Promoting the Osteoblastic Differentiation
Hong Fu, Wenqin Hou, Tailin Guo*
College of Medicine, Southwest Jiaotong University, Chengdu Sichuang

Received: Aug. 7th, 2019; accepted: Aug. 22nd, 2019; published: Aug. 29th, 2019

ABSTRACT
RMRP RNA is a long non-coding RNA. Mutations in the different sites, including regulation regions and transcription regions, of RMRP RNA are sources of some autosomal recessive skeletal dysplasia. One of them is CHH. RMRP RNA can form a endonuclease RNase MRP to exert it’s function. Or it produce two microRNAs (RMRP-S1 and RMRP-S2) through the Dicer enzyme-dependent pathway to regulate cells. RMRP RNA is most involved in the research of cancer. It is farely understood that how RMRP RNA is engaged in the differentiation of osteoblast. In this review, we will state the process of osteoblast differentiation and the relationship between substrates of RNase MRP, RMRP-S1 and RMRP-S2 and the osteoblastic differentiation to promote the follow-up study of the molecular mechanism of RMRP RNA in the osteoblastic differentiation.
Keywords:RMRP RNA, Osteoblastic Differentiation, RNase MRP, RMRP-S1/2, Substrates
长链非编码RNA RMRP RNA促成骨分化的 研究进展
付洪,侯文青,郭泰林*
西南交通大学医学院,四川 成都

收稿日期:2019年8月7日;录用日期:2019年8月22日;发布日期:2019年8月29日

摘 要
RMRP RNA是一个长链非编码RNA。RMRP RNA不同位点的突变,包括转录区和调控区的突变会导致几种常染色体隐性的骨骼发育不良,其中之一是CHH。RMRP RNA可以通过形成核酸内切酶RNase MRP发挥功能,或者通过Dicer酶依赖途径产生2种microRNA,即RMRP-S1和RMRP-S2,调控细胞。与RMRP RNA研究相关最多的方面是关于癌症的发生,在成骨分化中研究很少。该综述从成骨发育过程,RNase MRP、RMRP-S1和RMRP-S2的底物与成骨发育的可能的关系几个方面进行阐述,为后续研究RMRP RNA在成骨发育中的分子机制提供一个参考。
关键词 :RMRP RNA,成骨发育,RNase MRP,RMRP-S1/2,底物

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
RMRP RNA (RNA component of mitochondrial RNA processing endoribonuclease)是一个长链非编码RNA,在不同的真核生物中是高度同源的。在大鼠和小鼠中,RMRP RNA的长度都是275 bp,其同源性为95%。在大鼠中的RMRP RNA也叫做7-2 RNA,在人类中RMRP RNA的长度是277 bp [1] 。在RMRP RNA基因中没有内含子。RMRP RNA是一个多功能的长链非编码RNA。它可以和一些蛋白亚基形成RNase MRP (mitochondrial RNA processing endoribonuclease)核酸内切酶复合物 [2] ,或者和端粒酶相关的逆转录蛋白结合形成一个RNA依赖的RNA聚合酶。此外RMRP RNA还可以通过Dicer (ribonuclease III)酶切途径产生2种miRNA,即RMRP-S1和RMRP-S2。RMRP RNA基因的突变会导致严重的侏儒症,其中一种称为软骨-毛发发育不良CHH (Cartilage-Hair Hypoplasia) [3] ,CHH也称为干骺端软骨发育不良。到目前为止,已有超过90个RMRP RNA基因中的致病性突变位点被发现。这些突变位于转录区或在近端启动子区,通常在位于TATA盒和转录起始位点之间。启动子突变会导致RMRP基因的转录量改变。而转录区域的突变则通常影响RNase MRP复合物组装、酶活性、亚细胞定位、底物识别或RMRP-S1和RMRP-S2底物的特异性 [4] 。一些突变位点会造成细胞有丝分裂不正常 [5] 。CHH的特点是短肢侏儒症伴异常生长板发育以及其它可能症状包括贫血,稀疏的头发,先天性巨结肠疾病,受损的t细胞免疫力和支气管受损。此外,成年患者更易患某些癌症(如鳞状细胞癌、非霍奇金淋巴瘤和基底细胞癌) [1] 。RMRP RNA在癌细胞增殖、转移和侵染都有较多的研究 [6] 。在与成骨发育相关疾病研究的较多的是不同RMRP RNA的突变位点造成的生长板发育不良。分子机制上的研究尚未被阐明。该篇文章探讨RMRP RNA的功能和可能的参与成骨发育的分子机制。
2. 软骨内成骨过程
骨骼发育过程中的纵向骨生长和肢体的生长方式是软骨内成骨。软骨内成骨在发育的长骨生长板中进行,是一个多阶段的过程。生长板分为增殖区、肥厚区和重塑区。增殖期由高度增殖的软骨细胞组成,它们分化成矿化肥大的软骨细胞,就是肥厚期。这些软骨细胞要么死于凋亡,要么转化为成骨细胞,此时就进入重塑区。而细胞外矿化基质(ECM)为成骨细胞和破骨细胞的粘附和重塑提供了一个支架,为骨的形成和后来的长骨生长和四肢发育奠定基础。在生长板的增殖区,Sox9 (SRY-box transcription factor 9)促进II型胶原Col2a1表达,是这增殖区软骨的主要标志。Runx2 (Runx family transcription factor 2)和Mef2c促进X型胶原Col10a1在软骨分化肥厚期的表达 [7] ,此为肥厚区的标志物。许多在各个时期表达的,且对长骨生长板发育至关重要的基因的突变也会导致生长板发育不良。
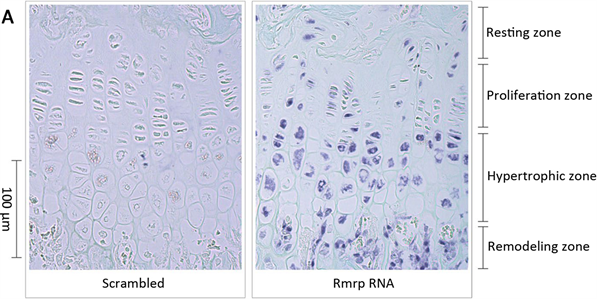
Figure 1. The distribution of RMRP RNA in the grouth plate of mouse
图1. RMRP RNA在小鼠生长板的表达情况(200倍放大倍数) [1]
3. RMRP RNA能够促进软骨内成骨
RMRP RNA在长骨生长板的肥厚区和重塑区都是高表达的,在增殖期则是低表达(图1)。在当RMRP RNA从成骨分化一开始就被siRNA下调时,成骨细胞分化严重受损,与成骨细胞分化密切相关的基因Runx2和Alp (alkaline phosphatase)等的表达减少(p < 0.05)。此外胞外基质矿化,糖胺聚糖含量也减少,总体而言RMRP RNA被抑制时会导致细胞肥厚期和肥厚期以后的成骨分化时期被抑制,对细胞的增殖期则是促进作用。这说明RMRP RNA对成骨细胞分化具有正调控作用。此外,在成骨细胞分化过程中起重要作用的WNT (WNT family member)信号通路和BMP-2 (Bone Morphogenetic Protein 2)信号通路会提高RMRP RNA的表达,且BMP-2对RMRP RNA表达的促进作用要远远大于WNT信号通路 [1] 。这是从细胞层面来讲,RMRP RNA能促进成骨细胞分化。这与从个体宏观层面由于RMRP RNA不同位点的突变造成的CHH是相互印证的。但分子层面的具体机制还未清楚。
4. RNase MRP的结构与功能
RNase MRP是一种小的核仁核蛋白(snoRNP)颗粒,由RMRP长链非编码RNA (lncRNA)和10个蛋白质亚基(Rpp14、Rpp20、Rpp21、Rpp25、Rpp30、Rpp38、Rpp40、hPop1、hPop4和hPop51)组成(图2)。RNase MRP广泛存在于真核生物中,是一种核糖核酸内切酶,可裂解多种RNA底物。目前已知的RNase MRP的底物有Viperin mRNA [8] ,CLB2 (cyclin B2) mRNA [9] 和pre-rRNA [10] (图3)。Viperin蛋白与机体抗病毒有关,一些少量的白细胞介素和病毒感染都可以大量诱导Viperin蛋白的表达 [11] 。Viperin蛋白在软骨内成骨过程中的作用尚不清楚。和Viperin mRNA以及CLB2 mRNA不同,RNase MRP对pre-rRNA的切割是对pre-rRNA进行加工,促进rRNA的成熟。rRNA是核糖体的组成成分,参与蛋白质的翻译。
RNase MRP底物的CLB2与成骨发育的可能关系
CLB2是一个细胞周期蛋白,在有丝分裂过程中起着重要作用。CLB2与CDK1 (cyclin dependent kinase 1) 结合,使其底物磷酸化,调控有丝分裂。CLB1 (cyclin B1)和CLB2都可以与CDK1结合,它们在约100个N端氨基酸中存在差异。其余约300个C端氨基酸的CLB1和CLB2有57%同源性。一些底物都可以
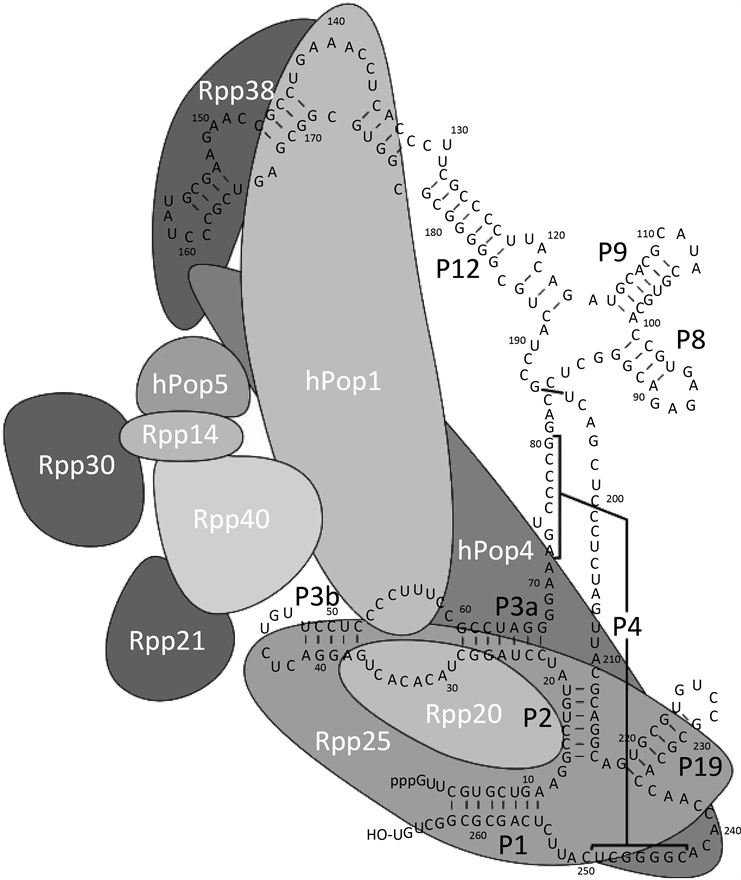
Figure 2. The structure of RNase MRP
图2. RNase MRP的结构 [3]
被CLB1和CLB2结合的CDK1磷酸化。但是CLB1的底物较多,而且比CLB2更重要,因为完全敲除CLB1的小鼠在未出生之前就死亡,而CLB2敲除的小鼠则可以存活,但相比正常小鼠它的重量较轻,体积较小 [12] 。目前已知的CDK1的底物有Runx2、YAP (Yes associated protein 1)和TAZ (tafazzin)。它们都与BMSCs向成骨细胞分化有关。CDK1磷酸化Runx2的S472位点,改变其转录活性 [13] 。YAP在T119,S289和S3673个位点被CDK1磷酸化,从而增强YAP的转录活性,使其在细胞增殖中发挥更好的作用 [14] 。尽管YAP和TAZ被视为高度同源的2个蛋白,TAZ在S90、S105、T326和T346这4个位点被CDK1磷酸化以后,却会使TAZ的转录活性降低,抑制TAZ的功能。这3个蛋白是否能够被CDK1和CLB2的复合物所磷酸化需要被进一步的实验证明。
已知的CLB2和CDK1复合物的底物包括GM130 (Golgi matrix protein 130 kD)。GM130是顺式高尔基体的基质蛋白,它分布在高尔基体,微管和内质网上。与p115 (USO1 vesicle transport factor),巨蛋白,GRASP65 (golgi reassembly stacking protein 1)和Rab GTPases(ras-related gtp-binding protein)等高尔基体相关蛋白相互作用,维持高尔基体的结构,参与细胞极性形成,有丝分裂纺锤体组装,控制糖基化,参与膜泡运输。CLB2和CDK1复合物磷酸化GM130的SER25位点,这会造成GM130无法和p115锚定蛋白结合,在G2/M期参与COPI囊泡介导的高尔基体的囊泡化。COPI (coat protein I)囊泡主要参与高尔基体向内质网的蛋白运输,负责回收内质网相关蛋白,维持内质网正常的结构与功能。此外也有文献证明了COPI也参与了原骨胶原从内质网到高尔基体的运输。包括I型胶原前体。I型胶原在成骨细胞基质矿化的作用是为磷酸钙沉淀提供一个附着位点,从而促进基质矿化。这可能是一个RMRP RNA如何促进成骨细胞胞外基质矿化的一个分子机制,值得进一步思考并证明。CLB2在细胞有丝分裂时期起作用,能够促进细胞增殖。在长骨生长板肥厚期的细胞增殖速度慢,在这个时期RMRP RNA的表达量最高。因此RMRP RNA也可能通过降低CLB2,从而促进生长板增殖期细胞向肥厚期转化 [1] 。

Figure 3. Substrates of RNase MRP
图3. RNase MRP的作用底物 [8] [9] [10]
5. RMRP-S1和RMRP-S2的底物
RMRP RNA通过Dicer酶依赖性途径产生2种miRNA,即RMRP-S1和RMRP-S2。RMRP RNA某些位点突变能导致人CHH,一些致病突变则位于RMRP-S1和RMRP-S2上。不同于siRNA,miRNA作用于底物只需要部分碱基配对就能够使其底物被切割降解。因此RMRP-S1和RMRP-S2都存在许多的作用底物。目前已知的RMRP-S1的底物有RNU4ATAC (RNA, U4ATAC small nuclear)、RBBP9 (RB binding protein 9, serine hydrolase)和MTDH (metadherin)等。并没有发现与成骨发育相关的基因。在众多的RMRP-S2底物中,有2个基因已经明确参与成骨细胞的发育,即PTcH2 (patched 2)和Sox4 (SRY-box transcription factor 4) (图4) [15] 。
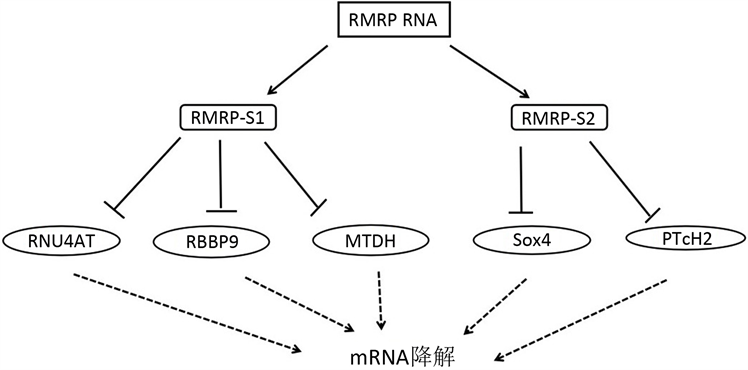
Figure 4. Substrates of RMRP-S1 and RMRP-S2
图4. RMRP-S1和RMRP-S2的底物 [15]
5.1. RMRP-S2的底物Ptch2在成骨发育中的作用
人Ptch2基因DNA大约15 Kb,总共22个外显子,它的翻译产物含有1203个氨基酸,推断蛋白结构有12个跨膜区(TM)和2个特别大的细胞外环。这个环是HH配体的结合位点。PTcH2和PTcH1是高度同源的,它们都可以介导HH信号通路。不同的HH (hedgehog signaling molecule)配体,包括SHH (sonic hedgehog signaling molecule)、IHH (Indian hedgehog signaling molecule)、DHH (desert hedgehog signaling molecule),对2者的亲和性也是相似的。和PTcH1 (patched 1)一样,PTcH2介导HH信号通路。在没有HH信号通路配体时,PTcH2结合smo (smoothened, frizzled class receptor),并抑制smo的活性,从而抑制下游相关的信号通路。当有HH配体时,PTcH2会结合该配体,释放smo,从而激活下游相关信号通路。特别的是,完全敲除PTcH2的小鼠并没有明显的疾病或缺陷发生,但当同时半敲除PTcH1时,这会使PTcH1半敲除造成的疾病机率增加 [16] 。SHH和IHH都参与成骨细胞分化,IHH主要在成骨细胞分化的增殖期和肥厚期之间的前肥厚期表达,它的作用是促进成骨细胞分化的增殖期向肥厚期的转化。比如它可以通过和非经典的WNT5A (WNT family member 5A)信号通路一起相互作用诱导Bapx1 (NK3 homeobox 2)蛋白的降解 [17] ,Bapx1的作用是促进细胞增殖和抑制Runx2的表达 [18] 。此外IHH还可以促进PTHrP (parathyroid hormone like hormone)的表达来促进软骨细胞的增殖,从而促进长骨生长板的增殖期,过量表达的PTHrP会抑制成骨分化 [19] 。SHH主要是在成骨细胞分化的增殖期起作用。但要想弄清楚RMRP-S2如何通过PTcH2调节成骨细胞分化和发育,还需要进一步进行实验证明。
5.2. RMRP-S2的底物Sox4与成骨的关系
Sox4是另一个参与成骨细胞发育的基因。Sox4包含Sox家族特有的高移动性(HMG)区,在人类,老鼠,鱼和鸡等动物中是高度保守的。可表达于大脑,肺,性腺,胸腺和心脏。它与淋巴细胞分化有关。转录因子Sox4对胎儿发育至关重要,Sox4−/−纯合子小鼠在子宫内死亡。Sox4的mRNA是表达于胚胎早期生长板并由甲状旁腺激素调节,Sox4+/−小鼠的骨量相对正常小鼠显著降低(p < 0.05)。Sox4主要表达在成骨细胞发育的重塑区,其功能是促进OCN (bone gamma-carboxyglutamate protein)和Osx (Sp7 transcription factor)的表达 [20] (图5)。RMRP RNA在重塑区的表达也是比较高的,而来源于RMRP RNA的RMRP-S2会导致Sox4的降解。但RMRP-S2具体如何调控Sox4,需要进一步的实验验证。
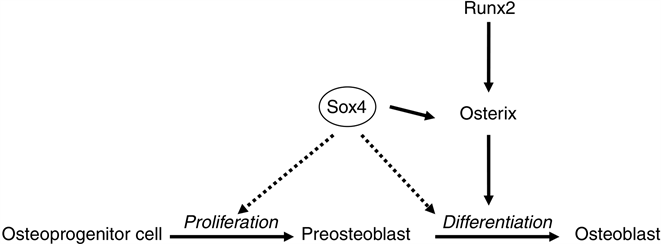
Figure 5. The function of Sox4 in the osteoblastic differentiation
图5. Sox4在成骨细胞发育中的作用示意图 [20]
6. 结语
目前除了已知的在成骨细胞分化过程中起作用的有Sox4、PTcH2以外,还没有明确发现其它与RNase MRP、RMRP-S1和RMRP-S2相关的基因参与成骨细胞分化。且RMRP RNA在成骨发育过程中如何具体时空性的调控PTcH2和Sox4也尚未阐明。考虑到RMRP RNA通过RNase MRP、RMRP-S1和RMRP-S2还拥有大量的底物,要想弄清楚RMRP RNA在促进细胞向成骨方向分化中具体的分子机制,仍然需要大量基础研究的积累。只有这样,才会一步步揭开RMRP RNA在成骨细胞分化中作用的分子机制,从而为治疗因为RMRP RNA基因突变造成的长骨生长板发育不良相关的疾病提供理论基础和可能。
文章引用
付 洪,侯文青,郭泰林. 长链非编码RNA RMRP RNA促成骨分化的研究进展
Research Advances of the Long Non-Coding RNA RMRP RNA Promoting the Osteoblastic Differentiation[J]. 生物物理学, 2019, 07(03): 49-56. https://doi.org/10.12677/BIPHY.2019.73005
参考文献
- 1. Steinbusch, M.M.F., Caron, M.M.J., Surtel, D.A.M., Friedrich, F., Lausch, E., Pruijn, G.J.M., Verhesen, W., Schroen, B.L.M., van Rhijn, L.W., Zabel, B. and Welting, T.J.M. (2017) Expression of RMRP RNA Is Regulated in Chondrocyte Hypertrophy and Determines Chondrogenic Differentiation. Scientific Reports, 7, Article No. 6440. https://doi.org/10.1038/s41598-017-06809-5
- 2. Zhu, Y., Stribinskis, V., Ramos, K.S. and Li, Y. (2006) Se-quence Analysis of RNase MRP RNA Reveals Its Origination from Eukaryotic RNase P RNA. RNA, 12, 699-706. https://doi.org/10.1261/rna.2284906
- 3. Welting, T.J., van Venrooij, W.J. and Pruijn, G.J. (2004) Mutual Inter-actions between Subunits of the Human RNase MRP Ribonucleoprotein Complex. Nucleic Acids Research, 32, 2138-2146. https://doi.org/10.1093/nar/gkh539
- 4. Hermanns, P., Tran, A., Munivez, E., Carter, S., Zabel, B., Lee, B. and Leroy, J.G. (2006) RMRP Mutations in Cartilage-Hair Hypoplasia. American Journal of Medical Genetics. Part A, 140, 2121-2130. https://doi.org/10.1002/ajmg.a.31331
- 5. Hermanns, P., Bertuch, A.A., Bertin, T.K., Dawson, B., Schmitt, M.E., Shaw, C., Zabel, B. and Lee, B. (2005) Consequences of Mutations in the Non-Coding RMRP RNA in Cartilage-Hair Hypoplasia. Human Molecular Genetics, 14, 3723-3740. https://doi.org/10.1093/hmg/ddi403
- 6. Feng, W., Li, L., Xu, X., Jiao, Y. and Du, W. (2017) Up-Regulation of the Long Non-Coding RNA RMRP Contributes to Glioma Progression and Promotes Glioma Cell Proliferation and Invasion. Archives of Medical Science, 13, 1315-1321. https://doi.org/10.5114/aoms.2017.66747
- 7. Provot, S. and Schipani, E. (2005) Molecular Mechanisms of Endochondral Bone Development. Biochemical and Biophysical Research Communications, 328, 658-665. https://doi.org/10.1016/j.bbrc.2004.11.068
- 8. Mattijssen, S., Hinson, E.R., Onnekink, C., Hermanns, P., Zabel, B., Cresswell, P. and Pruijn, G.J. (2011) Viperin mRNA Is a Novel Target for the Human RNase MRP/RNase P Endoribonuclease. Cellular and Molecular Life Sciences, 68, 2469-2480. https://doi.org/10.1007/s00018-010-0568-3
- 9. Gill, T., Cai, T., Aulds, J., Wierzbicki, S. and Schmitt, M.E. (2004) RNase MRP Cleaves the CLB2 mRNA to Promote Cell Cycle Progression: Novel Method of mRNA Degradation. Molecular and Cellular Biology, 24, 945-953. https://doi.org/10.1128/MCB.24.3.945-953.2004
- 10. Welting, T.J., Kikkert, B.J., van Venrooij, W.J. and Pruijn, G.J. (2006) Differential Association of Protein Subunits with the Human RNase MRP and RNase P Complexes. RNA, 12, 1373-1382. https://doi.org/10.1261/rna.2293906
- 11. Teng, T.S., Foo, S.S., Simamarta, D., Lum, F.M., Teo, T.H., Lulla, A., Yeo, N.K., Koh, E.G., Chow, A., Leo, Y.S., Merits, A., Chin, K.C. and Ng, L.F. (2012) Viperin Re-stricts Chikungunya Virus Replication and Pathology. The Journal of Clinical Investigation, 122, 4447-4460. https://doi.org/10.1172/JCI63120
- 12. Joiner, D.M., Less, K.D., VanWieren, E. and Williams, B.O. (2013) Mice with Global Deletion of Mitogen Inducible Gene 6 Display Rapid and Severe Cartilage and Subchondral Bone Damage after Ligament and Meniscus Injury. Osteoarthritis and Cartilage, 21, S13-S14. https://doi.org/10.1016/j.joca.2013.02.049
- 13. Galindo, M., Pratap, J., Young, D.W., Hovhannisyan, H., Im, H.J., Choi, J.Y., Lian, J.B., Stein, J.L., Stein, G.S. and van Wijnen, A.J. (2005) The Bone-Specific Expression of Runx2 Os-cillates during the Cell Cycle to Support a G1-Related Antiproliferative Function in Osteoblasts. The Journal of Bio-logical Chemistry, 280, 20274-20285. https://doi.org/10.1074/jbc.M413665200
- 14. Yang, S., Zhang, L., Liu, M., Chong, R., Ding, S.J., Chen, Y. and Dong, J. (2013) CDK1 Phosphorylation of YAP Promotes Mitotic Defects and Cell Motility and Is Essential for Neo-plastic Transformation. Cancer Research, 73, 6722-6733. https://doi.org/10.1158/0008-5472.CAN-13-2049
- 15. Rogler, L.E., Kosmyna, B., Moskowitz, D., Bebawee, R., Rahimzadeh, J., Kutchko, K., Laederach, A., Notarangelo, L. D., Giliani, S., Bouhassira, E., Frenette, P., Roy-Chowdhury, J. and Rogler, C.E. (2014) Small RNAs Derived from lncRNA RNase MRP Have Gene-Silencing Activity Relevant to Human Cartilage-Hair Hypoplasia. Human Molecular Genetics, 23, 368-382. https://doi.org/10.1093/hmg/ddt427
- 16. Zaphiropoulos, P. (2011) PTCH2 (Patched Homolog 2 (Drosophila)). Atlas of Genetics and Cytogenetics in Oncology and Haematology. https://doi.org/10.4267/2042/38598
- 17. Mak, K.K., Chen, M.H., Day, T.F., Chuang, P.T. and Yang, Y. (2006) Wnt/Beta-Catenin Signaling Interacts Differentially with Ihh Signaling in Controlling Endochondral Bone and Synovial Joint Formation. Development, 133, 3695-3707. https://doi.org/10.1242/dev.02546
- 18. Yamashita, S., Andoh, M., Ueno-Kudoh, H., Sato, T., Miyaki, S. and Asahara, H. (2009) Sox9 Directly Promotes Bapx1 Gene Expression to Repress Runx2 in Chondrocytes. Experimental Cell Research, 315, 2231-2240. https://doi.org/10.1016/j.yexcr.2009.03.008
- 19. Zhang, M., Xie, R., Hou, W., Wang, B., Shen, R., Wang, X., Wang, Q., Zhu, T., Jonason, J.H. and Chen, D. (2009) PTHrP Prevents Chondrocyte Premature Hypertrophy by Induc-ing Cyclin-D1-Dependent Runx2 and Runx3 Phosphorylation, Ubiquitylation and Proteasomal Degradation. Journal of Cell Science, 122, 1382-1389. https://doi.org/10.1242/jcs.040709
- 20. Nissen-Meyer, L.S., Jemtland, R., Gautvik, V.T., Pedersen, M.E., Paro, R., Fortunati, D., Pierroz, D.D., Stadelmann, V.A., Reppe, S., Reinholt, F.P., Del Fattore, A., Rucci, N., Teti, A., Ferrari, S. and Gautvik, K.M. (2007) Osteopenia, Decreased Bone Formation and Impaired Osteoblast Development in Sox4 Heterozygous Mice. Journal of Cell Science, 120, 2785-2795. https://doi.org/10.1242/jcs.003855