Advances in Marine Sciences
Vol.03 No.02(2016), Article ID:17498,12
pages
10.12677/AMS.2016.32005
Phytoplankton Responses to Phosphorus in Sanggou Bay in Spring and Autumn
Wenqi Xu, Sumei Liu
Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao Shandong

Received: Apr. 11th, 2016; accepted: May 3rd, 2016; published: May 6th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Nutrient distribution, phytoplankton size structure and phytoplankton cell associated phosphorus characters of nanophytoplankton and picophytoplankton were studied during the two cruises in May and September of 2014. The results show that nutrients distributions have seasonal variation in Sanggou Bay due to aquaculture activities. Nutrient concentrations are lower in spring than in autumn. In spring and autumn, phosphorus would limit phytoplankton growth. Content of Chlorophyll a decreases from the east of Sanggou Bay to the west in spring, while in autumn the distribution trend is opposite. Phytoplankton is mainly dominated by nanophytoplankton in spring, while in autumn both nano- and pico-phytoplankton are the dominance of the community. From bay mouth to bay head, average size of phytoplankton is reduced both in spring and autumn. In- tracellular phosphorus is dominance of nano- and pico-phytoplankton total cellular phosphorus, which contributes to 64% - 93%. The results of correlation analysis between cell associated phos- phorus contents and nutrients indicated a distinct positive correlation between total cellular phosphorus, intracellular phosphorus of nanophytoplankton and DIP, DSi (r ≥ 0.796), but no correlation between cell associated phosphorus of picophytoplankton and nutrients (r < |0.402|).
Keywords:Sanggou Bay, Nutrients, Phytoplankton, Size Structure, Cell Associated Phosphorus

春季和秋季桑沟湾浮游植物对磷的响应
徐文琦,刘素美
中国海洋大学,海洋化学理论与工程技术教育部重点实验室,山东 青岛

收稿日期:2016年4月11日;录用日期:2016年5月3日;发布日期:2016年5月6日

摘 要
于2014年5月和9月对桑沟湾不同养殖区营养盐分布、浮游植物粒级结构和微型浮游植物(nanophy- toplankton, 2~20 μm)、微微型浮游植物(picophytoplankton, 0.2~2 μm)细胞不同结合态磷含量及影响因素进行了研究。结果表明:受养殖活动的影响,桑沟湾营养盐分布具有明显的季节变化,春季营养盐浓度低于秋季,春季和秋季磷酸盐是桑沟湾浮游植物生长的限制性营养盐;春季叶绿素a (Chla)含量从湾口向湾顶逐渐降低,浮游植物以nano-级浮游植物为主,秋季Chla与春季分布趋势相反,从湾口向湾顶逐渐升高,浮游植物以nano-级和pico-级为主,春季和秋季,从湾口向湾顶浮游植物呈小型化趋势;桑沟湾微型和微微型浮游植物细胞总磷均以细胞内结合态磷为主,占细胞总磷的比例为64%~93%,微型浮游植物细胞不同结合态磷的含量显著高于微微型浮游植物。微型和微微型浮游植物细胞总磷和细胞内结合态磷的含量与营养盐的相关性分析结果显示,微型浮游植物细胞总磷和细胞内结合态磷的含量与DIP、DSi有显著的正相关关系(r ≥ 0.796),而微微型浮游植物细胞不同结合态磷的含量与各项营养盐均没有显著的相关性(r < |0.402|)。
关键词 :桑沟湾,营养盐,浮游植物,粒级结构,细胞结合态磷

1. 引言
海洋中的磷是限制初级生产力的关键因子之一,作为海洋浮游植物赖以生存的一种必需营养元素,磷参与细胞的生长与能量传递等重要新陈代谢过程,是组成生命体必不可缺的结构和功能成分。在世界许多海区的生态系统中,磷可能是全部或部分光合作用群落的限制性营养盐 [1] ,例如马尾藻海 [2] - [4] 、地中海 [5] 和西北大西洋 [6] 。Redfield比值(106C:16N:1P) [7] 一直被认为是区分海洋中浮游植物氮限制和磷限制状态的标准。然而最近的研究结果充分证明,不同种类浮游植物之间、不同营养盐结构下,浮游植物细胞元素比值不同 [8] 。更有新的证据表明,浮游植物的元素比值受到细胞不同结合态磷(细胞内结合态磷和细胞表面吸附态磷)的影响 [9] 。细胞结合态磷中一部分以简单的非生物吸附的方式结合在细胞表面,并且可能是以无机磷酸盐的形式存在,剩余部分是细胞内部的生物磷库。浮游植物细胞表面吸附态磷在细胞总磷中所占比例与浮游植物的种类、所处生长阶段、细胞对磷的需求和外界磷酸盐的含量有关 [10] 。浮游植物细胞表面吸附态的磷和细胞内结合态磷的同时存在,说明浮游植物细胞对磷酸盐的吸收可能是两步的动力学过程:磷酸盐首先被吸附在细胞表面,再经过细胞膜进入细胞内部被利用。已报道的氮磷营养元素比值对Redfield比值的偏离可能是由于浮游植物细胞表面结合态磷的不同 [9] [10] 。因此,细胞表面吸附态磷和细胞内结合态磷的同时测定,对准确评价浮游植物氮限制和磷限制状态非常重要。在全球海洋环境下,不同海区氮磷比值受到众多因素的影响,例如陆源的输入、大气沉降、沉积物水界面交换和水生生物等。而在近岸生态系统中,大规模的海水养殖对海区生态环境尤其是营养盐结构和浮游植物群落结构的影响非常显著。例如,饵料的投入、水产品的收获和养殖生物的代谢活动等对水体中营养元素的比值、形态和分布造成影响。尤其是水产养殖造成的氮磷营养盐的输入和氮磷比值改变,能够改变浮游植物群落结构,促进有害藻华的产生,毒害养殖生物,影响生态环境 [11] [12] 。
桑沟湾是一个半封闭海湾,位于山东威海荣成市境内,湾口向东,与黄海相连。位于东亚季风区的桑沟湾,具有较显著的海洋性气候特征,冬季多偏北风,夏季多偏南风,降雨主要集中在6~9月,降雨量可占全年降雨总量的73.3%,12月至次年3月降雨量最少,约占全年降雨总量的7% (中国海湾志,1991)。注入桑沟湾的河流主要有沽河、巴河、桑干河和崖头河等。桑沟湾的潮汐特征为不正规半日潮和正规半日潮流,潮流基本属于往复流。涨潮时,海水由湾口的北部和中部流入湾内,南部流出湾外,落潮时相反 [13] 。桑沟湾是中国北方典型的海水综合养殖海湾,养殖的生物主要有海带、扇贝、牡蛎和鱼类等。在桑沟湾,海带主要养殖在水深较深、水交换通畅的湾口和湾外区,养殖周期为每年的10月份到次年的4~5月份;海带养殖区西部邻接海带养殖区的海域为贝藻混养区;贝藻混养区以西至东部湾顶为贝类养殖区,夏季和秋季为贝类代谢活动最强的季节;桑沟湾的西南部为鱼类网箱养殖区 [14] [15] 。高密度的海水养殖活动影响了海区的水动力条件,海带和养殖筏架阻挡了桑沟湾内外水流的交换作用 [16] 。受海带生长和扇贝代谢活动等影响,桑沟湾内浮游植物在不同季节营养盐限制因子不同 [17] [18] 。同时,受养殖滤食性贝类的影响,桑沟湾浮游植物优势种群由甲藻变为硅藻 [19] 。
本文在桑沟湾开展营养盐结构、浮游植物粒级结构和浮游植物细胞不同结合态磷的研究,探究不同粒径浮游植物对营养盐和养殖活动的响应,以及微型和微微型浮游植物对磷的吸收利用差异。
2. 实验方法
2.1. 样品采集
分别于2014年5月12日(春季)和2014年9月23日在桑沟湾不同养殖区选取站位,调查区域及采样站位如图1所示。所有站位采集表、底层溶解态营养盐样品,每个养殖区选取一个站位(SG-1、SG-3、SG-6、SG-13、SG-15)采集表层颗粒态磷、分粒级Chla、微型和微微型浮游植物细胞不同结合态磷样品。
采集表、底层海水,用0.4 μm聚碳酸酯滤膜过滤,滤液−20℃冷冻保存,用于测定各溶解态营养盐;滤膜−20℃保存,烘干后用于测定总颗粒态磷(Total Particle Phosphorus, TPP)和颗粒态无机磷(Particle Inorganic Phosphorus, PIP)。采集表层海水,200 μm筛绢除去大型浮游动物后,分级过滤得到不同粒径Chla样品,滤膜−20℃避光保存。

Figure 1. Location of different aquaculture zones and stations for the cruises of SGB in May and September of 2014
图1. 桑沟湾各养殖区及2014年5月和9月调查站位分布图
微型、微微型浮游植物细胞不同结合态磷样品采集:采集表层海水,微型浮游植物过滤前,先用20 μm筛绢除去小型浮游植物,微微型浮游植物过滤前,先用2 μm聚碳酸酯滤膜除去小型和微型浮游植物。为区分浮游植物细胞内结合态磷和细胞表面吸附态磷,采用草酸盐淋溶试剂 [20] 将吸附在细胞表面的磷除去,测定淋溶后滤膜上浮游植物样品磷的含量,为浮游植物细胞内结合态磷(Intracelluar phosphorus);与此同时,过滤一份浮游植物样品,不经草酸盐淋溶试剂淋溶,直接测定得浮游植物细胞总磷(Total phosphorus)的含量,二者的差值即为浮游植物细胞表面吸附态磷(Cell surface-adsorbed phosphorus)的含量,滤膜−20℃避光保存。
2.2. 样品测定与分析
使用德国SEAL公司Auto Analyzer (AA3)连续流动分析仪测定海水中溶解态营养盐,各项精密度 < 3%。铵氮(NH4-N)采用次溴酸钠氧化法手工测定。溶解无机氮(DIN)为NH4-N、NO2-N和NO3-N三者之和。TDN和TDP采用碱性过硫酸钾氧化法分别转化为NO3-N和DIP后测定 [21] 。TDN与DIN的差值为溶解有机氮(DON),TDP与DIP的差值为溶解有机磷(DOP)。颗粒态无机磷(PIP)和总颗粒态磷(TPP)采用Aspila等(1976) [22] 的方法测定,TPP在颗粒态有机磷(POP)为TPP与PIP的差值。使用近海海洋沉积物成分分析标准物质(GBW07314)进行回收率、准确度和精密度测定,回收率约为93.9%,PIP精密度为0.96% (n = 7),TPP精密度为1.1% (n = 7),POP精密度为5.8% (n = 7)。
Chla的测定采用荧光分光光度法,方法精密度为3.4%。
浮游植物细胞不同结合态磷的测定采用混酸消解法:样品膜烘干称重后,放于消解罐内,加入盐酸、硝酸、氢氟酸,密封后170℃~175℃消解约30小时。消解结束后,将酸液蒸发至近干,加入硝酸1 mL,用Milli-Q水稀释,NaOH溶液调节pH,磷钼蓝法测定总磷。方法回收率和精密度分别为98.1%、0.90% (n = 5)。
用MapViewer 7.2软件作图,分析春季和秋季桑沟湾各养殖区微型、微微型浮游植物细胞不同结合态磷含量和分布趋势。用SPSS 11.5软件分析微型、微微型浮游植物细胞不同结合态磷的含量与各形态营养盐的相关性。
2.3. 浮游植物粒级指数
为了用单一参数表征浮游植物粒径结构,本文采用浮游植物粒级指数(SI, size index)的方法 [23] 来粗略指示调查期间桑沟湾浮游植物的粒级结构。此方法中首先分别设定50,5和1 μm为小型浮游植物、微型浮游植物和微微型浮游植物的平均中值粒径,则SI为各粒径浮游植物的中值粒径与其在总浮游植物中所占比例的乘积加和,即

式中,a、b、c分别表示微微型、微型和小型浮游植物在总浮游植物中所占比例。
3. 结果与讨论
3.1. 春季和秋季桑沟湾各养殖区营养盐浓度
春季和秋季桑沟湾各养殖区调查站位营养盐浓度见图2。湾内春季和秋季NH4-N的浓度分别为1.16~3.08、1.85~4.74 μmol∙L−1,分别占DIN的45%、39%;NO3-N的浓度分别为1.35~3.18、0.59~4.85 μmol∙L−1,分别占DIN的51%、42%,NO3-N是DIN的主要存在形式;DSi的浓度分别为3.52~11.3、4.78~18.4 μmol∙L−1;DIP的浓度分别为0.09~0.29、0.11~0.59 μmol∙L−1,DIP的浓度高于DOP,表层水体TDP浓度高于TPP。桑沟湾春季和秋季DIN:DIP:DSi分别为22:1:27和33:1:40,与Redfield比值相比较,桑沟
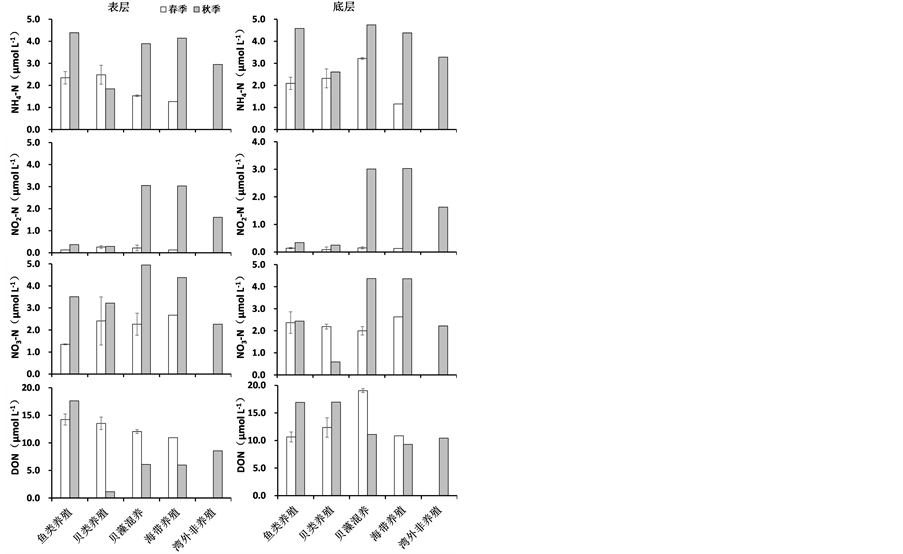
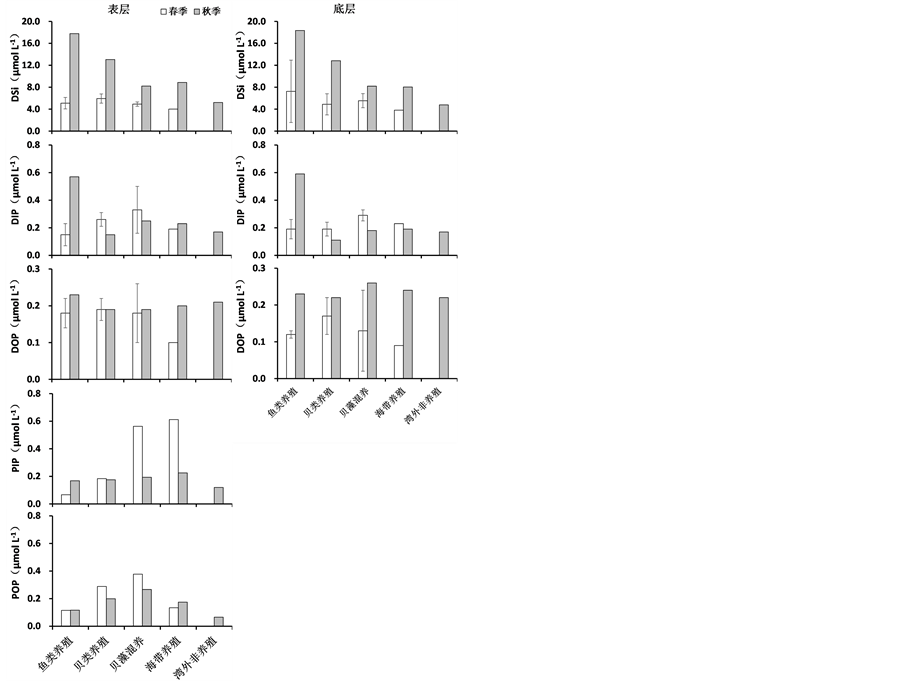
Figure 2. Nutrient concentrations of surface and near bottom water (µmol∙L−1) in different aquaculture regions of SGB in spring and autumn
图2. 春季和秋季桑沟湾不同养殖区表、底层营养盐浓度(µmol∙L−1)变化
湾春季和秋季存在明显的潜在磷限制情况,尤其是春季在湾顶的鱼类养殖区DIP的浓度更是小于浮游植物生长的最低阈值(0.1 μmol∙L−1) [24] ,这一结果与李瑞环(2014)在2013年4月对桑沟湾的大面调查结果相似 [25] 。春季和秋季的调查结果比较发现,桑沟湾春季营养盐的浓度明显低于秋季,这一结果与李瑞环(2014) [25] 、孙珊等(2010) [26] 、史洁(2009) [16] 和宋云利等(1996) [27] 调查结果相似。桑沟湾内大规模的养殖活动是造成营养盐平面分布和季节变化的主要原因。
在桑沟湾,春季是海带生长最快速的季节,而到4~5月份海带的长度基本达到最长并逐渐开始收获。海带的养殖对春季桑沟湾营养盐的分布有生长吸收和阻碍湾内外海水交换两方面的影响。首先,海带是适于生长在5℃~10℃冷水性藻类 [28] ,而春季海水的温度适合海带的快速生长,从水体中吸收大量营养盐,造成春季营养盐的含量较低。桑沟湾的潮流属于往复流类型,涨潮时,湾外海水由湾口的北部和中部向湾内西南方向流去,在春季携带着相对高营养盐的黄海沿岸水流入湾内,而此时在桑沟湾湾口快速长大的海带却阻碍了湾内低营养盐的海水与湾外高营养盐海水的交换作用。赵俊等(1996) [29] 计算出桑沟湾的海水平均半交换周期在春季比秋季长20% (7天),同时史洁(2009) [16] 调查结果也指出,在春季从桑沟湾的湾口至湾顶平均流速在表层水体衰减了63%。因此,春季桑沟湾湾口处密集生长的海带和养殖设施阻碍了海水的交换,使湾内营养盐得不到及时的补充,伴随着养殖海带和浮游植物的生长对营养盐不断吸收,造成了春季湾内营养盐的低值。
秋季海带还未下苗,桑沟湾海水交换情况比较好,相比于夏季湾内水温降低,限制了浮游植物的光合作用 [30] ,对营养盐的吸收利用减少,因此秋季桑沟湾内营养盐浓度普遍较高,几乎不存在低于浮游植物生长阈值的现象(DIN为1.0 μmol∙L−1,DIP为0.1 μmol∙L−1,DSi为2 μmol∙L−1) [24] 。贝类养殖也是造成桑沟湾秋季营养盐浓度较高的重要原因。Mao et al. (2006) [15] 对桑沟湾内牡蛎的呼吸速率、铵盐和磷酸盐排泄率的全年研究结果发现,养殖贝类在夏秋季节新陈代谢最旺盛,可以向海水中排泄大量的铵盐(每克干重1.0~5.42 μmol∙h−1)和磷酸盐(每克干重0.13~0.65 μmol∙h−1),使湾内营养盐浓度升高。同时,贝类的滤食作用还能够促进上层悬浮颗粒物向底层的迁移 [31] [32] ,贝类排泄的粪便和假粪等有机质沉积到海底,由于夏秋季节温度较高,微生物活动旺盛,促进了有机质的矿化作用,使营养盐的浓度升高。秋季浮游植物对营养盐的吸收利用减少,并且没有海带的吸收作用,都会造成秋季贝类排泄的营养盐在湾内积累,营养盐浓度的升高。此外,秋季由于降雨的影响,陆地径流量较大,随之陆源输入的营养盐增多,也造成了湾顶营养盐的积累。
3.2. 春季和秋季桑沟湾各养殖区浮游植物粒级结构
春季和秋季桑沟湾Chla总量分别为0.37~1.65、1.04~4.44 μg∙L−1,春季浮游植物生物量明显低于秋季。春季从湾口处的海带养殖区到湾顶的鱼类养殖区,Chla总量逐渐减小,而在秋季分布趋势恰好相反(图3)。春秋季节桑沟湾内Chla含量和分布差异可能主要受湾内营养盐浓度的影响。桑沟湾内营养盐的浓度不仅春季明显低于秋季,并且两个季节营养盐分布趋势恰好相反,春季受养殖海带的影响营养盐浓度从湾口向湾顶逐渐降低,秋季受贝类排泄释放营养盐和陆地径流的影响营养盐浓度从湾口向湾顶逐渐升高 [25] [26] 。高浓度的营养盐为秋季浮游植物的生长提供了物质基础,同时秋季水温高于春季,相比春季秋季的水温更适合浮游植物的生长。郝林华等(2012) [30] 的研究结果也显示桑沟湾Chla的含量秋季明显高于春季。
春季浮游植物以nano-浮游植物为主,占浮游植物总量的57% ± 22%;秋季nano-级和pico-级浮游植物共同占优势,分别占浮游植物总量的53% ± 9%、34% ± 12%;不论春季还是秋季,从湾口向湾顶,桑沟湾内浮游植物粒径呈小型化的趋势。春季和秋季浮游植物平均粒级指数(SI)分别为15、9,说明秋季浮游植物的平均粒径明显小于春季的调查结果。李瑞环(2014) [25] 在2012年6月、9月和2013年5月进行

Figure 3. Concentrations (μg∙L−1) and compositions of Chla in different aquaculture regions of SGB in spring and autumn
图3. 春季和秋季桑沟湾不同养殖区Chla总量(μg∙L−1)和组成的变化
的围隔受控培养实验中发现,夏季和秋季鱼类养殖区微微型浮游植物对总浮游植物的贡献率显著高于春季,这与本文的研究结果相似。秋季桑沟湾养殖贝类代谢活动旺盛,贝类对3 μm以上浮游植物的滤食性作用 [33] 可能是导致此时桑沟湾尤其是湾顶贝类养殖区浮游植物粒径偏小的主要原因。李瑞环(2014) [25] 在2012年9月进行的路基围隔实验也显示,滤食性贝类的养殖更有利于微微型浮游植物的生长。研究表明水体温度升高会促进浮游植物由粒径较大的硅藻转换为粒径较小的pico-级浮游植物 [34] [35] ,而桑沟湾水体温度秋季高于春季,因此水温也可能是导致秋季浮游植物粒径小于春季的原因。
3.3. 春季和秋季桑沟湾浮游植物对磷的响应
桑沟湾春季调查站位微型、微微型浮游植物细胞总磷的含量分别为22.7~31.7、6.39~22.3 μmol∙g−1,细胞内结合态磷的含量分别为18.9~22.4、4.84~19.8 μmol∙g−1,细胞表面吸附态磷的含量分别为3.56~9.25、1.03~2.54 μmol∙g−1,微型浮游植物细胞各结合态磷的含量均高于微微型浮游植物;秋季桑沟湾调查站位微型、微微型浮游植物细胞总磷的含量分别为22.6~51.7、3.59~13.6 μmol∙g−1,细胞内结合态磷的含量分别为21.5~32.4、2.29~11.0 μmol∙g−1,细胞表面吸附态磷的含量分别为1.10~19.3、1.30~3.02 μmol∙g−1,与春季相类似,细胞各结合态磷的含量也是微型浮游植物显著高于微微型。秋季微型浮游植物细胞不同结合态磷的含量明显高于春季的调查结果,微微型浮游植物的调查结果在两个季节没有显著性差异。桑沟湾春季和秋季调查站位,微型和微微型浮游植物细胞总磷均是以细胞内结合态磷为主,细胞内结合态磷对细胞总磷的贡献率为64%~93%。Delaware河口、Delaware内湾 [10] 和Erie湖 [36] 浮游植物群落细胞内结合态磷占细胞总磷的比例为54%~85%、66%~100%;金杰(2014) [37] 对中国近海小型浮游植物的研究结果也显示,细胞总磷主要以细胞内结合态磷的形式存在,细胞内结合态磷对细胞总磷的贡献率为55%~98%,与桑沟湾的调查结果相近。而与大西洋的藻华样品相比,桑沟湾细胞表面吸附态磷占细胞总磷的比例较小,大西洋藻华样品细胞表面吸附态磷占细胞总磷的比例为60%~65%,是细胞总磷的主要存在形式 [9] 。
桑沟湾春季和秋季各养殖区微型和微微型浮游植物细胞不同结合态磷的分布如图4所示,秋季从湾口的海带养殖区到湾顶的贝类养殖区和鱼类养殖区,微型浮游植物细胞总磷的含量升高,且细胞表面吸附态磷占细胞总磷的比例也增加,春季微微型浮游植物细胞总磷的分布也有相似的规律,但微型浮游植物细胞总磷的分布规律不明显。
营养盐是浮游植物生长繁殖的物质基础,同时有研究表明浮游植物细胞不同结合态磷的含量与浮游


Figure 4. Distributions of cell associated phosphorus (intracellular phosphorus, P-intra; cell surface adsorbed phosphorus, P-sur) contents of both nanophytoplankton and picophytoplankton in different aquaculture regions of SGB in spring and autumn
图4. 春季和秋季桑沟湾各养殖区微型(nano-)、微微型(pico-)浮游植物细胞不同结合态磷(细胞内结合态磷,P-intra;细胞表面吸附态磷,P-sur)分布
植物的种类、外界磷酸盐的含量等因素有关 [10] 。因此本文对桑沟湾调查站位表层水体中微型、微微型浮游植物细胞不同结合态磷的含量与营养盐进行相关性,结果如表1和表2所示。从表1可知,微型浮游植物细胞总磷和细胞内磷的含量与DIP和DSi有显著的正相关关系,细胞表面吸附态磷含量与DSi有显著的正相关关系,细胞不同结合态磷与DOP均没有显著相关性,分析原因可能是由于浮游植物细胞优先利用DIP满足自身生长需要,并且细胞表面吸附态磷也是以无机磷酸盐的形式存在 [9] 。因此微型浮游植物吸收磷的能力与环境中营养盐的浓度,尤其是无机营养盐的浓度密切相关,高浓度的DIP能够促进浮游植物吸收利用磷酸盐,增加细胞总磷和细胞内磷的含量,在营养盐条件充足时,微型浮游植物“奢侈吸收”的磷酸盐可以作为浮游植物的磷库,而当环境中磷酸盐匮乏时,储存在细胞内部及吸附在细胞表面的磷能够维持浮游植物细胞一段时间的增长和繁殖。DSi也能促进微型浮游植物细胞总磷和细胞内结
Table 1. Correlation analysis between cell associated phosphorus of nanophytoplankton and nutrients
表1. 桑沟湾微型浮游植物细胞不同结合态磷与营养盐的相关性分析
**:在0.01水平(双侧)显著相关;*:在0.05水平(双侧)显著相关
Table 2. Correlation analysis between cell associated phosphorus of picophytoplankton and nutrients
表2. 桑沟湾微微型浮游植物细胞不同结合态磷与营养盐的相关性分析
**:在0.01水平(双侧)显著相关;*:在0.05水平(双侧)显著相关
合态磷的增加,可能与桑沟湾内浮游植物种类有关,由于贝类对富含脂肪酸的甲藻的高摄食率,桑沟湾水体中硅藻是浮游植物的优势藻种 [38] - [40] ,硅酸盐的增加能够促进硅藻的生长,有可能进一步促进浮游植物细胞对磷酸盐的吸收,此推论仍需进一步实验验证。
与微型浮游植物相比,微微型浮游植物细胞不同结合态磷的含量与各项营养盐均没有显著相关性。金杰(2014) [37] 测定了浙闽近海和中国近海表层海水小型浮游植物细胞不同结合态磷的含量,并与营养盐等环境因子进行了相关性分析,结果显示,小型浮游植物细胞总磷和细胞内结合态磷的含量与DIN、DIP均有显著的正相关关系,与本文微型浮游植物的研究结果相似,与微微型浮游植物的结果不同。与微型和小型浮游植物对比,微微型浮游植物细胞各结合态磷含量与营养盐无显著相关性的原因可能是微微型浮游植物对磷酸盐的吸收具有更小的半饱和常数,能够适应营养盐浓度更低的环境。研究表明,生长在低纬度低磷海区的原绿球藻和聚球藻正是凭借对磷的较低需求和细胞内较低的磷含量而成为海区的优势藻种 [41] 。魏玉秋等(2015) [42] 、乐凤凤等(2015) [43] 、张渊洲等(2015) [44] 在南海北部和乐凤凤等(2011) [45] 在长江口及邻近海域的研究均显示,微微型浮游植物丰度与营养盐存在显著的负相关关系,这也说明微微型浮游植物对贫营养盐环境的适应性。某些蓝藻和细菌为了适应寡磷的环境能够利用非磷元素合成膜脂和遗传物质,减少了细胞内磷的含量和对磷的需求 [46] [47] 。
4. 结论
1) 受养殖活动的影响,桑沟湾营养盐的分布具有明显的季节变化:春季,由于海带快速生长吸收大量营养盐,同时海带以及其它养殖设施阻碍了湾内外海水的交换,营养盐浓度较低;秋季,海带已收获,贝类生长代谢活动旺盛向水体释放大量营养盐,且陆地径流输入大于春季,秋季营养盐浓度高于春季。春季和秋季桑沟湾内浮游植物主要受到磷酸盐的限制。
2) 春季桑沟湾Chla总量从湾口处的海带养殖区到湾顶的鱼类和贝类养殖区逐渐降低,秋季分布趋势相反。春季桑沟湾浮游植物以nano-级浮游植物为主,秋季由于养殖贝类滤食作用的影响pico-级浮游植物比例升高,浮游植物以nano-级和pico-级为主。春季和秋季,从桑沟湾湾口向湾顶浮游植物呈小型化趋势。
3) 桑沟湾春季和秋季微型、微微型浮游植物细胞总磷以细胞内结合态磷为主。微微型浮游植物细胞不同形态磷的含量均显著小于微型浮游植物。微型浮游植物细胞总磷和细胞内结合态磷含量与DIP和DSi存在显著的正相关关系(r ≥ 0.796),微微型浮游植物细胞各结合态磷的含量与营养盐均没有显著的相关性(r < |0.402|)。
文章引用
徐文琦,刘素美. 春季和秋季桑沟湾浮游植物对磷的响应
Phytoplankton Responses to Phosphorus in Sanggou Bay in Spring and Autumn[J]. 海洋科学前沿, 2016, 03(02): 26-37. http://dx.doi.org/10.12677/AMS.2016.32005
参考文献 (References)
- 1. Thingstad, T.F., Kromm M.D., Mantoura, R.F.C., et al. (2005) Nature of Phosphorus Limitation in the Ultraoligotrophic Eastern Mediterranean. Science, 309, 1068-1071. http://dx.doi.org/10.1126/science.1112632
- 2. Wu, J., Sunda, W., Boyle, E.A., et al. (2000) Phosphate Depletion in the Western North Atlantic Ocean. Science, 289, 759-762. http://dx.doi.org/10.1126/science.289.5480.759
- 3. Sañudo-Wilhelmy, S.A., Kustka, A.B., Gobler, C.J., et al. (2001) Phosphorus Limitation of Nitrogen Fixation by Trichodesmium in the Central Atlantic Ocean. Nature, 411, 66-69. http://dx.doi.org/10.1038/35075041
- 4. Mills, M.M.C., Ridame, M., Davey, J., et al. (2004) Iron and Phosphorus Co-Limit Nitrogen Fixation in the Eastern Tropical North Atlantic. Nature, 429, 292-294. http://dx.doi.org/10.1038/nature02550
- 5. Diaz, F., Raimbault, P., Boudjellal, B., et al. (2001) Early Spring Phosphorus Limitation of Primary Productivity in a NW Mediterranean Coastal Zone (Gulf of Lions). Marine Ecology Progress Series, 211, 51-62. http://dx.doi.org/10.3354/meps211051
- 6. Ammerman, J.W., Hood, R.R., Case, D.A., et al. (2003) Phosphorus Deficiency in the Atlantic: An Emerging Paradigm in Oceanography. Eos, Transactions American Geophysical Union, 84, 165-170. http://dx.doi.org/10.1029/2003EO180001
- 7. Redfield, A.C. (1958) The Biological Control of Chemical Factors in the Environment. American Scientist, 46, 205- 221.
- 8. Quigg, A., Finkel, Z.V., Irwin, A.J., et al. (2003) The Evolutionary Inheritance of Elemental Stoichiometry in Marine Phytoplankton. Nature, 425, 291-294. http://dx.doi.org/10.1038/nature01953
- 9. Sañudo-Wilhelmy, S.A., Tovar-Sanchez, A., Fu, F.X., et al. (2004) The Impact of Surface-Adsorbed Phosphorus on Phytoplankton Redfield Stoichiometry. Nature, 432, 897-901. http://dx.doi.org/10.1038/nature03125
- 10. Fu, F.X., Zhang, Y., Leblanc, K., et al. (2005) The Biological and Biogeochemical Consequences of Phosphate Scavenging onto Phytoplankton Cell Surfaces. Limnology and Oceanog-raphy, 50, 1459-1472. http://dx.doi.org/10.4319/lo.2005.50.5.1459
- 11. Tilman, D., Kilham, S.S. and Kilham, P. (1982) Phytoplankton Community Ecology: The Role of Limiting Nutrients. Annual Review of Ecology and Systematics, 13, 349-372. http://dx.doi.org/10.1146/annurev.es.13.110182.002025
- 12. Glibert, P.M., Anderson, D.M., Gentien, P., et al. (2005) The Global, Complex Phenomena of Harmful Algal Blooms. Oceanography, 18, 136-147. http://dx.doi.org/10.5670/oceanog.2005.49
- 13. Shi, J., Wei, H., Zhao, L., et al. (2011) A Physical-Biological Coupled Aquaculture Model for a Suspended Aquaculture Area of China. Aquaculture, 318, 412-424. http://dx.doi.org/10.1016/j.aquaculture.2011.05.048
- 14. 张继红. 滤食性贝类养殖活动对海域生态系统的影响及生态容量评估[D]: [博士学位论文]. 青岛: 黄海水产研究所, 2008.
- 15. Mao, Y.Z., Zhou, Y., Yang, H.S., et al. (2006) Seasonal Variation in Metabolism of Cultured Pacific Oyster, Crassostreagigas, in Sanggou Bay, China. Aqua-culture, 253, 322-333. http://dx.doi.org/10.1016/j.aquaculture.2005.05.033
- 16. 史洁. 物理过程对半封闭海湾养殖容量影响的数值研究[D]: [博士学位论文]. 青岛: 中国海洋大学, 2009.
- 17. 张继红, 蒋增杰, 王巍, 等. 桑沟湾营养盐时空分布及营养盐限制分析[J]. 渔业科学进展, 2010, 31(4): 16-25.
- 18. 曲克明, 宋云利, 徐勇, 等. 桑沟湾养殖水域春季和夏季营养限制的现场实验[J]. 海洋环境科学, 2008, 27(2): 124-127.
- 19. 张莉红, 张学雷, 李瑞香, 等. 桑沟湾扇贝养殖对甲藻数量的影响[J]. 海洋科学进展, 2005, 23(3): 342-346.
- 20. Tovar-Sanchez, A., Sañudo-Wilhelmy, S.A., Garcia-Vargas, M., et al. (2003) A Trace Metal Clean Reagent to Remove Surface-Bound Iron from Marine Phytoplankton. Marine Chemistry, 82, 91-99. http://dx.doi.org/10.1016/S0304-4203(03)00054-9
- 21. Grasshoff, K., Kremling, K. and Ehrhardt, M., Eds. (1999) Methods of Seawater Analysis. 3rd Edition, Wiley-VCH, Weinheim, 159-228. http://dx.doi.org/10.1002/9783527613984
- 22. Aspila, K.I., Agemian, H. and Chau, A.S.Y. (1976) A Semiauto-matic Method for the Determination of Inorganic, Organic and Total Phosphorus in Sediment. Analyst, 101, 187-197. http://dx.doi.org/10.1039/an9760100187
- 23. Bricaud, A., Claustre, H., Ras, J., et al. (2004) Natural Variability of Phytoplanktonic Absorption in Oceanic Waters: Influence of the Size Structure of Algal Populations. Journal of Geophysical Research: Oceans, 109.
- 24. Justić, D., Rabalais, N.N., Turner, R.E., et al. (1995) Changes in Nutrient Structure of River-Dominated Coastal Waters: Stoichiometric Nutrient Balance and Its Consequences. Estuarine, Coastal and Shelf Science, 40, 339-356. http://dx.doi.org/10.1016/S0272-7714(05)80014-9
- 25. 李瑞环. 生态养殖活动影响下营养盐动力学研究——以桑沟湾为例[D]: [博士毕业论文]. 青岛: 中国海洋大学, 2014.
- 26. 孙珊, 刘素美, 任景玲, 等. 桑沟湾养殖海域营养盐和沉积物-水界面扩散通量研究[J]. 海洋学报, 2010, 32(6): 108-117.
- 27. 宋云利, 崔毅, 孙耀, 等. 桑沟湾养殖海域营养状况及其影响因素分析[J]. 海洋水产研究, 1996, 17(2): 41-51.
- 28. 曾呈奎, 吴超元, 孙国玉. 温度对海带孢子体生长和发育的影响[J]. 植物学报, 1957, 6(2): 103-130.
- 29. 赵俊, 周诗赉, 孙耀, 等. 桑沟湾增养殖水文环境研究[J]. 海洋水产研究, 1996, 17(2): 68-79.
- 30. 郝林华, 孙丕喜, 郝建民, 等. 桑沟湾海域叶绿素a的时空分布特征及其影响因素研究[J]. 生态环境学报, 2012, 21(2): 338-345.
- 31. Kautsky, N. (1987) Role of Biodeposition by Mytilusedulis in the Ciculation of Matter and Nutrients in a Baltic Coastal Ecosystim. Marine Eco-logical Progress Series, 38, 201-212. http://dx.doi.org/10.3354/meps038201
- 32. Widdows, J., Brinsley, M.D., Salkeld, P.N., et al. (1998) Use of Annular Flumes to Determine the Influence of Current Velocity and Bivalves on Material Flux at the Sediment-Water Interface. Estuaries, 21, 552-559.
- 33. Newell, R.I.E. (2004) Ecosystem Influences of Natural and Cultivated Populations of Suspension-Feeding Bivalve Molluscs: A Review. Journal of Shellfish Research, 23, 51-62. http://dx.doi.org/10.2307/1353294
- 34. Noiri, Y., Kudo, I., Kiyosawa, H., et al. (2005) In-fluence of Iron and Temperature on Growth, Nutrient Utilization Ratios and Phytoplankton Species Composition in the Western Subarctic Pacific Ocean during the SEEDS Experiment. Progress in Oceanography, 64, 149-166. http://dx.doi.org/10.1016/j.pocean.2005.02.006
- 35. Hare, C.E., Leblanc, K., Ditullio, G.R., et al. (2007) Conse-quences of Increased Temperature and CO2 for Phytoplankton Community Structure in the Bering Sea. Marine Ecology Progress, 352, 9-16. http://dx.doi.org/10.3354/meps07182
- 36. Saxton, M.A., Arnold, R.J., Bourbonniere, R.A., et al. (2012) Plasticity of Total and Intracellular Phosphorus Quotas in Microcystis aeruginosa Cultures and Lake Erie Algal Assemblages. Frontiers in Microbiology, 3, 3. http://dx.doi.org/10.3389/fmicb.2012.00003
- 37. 金杰. 典型海域浮游植物对磷的响应及营养盐动力学研究[D]: [博士毕业论文]. 青岛: 中国海洋大学, 2014.
- 38. 刘慧, 方建光, 董双林, 等. 莱州湾和桑沟湾养殖海区浮游植物的研究II[J]. 海洋水产研究, 2003, 24(3): 20-28.
- 39. 慕建东, 董玮, 陈碧娟, 等. 桑沟湾浮游植物生态特征[J]. 渔业科学进展, 2009, 30(3): 91-96.
- 40. 李超伦, 张永山, 孙松, 等. 桑沟湾浮游植物种类组成、数理分布及其季节变化[J]. 渔业科学进展, 2010, 31(4): 1-8.
- 41. Bertilsson, S., Berglund, O., Karl, D.M., et al. (2003) Ele-mental Composition of Marine Prochlorococcus and Synechococcus: Implications for the Ecological Stoichiometry of the Sea. Limnology and Oceanography, 48, 1721-1731. http://dx.doi.org/10.4319/lo.2003.48.5.1721
- 42. 魏玉秋, 孙军, 丁昌玲, 等. 2014年夏季南海北部超微型浮游植物分布及环境因子影响[J]. 海洋学报, 2015, 37(12): 56-65.
- 43. 乐凤凤, 蔡昱明, 孙军, 等. 2009年冬、夏季南海北部超微型浮游生物的分布特征及其环境相关分析[J]. 海洋学报, 2015, 37(12): 41-55.
- 44. 张渊洲, 张健林, 杨清松, 等. 南海北部春季微微型浮游植物丰度的分布[J]. 生物学杂志, 2015, 32(5): 58-62.
- 45. 乐凤凤, 刘诚刚, 郝锵, 等. 2006年秋季长江口及邻近海域微微型浮游生物的分布特征及环境影响因素[J]. 海洋学研究, 2011, 29(3): 108-117.
- 46. Mooy, B.A.S.V., Fredricks, H.F., Pedler, B.E., et al. (2009) Phytoplankton in the Ocean Use Non-Phosphorus Lipids in Response to Phosphorus Scarcity. Nature, 458, 69-72. http://dx.doi.org/10.1038/nature07659
- 47. Fekry, M.I., Tipton, P.A. and Gates, K.S. (2011) Kinetic Consequences of Replacing the Internucleotide Phosphorus Atoms in DNA with Arsenic. ACS Chemical Biology, 6, 127-130. http://dx.doi.org/10.1021/cb2000023
