Advances in Marine Sciences
Vol.03 No.04(2016), Article ID:19192,8
pages
10.12677/AMS.2016.34017
Review of Benthic Microalgae Biomass in Surface Sediments of Salt Marshes in Coastal Wetlands
Yurun Chen1,2, Ping Zuo1,2*
1School of Geographic and Oceanographic Sciences, Nanjing University, Nanjing Jiangsu
2MOE Key Laboratory of Coast and Island Development, Nanjing University, Nanjing Jiangsu

Received: Nov. 7th, 2016; accepted: Dec. 8th, 2016; published: Dec. 13th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Benthic microalgae of salt marshes are an important producer in wetland ecosystems, which has drawn the world’s attention for many years. The article summarized the researches on relevant issues and scientific achievements about benthic microalgae. The biomass or primary production is still the basic indicators. Biomass of benthic microalgae has various temporal and spatial characteristics in different coastal wetlands. There are many factors, such as sediment grain size, vegetation of salt marshes, nutrient concentration, which combined together to affect the growth of benthic microalgae.
Keywords:Benthic Microalgae, Biomass, Salt Marshes, Primary Production, Chlorophyll a

盐沼湿地沉积物表层微型藻类生物量分析综述
陈禹润1,2,左平1,2*
1南京大学地理与海洋科学学院,江苏 南京
2南京大学海岸与海岛开发教育部重点实验室,江苏 南京

收稿日期:2016年11月7日;录用日期:2016年12月8日;发布日期:2016年12月13日

摘 要
盐沼湿地中的底栖微藻是该湿地生态系统的重要初级生产者,是多年来的研究热点之一。本文在国内外众多研究观测的基础上,尝试对底栖微藻研究进行综合性的文献总结,旨在对底栖微藻的相关问题与科研成果进行一个初步小结和概括。生物量或初级生产力仍是研究底栖微藻的基础指标。基于多地长期观测数据,发现底栖微藻的生物量存在显著的时空差异:地区性差异巨大,同一区域季相变化明显。沉积物粒度、盐沼植被、营养物浓度等多种因素共同作用,综合影响底栖微藻的生长。
关键词 :底栖微藻,生物量,盐沼湿地,初级生产力,叶绿素a

1. 盐沼湿地生态系统与微型藻类
盐沼湿地(salt marshes)是指受海洋潮汐周期性或间歇性影响的,覆有有根挺水草本植物的咸水或淡咸水淤泥质滩涂,多位于海陆交错地带,具有咸淡水交替、生物呈带状分布等特点 [1] [2] [3] 。根据盐沼发育的环境条件,一般将盐沼分为2类:① 以海洋潮汐作用为主导,主要分布在有沙坝、沙洲、离岛作为屏障的区域;② 以径流作用为主导,主要是各大河口、三角洲 [4] 。盐沼湿地是我国主要的滨海湿地类型之一,所有沿海省、市均有分布,较典型的区域有辽河口、黄河口、苏北淤泥质海滩、长江口等。
盐沼湿地的生物分布呈现明显的分带现象。Boorman根据欧洲部分盐沼受潮汐影响的频率将完全自然的植物群落沿高程由低到高分成5个带,但是由于人类活动对海岸的改造,目前常用的分带是:先锋植物带、低潮滩、中潮滩 [2] [3] 。Whitney & Darley根据光照强度将潮间带非自然的、以互花米草为主的盐沼湿地分成三个区域:泥滩、密集高大米草滩、高潮带的稀疏矮小米草滩 [5] 。在盐沼湿地生态系统的食物网中,生产者群落主要由耐盐维管植物、浮游植物和底栖微藻组成。其中底栖微藻以硅藻群落为主,也常伴有裸藻、蓝藻、绿藻等。消费者群落一般由游泳动物、大型无脊椎动物、昆虫、浮游动物和鸟类组成 [6] 。
底栖微藻对食物网的贡献很大。用稳定同位素分析加利福尼亚盐沼湿地的食物网结构,δ13C和δ34S集中分布在底栖微藻和浮游藻类中的动物样品占总数的88%,维管植物居次 [7] 。中上层鱼类对浮游植物有更大的依赖性,而底层鱼类更依赖维管植物碎屑和底栖微藻 [8] 。用δ13C稳定同位素分析长江口盐沼湿地的食物网结构,发现游泳动物更依赖维管植物及其碎屑,而微型藻类(以底栖微藻为主)是大型无脊椎动物的主要碳源。互花米草入侵还会改变原环境的食源构成,如无脊椎动物的食性从以底栖微藻为主转变为互花米草与微藻混合搭配 [6] 。大量研究表明不论是在浑浊河口区、浅海陆架还是在盐沼湿地系统中,底栖微藻的生物量和生产力都远远高于浮游植物 [9] [10] [11] 。底栖微藻所拥有的高生产力为底栖植食动物、食底泥动物以及食悬浮动物(通过再悬浮作用)创造了巨大的食物来源 [10] ,使潮间带生态系统成为生产力较高的生态系统之一 [12] 。
初级生产力、生物量和食物网结构始终是盐沼生态系统的重要研究内容之一。初级生产力反映了系统内初级生产者通过光合作用产生有机碳的能力 [13] ,底栖微藻对其总量的贡献可高达50% [14] 。目前主要通过稳定同位素分析来研究生产者对于食物网的相对贡献。生物量是指生物在给定时间内的现存质量,现存量研究是生态系统研究不可或缺的部分 [15] 。底栖微藻生物量与生产力具有较明显的相关关系,两者随时间的变化趋势非常相似 [16] [17] 。生物量一般用叶绿素a(chl.a)浓度表征。底栖微藻主要分布在沉积物表层0~2 cm范围内 [18] 。其垂直分布特征表现为chl.a含量随沉积物深度的增加而减少。其中0~0.5 cm深的chl.a含量占表层2 cm内chl.a总量的60 %,表层1cm内chl.a含量可达总量的80%以上 [11] 。因此,宁修仁等建议将单位面积沉积物表层2 cm中的chl.a含量(mg·m2)作为底栖微藻生物量 [19] 。
2. 取样及分析方法
在研究区域中,一般根据需要随机设置一条或多条断面,再根据需要设置若干取样点,梅花状取样 [6] [15] 。底质样品用直径25 mm去掉针头端的塑料注射器采集,随后用推杆从底部将柱状的泥样推出针管,用刀片截取表层0~20 mm,依据海洋调查规范(GB/T 12763.3-2007)分析 [20] 。
chl.a的测定方法主要有分光光度法、荧光法、HPLC三种方法。分光光度法又分三色法和单色法两种,目前大多用Lorenzen的单色法测定chl.a和脱镁叶绿素 [21] [22] 。计算公式如下:
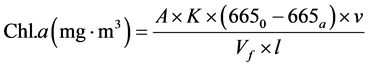
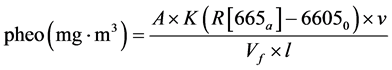
其中,A:chl.a的吸光度,A = 11.0;K:衡量纯chl.a吸光度减少量的因数,K = 2.43;R:纯chl.a酸化前后的吸光度比值,R = 1.7;6650:酸化前的吸光度;665a:酸化后的吸光度;v:提取液体积;Vf:过滤水样的体积;L:比色皿光程长。
在此基础上,Whitney & Darley改进了双萃取分光光度法 [23] [24] ,尽可能地减少了叶绿素和其他色素降解产物的干扰。分光光度法是测量叶绿素浓度最成熟且应用最广泛的一种方法,也是目前国内测定水体chl.a的标准方法。但是分光法操作过程繁琐,提取时间长,需要大量样品 [25] ,当单位水体中叶绿素含量极低,或水样量很少时,用普通分光光度法测定叶绿素,其灵敏度不高 [26] 。
Yentsch & Menzel率先使用荧光法测定海水中的chl.a和脱镁chl.a浓度 [27] 。荧光分光光度法主要测定具有活性的叶绿素,其灵敏度比一般分光光度法高10~100倍 [26] 。精确实验证明荧光法与分光光度法测量chl.a的结果没有显著差异 [28] 。目前科学研究中常用荧光法。其计算公式如下:
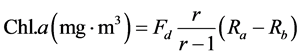
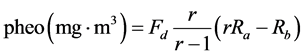
Rb:酸化前样品的荧光读数;Ra:酸化后样品荧光读数;r:纯chl.a的酸化比;Fd是与所用仪器和选用的灵敏度等有关的换算因子。
现代研究中亦采用HPLC (高效液相色谱仪)方法测量水体中浮游植物的各色素含量,其原理是不同色素具有不同的色谱峰,HPLC系统可将其分离并检测获得色谱图,与标准色素比较保留时间和色谱图可鉴定色素种类,根据色谱峰面积计算色素含量 [29] 。此方法具有精确度高、测量时间短、预处理复杂、花费大等特点。
3. 研究进展
3.1. 沉积物粒度对底栖微藻生物量的影响
沉积物粒度与底栖微藻生物量密切相关。一般来说,底栖微藻在砂质沉积物为主的环境生长较好;如果此沉积物中还含有少量淤泥,则会明显促进底栖微藻的生长 [30] [31] [32] ;若此沉积物含有粒径较大的碎屑颗粒(如贝壳等),则会轻微抑制其生长 [10] 。
Pinckney & Zingmark曾对South Carolina北部(33˚N, 79˚W)的盐沼湿地进行了长达18个月的底栖微藻生物量和生产力调查。在潮间带砂滩、潮下带浅滩、矮小米草滩、高大米草滩和潮间带泥滩这5种环境类型中,潮下带浅滩含量最低(60.4 mg∙m−2),高大米草滩含量最高(101.5 mg∙m−2),潮间带泥滩、矮小米草滩、潮间带砂滩的含量接近(72.0, 73.3, 77.2 mg∙m−2) [30] 。在没有大型维管植物影响的滩面,砂质潮滩的chl.a浓度要比淤泥质潮滩要高,这一结果与在新西兰Manukau Harbour河口 [10] 、墨西哥湾大陆架浅海湿地 [31] 的研究相似。在有互花米草生长的淤泥质沉积环境中,底栖微藻的生物量与细颗粒物质含量呈微弱的正相关关系,此外还与互花米草的密集、生长程度呈显著的正相关关系,这一结果与佐治亚滨海湿地 [32] 、江苏如东盐沼湿地的研究 [15] 相似。在没有互花米草影响的潮间带砂滩和潮下带,底栖微藻的变动幅度较大,受环境因素影响较高。底栖微藻在细颗粒物质含量超过30%的盐沼区域的稳定性较高,但是互花米草的生长会对这种稳定性产生影响。
因此,在没有米草等盐沼植物干扰的海岸,底栖微藻一般在砂质沉积物为主的环境生长较好,砂质沉积物中如果还含有少量的淤泥,对底栖微藻的生长表现为明显促进;若含有粒径较大的碎屑颗粒(如贝壳等),对底栖微藻生长表现为轻微抑制 [10] 。但是这一结论与崇明东滩中潮带盐沼光滩的结果相反:即使细颗粒物质达40%以上,chl.a浓度与细颗粒物质的浓度仍然呈微弱的正相关关系 [33] 。
3.2. 盐沼植被对底栖微藻生物量的影响
底栖微藻生物量与盐沼植被类型、纬度、季节变化均密切相关,存在较大的差异性。一般来说,在北半球,春季,底栖微藻的生物量会上升到一个高值;夏季当维管植物生长最茂盛时,底栖微藻的chl.a浓度会迅速降低;至秋季达最低值后会缓慢回升至次年春季或者保持几个月的低谷平台期后再回升 [30] 。
美国密西西比州Graveline Bay盐沼湿地(30˚N, 88˚W)主要有4种维管植物优势群落:灯芯草属、盐草属、米草属和藨草属,沉积物优势物种都是小型壳缝羽纹硅藻 [34] 。用双萃取分光光度法测量各群落中底栖微藻的chl.a浓度。灯芯草属、盐草滩底栖微藻的年平均chl.a浓度最低(59, 57 mg∙m−2),米草滩95 mg∙m−2,藨草属最高(160 mg∙m−2)。chl.a浓度从3月开始迅速上升,至4、5月趋向最高值,随后迅速降低。在6、7月,当维管植物生长到最粗壮、密度最高时,底栖微藻的chl.a浓度迅速降低。7~9月处于低谷平台期,浓度基本不变。在9、10月开始稳定回升直至次年1月份趋于平稳(见图1)。
荷兰Western Scheldt estuary覆盖有50%的互花米草,用HPLC方法测定泥滩和砂滩上的底栖微藻生物量,发现光滩在不同时间段的浓度变化亦非常剧烈 [35] 。其生物量在2~5月不断增加,5、6月达到最高值。与Pickney [30] 、Sullivan [34] 的结果相比均表现出时间上的滞后性。随后迅速降低,其中泥滩没有出现低谷平台期,砂滩在11~2月会经历较长时间的平台期然后开始回升,平台期的出现时间也呈现滞后性。这一差异的产生可能与高纬度季节性温差变化大或其他因素有关,目前尚无具体的研究可以证明。
3.3. 控制实验研究底栖微藻生物量的影响因素
由于底栖微藻的生物量受到多种因素的影响,如植被类型及稀疏程度、沉积物类型、温度、营养盐、光照等。因此涉及不同生态因子的控制实验进行相关研究成为研究热点之一。
比较基础性的工作是在佐治亚州海岸(Coastal Geogorgia)的萨佩洛岛(Sapelo Island)和撒蒂拉河(Satilla River)盐沼湿地 [32] 。萨佩洛岛是天然未开发的岛屿,萨蒂拉河受人类活动影响,有大量生活污水排放进入盐沼。两个区域的大型植物均以互花米草为主,底栖微藻群落均以壳缝羽纹硅藻为主,都生长在良好的粉砂淤泥质沉积物表面。在萨佩洛岛盐沼的光滩、密集米草区和稀疏米草区中,密集米草区的chl.a浓
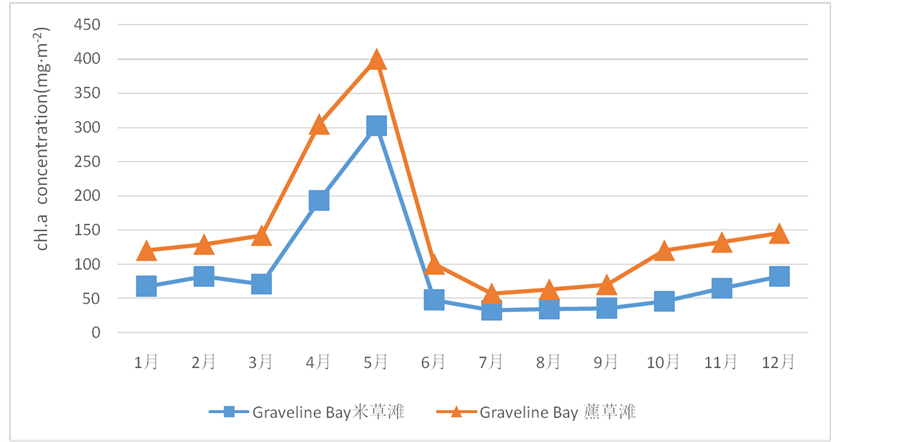
Figure 1. Chl.a concentration (mg∙m−2) beneath the Spartina canopy and Scirpus canopy of Graveline Bay Marsh, Mississippi
图1. Graveline Bay米草滩和藨草滩中沉积物chl.a浓度变化趋势
度始终最高,这一点与Pickney的结果一致。
该区域的营养物控制实验分别添加了硝酸盐和磷酸盐,两块湿地沉积物中的chl.a浓度都随着添加营养物质浓度的增加而上升,与脱镁降解色素的相关性并不显著。值得一提的是,两个区域的chl.a与降解色素的比值均随着营养物质浓度的增加而变大。这一比值已经成为判断生物量影响因素的参考标准,有关比值在不同区域、不同生态系统的细化是底栖微藻生物量研究的基础。
国内目前缺乏初级生产力和生物量的长期观测资料。学者大多研究典型盐沼湿地,如属于长江口盐沼湿地的崇明东滩、长沙、横沙、南汇、东滩、九段沙等,以及江苏北部滨海湿地等。该区域主要大型维管植物是海三棱藨草、互花米草和芦苇。底栖微藻以羽纹硅藻纲的菱形藻属(Nitzschia sp.)和舟形藻属(Navicula sp.)为主 [11] 。
在长江口东滩、九段沙、南汇盐沼湿地的季相调查(1、5、8、11月)中,用分光光度法测量本土藨草属和互花米草群落的底栖微藻生物量 [36] ,结果显示九段沙湿地两种群落的底栖微藻的chl.a浓度均未超过20 mg∙m−2。南汇湿地两种群落的底栖微藻生物量均在8~11月迅速增长,甚至超过春、夏季,在5月份处于低值。东滩湿地两种群落的底栖微藻生物量均在5~11月缓慢下降,与Pickney的长期观测结果相似。其结论为底栖微藻的生物量在互花米草区和藨草区不存在明显差异。长江口盐沼湿地河口与海洋交互作用异常复杂,其生物量的时间变化趋势与其他地区可能存在较大差异,需要具体分析研究。
在九段沙的4种主要湿地类型(光滩、藨草区、米草区、芦苇区)中,6月份底栖微藻生物量顺序为光滩 > 藨草区 > 米草区 > 芦苇区,12月份顺序为藨草区 > 光滩 > 米草区 > 芦苇区 [11] 。单位面积潮滩上chl.a的浓度远远高于其上覆水体中的chl.a浓度(水体中的浓度约为0.74 mg·m2),与众多研究结果相符。如北加利福尼亚的昂斯洛湾(Onslow Bay),底栖微藻生物量是浮游植物的3~8倍 [24] ,马努考海港底栖微藻的平均初级生产力是浮游植物的4倍 [10] 。Joint曾指出河口泥滩的底栖微藻生产力是浮游植物的2倍 [37] 。九段沙湿地底栖微藻的总生物量约为267.6 × 106 g。底栖微藻占全部生产者生物量的比例只有0.41%,年初级生产力却十分可观,达8590.9 × 106 g∙a−1,占盐沼总生产力的16.53%,与国外研究相比属于正常水平。
在江苏如东海岸湿地(高大米草滩、矮小米草滩、光滩、米草盐蒿交错区)的研究(分光光度法)中,7月沉积物chl.a含量顺序为高大米草滩 > 矮小米草滩 > 光滩 > 米草盐蒿交错区,10月则是光滩 > 矮小米草滩 > 高大米草滩 > 米草盐蒿交错区 [15] 。影响沉积物chl.a含量的因素有互花米草的有无及长势大小、沉积物粒度、季节等。
4. 研究热点与展望
盐沼湿地广泛分布在潮间带地区、河口及海岸,能提供物质生产、抵御风暴潮灾害、净化污染物、固沙促淤、生物多样性保育等重要的生态系统服务功能 [38] ,具有较高的生态及经济价值,甚至由于其较高的初级生产力和较低的甲烷释放率而成为缓解全球变暖的有效蓝色碳汇,近年来引起全球范围内的热切关注 [39] 。
盐沼湿地生态系统受到潮汐、沉积物、光照和营养物质等多种环境因素的影响。潮汐和盐度对生物群落的影响最大,二者一起决定了盐沼生物的分带分布 [38] ,此外还受到养分有效度、土壤颗粒度、溶氧度、PH、氧化还原电位、潮淹时间、环流与波浪作用等因子的共同影响 [3] 。潮水周期性的淹没及人类活动影响的共同作用,使得潮间带生态系统具有极大的复杂性及脆弱性 [15] 。
底栖微藻生产效率的最佳温度可能在15℃~30℃之间波动,波动的可能原因是酶活性的改变 [32] 。光照强度和光照时间也会影响底栖微藻的生物量和初级生产力。盐沼湿地中大型维管植物的生长情况、沉积物的颗粒成分比例、季节的改变都会影响底栖微藻的生物量。光滩底栖微藻生物量之所以高于有植被覆盖的潮滩,是因为光滩的光照饱和点要高于有植被覆盖的区域。但在光饱和点下,高密度覆盖区域的底栖微藻初级生产力最高。随着营养物质浓度的增加,底栖微藻的生物量亦明显增加。因此,大型维管束植物的生长情况、光照强度、日照时间、营养物质和温度都会影响底栖微藻生物量 [32] [40] 。
而在相邻的有不同植被覆盖的区域,如果沉积物温度、盐度、孔隙度、有机碳含量、营养盐浓度、维管植物凋落物等差异不大,底栖微藻与群落结构和生物量亦不会有明显差异。因此物质结构的不同对沉积物属性、大型动物的密度和群落结构不会产生明显的改变 [36] 。但也不能一概而论,即直接对野外的环境属性调查并不能够反映某一因素是否影响底栖微藻生长,必须进行控制变量、大梯度范围的精确实验才能确定。因为营养元素的常规流动、气体交换和氧化还原环境的维持可能依赖于底栖微藻的稳定性,进而创造更适合微藻生长的环境。动物捕食和物理扰动会破坏沉积物表层的这种稳定性 [41] 。
因此,目前可以确定的是底栖微藻的生物量的确受到多种多样的影响,但是单一因素对底栖微藻的影响是正反馈还是负反馈,以及其限制点都尚未明晰,其背后隐藏的动力学、生态学机制也还有待考证,其显著的区域性差异目前也原因不明。Velasquez的工作也许为我们提供了一个新的思路,即把Chl.a与Pheo.a的比值作为影响因子的判断标准,但是准确的比值关系与其所蕴含的生物学意义还有待研究。
5. 结论
本文是国内首次对历年来国内外的盐沼湿地底栖微藻研究进行综合性总结,探讨底栖微藻的研究现状、存在问题和未来研究方向,以期后来者对底栖微藻研究能拥有整体的视角和把握。
目前对底栖微藻生物量的测量手段已经十分成熟,数据精确度较高,我们可以较容易地获取有关数据,对底栖微藻的有关研究已经进入定量阶段。对微藻生物量进行长期观测与记录对研究盐沼、浅海、河口等生态系统的内部变化具有重要意义,但受限于科研成本等多种因素,我国仍然缺乏连续的、长期的观测数据。从国内外已有的研究来看,底栖微藻生物量变化的一般趋势基本明确:从春季开始迅速上升,并在5月左右达到最大值后迅速下降,随后保持低值并缓慢回升。但是由于不同地区之间的特殊性差异,仍存在着相邻空间时间滞后、相似区域生物量差异巨大、低谷平台期未显现等问题。潮汐、盐度、沉积物粒度、盐沼植被以及营养物浓度等因素都会对底栖微藻的生长产生显著影响,但是其影响的程度和相关性在不同区域也不尽相同,尚未得到统一结论。
目前国内外都还无法建立一般化模型,仍难以确定多因素对底栖微藻的综合影响。因此,依据观测站长期定位观测底栖微藻的年度季相变化,定量研究各因子对底栖微藻生物量的影响、因子之间的综合效应是当前亟需的工作。
基金项目
本研究受国家自然科学基金(41471431)资助。
文章引用
陈禹润,左 平. 盐沼湿地沉积物表层微型藻类生物量分析综述
Review of Benthic Microalgae Biomass in Surface Sediments of Salt Marshes in Coastal Wetlands[J]. 海洋科学前沿, 2016, 03(04): 127-134. http://dx.doi.org/10.12677/AMS.2016.34017
参考文献 (References)
- 1. Williams, T.P., Bubb, J.M. and Lester, J.N. (1994) Metal Accumulation within Salt Marsh Environments: A Review. Marine Pollution Bulletin, 28, 277-290. https://doi.org/10.1016/0025-326X(94)90152-X
- 2. Boorman, L.A. (2003) Salt Marsh Review: An Overview of Coastal Saltmarshes, Their Dynamic and Sensitivity Characteristics for Conservation and Management. Peterborough: JNCC Report, No.334, 6-7.
- 3. 王卿. 盐沼植物群落研究进展: 分布、演替及影响因子[J]. 生态环境学报, 2012, 21(2): 375-388.
- 4. 童春富. 河口湿地生态系统结构、功能与服务: 以长江口为例[D]: [博士学位论文]. 上海: 华东师范大学, 2004.
- 5. Whitney, D.E. and Darley, W.M. (1983) Effect of Light Intensity upon Salt Marsh Benthic Microalgal Photosynthesis. Marine Biology, 75, 249-252. https://doi.org/10.1007/BF00406009
- 6. 全为民. 长江口盐沼湿地食物网的初步研究: 稳定同位素分析[D]: [博士学位论文]. 上海: 复旦大学, 2007.
- 7. Sullivan, M.J. and Moncreiff, C.A. (1990) Edaphic Algae Are an Important Component of Salt Marsh Food-Webs: Evidence from Multiple Stable Isotope Analyses. Marine Ecology Progress Series, 62, 149-159. https://doi.org/10.3354/meps062149
- 8. Litvin, S.Y. and Weinstein, M.P. (2003) Life History Strategies of Estuarine Nekton: The Role of Marsh Macrophytes, Benthic Microalgae, and Phytoplankton in the Trophic Spectrum. Estuaries, 26, 552-562. https://doi.org/10.1007/BF02823730
- 9. MacIntyre, H.L. and Cullen, J.J. (1996) Primary Production by Suspended and Benthic Microalgae in a Turbid Estuary: Time-Scales of Variability in San Antonio Bay, Texas. Marine Ecology Progress Series, 145, 245-268. https://doi.org/10.3354/meps145245
- 10. Cahoon, L.B. & Safi, K.A. (2002) Distribution and Biomass of Benthic Microalgae in Manukau Harbour, New Zealand. New Zealand Journal of Marine and Freshwater Research, 36, 257-266. https://doi.org/10.1080/00288330.2002.9517084
- 11. 商栩. 长江口盐沼湿地底栖微藻的分布特征及其对有机质产出的贡献[J]. 海洋学报, 2009, 31(5): 40-47.
- 12. Brito, A., Newton, A., Tett, P. and Fernandes, T.F. (2009) Temporal and Spatial Variability of Microphytobenthos in a Shallow Lagoon: Ria Formosa (Portugal). Estuarine Coastal and Shelf Science, 83, 67-76. https://doi.org/10.1016/j.ecss.2009.03.023
- 13. 周伟华, 袁翔城, 霍文毅. 长江口邻域叶绿素a和初级生产力的分布[J]. 海洋学报, 2004, 26(3): 143-150.
- 14. Perissinotto, R., Nozais, C. and Kibirige, I. (2002) Spatiotemporal Dynamics of Phytoplankton and Microphytobenthos in a South African Temporarily-Open Estuary. Estuarine, Coastal, and Shelf Science, 55, 47-58. https://doi.org/10.1006/ecss.2001.0885
- 15. 王丹丹. 江苏如东海岸互花米草盐沼沉积物叶绿素a分布特征[J]. 生态学杂志, 2012, 31(9): 2247-2254.
- 16. Cadée, G.C. and Hegeman, J. (1977) Distribution of Primary Production of the Benthic Microflora and Accumulation of Organic Matter on a Tidal Flat Area, Balgzand, Dutch Wadden Sea. Netherlands Journal of Sea Research, 11, 24-41. https://doi.org/10.1016/0077-7579(77)90019-9
- 17. Colijn, F. and de Jonge, V.N. (1984) Primary Production of Microphytobenthos in the Ems-Dollard Estuary. Marine Ecology—Progress Series, 14, 185-196. https://doi.org/10.3354/meps014185
- 18. 李少朋. 潮滩底栖微藻生物量垂直变化对其遥感反演模式的影响[J]. 生态科学, 2014, 33(6): 1155-1159.
- 19. 宁修仁, 刘子琳. 象山港潮滩底栖微型藻类现存量和初级生产力[J]. 海洋学报, 1999, 21(3): 98-105.
- 20. 姜祖辉. 胶州湾红岛潮间带底栖微藻种类组成及其生物量变化[J]. 海洋水产研究, 2007, 28(5): 74-80.
- 21. 陈宇炜, 高锡云. 浮游植物叶绿素a含量测定方法的比较测定[J]. 湖泊科学, 2000, 12(2): 185-187.
- 22. Lorenzen, C.J. (1967) Determination of Chlorophyll and Pheo-Pigments: Spectrophotometric Equations. Limnology and Oceanography, 12, 343-346. https://doi.org/10.4319/lo.1967.12.2.0343
- 23. Whitney, D.E. and Darley, W.M. (1979) A Method for the Determination of Chlorophyll a in Samples Containing Degradation Products. Limnology and Oceanography, 24, 183-186. https://doi.org/10.4319/lo.1979.24.1.0183
- 24. Cahoon, L.B. and Cooke, J.E. (1992) Benthic Microalgal Production in Onslow Bay, North Carolina, USA. Marine Ecology Progress Series, 84, 185-196. https://doi.org/10.3354/meps084185
- 25. 吕鹏翼. 荧光法测定水体叶绿素的影响因素研究[D]: [硕士学位论文]. 河北: 河北科技大学, 2014.
- 26. 王建, 王骥. 浮游植物叶绿素与脱镁叶绿素的测定方法[J]. 武汉植物学研究, 1984, 2(2): 321-328.
- 27. 王荣. 荧光法测定浮游植物色素计算公式的修正[J]. 海洋科学, 1986, 10(3): 1-5.
- 28. 孙力. 荧光法与分光光度法测定叶绿素a的对比试验[J]. 安徽化工, 2003, 29(5): 46-47.
- 29. 国家海洋局及其相关单位. GB/T. 12763.3-2007. 海洋调查规范[S]. 北京: 中国标准出版社, 2007.
- 30. Pinckney, J. and Zingmark, R.G. (1993) Biomass and Production of Benthic Microalgal Communities in Estuarine Habitats. Coastal and Estuarine Research Federation, 16, 887-897.
- 31. Grippo, M.A., Fleeger, J.W., Rabalais, N.N., Condrey, R. and Carman, K.R. (2010) Contribution of Phytoplankton and Benthic Microalgae to Inner Shelf Sediments of the North-Central Gulf of Mexico. Continental Shelf Research, 30, 456-466. https://doi.org/10.1016/j.csr.2009.12.015
- 32. Velasquez (2005) Benthic Primary Production in Coastal Salt Marsh Systems. Master Thesis, Augusta State University, Augusta.
- 33. 李万会. 滩涂沉积物中叶绿素a浓度与沉积特性的关系[J]. 华东师范大学学报(自然科学版), 2007, 2007(4): 26- 32.
- 34. Sullivan (1988) Primary Production of Edaphic Algal Communities in a Mississippi Salt Marsh. Journal of Phycology, 24, 49-58.
- 35. De Jong, D.J. and de Jonge, V.N. (1995) Dynamics and Distribution of Microphytobenthic Chlorophyll-a in the Western Scheldt Estuary (SW Netherlands). Hydrobiologia, 311, 21-30. https://doi.org/10.1007/BF00008568
- 36. Quan, W., Zhang, H., Wu, Z., Jin, S., Tang, F. and Dong, J. (2016) Does Invasion of Spartina alterniflora Alter Microhabitats and Benthic Communities of Salt Marshes in Yangtze River Estuary? Ecological Engineering, 88, 153-164. https://doi.org/10.1016/j.ecoleng.2015.12.026
- 37. Joint, I.R. (1978) Microbial-Production of an Estuarine Mudflat. Estuarine and Coastal Marine Science, 7, 185-195. https://doi.org/10.1016/0302-3524(78)90074-9
- 38. 贺强, 安渊, 崔保山. 滨海盐沼及其植物群落的分布与多样性[J]. 生态环境学报, 2010, 19(3): 657-664.
- 39. 曹磊, 宋金明, 李学刚, 袁华茂, 李宁, 段丽琴. 中国滨海盐沼湿地碳收支与碳循环过程研究进展[J]. 生态学报, 2013, 33(17): 5141-5152.
- 40. Thoresen, M. (2004) Temporal and Spatial Variation in Seston Available to Oysters and the Contribution of Benthic Diatoms to Their Diet in the Duplin River, Georgia. PhD Thesis, University of Georgia, Georgia.
- 41. CahoonL, B. (1999) The Role of Benthic Microalgae in Neritic Ecosystem. Oceanography and Marine Biology: An Annual Review, 37, 47-86.