Journal of Organic Chemistry Research
Vol.
10
No.
04
(
2022
), Article ID:
58851
,
7
pages
10.12677/JOCR.2022.104014
2,3-Wittig反应的研究进展
陈书升*,王欢欢,张理明
浙江师范大学,化学与生命科学学院,浙江 金华
收稿日期:2022年8月28日;录用日期:2022年12月1日;发布日期:2022年12月8日

摘要
[2,3]-Wittig重排不同于传统的[3,3]-Claisen重排,自发现起得到了合成化学家的广泛关注,并得到了充分的研究。由于其能实现化学键高效简洁的转化,且能得到具有高度衍生化的含烯丙基的产物,[2,3]-Wittig重排在全合成领域具有重要的地位。本文旨在从该反应的最初发现、重排前体的构建、不对成重排的实现等方面,全面系统的介绍有别于传统[3,3]-Claisen重排的[2,3]-Wittig重排反应。
关键词
[2,3]-Wittig重排,重排前体,烯丙基化

The Progress of [2,3]-Wittig Rearrangement
Shusheng Chen*, Huanhuan Wang, Liming Zhang
College of Chemistry and Life Science, Zhejiang Normal University, Jinhua Zhejiang
Received: Aug. 28th, 2022; accepted: Dec. 1st, 2022; published: Dec. 8th, 2022

ABSTRACT
[2,3]-Wittig rearrangement is an attractive reaction, which is extremely different from the traditional [3,3]-claisen rearrangement, and has received extensive attention from chemists since its initial discovery. Due to its efficient and concise transformation of chemical bonds and the ability to obtain highly derivatized allyl-containing products, [2,3]-Wittig rearrangement plays an important role in total synthesis. This review attempts to provide comprehensive knowledge about [2,3]-Wittig rearrangement, including initial discovery, construction of substrates, asymmetrical rearrangements, and so on.
Keywords:[2,3]-Wittig Rearrangement, Substrates of Rearrangement, Allylation

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
[2,3]-Wittig重排反应类似于传统的[3,3]-Claisen和Cope重排,是一类符合Woodward-Hoffmann规则的一种周环反应。重排反应具有自身独特的区域选择性、立体选择性,并且能在一步反应内实现化学键的构建和原子的高效重组,因此自发现以来备受关注,[2,3]-Wittig重排反应也不例外。[2,3]-Wittig重排反应总的反应过程如图1,机理上类似于SNi反应。SNi反应全称为分子内亲核取代反应,其中S代表取代,N代表亲核,i代表分子内。重排结构中的X一般为氧原子,Y可以为带负电荷或未成键的孤对电子,重排前体也可以是叶立德 [1]。随着研究的逐渐深入,[2,3]-Wittig重排反应中出现不同类的重排底物,各自被命名为不同的人名反应,如Sommelet的反应等等。本文主要从最初发现、构建重排前体的不同方式、不对称重排的实现等方面,系统介绍[2,3]-Wittig重排反应的研究进展。
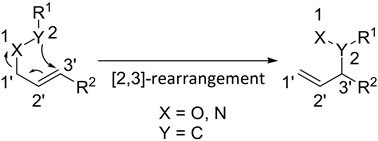
Figure 1. General process of [2,3]-Wittig rearrangement
图1. [2,3]-Wittig重排反应的一般过程
2. 传统的[2,3]-Wittig Rearrangement
[2,3]-Wittig重排反应首次发现于1942年。Wittig [2] 及其同事发现,在强碱(正丁醇钠或甲基锂)作用下,烯丙基芴基醚在发生[1,2]-重排的同时得到了具有高烯丙醇结构单元的[2,3]-重排产物(图2,Equation 1)。随后,Y. Makizumi及J. Cast等 [3] 人对该反应进行机理研究。由于[1,2]-重排的公认的机理为自由基对的解离–再结合,而[2,3]-重排被认为是热力学驱动的协同反应,同时满足霍夫曼规则和前线轨道理论,故反应中两者通常没有表现出显著的选择性,反应能同时得到不同比例的两种产物。但研究发现,温度越低越有利于[2,3]-重排的发生 [4],故传统的[2,3]-重排温度一般尽可能低。
不可否认的是,反应中通常使用烷基锂等强碱,导致反应底物范围比较狭窄。2015年,Scott E. Denmark课题组 [5] 报道了在3℃~5℃,甲苯作溶剂,相转移催化剂催化下,可使用较弱的氢氧化钾为碱发生[2,3]-Wittig重排,研究结果展现了相转移催化剂对重排反应具有独特的催化特性(图2,Equation 2)。
除了碱性条件下拔质子形成碳负离子外,羰基化合物在路易斯酸催化下互变异构为烯醇式 [6] (图2,Equation 3),或与二级胺缩合形成烯胺 [7] (图2,Equation 4),也可进行[2,3]-Wittig重排反应。近期,Dean J. Tantillo课题组 [8] 讨论了α-重氮羰基化合物与烯丙基醚的金属催化的[2,3]-Wittig重排反应,该类将重排与金属卡宾相结合,最早由W. Kirmse于1968年报道,称为Doyle-Kirmse反应(图2,Equation 5)。
3. Still-Wittig重排反应
1978年,Still及其同事 [9] 将烯丙醇与三正丁基碘甲基锡在氢化钾作用下,原位形成重排前体(图3),
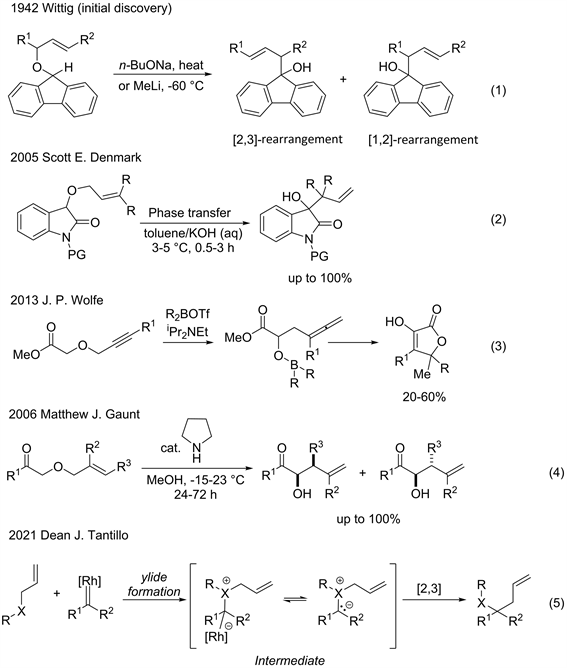
Figure 2. Traditional [2,3]-Wittig rearrangement
图2. 传统[2,3]-Wittig重排

Figure 3. Still-Wittig rearrangement
图3. Still-Wittig重排
并在丁基锂作用下实现较高产率和高立体选择性的[2,3]-重排反应,首次得到了Z-构型的高烯丙醇衍生物。
该反应还第一次以锡-锂交换的方式生成碳负离子,有别于传统的拔质子的方式,使底物兼容性有了大幅提高。因此,Still-Wittig 重排反应广泛应用于天然产物全合成中,如Pre-schisanartanin C [10]、(±)-Maoecrystal V [11]、(−)-Candelalide A [12] (图3)等。
4. aza-Wittig重排反应
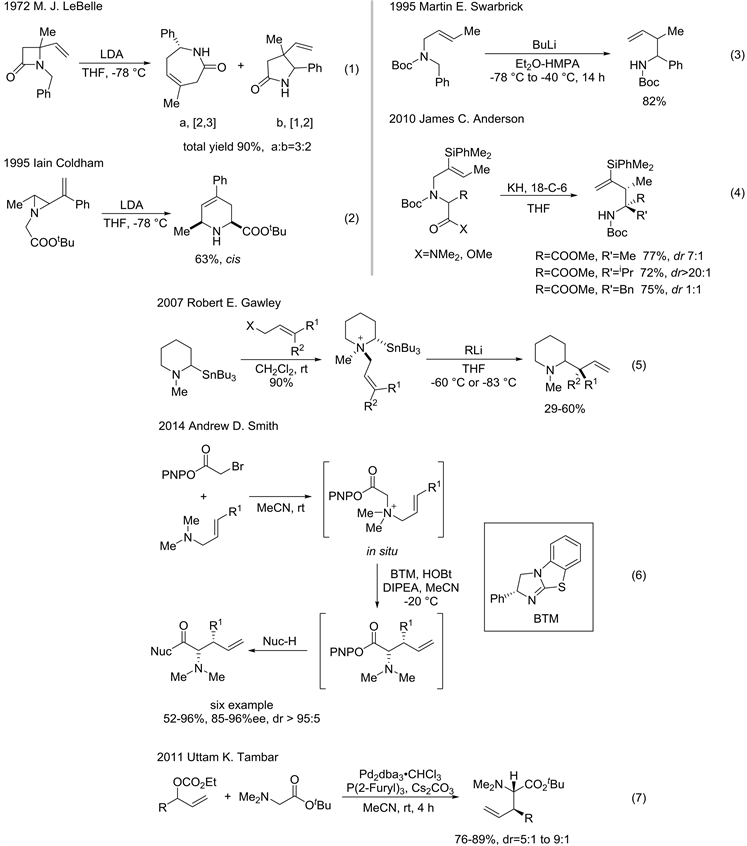
Figure 4. Aza-Wittig rearrangement
图4. Aza-Wittig重排反应
如果将反应底物中X为氮原子(图1),也能发生[2,3]-Wittig重排,被称为aza-Wittig重排反应。
1972年,M. J. LeBelle课题组 [13] 发现l-苄基-4-乙烯基-2-氮杂环丁烷在LDA作用下,发生[2,3]-重排,扩环得到五元内酰胺,但是同时有较高比例的[1,2]-重排产物(比例为3:2,总产率90%) (图4)。1995年,Iain Coldham [14] 发现乙烯基氮丙啶在LDA作用下,可以发生[2,3]-重排,以中等收率得到扩环的氨基酸衍生物。由于三元环和四元环都具有较大的张力,[2,3]-重排不适用于无张力环和链状底物中,反应不具备普适性。同年,Martin E. Swarbrick [15] 发现将烯丙基苄基胺的氮原子进行Boc保护,通过攫取苄位的氢原子形成碳负离子,以82%的产率得到重排产物。该反应通过设计合适的链状重排前体,解决了无张力驱动下的[2,3]-aza-Wittig重排反应,极大的推动了该领域的发展。2010年,James C. Anderson课题组 [16] 将底物范围拓展到含羰基化合物的三级胺,以91%的产率和高对映选择性(dr > 20:1)得到α-氨基酸酯衍生物。
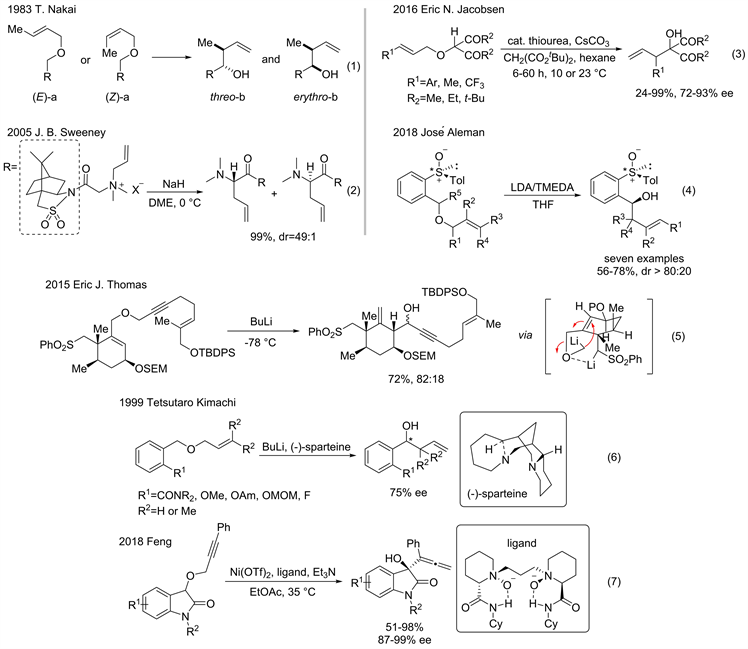
Figure 5. Asymmetrical Wittig rearrangement
图5. 不对成Wittig重排
除了烯丙基三级胺类结构外,氮叶立德也可以进行[2,3]-aza-Wittig重排反应。随之而来的是,如何高效构建氮叶立德成为研究者关注的重点。2007年,Robert E. Gawley课题组 [17] 报道了从环状二级胺出发,与卤代烃制备季铵盐后,在丁基锂作用下形成碳负离子重排。季铵盐需要分离,且分离困难,于是Andrew D. Smith课题组 [18] 随后报道了二级胺和卤代烃的一锅法[2,3]-aza-Wittig重排反应的研究。
此外,Uttam K. Tambar课题组 [19] 于2011年报道了,在钯催化下,实现了烯丙基乙基碳酸酯与二级胺原位构建叶立德,并发生[2,3]-重排。
5. 不对称[2,3]-Wittig重排反应
[2,3]-Wittig重排反应过程中存在五元环过渡态,因此产物往往表现出一定的立体选择性。由于E-构型的双键具有热力学稳定性,重排产物中双键构型几乎为单一的E-构型。早在1983年,T. Nakai课题组 [20] 已研究了不同取代的重排前体及双键的不同构型对立体选择性的影响,即苏式(图5,erythro-b)和赤式(图5,thero-b)的产物比例不同,得出以下规律:1) 几乎所有Z式双键都能转化为赤式,E式转化为苏式;2) 不同的R基团对选择性影响较大。
为解决结构复杂的底物重排的立体选择性问题,分子内的手性诱导是方案之一。2005年,J. B. Sweeney [21] 在分子内引入手性桥环,以高立体选择性(dr = 49:1)、接近完全转化的产率得到目标产物。2018年,José Aleman课题组 [22] 则巧妙地将手性亚砜作为诱导片段。但是,分子内手性片段的引入不可避免地导致底物受限,也为产物的后期修饰造成困难。
作为替代方案,Eric J. Thomas课题组 [23] 利用分子内固有的基团与锂离子的络合,选择性地形成不同构象,进而转化为不同产物,为多氧代的复杂分子的选择性[2,3]-重排提供了新的思路。1999年,Tetsutaro Kimachi课题组 [24] 则在体系中除丁基锂外,加入手性有机碱,得到75%ee值的产物。2016年,Eric N. Jacobsen课题组 [25] 报道了手性硫脲衍生物作为催化剂,碳酸铯作碱,室温下以优秀的产率和立体选择性得到重排产物。2018年,冯小明课题组 [26] 发现,在路易斯酸和手性配体的共同作用下,从消旋的N-苄基保护的3-苯基炔丙基氧基羟吲哚出发,通过动力学拆分,得到接近99%ee值的可高度衍生化的产物,同时构建了一个手性季碳。
6. 总结
自1942年发现至今,[2,3]-Wittig重排反应在合成高烯丙醇衍生物上体现出不可替代性。随着化学家们研究的深入,该反应由最初的烷基锂、−78℃的低温的苛刻条件到有机弱碱、室温下反应,反应条件逐渐温和。同时,卡宾化学、有机小分子催化等新颖的方法学研究成果,使得重排前体的构建方式不断多样,重排底物对反应兼容性不断提升。重排反应的不对成研究也极大提高了该反应的价值。但是不可否认的是,目前应用较为广泛的Still-Wittig反应由于苛刻的反应条件,仅仅在全合成早期阶段应用较广,在后期修饰比较少见,发展条件温和、底物普适性高的Wittig反应仍然是未来的努力方向。
文章引用
陈书升,王欢欢,张理明. 2,3-Wittig反应的研究进展
The Progress of [2,3]-Wittig Rearrangement[J]. 有机化学研究, 2022, 10(04): 138-144. https://doi.org/10.12677/JOCR.2022.104014
参考文献
- 1. Hoffmann, R.W. (1979) Stereochemistry of [2,3] Sigmatropic Rearrangements. Angewandte Chemie International Edition, 18, 563-572. https://doi.org/10.1002/anie.197905633
- 2. Lansbury, P.T. and Pattison, V.A. (1962) Some Reactions of α-Metalated Ethers. The Journal of Organic Chemistry, 27, 1933-1939. https://doi.org/10.1021/jo01053a001
- 3. Cast, J., Stevens, T.S. and Holmes, J. (1960) Molecular Rearrangement and Fission of Ethers by Alkaline Reagents. Journal of the Chemical Society, 3521-3527. https://doi.org/10.1039/jr9600003521
- 4. Baldwin, J.E., De Bernardis, J. and Patrick, J.E. (1970) Anion Rearrangements: Duality of Mechanism in the Decomposition of Allylic Ether Anions and Synthetic Applications. Tetrahedron Letters, 11, 353-356. https://doi.org/10.1016/0040-4039(70)80082-X
- 5. Denmark, S.E. and Cullen, L.R. (2015) Development of a Phase-Transfer-Catalyzed, [2,3]-Wittig Rearrangement. The Joural of Organic Chemistry, 80, 11818-11848. https://doi.org/10.1021/acs.joc.5b01759
- 6. Everett, R.K. and Wolfe, J.P. (2013) Synthesis of Substituted 3-Hydroxy-2-Furanone Derivatives via an Unusual Enolate Wittig Rearrangement/Alkylative Cyclization Sequence. Organic Letter, 15, 2926-2929. https://doi.org/10.1021/ol4009188
- 7. McNally, A., Evans, B. and Gaunt, M.J. (2006) Organocatalytic Sigmatropic Reactions: Development of a [2,3] Wittig Rearrangement through Secondary Amine Catalysis. Angewandte Chemie International Edition, 45, 2116-2119. https://doi.org/10.1002/anie.200504301
- 8. Laconsay, C.J. and Tantillo, D.J. (2021) Metal Bound or Free Ylides as Reaction Intermediates in Metal-Catalyzed [2,3]-Sigmatropic Rearrangements? It Depends. ACS Catalysis, 11, 829-839. https://doi.org/10.1021/acscatal.0c04768
- 9. Still, W.C. and Mitra, A. (1978) A Highly Stereoselective Synthesis of Z-Trisubstituted Olefins via [2,3]-Sigmatropic Rearrangement. Preference for a Pseudoaxially Substituted Transition State. Journal of the American Chemical Society, 100, 1927-1928. https://doi.org/10.1021/ja00474a049
- 10. Jiang, Y.L., Yu, H.X., Li, Y., Qu, P., Han, Y.X., Chen, J.H. and Yang, Z. (2020) Asymmetric Total Synthesis of Pre-Schisanartanin C. Journal of the American Chemical Society, 142, 573-580. https://doi.org/10.1021/jacs.9b11872
- 11. Peng, F. and Danishefsky, S.J. (2012) Total Synthesis of (+/-)-Maoecrystal V. Journal of the American Chemical Society, 134, 18860-18867. https://doi.org/10.1021/ja309905j
- 12. Watanabe, K., Iwasaki, K., Abe, T., Inoue, M., Suzuki, T. and Katoh, T. (2005) Enantioselective Total Synthesis of (-)-Candelalide A, a Novel Blocker of the Voltage-Gated Potassium Channel Kv1.3 for an Immunosuppressive Agent. Organic Letter, 7, 3745-3748. https://doi.org/10.1021/ol051398c
- 13. Durst, T., Van den Elzen, R. and LeBelle, M.J. (1972) Base-Induced Ring Enlargements of 1-Benzyl- and 1-allyl-2-azetidinones. Journal of the American Chemical Society, 94, 9261-9263. https://doi.org/10.1021/ja00781a065
- 14. Coldham, I., Collis, A.J., Mould, R.J. and Rathmell, R.E. (1995) Ring Expansion of Aziridines to Piperidines Using the Aza-Wittig Rearrangement. Tetrahedron Letters, 36, 3557-3560. https://doi.org/10.1016/0040-4039(95)00557-S
- 15. Anderson, J.C., Siddons, D.C., Smith, S.C. and Swarbrick, M.E. (1995) Aza-[2,3]-Wittig Sigmatropic Rearrangement of Crotyl Amines. Journal of the Chemical Society, Chemical Communications, 1835-1836. https://doi.org/10.1039/c39950001835
- 16. Anderson, J.C. and Davies, E.A. (2010) Diastereoselective Synthesis of Substituted Prolines via 5-Endo-Trig Cyclisations of Aza-[2,3]-Wittig Sigmatropic Rearrangement Products. Tetrahedron, 66, 6300-6308. https://doi.org/10.1016/j.tet.2010.04.095
- 17. Gawley, R.E. and Moon, K. (2007) Stereoselective [2,3]-Sigmatropic Rearrangements of Unstabilized Nitrogen Ylides. Organic Letter, 9, 3093-3096. https://doi.org/10.1021/ol071188v
- 18. West, T.H., Daniels, D.S., Slawin, A.M. and Smith, A.D. (2014) An Isothiourea-Catalyzed Asymmetric [2,3]-Rearrangement of Allylic Ammonium Ylides. Journal of the American Chemical Society, 136, 4476-4479. https://doi.org/10.1021/ja500758n
- 19. Soheili, A. and Tambar, U.K. (2011) Tandem Catalytic Allylic Amination and [2,3]-Stevens Rearrangement of Tertiary Amines. Journal of the American Chemical Society, 133, 12956-12959. https://doi.org/10.1021/ja204717b
- 20. Mikami, K., Kimura, Y., Kishi, N. and Nakai, T. (1983) Acyclic Diastereoselection of the [2,3]-Wittig Sigmatropic Rearrangement of a Series of Isomeric Crotyl Ethers. A Conceptual Model for the Transition-State Geometry. The Journal of Organic Chemistry, 48, 279-281. https://doi.org/10.1021/jo00150a033
- 21. Workman, J.A., Garrido, N.P., Sancon, J., Roberts, E., Wessel, H.P. and Sweeney, J.B. (2005) Asymmetric [2,3]- Rearrangement of Glycine-Derived Allyl Ammonium Ylids. Journal of the American Chemical Society, 127, 1066-1067. https://doi.org/10.1021/ja043768i
- 22. Rodriguez, R.I., Ramirez, E., Fernandez-Salas, J.A., Sanchez-Obregon, R., Yuste, F. and Aleman, J. (2018) Asymmetric [2,3]-Wittig Rearrangement: Synthesis of Homoallylic, Allenylic, and Enynyl Alpha-Benzyl Alcohols. Organic Letter, 20, 8047-8051. https://doi.org/10.1021/acs.orglett.8b03659
- 23. Blackburn, T.J., Kilner, M.J. and Thomas, E.J. (2015) Synthetic Approaches to Phomactins: On the Stereoselectivity of Some [2,3]-Wittig Rearrangements. Tetrahedron, 71, 7293-7309. https://doi.org/10.1016/j.tet.2015.04.005
- 24. Kawasaki, T. and Kimachi, T. (1999) Sparteine-Mediated Enantioselective [2,3]-Wittig Rearrangement of Allyl Ortho-Substituted Benzyl Ethers and Ortho-Substituted Benzyl Prenyl Ethers. Tetrahedron, 55, 6847-6862. https://doi.org/10.1016/S0040-4020(99)00338-5
- 25. Kennedy, C.R., Guidera, J.A. and Jacobsen, E.N. (2016) Synergistic Ion-Binding Catalysis Demonstrated via an Enantioselective, Catalytic [2,3]-Wittig Rearrangement. ACS Central Science, 2, 416-423. https://doi.org/10.1021/acscentsci.6b00125
- 26. Xu, X., Zhang, J., Dong, S., Lin, L., Lin, X., Liu, X. and Feng, X. (2018) Nickel(II)-Catalyzed Asymmetric Propargyl [2,3] Wittig Rearrangement of Oxindole Derivatives: A Chiral Amplification Effect. Angewandte Chemie International Edition, 57, 8734-8738. https://doi.org/10.1002/anie.201804080