Hans Journal of Medicinal Chemistry
Vol.06 No.02(2018), Article ID:24998,8
pages
10.12677/HJMCe.2018.62005
Research Progress on Synthesis and Biological Activity of Rhubarb Acid Derivatives
Li Miao, Wenlong Wang*
School of Pharmacy, Jiangnan University, Wuxi Jiangsu

Received: Apr. 25th, 2018; accepted: May 16th, 2018; published: May 23rd, 2018

ABSTRACT
Rhein is one of the active ingredients of traditional Chinese medicine aloe and rhubarb, and contains planar 1,8-dihydroxy anthraquinone structural units, with poor solubility and low bioavailability. In order to improve its physical and chemical properties, improve bioavailability and find new indications, domestic and foreign scholars have conducted in-depth studies on rhein derivatives. This article briefly reviewed the synthesis of rhein derivatives and their biological activities in reducing blood sugar, anti-inflammatory and anti-tumor.
Keywords:Rhein Derivatives, Synthesis, Biological Evaluation
大黄酸衍生物的合成及生物活性研究进展
缪丽,王文龙*
江南大学药学院,江苏 无锡

收稿日期:2018年4月25日;录用日期:2018年5月16日;发布日期:2018年5月23日

摘 要
大黄酸是中药芦荟、大黄的有效成分之一,含有平面状的1,8-二羟基蒽醌结构单元,存在溶解度差、生物利用度低等问题。为了改善其理化性质,提高生物利用度,发现新的适应症,国内外学者围绕大黄酸衍生物做了深入研究。本文简要综述了大黄酸衍生物的合成及其在降血糖、消炎以及抗肿瘤等方面的生物活性研究进展。
关键词 :大黄酸衍生物,合成,生物活性评价

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
大黄酸在蓼科、豆科、芸香科及百合科等多种植物中广泛分布,具有抗病毒、抗肿瘤、抗炎以及降糖调脂等生物活性 [1] [2] [3] [4] 。从结构上看,大黄酸含有平面状的1,8-二羟基蒽醌结构单元,具有电化学氧化还原性质 [5] [6] ,其特殊的平面结构以及结构中存在的1位羟基、8位羟基和3位羧基导致该化合物溶解度差,生物利用度低。近年来,研究人员为了改善大黄酸类衍生物的理化性质,提高生物利用度,发现新的适应症,主要围绕大黄酸的1位羟基、8位羟基和3位羧基进行修饰 [7] ,以期得到成药性好的衍生物。值得一提的是,将大黄酸1位和8位的羟基乙酰化后得到双乙酰大黄酸(双醋瑞因,Diacerein)(结构如图1所示),作为治疗骨关节炎的药物已经在意大利上市,可被人体迅速代谢为大黄酸而发挥作用 [7] [8] [9] 。本文简要综述了大黄酸衍生物的合成及其在降血糖、消炎以及抗肿瘤等方面的生物活性研究进展。
2. 具降血糖活性的大黄酸衍生物
最初,曹贺 [8] 等人以大黄酸为母体,设计并合成大黄酸-酰胺类衍生物,得到化合物库1 (见图2)。在糖尿病肾病小鼠模型上的构效关系研究表明:当把3位羧基衍生化为酰胺时,这些衍生物均表现出明显的降血糖活性。为了丰富化合物的结构多样性,改善衍生物的生物利用度,Zhu [10] 等人用酸酐或TBSCl

Figure 1. The structure of Diacerein
图1. 双醋瑞因的结构
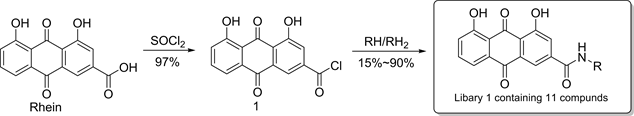
Figure 2. Synthesis of compound library 1
图2. 化合物库1的合成
保护大黄酸母核上的两个羟基,分别得到中间体2和3,然后在碱性条件下与各种类型的胺缩合,得到化合物库2(见图3)。
在HepG2细胞模型上摄取葡萄糖的能力研究结果显示 [11] ,当这些化合物浓度设定为10 mg∙L−1时,HepG2细胞吸收葡萄糖的能力较对照组大黄酸在相同浓度下HepG2细胞吸收葡萄糖的能力有所提升,通过测定其ClogP值对比发现,尤其化合物4(ClogP = 8.924)和化合物5(ClogP = 9.938)较对照组大黄酸(ClogP = −1.633)具有显著的差异。这些结果说明,一方面引入的TBS基团可以调节其脂水分配系数,改善其溶解度,进而使其生物利用度得到进一步提升,另一方面当把羧基修饰改造生成各种酰胺类化合物时,可明显提高其降血糖活性。
基于此,为了得到高活性的降血糖药物,Zhu [12] 等人设想:如果保留羧基,在母核上引入其他基团,还能否具有降血糖活性?他们以大黄素(Emodin)为原料,在大黄酸母核的6位引入烷氧基,设计并合成了化合物21-25,以期得到高活性降血糖化合物。具体合成路线如图4所示 [12] [13] ,首先以商品化合物大黄素为母体和不同链长的溴代烷烃于微波反应器中反应得到化合物6-10,然后在碱性条件下,化合物6-10和乙酸酐反应得到含乙酰氧基的化合物11-15,最后经过氧化和脱保护得到化合物21-25。
通过测定化合物21-25对α-葡萄糖淀粉酶的抑制活性研究显示 [12] ,所有化合物对酶均有抑制作用。当浓度为100 mg∙L−1时,化合物21和化合物22较对照组大黄素对α-葡萄糖淀粉酶的抑制活性有所提高,有意思的是,含正辛烷氧基的化合物23(Ki = 60.6%)对酶表现出最强的抑制活性,是大黄素(Ki = 23.6%)的3倍左右,而化合物24和化合物25抑制作用又逐渐减弱,说明取代基的链长对活性有明显的影响。这些结果显示,保留羧基,对大黄酸母核其他位置进行修饰改造,引入一些脂溶性基团,有利于改善溶解度,提高生物利用度和降血糖活性。有趣的是,随着引入的烷烃链的增长,化合物对α-葡萄糖淀粉酶的抑制作用也随之加强,但当碳原子数大于8时,其抑制作用又逐渐减弱 [11] 。这些结果说明,当引入的
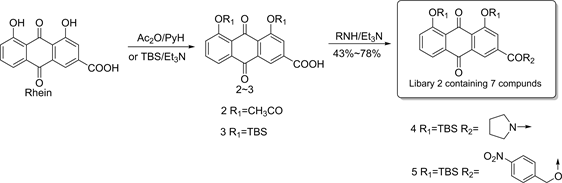
Figure 3. Synthesis of compound library 2
图3. 化合物库2的合成
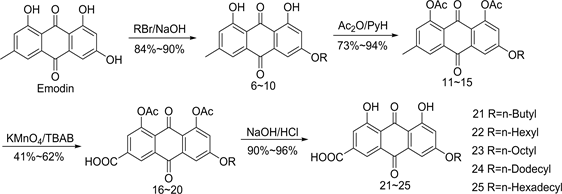
Figure 4. Synthesis of compound 21-25
图4. 化合物21-25的合成
烷烃链越长,产生的位阻就越大,从而会影响化合物与酶的相互作用。因此只有当引入适当链长的烷烃时,才具有较好降血糖活性。
3. 具抗炎活性的大黄酸衍生物
研究表明,大黄酸还具有显著的抗炎活性,Owton [14] 等人早期以大黄酸为母体,设计合成治疗骨关节炎的大黄酸衍生物。经对豚鼠口服给药后发现:当大黄酸的1,8-二羟基甲基化,5号位置连接氟原子时得到化合物26(图5),与双醋瑞因相比可以显著提高抗炎作用,但这类化合物具有遗传毒性 [14] 。为了克服以上缺陷,Baxter [15] 等人在大黄酸1,8-二羟基位置进行结构修饰,设计合成一系列大黄酸酯类衍生物,实验结果表明,化合物27(图6)抗炎作用最为显著,究其原因,主要在于连接的酯基不但能够改善其溶解度、降低胃肠道毒副作用,还可以阻碍抗炎因子的释放,从而大大增强抗炎活性。后来蔡进等人将以多聚醇为连接体,将大黄酸和非甾体抗炎药对接偶联,形成新型抗炎化合物,合成得到小型化合物库3和化合物库4。具体合成路线如图7所示 [16] [17] ,首先大黄酸先经过乙酰化和酰氯化得到化合物28,然后与不同链长的多聚醇(n = 1,2,3)反应得到化合物29-31,随后在碱性条件下,化合物29-31和非甾体抗炎药偶联得到化合物库3,化合物库3的化合物经去乙酰化得到化合物库4。
在体外活性测试结果表明 [16] ,化合物库3和化合物库4中的所有化合物对HAP(羟基磷灰石)都有一定的吸收能力。当剂量为80mg时,化合物32和化合物33对HAP的吸收率均能达到70%,表现了良好的骨靶向性。在体内活性测试结果表明,大部分化合物对耳廓肿大老鼠显示抗炎效果,其中化合物32和化合物33的抗炎作用最为突出。值得一提的是化合物32的抗炎效果明显优于双醋瑞因,这些结果为开发新型高效抗炎药物提供了思路。
4. 具抗肿瘤活性的大黄酸衍生物
研究显示,大黄酸具有一定的抗肿瘤活性,这主要与平面状的1,8-二羟基蒽醌结构单元有关 [18] 。Yang等人将大黄酸3位的羧基转换成氨基,设计并合成了小规模化合物库5 [19] ,以期得到具有抗肿瘤活性的化合物。具体合成路线如图8所示 [20] [21] ,首先将大黄酸的两个羟基和一个羧基甲基化,得到中

Figure 5. Compound 26
图5. 化合物26

Figure 6. Compound 27
图6. 化合物27
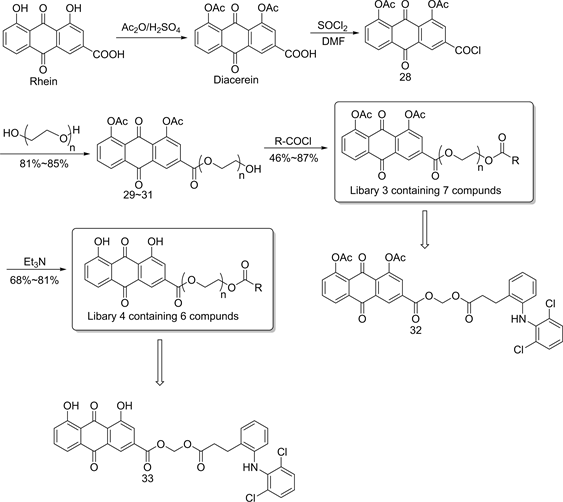
Figure 7. Synthesis of compound library 3 and 4
图7. 化合物库3和化合物库4的合成

Figure 8. Synthesis of compound library 5
图8. 化合物库5的合成
间体34,然后水解得到酸性中间体35,中间体35在碱性条件下和叠氮磷酸二苯酯反应得到化合物36,经库尔提斯重排(Curtius rearrangement)反应得到氨基化合物37,化合物37经去甲基化后得到化合物38,之后与氯乙酰氯反应得到化合物39,最后化合物39与不同的胺反应得到化合物库5。
在HeLa细胞和MOLT4细胞模型上的活性测试结果表明,这些衍生物对这2种细胞都有一定的抑制作用 [19] 。其中化合物39的抗肿瘤活性明显优于化合物库5中的所有化合物,对HeLa细胞(IC50 = 2.7 μmol∙L−1)和MOLT4细胞(IC50 = 0.6 μmol∙L−1)分别表现了良好的细胞毒活性。这些结果说明,化合物39连接的氯乙酰基侧链容易与DNA结合,使其构象发生改变,从而抑制肿瘤细胞的生长 [20] 。
此外,Huang [22] 等人将大黄酸3位的羧基通过酯化反应得到酯衍生物(化合物库6,见图9)。
HeLa细胞活性测试结果表明,随着化合物浓度的增大,这些酯类衍生物对HeLa细胞株的抑制作用普遍强于相同浓度下大黄酸对HeLa细胞株的抑制作用,其中化合物40在浓度为100 μg∙mL−1时,抑制作用最为明显,可达到70%,但低于对照组喜树碱在相同浓度下对HeLa细胞株的抑制作用。此外,随着酯基的位阻变大,衍生物对HeLa细胞株的抑制作用明显减弱,这些信息为设计、合成新型高效抗肿瘤的大黄酸衍生物提供了宝贵的思路。
在Huang等人的研究基础上,Tian [23] [24] 等人继续设计并合成了1,8-二乙酰基大黄酸-(2-溴)-乙酯(化合物41)。具体的合成路线如图10所示 [23] ,先将大黄酸的1,8-二羟基进行双乙酰化得双乙酰大黄酸,然后在碱性条件下,与1,2-二溴乙烷反应得化合物41。对比化合物41和大黄酸的LogP值,发现化合物41的LogP值明显小于大黄酸,说明化合物41的水溶性明显优于大黄酸。化合物41对骨肉瘤MG-63细胞的生长抑制结果表明,化合物41对骨肉瘤MG-63细胞的抑制作用明显高于相同浓度下大黄酸对MG-63细胞的抑制作用,有可能是因为引入的卤素增强了化合物与DNA的相互作用,从而提高化合物的抗肿瘤活性。
5. 总结与展望
综上所述,大黄酸作为生物活性广泛的天然产物,引起了国内外学者的广泛关注。对大黄酸及其衍生物在抗肿瘤、抗炎、降血糖等领域的研究成果,为后续进一步改善化合物的成药性和发现新的适应症积累宝贵的经验,也为基于天然产物发现新型药物的研发理念提供了新的案例。由于其特殊的平面结构导致化合物溶解度差,生物利用度低,但以双醋瑞因为代表的实例作为治疗骨关节的药物已经在意大利上市。因此,我们坚信在不久的将来会有成药性好的大黄酸药物出现,前景广阔,值得我们进一步探究。
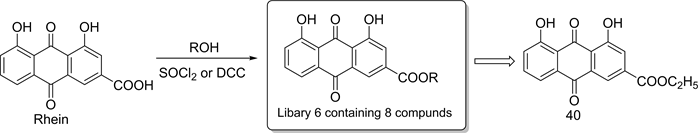
Figure 9. Synthesis of compound library 6
图9. 化合物库6的合成
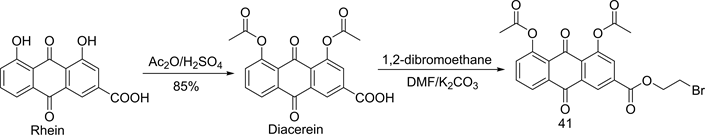
Figure 10. Synthesis of compound 41
图10. 化合物41的合成
基金项目
国家自然科学基金面上项目(21772068),江苏省产学研前瞻性联合研究项目(BY2016022-37)。
文章引用
缪丽,王文龙. 大黄酸衍生物的合成及生物活性研究进展
Research Progress on Synthesis and Biological Activity of Rhubarb Acid Derivatives[J]. 药物化学, 2018, 06(02): 29-36. https://doi.org/10.12677/HJMCe.2018.62005
参考文献
- 1. 周昌健. 大黄酸–氨基酸偶联物的合成及抗肿瘤活性初步研究[D]: [硕士学位论文]. 新疆: 石河子大学, 2015.
- 2. Zhou, Y.X., Xia, W., Yue, W., et al. (2015) Rhein: A Review of Pharmacological Activities. Evidence-Based Complementary Alternative Medicine, 578107.
- 3. 唐敏, 李鸿, 周国梅, 等. 大黄酸调控Rac1/LIMK1/cofilin信号通路抑制卵巢癌细胞运动与侵袭[J]. 中国药理学通报, 2016, 32(3): 366-372.
- 4. Sun, H., Luo, G., Chen, D., et al. (2016) A Comprehensive and System Review for the Pharmacological Mechanism of Action of Rhein, an Active Anthraquinoneingredient. Frontiers in Pharmacology, 7, 1-16. https://doi.org/10.3389/fphar.2016.00247
- 5. 严志红, 黎拒难, 唐睿. 碳糊电极吸附催化伏安法测定大黄酸[J]. 药物分析杂志, 2010, 30(2): 329-331.
- 6. 余佳, 吴晓青, 孙海峰, 等. 大黄酸及其衍生物的生物活性研究进展[J]. 药学与临床研究, 2008, 16(2): 125-128.
- 7. 陈秋荷, 皮荣标, 陈景考. 大黄酸及其衍生物: 合成与药理作用研究进展[J]. 药学研究, 2016, 35(3): 161-167.
- 8. 曹贺, 杜娟, 孙伟新, 等. 大黄酸衍生物的制备及其抗糖尿病肾病活性研究[J]. 中国药物化学杂志, 2011, 21(3): 189-194.
- 9. Legendre, F., Heuze, A., Boukerrouche, K., et al. (2009) Rhein, the Metabolite of Diacerhein, Reduces the Proliferation of Osteoarthritic Chondrocytes and Synoviocytes without Inducing Apoptosis. Scandinavian Journal of Rheuma-tology, 38, 104-111. https://doi.org/10.1080/03009740802421996
- 10. Zhu, X., Ye, X., Song, L., et al. (2013) Synthesis and Hypoglycemic Activity Evaluation of Rhein Amide Derivatives. Medicinal Chemistry Research, 22, 2228-2234. https://doi.org/10.1007/s00044-012-0215-7
- 11. Xu, J., Ma, M. and Puecell, W.M. (2003) Characterisation of Some Cy-totoxic Endpoints Using Rat Liver and HepG2 Spheroids as in Vitro Models and Their Application in Hepatotoxicity Studies. I. Glucose Metabolism and Enzyme Release as Cytotoxic Markers. Toxicology and Applied Pharmacology, 189, 100-111. https://doi.org/10.1016/S0041-008X(03)00089-9
- 12. Zhu, X., Ye, X., Yuan, L., et al. (2012) Synthesis and Hypoglycemic Activity Evaluation of 7-Alkoxyl-Rhein. Medicinal Chemistry Research, 21, 421-427. https://doi.org/10.1007/s00044-010-9511-2
- 13. 朱小康, 叶小利, 袁吕江, 等. 微波辐射下6-烷氧基大黄酸的合成及抑菌活性研究[J]. 有机化学, 2010, 30(9): 1335-1341.
- 14. Owton, W.M., Michael, B., Martin, V.M., et al. (1995) Synthesis of 4, 5, 8-Trimethoxy-9, 10-Dioxo-9, 10-Dihy- droanthracene-2-Carboxylic Acid, an Analogue of Rhein with Improved System Exposure in the Guinea Pig. Journal of the Chemical Society, 7, 931-934.
- 15. Baxter, A.D. and Walmsley, A. (2005) Ester Derivatives of Rhein and Their Therapeutic Use. US, 105911557. 2005-03-04.
- 16. Cai, J., Duan, Y., Yu, J., et al. (2012) Bone-Targeting Glycol and NSAIDS Ester Prodrugs of Rhein: Synthesis, Hydroxyapatite Affinity, Stability, Anti-Inflammatory, Ulcerogenicity Index and Pharmacokinetics Studies. European Journal of Medicinal Chemistry, 55, 409-419. https://doi.org/10.1016/j.ejmech.2012.07.053
- 17. Duan, Y., Yu, J., Liu, S., et al. (2009) Synthesis of Anthraqui-none-Ibuprofen Prodrugs with Hydroxyapatite Affinity and Anti-Inflammatory Activity Characteristics. Medicinal Chemistry, 5, 577-582. https://doi.org/10.2174/157340609790170498
- 18. Shi, P., Huang, Z. and Chen, G. (2008) Rhein Induces Apoptosis and Cell Cycle Arrest in Human Hepatocellular Carcinoma BEL-7402 Cells. The American Journal of Chinese Medicine, 36, 805-813. https://doi.org/10.1142/S0192415X08006259
- 19. Yang, X., Sun, G., Yang, C., et al. (2011) Novel Rhein Analogues as Potential Anticancer Agents. ChemMedChem, 6, 2294-2301. https://doi.org/10.1002/cmdc.201100384
- 20. Yao, G., Ye, M., Huang, R., et al. (2014) Synthesis and Antitumor Activities of Novel Rhein α-aminophosphonates conjugates. Bioorganic & Medicinal Chemistry Letters, 24, 501-507. https://doi.org/10.1016/j.bmcl.2013.12.030
- 21. Tan, J.H., Zhang, Q.X., Huang, Z.S., et al. (2006) Synthesis, DNA Binding and Cytotoxicity of New Emodin Derivatives. European Journal of Medicinal Chemistry, 41, 1041-1047. https://doi.org/10.1016/j.ejmech.2006.04.006
- 22. 黄新炜. 大黄酸酯类衍生物的合成及体外抗肿瘤活性研究[J]. 化学工程师, 2017, 9: 18-23.
- 23. 田炜, 粟正英, 蓝富, 等. 1,8-二乙酰基大黄酸-(2-溴)-乙酯的合成及对骨肉瘤MG-63细胞的作用研究[J]. 中国药理学通报, 2018, 34(1): 55-60.
- 24. Huang, J.K., Zhang, Z., Huang, P., et al. (2016) Design, Synthesis and Biological Evaluation of Rhein Derivatives as Anticancer Agents. MedChemComm, 7, 1812-1818. https://doi.org/10.1039/C6MD00252H
NOTES
*通讯作者。