Hans Journal of Medicinal Chemistry
Vol.
08
No.
03
(
2020
), Article ID:
37127
,
5
pages
10.12677/HJMCe.2020.83009
Biological Evaluation of Benzo[c]heterocyclic Compounds against SHP2
Bo Feng, Xiaoyu Chen, Rajendran Satheeshkumar, Wenlong Wang*
School of Pharmaceutical Science, Jiangnan University, Wuxi Jiangsu

Received: Jul. 30th, 2020; accepted: Aug. 13th, 2020; published: Aug. 20th, 2020

ABSTRACT
To explore the chemical space of SHP2 inhibitors by changing Benzo[c][1,2,5]thiadiazole moiety into Benzo[c]heterocycle moiety, a series of Benzo[c]heterocyclic compounds have been designed, synthesized and evaluated their biological activities against SHP2. Among them, compound 14 displayed moderate inhibitory activity with IC50 of 26.22 μM against SHP2.
Keywords:Benzo[c]heterocyclic Compounds, SHP2, Inhibitors, Structure-Activity Relationships (SARs)

苯并五元杂环化合物抑制SHP2生物活性研究
冯勃,陈晓禹,Rajendran Satheeshkumar,王文龙*
江南大学药学院,江苏 无锡

收稿日期:2020年7月30日;录用日期:2020年8月13日;发布日期:2020年8月20日

摘 要
为拓展含苯并噻二唑结构单元的SHP抑制剂的化学空间,我们将苯并噻二唑结构单元转化为苯并噻唑、苯并咪唑、吲哚等结构单元,设计并合成了8个苯并五元杂环化合物。活性测试结果表明,部分化合物对SHP2显示了一定强度的抑制活性。其中化合物14 (IC50 = 26.22 μM)对SHP2显示了中等强度的抑制活性。
关键词 :苯并五元杂环化合物,SHP2PTP,抑制剂,构效关系

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
SHP2是由PTPN11编码的一种在体内广泛表达的蛋白酪氨酸磷酸酶,调节细胞内的蛋白磷酸化水平,参与多种细胞生命活动 [1]。SHP2的异常活化和突变被认为与多种恶性肿瘤的发生发展有着密切的联系 [2],是潜在的抗肿瘤靶点 [3]。虽然SHP2抑制剂取得了重要的进展 [4],但是,无论在数量上还是在结构多样性上,SHP2抑制剂仍然无法满足生物学研究和新药开发的需要 [5] [6] [7] [8] [9]。在前期的工作中,我们发现了含苯并噻二唑结构单元的SHP2抑制剂 [10]。如图1所示,为拓展SHP2抑制剂的化学空间,我们将苯并噻二唑结构单元转化为苯并噻唑、苯并咪唑、吲哚等结构单元,设计并合成了8个苯并五元杂环化合物,其结构经1HNMR和13CNMR分析测试确认,合成路线如图2和图3所示。活性测试结果表明,部分化合物对SHP2显示了一定强度的抑制活性。其中化合物14 (IC50 = 26.22 μM)对SHP2显示了中等强度的抑制活性,为后续的SHP2抑制剂研究工作奠定了一定的基础。
2. 材料与方法
2.1. 材料
1H-NMR和13C-NMR谱采用Bruker AVⅢ-400 MHz型核磁共振仪测定;所用化学试剂除特殊说明外,均为市售分析纯或化学纯,未经特殊处理直接使用,部分有机试剂使用前经常规处理。SHP2催化域蛋白(SHP2PTP:246-523AA)国家新药筛选中心实验室纯化,6,8-二氟-4-甲基-7-羟基香豆素磷酸酯(DiFMUP),购自英潍捷基公司。
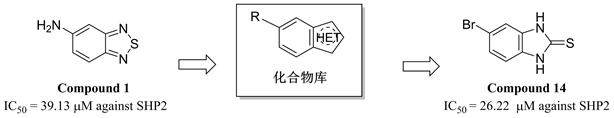
Figure 1. The design of target compounds
图1. 目标化合物的设计
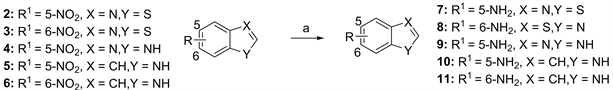 试剂和条件:a) Fe/NH4Cl, EtOH/H2O, 90℃。
试剂和条件:a) Fe/NH4Cl, EtOH/H2O, 90℃。
Figure 2. Synthetic route for compounds 7 - 11
图2. 化合物7~11的合成路线
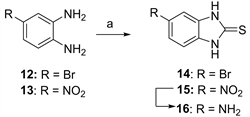 试剂和条件:a) CS2, NaOH, EtOH/H2O, 100℃; b) Fe/NH4Cl, EtOH/H2O, 90℃。
试剂和条件:a) CS2, NaOH, EtOH/H2O, 100℃; b) Fe/NH4Cl, EtOH/H2O, 90℃。
Figure 3. Synthetic route for compound 14 - 16
图3. 化合物14~16的合成路线
2.2. 化合物7~11以及14~16的合成
5-硝基苯并噻唑(1 g, 5.56 mmol)和NH4Cl (1.19 g, 22.22 mmol)的乙醇和水(2:1, 15 mL)溶液,置于90℃油浴锅中回流反应30 min后加入铁粉(1.24 g, 22.22 mmol),继续回流搅拌反应3 h,监测反应完全后,热抽滤,滤渣用热乙醇洗涤2次,滤液冷却后,饱和NaHCO3水溶液调碱,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析分离(5:1石油醚/乙酸乙酯)得淡黄色固体化合物7 (707 mg,收率84.9%)。1H NMR (400 MHz, DMSO-d6) δ:8.89 (s, 1H),7.73 (d, J = 8.8 Hz, 1H),7.14 (d, J = 2.4 Hz, 1H),6.83 (dd, J = 8.8 Hz, J = 2.4 Hz, 1H),5.41 (s, 2H);13C NMR (100 MHz, DMSO-d6) δ:149.64,147.77,145.28,135.69,123.57,115.42,104.32。用类似方法合成化合物8~11。
6-氨基-1,3-苯并噻唑(8),白色固体,收率94.2%;1H NMR (400 MHz, CDCl3) δ:8.91 (s, 1H),7.69 (d, J = 8.8 Hz, 1H),7.41 (d, J = 2.4 Hz, 1H),6.86 (dd, J = 8.4 Hz, J = 2.0 Hz, 1H),3.85 (s, 1H);13C NMR (100 MHz, CDCl3) δ:155.79,155.26,148.34,122.46,120.88,115.61,106.39。
5-氨基苯并咪唑(9),棕色固体性状,收率77.9%;1HNMR (400 MHz, DMSO-d6) δ:7.87 (s, 1H),7.26 (d, J = 8.8 Hz, 1H),7.68 (d, J = 2.0 Hz, 1H),6.52 (dd, J = 8.4 Hz, J = 2.0 Hz, 1H);13C NMR (100 MHz, DMSO-d6) δ:144.92,139.91,137.39,133.21,117.42,111.95,97.18。
5-氨基吲哚(10),棕色固体,收率78.3%;1H NMR (400 MHz, DMSO-d6) δ:10.57 (s, 1H),7.13 (t, J = 2.8 Hz, 1H),7.09 (d, J = 8.4 Hz, 1H),6.70 (d, J = 2.0 Hz, 1H),6.51 (dd, J = 8.4 Hz, J = 2.0 Hz, 1H),6.14 (s, 1H),4.42 (s, 2H);13C NMR (100 MHz, DMSO-d6) δ:141.44,130.25,129.02,125.19,112.31,111.84,103.73,100.11。
6-氨基吲哚(11),淡黄色固体,收率90.1%;1H NMR (400 MHz, DMSO-d6) δ:10.45 (s, 1H), 7.18 (d, J = 8.4 Hz, 1H),6.97 (t, J = 2.4 Hz, 1H),6.57 (s, 1H),6.39 (dd, J = 8.4 Hz, J = 1.6 Hz, 1H),6.19 (t, J = 2.0 Hz, 1H),4.68 (s, 2H);13C NMR (100 MHz, DMSO-d6) δ:144.10,137.98,122.18,120.49,120.02,110.25,101.28,95.68。
将4-溴邻苯二胺(100 mg, 0.538 mmol)、CS2 (408 mg, 5.38 mmol)、NaOH (107.5 mg, 2.69 mmol)以及乙醇和水(2:1, 1 mL)做溶剂,反应液置于100℃油浴中反应3 h,薄层层析色谱监测反应完全后,取出冷却,加HCl (1N)调成中性,有固体析出,抽滤,固体水洗,干燥,得淡黄色固体化合物14 (68 mg, 55.5%)。1H NMR (400 MHz, DMSO-d6) δ:12.70 (d, J = 14.4 Hz, 2H),7.30~7.27 (m, 2H),7.09 (d, J = 9.2 Hz, 1H);13C NMR (100 MHz, DMSO-d6) δ:169.64,134.13,132.09,125.42,114.78,112.40,111.49。用类似方法合成化合物15。
5-硝基-2-巯基苯并咪唑(15),棕色固体,收率49.2%;1H NMR (400 MHz, DMSO-d6) δ:13.14 (s, 2H),8.08 (dd, J = 8.8 Hz, J = 2.0 Hz, 1H),7.89 (d, J = 2.0 Hz, 1H),7.31 (d, J = 8.8 Hz, 1H);13C NMR (100 MHz, DMSO-d6) δ:172.28,143.09,137.86,132.73,119.44,109.74,105.13。
将含有化合物15 (200 mg, 1.03 mmol)和NH4Cl (219 mg, 4.10 mmol)的乙醇和水(2:1, 3 mL)溶液置于90℃油浴锅中回流反应30 min后加入铁粉(229.6 mg, 4.10 mmol),继续回流搅拌反应1 h,监测反应完全后,热抽滤,滤渣用热乙醇洗涤2次,滤液冷却后,饱和NaHCO3水溶液调碱,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析分离(2:1石油醚/乙酸乙酯)得淡黄色固体化合物16 (86 mg,收率50.9%)。1H NMR (400 MHz, DMSO-d6) δ:11.91 (s, 2H),8.05 (d, J = 9.6 Hz, 1H),6.40~6.37 (m, 2H),4.97 (s, 2H);13C NMR (100 MHz, DMSO-d6) δ:166.36,145.42,133.84,124.09,110.27,110.24,94.86。
3. 结果与讨论
本研究以Na3VO3作为阳性对照,表1中汇总了评价苯并五元杂环化合物(7~11, 14~16)对SHP2PTP的抑制活性 [10]。实验结果表明,当苯并杂环为苯并噻唑、苯并咪唑、吲哚时,氨基在6位的化合物(8和11),对于酶的抑制活性明显优于氨基在5位的化合物(7和10),含有苯并噻唑环的化合物(7和8)的抑制活性优于苯并咪唑和吲哚的化合物,这些结果显示,氨基的位置以及杂环的结构对化合物的抑制活性有一定的影响。5位氨基取代的1,3-二氢-2H-苯并[d]咪唑-2-硫酮16的抑制活性优于对应的苯并噻唑化合物7、苯并咪唑化合物9和吲哚化合物10,这一结果进一步说明杂环类型对化合物的抑制活性会产生一定的影响。在1,3-二氢-2H-苯并[d]咪唑-2-硫酮化合物14~16中,溴代化合物14的活性优于化合物1,IC50达到了26.22 μM。遗憾的是,该化合物对SHP2PTP的抑制活性明显低于阳性对照Na3VO3。
Table 1. Inhibitory ratio of Benzo[c]heterocyclic compounds 7 - 11, 14 - 16 against SHP2 PTP
表1. 苯并五元杂环化合物(7~11, 14~16)对SHP2PTP的抑制活性
aValues tested at 20 μg∙mL−1 concentration; bThe pNPP assay. IC50 values were determined by regression analyses and expressed as means ± SD of three replications; cNot tested; d Positive control.
4. 结论
本文为拓展SHP2抑制剂的化学空间,设计并合成了8个含苯并噻唑、苯并咪唑、吲哚以及1,3-二氢-2H-苯并[d]咪唑-2-硫酮等结构单元的化合物,其中5-溴-1,3-二氢-2H-苯并[d]咪唑-2-硫酮(化合物14)表现了一定的抑制活性,构效关系分析结果表明,杂环的类型以及苯环上取代基的类型,对化合物的活性产生一定的影响。
基金项目
江苏省自然科学基金(BK20190608)和江苏省博士后科研资助计划(2019K220)。
文章引用
冯勃,陈晓禹,RajendranSatheeshkumar,王文龙. 苯并五元杂环化合物抑制SHP2生物活性研究
Biological Evaluation of Benzo[c]heterocyclic Compounds against SHP2[J]. 药物化学, 2020, 08(03): 79-83. https://doi.org/10.12677/HJMCe.2020.83009
参考文献
- 1. Zhang, J., Zhang, F. and Niu, R. (2015) Functions of Shp2 in Cancer. Journal of Cellular and Molecular Medicine, 78, 2075-2083. https://doi.org/10.1111/jcmm.12618
- 2. Frankson, R., Yu, Z.H., Bai, Y., Li, Q., Zhang, R.Y., et al. (2017) Therapeutic Targeting of Oncogenic Tyrosine Phosphatases. Cancer Research, 7, 5701-5705. https://doi.org/10.1158/0008-5472.CAN-17-1510
- 3. Chen, Y.N., LaMarche, M.J., Chan, H.M., Fekkes, P., Carcia-Fortanet, J., et al. (2016) Allosteric Inhibition of SHP2 Phosphatase Inhibits Cancers Driven by Receptor Tyro-sine Kinases. Nature, 535, 148-152. https://doi.org/10.1038/nature18621
- 4. Butterworth, S., Overduin, M. and Barr, A.J. (2014) Targeting Protein Tyrosine Phosphatase SHP2 for Therapeutic Intervention. Future Medicinal Chemistry, 6, 1423-1437. https://doi.org/10.4155/fmc.14.88
- 5. Sarver, P., Acker, M., Bagdanoff, J.T., Chen, Z., et al. (2019) 6-Amino-3-Methylpyrimidinones as Potent, Selective, and Orally Efficacious SHP2 Inhibitors. Journal of Medicinal Chemistry, 62, 1793-1802. https://doi.org/10.1021/acs.jmedchem.8b01726
- 6. Wu, X., Xu, G., Li, X., Xu, W., et al. (2019) Small Molecule Inhibitor That Stabilizes the Autoinhibited Conformation of the Oncogenic Tyrosine Phosphatase SHP2. Journal of Me-dicinal Chemistry, 62, 1125-1137. https://doi.org/10.1021/acs.jmedchem.8b00513
- 7. Pádua, R.A.P., Sun, Y., Marko, I., Pitsawong, W., et al. (2018) Mechanism of Activating Mutations and Allosteric Drug Inhibition of the Phosphatase SHP2. Nature Communi-cation, 9, 4507. https://doi.org/10.1038/s41467-018-06814-w
- 8. Xie, J., Si, X., Gu, S., Wang, M., et al. (2017) Allosteric Inhib-itors of SHP2 with Therapeutic Potential for Cancer Treatment. Journal of Medicinal Chemistry, 60, 10205-10219. https://doi.org/10.1021/acs.jmedchem.7b01520
- 9. Wang, R.R., Liu, W.S., Zhou, L., Ma, Y. and Wang, R.L. (2019) Probing the Acting Mode and Advantages of RMC-4550 as an Src-Homology 2 Domain-Containing Protein Ty-rosine Phosphatase (SHP2) Inhibitor at Molecular Level through Molecular Docking and Molecular Dynamics. Journal of Biomolecular Structure and Dynamics, 38, 1-14. https://doi.org/10.1080/07391102.2019.1613266
- 10. Wang, W.-L., Chen, X.-Y., Gao, Y., Gao, L.-X., et al. (2017) Benzo[c][1,2,5]thiadiazole Derivatives: A New Class of Potent Src Homology-2 Domain Containing Protein Tyrosine Phosphatase-2 (SHP2) Inhibitors. Bioorganic & Medicinal Chemistry Letters, 27, 5154-5157. https://doi.org/10.1016/j.bmcl.2017.10.059
NOTES
*通讯作者。
