Advances in Clinical Medicine
Vol.
13
No.
01
(
2023
), Article ID:
60121
,
10
pages
10.12677/ACM.2023.131030
携带人MST4或人dnMST4转基因的 肺癌细胞株构建
韩留鑫1*,夏加伟1*,李云珍1,朱江春1,沈含章1,周玮莎1,赵文淘2#,李静3,肖东3
1昆明市第三人民医院(云南省传染性疾病临床医学中心,大理大学第六附属医院),重症医学科,血液净化中心,云南 昆明
2昆明医科大学第三附属医院(云南省肿瘤医院,云南省癌症中心),消化肿瘤内科,云南 昆明
3南方医科大学肿瘤研究所,广东 广州
收稿日期:2022年12月7日;录用日期:2023年1月2日;发布日期:2023年1月10日

摘要
目的:利用慢病毒感染分别建立稳定过表达MST4和dnMST4的人肺癌细胞株。方法:分别以pcDNA3.1-MST4、pcDNA3.1-MST4 T178A质粒为模板,PCR分别扩增MST4、MST4 T178A序列(均为1.251 kb),片段两侧分别添加EcoR I/BamH I和Xba I/BamH I酶切位点,分别In-Fusion克隆至pCDH-RFP和pHEZG中,次日挑选单克隆菌落,提取质粒并进行测序和酶切鉴定;所构建的载体分别命名为pCDH-MST4-RFP和pHEZG-dnMST4。按标准程序进行慢病毒包装,并确认是否成功生产慢病毒;用携带MST4和RFP基因的慢病毒分别感染人肺癌细胞A549和HCC827,用携带dnMST4和GFP基因的慢病毒分别感染人肺癌细胞A549和HCC827,以建立稳定过表达MST4和dnMST4的人肺癌细胞系。应用qRT-PCR和Westernblot检测所建立肺癌细胞系中MST4和dnMST4在RNA层面和蛋白层面的表达水平。结果:测序和酶切鉴定的结果均证实成功构建了pCDH-MST4-RFP和pHEZG-dnMST4,按标准程序生产的携带MST4和RFP基因以及携带dnMST4和GFP基因的慢病毒均能成功感染人肺癌细胞。结论:成功构建稳定过表达MST4或dnMST4的人肺癌细胞株,为进一步研究MST4在肺癌恶性进程中的生物学功能及机制打下了良好基础。
关键词
MST4,dnMST4,慢病毒载体,肺癌

Construction of Non-Small Cell Lung Cancer (NSCLC) Cell Lines Stably Overexpressing MST4 or dnMST4 Transgenes
Liuxin Han1*, Jiawei Xia1*, Yunzhen Li1, Jiangchun Zhu1, Hanzhang Shen1, Weisha Zhou1, Wentao Zhao2#, Jing Li3, Dong Xiao3
1Department of Critical Care Medicine, Blood Purification Centre, The Third People’s Hospital of Kunming (Yunnan Infectious Diseases Clinical Medical Center, The Sixth Affiliated Hospital of Dali University), Kunming Yunnan
2Department of Gastrointestinal Oncology, The Third Affiliated Hospital of Kunming Medical University (Yunnan Cancer Hospital, Yunnan Cancer Center), Kunming Yunnan
3Cancer Research Institute, Southern Medical University, Guangzhou Guangdong
Received: Dec. 7th, 2022; accepted: Jan. 2nd, 2023; published: Jan. 10th, 2023

ABSTRACT
Objective: To establish non-small cell lung cancer (NSCLC) cell lines stably overexpressing MST4 and dnMST4 Transgenes by lentivirus infection, respectively. Methods: The fragment of human MST4 gene was amplified by PCR from the template of pcDNA3.1-MST4, and subsequently cloned into the plasmid of pCDH-RFP to obtain the final vector of pCDH-MST4-RFP, which was used to produce lentiviruses carrying MST4 and RFP genes. The fragment of human dnMST4 gene was also amplified by PCR from the template of pcDNA3.1-MST4 T178A, and subsequently cloned into the plasmid of pHEZG to obtain the final vector of pHEZG-dnMST4, which was used to produce lentiviruses carrying dnMST4 and GFP genes. To establish human NSCLC cell lines stably overexpressing MST4 or dnMST4, lentiviruses harboring MST4 and RFP genes were employed to infect A549 and HCC827 cells, and lentiviruses harboring dnMST4 and GFP genes were also employed to infect A549 and HCC827 cells. The expression levels of MST4 and dnMST4 in the infected lung cancer cell lines at RNA and protein levels were detected by Western blot and qRT-PCR. Results: The lentivirus vector of pCDH-MST4-RFP and pHEZG-dnMST4 were successfully constructed. NSCLC cell lines A549 and HCC827 harboring MST4 and RFP transgenes were generated showing the expression of both MST4 and RFP transgenes. And the cell lines harboring dnMST4 and GFP transgenes were also generated showing the expression of both dnMST4 and GFP transgenes. Conclusion: NSCLC cell lines A549 and HCC827 stably expressing MST4 and dnMST4 transgenes were generated, which had laid a great foundation for further research on the biological function and mechanism of MST4 in the malignant process of lung cancer.
Keywords:MST4, dnMST4, Lentivirus Vector, Lung Cancer

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
肺癌是目前发病率和死亡率最高、对人类生命健康威胁最大的肿瘤,国家癌症中心在2022年3月最新发布的中国肿瘤现状和趋势报道中显示,肺癌的发病率在男性居首位,在女性居第二位,而肺癌的死亡率在男性和女性均居首位,在城市和农村肺癌的死亡率均居首位 [1]。可见,肺癌是严重威胁我国人民生命健康的首位疾病。虽然靶向治疗、免疫治疗新药在肺癌治疗中取得了一些临床进展,但是目前报道的肺癌五年生存率仍低于15% [2]。肺癌容易发生侵袭转移是造成患者死亡率高、预后差的主要原因 [3],我们前期的预实验结果提示MST4可能在抑制肺癌细胞上皮–间充质转化(Epithelial-mesenchymal transition, EMT)和侵袭转移进程中发挥重要作用。因此,我们拟分别建立稳定过表达人MST4和人MST4基因的显性负性突变体(Dominant negative mutant MST4, dnMST4)的肺癌细胞株,为下一步研究MST4在肺癌恶性进程中的生物学作用及机制打下良好基础。
2. 材料与方法
2.1. 材料与试剂
2.1.1. 载体
空载过表达质粒pCDH-CMV-MCS-EF1-RFP (简写为pCDH-RFP或pLV-con1)购自System Biosciences (SBI)公司;空载过表达质粒pHAGE-fullEF1a-MCS-IzsGreen (简写为pHEZG或pLV-con2)由Jeng-Shin Lee教授惠赠;模板质粒pCDNA3.1-MST4和pCDNA3.1-MST4 T178A由Hans Clevers教授赠予;psPAX2和pMD2.G慢病毒包装质粒由日内瓦大学Didier Trono博士赠予。
2.1.2. 主要试剂
高保真TaqDNA聚合酶、限制性内切酶Xba I、EcoR I和BamH I、dNTP、平末端磷酸化连接(BKL)试剂盒、DNA连接试剂盒和胶回收试剂盒、去磷酸化(BAP)试剂盒、裂解液Trizol和荧光定量PCR试剂盒均购自TaKaRa公司。质粒提取试剂盒购自德国QIAGEN公司,脂质体转染剂Lipofectamine2000、细胞培养用RPMI 1640培养基、细胞培养用胰蛋白酶、OptiMEM®I Medium和DMSO均购自美国Invitrogen 公司,细胞培养瓶和培养板购自美国Corning公司,细胞培养用胎牛血清购自德国PAA公司,逆转录试剂盒购自Bio-Rad公司,八连管购自AXYGEN公司,0.45um PVDF膜购自Millipore公司,SDS蛋白上样缓冲液购自杭州弗德生物,RIPA 蛋白裂解液购自美国Thermo Fisher公司,蛋白提取试剂盒、ECL化学发光试剂购自凯基生物公司,BCA蛋白浓度检测试剂盒购自上海碧云天公司,蛋白分子Marker购自Fermentas公司,MST4一抗(ab52491)和兔二抗(ab7090)均购自英国Abcam公司,其他科研试剂为国产或进口化学纯或分析纯。
2.1.3. 细胞
293FT细胞培养方法参见文献 [4],人肺癌细胞A549和HCC827细胞培养基为含有10%胎牛血清的1640培养基。
2.2. 方法
2.2.1. 携带人MST4和RFP基因的慢病毒表达载体pCDH-MST4-RFP的构建
以pcDNA3.1-MST4质粒为模板,设计引物,PCR扩增MST4片段(1.251kb) (5’→3’),In-Fusion克隆至利用EcoR I/BamH I双酶切的pCDH-RFP中(保留EcoR I和BamH I的酶切位点),MST4正向插入方向:插入片段的起始密码靠近EcoR I位点,终止密码靠近BamH I位点。次日挑选单克隆菌落,质粒提取并进一步行测序和酶切鉴定,鉴定正确的载体命名为pCDH-MST4-RFP。
2.2.2. 携带人MST4基因的显性负性突变体dnMST4 (Dominant Negative MST4)和GFP基因的慢病毒表达载体pHEZG-dnMST4的构建
以pcDNA3.1-MST4 T178A质粒为模板,设计引物,PCR扩增MST4 T178A片段(1251bp) (5’→3’),In-Fusion克隆至利用Xba I/BamH I双酶切的pHEZG中(保留Xba I和BamH I的酶切位点),MST4 T178A正向插入方向:插入片段的起始密码靠近Xba I位点,终止密码靠近BamH I位点。次日挑选单克隆菌落,质粒提取并进一步行测序和酶切鉴定,鉴定正确的载体命名为pHEZG-dnMST4。
2.2.3. 制备携带MST4和RFP基因的慢病毒
慢病毒的具体包装步骤参见文献 [3]。借助LipofectamineTM2000将病毒包装质粒pMD2.G、psPAX2和慢病毒载体pCDH-MST4-RFP共转染入293FT细胞,转染后48~72 h,借助倒置荧光显微镜观察到细胞发出红色荧光,说明细胞已成功表达RFP蛋白,确认转染成功后,3000~4000 r/min离心15 min以丢弃细胞碎片,将病毒上清收集于EP管中备用。
2.2.4. 制备携带dnMST4和GFP基因的慢病毒
操作方法如前述,借助LipofectamineTM2000将病毒包装质粒pMD2.G、psPAX2和慢病毒载体pHEZG-dnMST4共转染入293FT细胞,转染后48~72 h,借助倒置荧光显微镜观察到细胞发出绿色荧光,说明细胞已成功表达GFP蛋白,确认转染成功后,3000~4000 r/min离心15 min以丢弃细胞碎片,将病毒上清收集于EP管中备用。
2.2.5. 确认病毒成功包装并用慢病毒感染肿瘤细胞以建立稳定过表达MST4或dnMST4的肺癌细胞株
将携带RFP或MST4-RFP的病毒上清分别加入内含A549或HCC827细胞的细胞培养皿内,感染6~12 h后,用含有10%胎牛血清的1640培养基替换感染液,慢病毒感染细胞后24~48 h,在倒置荧光显微镜下观察红色荧光情况。同时将携带HEZG或HEZG-dnMST4的病毒上清分别加入内含A549或HCC827细胞的细胞培养皿内,感染6~12 h后,用含有10%胎牛血清的1640培养基替换感染液,慢病毒感染细胞后24~48 h,在倒置荧光显微镜下观察绿色荧光情况。
2.2.6. 荧光定量PCR (qRT-PCR)检测所建立的肺癌细胞株中MST4或dnMST4转基因的表达
dnMST4转基因是MST4基因的显性负性突变体(突变型蛋白和相关蛋白形成无功能二聚体),它可以抑制野生型MST4蛋白的功能;即dnMST4的作用仅在于使MST4的编码蛋白在有机体内丧失功能,产生无功能蛋白的蓄积,而不能使MST4在有机体内被敲除。qRT-PCR检测转基因dnMST4和MST4表达所用引物是相同的,引物序列如表1所示,GAPDH为内参,引物序列如表1所示;提取所建立的稳定细胞株总RNA,逆转录为cDNA,采用SYBR方法检测肺癌细胞株中dnMST4和MST4的表达水平。
Table 1. Primers for qRT-PCR analysis of human MST4 and GAPDH expression
表1. qRT-PCR检测肺癌细胞株中MST4和GAPDH表达水平所用引物
2.2.7. Western Blot检测所建立的肺癌细胞株中dnMST4或MST4转基因表达
取对数生长期的细胞,PBS洗2次以充分去除细胞培养基,加入适量RIPA裂解液并分别收集于EP管中,冰上震荡裂解30 min,4℃条件下14,000 rpm离心20分钟,收集上清,用蛋白浓度检测试剂盒测定蛋白浓度。将检测浓度后的蛋白样品调整为同样浓度后95℃煮5 min变性。对于每个蛋白样品,每孔分别上样50 μg后在10% SDS-聚丙烯酰胺凝胶上进行电泳分离蛋白,然后通过湿转法将目的蛋白转到活化后的PVDF膜上。将膜用1 × TBST配制的5% BSA室温封闭2 h,通过marker标尺条带,截取适合目的蛋白分子量的膜并做好相应标记,在4℃环境下孵育一抗(>15 h),目的蛋白MST4的一抗孵育浓度为1:2000。兔二抗(1:10,000浓度)在室温孵育1 h。将孵育二抗后的PVDF膜用1 × TBST洗涤3次。最后,通过增强型化学发光液ECL曝光检测到目的蛋白的印迹。
2.3. 统计学方法
统计分析均采用SPSS 22.0软件进行,两独立样本间的比较采用两独立样本t检验。两独立样本t检验的假设H0为两样本的总体均值相等,H1为两样本的总体均值不等,若P < 0.05,则拒绝假设H0,接受H1,认为两独立样本总体均值的95%可信区间不相等,两样本之间的差异具有统计学意义。
3. 结果
3.1. 慢病毒载体pCDH-MST4-RFP和pHEZG-dnMST4的构建及鉴定
3.1.1. pCDH-MST4-RFP和pHEZG-dnMST4的构建
按照“方法”中所提及的具体步骤成功构建了携带MST4或dnMST4的慢病毒载体,并将载体分别命名为pCDH-MST4-RFP和pHEZG-dnMST4。
3.1.2. pCDH-MST4-RFP测序和酶切鉴定
取1 μl前述连接用空载表达质粒pCDH-RFP产物进行电泳,可见一条带大小与理论预测值7.484 kb相符(图1,Lane 1)。取5 μl前述PCR扩增制备的MST4的PCR产物进行电泳,可见一条带大小与理论预测值1.251 kb相符(图1,Lane 2)。获得连接用Vector DNA和Insert DNA后,将二者进行连接反应,然后取上述产物进行质粒转化,次日随机挑选单克隆菌落摇菌,提取质粒DNA进一步行测序和酶切鉴定。经测序结果确认基因片段长度为1.251 kb的MST4的插入片段序列与原始序列一致(结果未提供)。应用BamH I将pCDH-MST4-RFP单酶切后电泳,可以见到一个条带,长度与理论预测值8.725 kb相符(图1,Lane 3),应用BamH I和EcoR I将pCDH-MST4-RFP双酶切后电泳,可以见到两个条带,其长度与理论预测值7.474 kb和1.251 kb相符(图1,Lane 4)。以上实验结果表明pCDH-MST4-RFP构建成功。
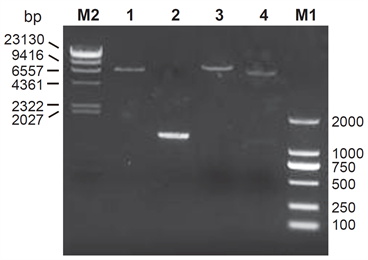 M1: DL 2000 (TaKaRa); M2: λ-Hind III digest (TaKaRa); Lane 1: pCDH-RFP Vector DNA; Lane 2: MST4 Insert DNA; Lane 3: pCDH-MST4-RFP digested by BamH I; Lane 4: pCDH-MST4-RFP digested by BamH I and EcoR I.
M1: DL 2000 (TaKaRa); M2: λ-Hind III digest (TaKaRa); Lane 1: pCDH-RFP Vector DNA; Lane 2: MST4 Insert DNA; Lane 3: pCDH-MST4-RFP digested by BamH I; Lane 4: pCDH-MST4-RFP digested by BamH I and EcoR I.
Figure 1. Enzyme digestion identification of pCDH-MST4-RFP
图1. pCDH-MST4-RFP载体酶切鉴定
3.1.3. pHEZG-dnMST4测序和酶切鉴定
取1 μl前述连接用空载表达质粒pHEZG产物进行电泳,可见一条带大小与理论预测值8.346 kb相符(图2,Lane 1)。取5 μl前述PCR扩增制备的MST4 T178A的PCR产物进行电泳,可见一条带大小与理论预测值1.251 kb相符(图2,Lane 2)。获得连接用Vector DNA和Insert DNA后,将二者进行连接反应,然后取上述产物进行质粒转化,次日随机挑选单克隆菌落摇菌,提取质粒DNA进一步行测序和酶切鉴定。经测序结果确认基因片段长度为1.251 kb的MST4 T178A的插入片段序列与原始序列一致(结果未提供)。应用BamH I将pHEZG-dnMST4单酶切后电泳,可以见到一个条带,长度与理论预测值9.597 kb相符(图2,Lane 3),应用BamH I和Xba I将pHEZG-dnMST4双酶切后电泳,可以见到两个条带,其长度与理论预测值8.346 kb和1.251 kb相符(图2,Lane 4)。以上实验结果表明pHEZG-dnMST4构建成功。
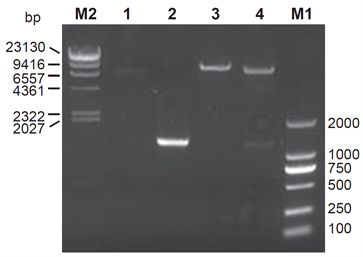 M1: DL 2000 (TaKaRa); M2: λ-Hind III digest (TaKaRa); Lane 1: pHEZG Vector DNA; Lane 2: dnMST4 Insert DNA; Lane 3: pHEZG-dnMST4 digested by BamH I; Lane 4: pHEZG-dnMST4 digested by Xba I and BamH I.
M1: DL 2000 (TaKaRa); M2: λ-Hind III digest (TaKaRa); Lane 1: pHEZG Vector DNA; Lane 2: dnMST4 Insert DNA; Lane 3: pHEZG-dnMST4 digested by BamH I; Lane 4: pHEZG-dnMST4 digested by Xba I and BamH I.
Figure 2. Enzyme digestion identification of pHEZG-dnMST4
图2. pHEZG-dnMST4载体酶切鉴定
3.2. 携带MST4和RFP基因的慢病毒包装以及携带dnMST4和GFP基因的慢病毒包装
将病毒包装质粒pMD2.G、psPAX2与pCDH-MST4-RFP质粒共转染293FT细胞,转染48 h后在倒置荧光显微镜下可以观察到红色荧光,证明转染成功(图3)。将病毒包装质粒pMD2.G、psPAX2与pHEZG-dnMST4质粒共转染293FT细胞,转染48 h后在倒置荧光显微镜下可以观察到绿色荧光,证明转染成功(图3)。
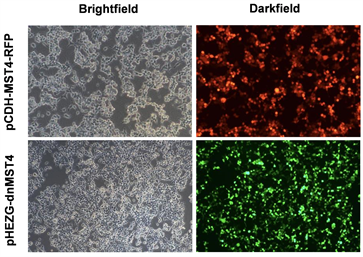
Figure 3. 293FT cells were transiently transfected with pCDH-MST4-RFP and pHEZG-dnMST4, respectively (virus package) (×100)
图3. pCDH-MST4-RFP和pHEZG-dnMST4分别瞬时转染293FT细胞(病毒包装) (×100)
3.3. 应用慢病毒感染人肺癌细胞
按“材料与方法”部分的具体实验步骤,用携带MST4和RFP基因的慢病毒分别感染人肺癌细胞A549和HCC827,感染后48 h可在倒置荧光显微镜下观察到细胞内的红色荧光,目的细胞被慢病毒成功感染,同时也说明经慢病毒感染的肺癌细胞已成功表达RFP蛋白(图4)。用携带dnMST4和GFP基因的慢病毒分别感染人肺癌细胞A549和HCC827,感染后48 h可在倒置荧光显微镜下观察到细胞内的绿色荧光,目的细胞被慢病毒成功感染,同时也说明经慢病毒感染的肺癌细胞已成功表达GFP蛋白(图5)。
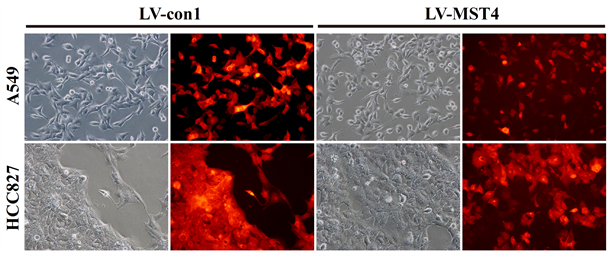
Figure 4. A549 and HCC827 cells were successfully infected by lentivirus carrying MST4 and RFP genes (×200)
图4. 携带MST4和RFP的慢病毒感染肺腺癌细胞株(×200)

Figure 5. A549 and HCC827 cells were successfully infected by lentivirus carrying dnMST4 and GFP genes (×200)
图5. 携带dnMST4和GFP的慢病毒感染肺腺癌细胞株(×200)
3.4. qRT-PCR和Western Blot检测所建立的人肺癌细胞株中MST4或dnMST4在RNA层面和蛋白层面的表达水平
检测结果显示,人肺癌细胞A549和HCC827中MST4和dnMST4表达水平在RNA水平和蛋白水平均明显升高,说明成功建立了稳定过表达MST4和稳定过表达dnMST4的人肺癌细胞株(图6)。
4. 讨论
慢病毒属于逆转录病毒的一种,可以高效感染处于分裂期和非分裂期的细胞;借助慢病毒感染可将其携带的外源基因高效整合进宿主细胞基因组中,外源基因可在细胞内长期稳定表达,这些优势是其它病毒介导的外源基因传递系统无可比拟的 [5]。
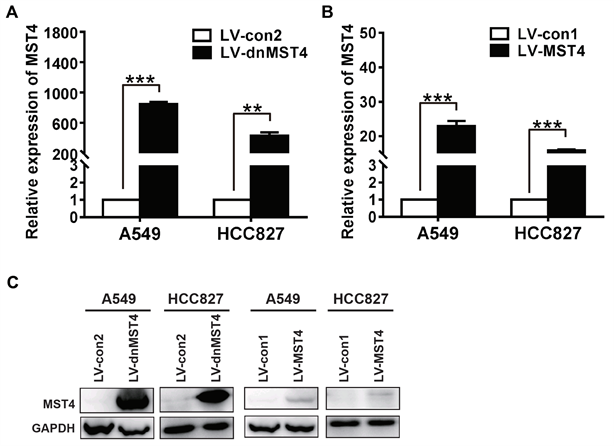 A:qRT-PCR检测稳定携带dnMST4转基因的A549和HCC827细胞株中MST4 mRNA水平;B:qRT-PCR检测稳定携带MST4转基因的A549和HCC827细胞株中MST4 mRNA水平;C:Western blot检测稳定携带MST4或dnMST4的A549和HCC827细胞株中MST4蛋白表达。***:P < 0.0001。
A:qRT-PCR检测稳定携带dnMST4转基因的A549和HCC827细胞株中MST4 mRNA水平;B:qRT-PCR检测稳定携带MST4转基因的A549和HCC827细胞株中MST4 mRNA水平;C:Western blot检测稳定携带MST4或dnMST4的A549和HCC827细胞株中MST4蛋白表达。***:P < 0.0001。
Figure 6. Detection of dnMST4 and MST4 expression in A549 and HCC827 cells after infected by lentivirus, respectively
图6. 稳定携带MST4或dnMST4的肺腺癌细胞株中MST4表达水平
在本研究中我们构建了MST4基因的显性负性突变体dnMST4,进而抑制野生型MST4蛋白的功能。显性负性突变体基因与野生型基因相比,其编码的蛋白质结构域或模体发生了变化,进而通过异常的二聚体或竞争性抑制改变野生型基因的功能。有研究表明,突变型p53蛋白能通过显性抑制效应抑制野生型p53蛋白的功能,所产生的效应即表现为显性负面效应(Dominant-negative effect),这种显性负面效应是指基因发生突变时,其会导致基因产物反向影响相同细胞中野生型的基因产物功能 [6]。有研究表明,通过基因的显性负性突变体来抑制内源性该基因的活性,是最特异的基因活性抑制方式 [7]。该研究中,我们在探究MST4基因功能时没有采用基因敲除的技术,而是采用显性失活突变技术,构建了MST4的显性负性突变体dnMST4,通过慢病毒感染的方式建立了稳定过表达MST4或dnMST4的人肺癌细胞株,意在从MST4基因功能获得和基因功能缺失两个方面来全面阐明MST4在肺癌细胞中的生物学功能。
磷酸化丝氨酸/苏氨酸蛋白激酶MST4 (Serine/threonine protein kinase MST4, mammalian Ste20-like protein kinase 4)基因定位于人类染色体Xq26,该基因编码的MST4蛋白全长416个氨基酸,包含一个N 端激酶结构域和一个C端调节结构域 [8] [9];MST4在人类组织中普遍性表达,其中在胎盘、胸腺和外周血白细胞中高表达,在脑、心、肺、肝、肌肉和肾脏中等量表达,在骨骼肌和胰腺低表达;MST4蛋白属于Ste20激酶GCKIII亚家族,其在细胞增殖 [10] [11]、细胞凋亡 [12]、天然免疫 [13]、细胞代谢 [14]、细胞生长和转化 [15]、EMT和转移 [16] 等过程中发挥重要作用。
我们课题组成员前期在肝癌上的研究显示,MST4在过表达miR-122诱导发生间充质–上皮转化(Mesenchymal-epithelial transition, MET)的肝癌细胞中表达升高,发生MET的肝癌细胞迁移能力下降 [17]。然而MST4在EMT和肺癌侵袭转移中的作用未见报道。我们前期的预实验结果提示MST4可能在肺癌EMT和侵袭转移过程中发挥抑制作用。因此,构建携带人MST4和人dnMST4转基因的肺癌细胞株就为后续从基因功能获得和缺失两个方面深入探究MST4在肺癌EMT和侵袭转移过程中的作用打下了良好的研究基础。
蛋白激酶是一种催化蛋白质磷酸化过程的酶,其通过磷酸化调节蛋白质的活性,从而参与了包括肿瘤恶性进程、炎症、自身免疫病、神经性疾病等在内的多种病理生理过程 [18]。蛋白激酶已成为21世纪最重要的药物靶点之一,全世界高达20%~33%的药物发现都和蛋白激酶超家族相关,截止2022年有68种FDA批准的治疗药物以大约24种不同的蛋白激酶为靶点,其中有58种药物用于肿瘤治疗 [19]。目前临床上很多抗肿瘤靶向药物均为蛋白激酶抑制剂,如肺癌的靶向治疗药物受体酪氨酸激酶抑制剂(吉非替尼、厄洛替尼、奥希替尼、阿法替尼、AZD9291和CO-1686),治疗慢性髓性白血病和恶性胃肠道间质瘤的酪氨酸激酶抑制剂(伊马替尼、达沙替尼)等。MST4作为一种蛋白激酶,具备作为靶向药物作用靶点的潜质。然而,MST4作为一种被新近发现的蛋白激酶,其在肺癌中的生物学功能及作用目前未见任何报道,因此构建稳定过表达人MST4和人dnMST4转基因的肺癌细胞株,对于进一步研究MST4在肺癌恶性进程中的生物学功能及机制具有重要意义。
基金项目
云南省科技厅地方高校联合专项(202001BA070001-043、202001BA070001-063);国家自然科学基金(82060425);云南省科技厅基础研究专项(202201AT070044)。
文章引用
韩留鑫,夏加伟,李云珍,朱江春,沈含章,周玮莎,赵文淘,李 静,肖 东. 携带人MST4或人dnMST4转基因的肺癌细胞株构建
Construction of Non-Small Cell Lung Cancer (NSCLC) Cell Lines Stably Overexpressing MST4 or dnMST4 Transgenes[J]. 临床医学进展, 2023, 13(01): 191-200. https://doi.org/10.12677/ACM.2023.131030
参考文献
- 1. Zheng, R.S., Zhang, S.W., Zeng, H.M., et al. (2022) Cancer Incidence and Mortality in China, 2016. Journal of the Na-tional Cancer Center, 2, 1-9. https://doi.org/10.1016/j.jncc.2022.02.002
- 2. Yang, T., Xiong, Y., Zeng, Y., et al. (2022) Current Status of Immunotherapy for Non-Small Cell Lung Cancer. Frontiers in Pharmacology, 13, Article ID: 989461. https://doi.org/10.3389/fphar.2022.989461
- 3. 张文谦, 李辉. 肺癌侵袭及转移机制的研究进展[J]. 中国临床新医学, 2022, 15(3): 198-201.
- 4. 贾俊双, 孙妍, 肖东, 等. 慢病毒介导的外源基因体外投递系统的建立[J]. 热带医学杂志, 2008, 8(10): 1028-1029.
- 5. 赵文淘, 赵尊兰, 史俊文, 等. 稳定过表达miR-26a肝癌细胞株的建立[J]. 热带医学杂志, 2013, 13(2): 140-142.
- 6. Boettcher, S., Miller, P.G., Sharma, R., et al. (2019) A Dominant-Negative Effect Drives Selection of TP53 Missense Mutations in Myeloid Malignancies. Science, 365, 599-604. https://doi.org/10.1126/science.aax3649
- 7. Yeh, P.Y., Yeh, K.H., Chuang, S.E., et al. (2004) Suppres-sion of MEK/ERK Signaling Pathway Enhances Cisplatin-Induced NF-kappaB Activation by Protein Phosphatase 4-Mediated NF-kappaB p65 Thr Dephosphorylation. Journal of Biological Chemistry, 279, 26143-26148. https://doi.org/10.1074/jbc.M402362200
- 8. Qian, Z., Lin, C., Espinosa, R., et al. (2001) Cloning and Characteri-zation of MST4, a Novel Ste20-Like Kinase. Journal of Biological Chemistry, 276, 22439-22445. https://doi.org/10.1074/jbc.M009323200
- 9. Lin, J.L., Chen, H.C., Fang, H.I., et al. (2001) MST4, a New Ste20-Related Kinase That Mediates Cell Growth and Transformation via Modulating ERK Pathway. Oncogene, 20, 6559-6569. https://doi.org/10.1038/sj.onc.1204818
- 10. Hao, W.C., Zhong, Q.L., Pang, W.Q., et al. (2020) MST4 Inhibits Human Hepatocellular Carcinoma Cell Proliferation and Induces Cell Cycle Arrest via Suppression of PI3K/AKT Pathway. Journal of Cancer, 11, 5106-5117. https://doi.org/10.7150/jca.45822
- 11. Han, X.M., Tian, P.Y., et al. (2019) MicroRNA-486-5p Inhibits Ovarian Granulosa Cell Proliferation and Participates in the Development of PCOS via Targeting MST4. European Review for Medical and Pharmacological Sciences, 23, 7217-7223.
- 12. Shi, Z., Jiao, S., Zhang, Z., et al. (2013) Structure of the MST4 in Complex with MO25 Provides Insights into Its Activation Mechanism. Structure, 21, 449-461. https://doi.org/10.1016/j.str.2013.01.007
- 13. Jiao, S., Zhang, Z., Li, C., et al. (2015) The Kinase MST4 Limits In-flammatory Responses through Direct Phosphorylation of the Adaptor TRAF6. Nature Immunology, 16, 246-257. https://doi.org/10.1038/ni.3097
- 14. Caputo, M., Cansby, E., Kumari, S., et al. (2021) STE20-Type Protein Kinase MST4 Controls NAFLD Progression by Regulating Lipid Droplet Dynamics and Metabolic Stress in Hepatocytes. Hepatology Communications, 5, 1183-1200. https://doi.org/10.1002/hep4.1702
- 15. Ma, X., Zhao, H., Shan, J., et al. (2007) PDCD10 Interacts with Ste20-Related Kinase MST4 to Promote Cell Growth and Transformation via Modulation of the ERK Pathway. Molecu-lar Biology of the Cell, 18, 1965-1978. https://doi.org/10.1091/mbc.e06-07-0608
- 16. Lin, Z.H., Wang, L., Zhang, J.B., et al. (2014) MST4 Promotes Hepatocellular Carcinoma Epithelial-Mesenchymal Transition and Metastasis via Activation of the p-ERK Pathway. In-ternational Journal of Oncology, 45, 629-640. https://doi.org/10.3892/ijo.2014.2455
- 17. Wang, S.C., Lin, X.L., Li, J., et al. (2014) MicroRNA-122 Triggers Mesenchymal-Epithelial Transition and Suppresses Hepatocellular Carcinoma Cell Motility and Invasion by Targeting RhoA. PLOS ONE, 9, e101330. https://doi.org/10.1371/journal.pone.0101330
- 18. 龙春庭, 邵敏, 陆小云. 激酶小分子抑制剂研究进展[J]. 药学学报, 2021, 56(2): 414-431.
- 19. Roskoski, R. (2022) Properties of FDA-Approved Small Molecule Protein Kinase Inhibitors: A 2022 Update. Pharmacological Research, 175, Article ID: 106037. https://doi.org/10.1016/j.phrs.2021.106037
NOTES
*第一作者:韩留鑫,夏加伟。
#通讯作者:赵文淘。
