Advances in Clinical Medicine
Vol.
11
No.
01
(
2021
), Article ID:
39907
,
9
pages
10.12677/ACM.2021.111032
Sprouty2蛋白在糖尿病性心肌病中表达的研究
白雨鑫1,潘艳明2,李欣欣1,刘勇3,周倩4,吴琦1,郭素芬1,刘贵波2,成永霞1*, 孙立新1*
1牡丹江医学院,第一临床医学院病理学教研室,黑龙江 牡丹江
2牡丹江医学院,基础医学院解剖教研室,黑龙江 牡丹江
3牡丹江医学院,医学比较中心,黑龙江 牡丹江
4牡丹江医学院,基础医学院病理学与病理生理学教研室,黑龙江 牡丹江

收稿日期:2020年12月19日;录用日期:2021年1月15日;发布日期:2021年1月22日

摘要
目的:探究Sprouty2蛋白对糖尿病心肌病纤维化程度的影响。方法:选取24只雄性SD大鼠随机分为正常组、DCM组、DCM + Sprouty2慢病毒干扰组,每组8只。DCM组、DCM + Sprouty2慢病毒干扰组高糖高脂饮食喂养4周后,腹腔注射链脲佐菌素30 mg/kg,而正常组普通饲料喂养,腹腔注射柠檬酸钠缓冲液,12周时进行慢病毒转染,16周进行超声心动图检测后处死并取材。分别进行Masson染色、天狼猩红染色、免疫组织化学和TUNEL染色。结果:与正常组相比,DCM组、DCM + Sprouty2慢病毒干扰组血糖值升高,而DCM + Sprouty2慢病毒干扰组与DCM组比较,血糖进一步升高。通过超声心动图检测发现,抑制Sprouty2蛋白表达会进一步加重心功能障碍。与正常组比较,DCM组、DCM + Sprouty2慢病毒干扰组凋亡细胞数有所增加,而DCM + Sprouty2慢病毒干扰组的凋亡细胞量明显上升。通过病理学染色观察到,敲低Sprouty2蛋白导致大量心肌纤维断裂,大量炎性细胞产生,胶原纤维表达明显升高。在免疫组化和蛋白表达上,DCM组、DCM + Sprouty2慢病毒干扰组心肌组织中α-平滑肌肌动蛋白(α-SMA)表达量升高,而DCM + Sprouty2慢病毒干扰组表达更加明显。结论:抑制Sprouty2蛋白可以促进DCM的纤维化程度,同时促进心肌细胞凋亡。因此,激活Sprouty2蛋白的表达可以逆转DCM。
关键词
糖尿病心肌病,Sprouty2蛋白,心肌纤维化

The Effect of Sprouty2 Protein on Diabetic Cardiomyopathy
Yuxin Bai1, Yanming Pan2, Xinxin Li1, Yong Liu3, Qian Zhou4, Qi Wu1, Sufen Guo1, Guibo Liu2, Yongxia Cheng1*, Lixin Sun1*
1Department of Pathology, The First Clinical Medical College, Mudanjiang Medical College, Mudanjiang Heilongjiang
2Department of Anatomy, Basic Medical College, Mudanjiang Medical College, Mudanjiang Heilongjiang
3Medical Comparison Center, Mudanjiang Medical College, Mudanjiang Heilongjiang
4Department of Pathology and Pathophysiology, Basic Medical College, Mudanjiang Medical College, Mudanjiang Heilongjiang

Received: Dec. 19th, 2020; accepted: Jan. 15th, 2021; published: Jan. 22nd, 2021

ABSTRACT
Object: To investigate the effect of Sprouty2 protein on the degree of fibrosis in diabetic cardiomyopathy. Methods: Twenty-four male SD rats were randomly divided into the normal group, the DCM group and the DCM + Sprouty2 lentiviral interference group, with 8 rats in each group. After 4 weeks of high-sugar and high-fat diet feeding in the DCM and DCM + Sprouty2 lentiviral interference groups, streptozotocin 30 mg/kg was intraperitoneally injected, while the normal group was fed with normal diet and intraperitoneally injected with sodium citrate buffer, lentiviral transfection was performed at 12 weeks, and echocardiography was performed at 16 weeks before sacrifice and sampling. Masson staining, Sirius red staining, immunohistochemistry and TUNEL staining were performed, respectively. Result: Compared with the normal group, the blood glucose values were increased in the DCM and DCM + Sprouty2 lentiviral interference groups, while the blood glucose was further increased in the DCM + Sprouty2 lentiviral interference group compared with the DCM group. Inhibition of Sprouty2 protein expression further aggravates cardiac dysfunction as detected by echocardiography. Compared with the normal group, the number of apoptotic cells increased in the DCM and DCM + Sprouty2 lentiviral interference groups, while the amount of apoptotic cells increased significantly in the DCM + Sprouty2 lentiviral interference group. As observed by pathological staining, knockdown of Sprouty2 protein resulted in fragmentation of a large number of myocardial fibers, production of a large number of inflammatory cells, and markedly elevated collagen fiber expression. In immunohistochemistry and protein expression, the expression of α-smooth muscle actin (α-SMA) and vimentin in myocardial tissue was increased in the DCM and DCM + Sprouty2 lentiviral interference groups, while the expression was more pronounced in the DCM + Sprouty2 lentiviral interference group. Conclusion: Inhibition of Sprouty2 protein can promote the degree of fibrosis and myocardial apoptosis in DCM. Thus, activating the expression of Sprouty2 protein could reverse DCM.
Keywords:Diabetic Cardiomyopathy, Sprouty2 Protein, Myocardial Fibrosis

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
目前全世界大约有4.25亿糖尿病患者,患病率为8.8%,且数据在进一步增加 [1]。有数据显示,超过半数的糖尿病患者死于相关心血管疾病并发症 [2]。糖尿病性心肌病已经成为糖尿病患者最主要的致死因素。近来的研究 [3] [4] 发现,糖尿病心肌中发生的脂质代谢紊乱、线粒体损伤、氧化应激等,最终都会引发心肌纤维化而导致心力衰竭 [5]。
研究表明,Sprouty蛋白表达的变化,可导致RTK等信号通路异常,引起组织生长发育失调、细胞异常增生及转化,从而在各种疾病的发生及疾病发展中具有重要的调控作用。
其中Sprouty2的过表达能够抑制血管内皮细胞的增殖,参与心血管系统病变。综上所述,本实验将首次研究Sprouty2在糖尿病性心肌中的表达,证实其是否参与了糖尿病性心肌病心肌纤维化的病变发展。同时,本实验采用Sprouty2干扰,进一步观察DCM的纤维化程度变化,明确Sprouty2是促进或是抑制DCM的进展,为深化糖尿病性心肌病纤维化提供理论依据。
2. 材料与方法
2.1. 实验材料
2.1.1. 实验动物
选择购自辽宁长生生物有限公司的SPF级雄性大鼠(6周龄)共24只,体重(200 ± 20) g。在牡丹江医学院动物房进行饲养,自由摄取饲料和水,湿度和温度在正常范围,12 h循环光暗交替。常规适应性喂养1周,将大鼠按每笼3只随机分配,本实验已经通过牡丹江医学院动物伦理委员会审查并获得批准。
2.1.2. 实验试剂与仪器
链脲佐菌素(STZ) (美国Sigma公司),高脂高糖饲料(成分包括胆固醇、玉米淀粉、蔗糖、纤维素、豆油等)购自小黍有泰(北京)生物科技有限公司,维持饲料由辽宁长生生物技术股份有限公司加工制备。Masson染色试剂盒和天狼猩红染色液购自北京索莱宝科技有限公司。TUNEL染色试剂盒(碧云天生物技术公司)。α-SMA单克隆抗体(碧云天生物技术公司),Sprouty2慢病毒shRNA (沈阳万类生物科技有限公司)。血糖测试仪和血糖试纸(上海罗氏公司),石蜡切片机(德国Leica公司),正置显微镜(德国Leica公司)。
2.2. 实验方法
2.2.1. 动物分组与模型制备
将24只SD大鼠随机分组,按每3只大鼠一笼进行喂养,实验分组为正常大鼠(NC组)、糖尿病心肌病大鼠(DCM组)、糖尿病心肌病大鼠 + Sprouty2慢病毒干扰组(DCM + Sprouty2慢病毒干扰组)。正常组大鼠进行普通饲料喂养,而剩余其他组别大鼠进行高脂高糖饮食,自由饮水 [6]。高脂条件下持续喂养4周后,将NC组、DCM组和DCM + Sprouty2慢病毒干扰组进行单次腹腔注射链脲佐菌素stz30 mg/kg,其余大鼠腹腔注射柠檬酸钠缓冲液。之后经尾静脉采血测量,当空腹血糖大于≥11.1 mmol/L时并且连续测量2至3天,建立2型糖尿病模型,喂养直至12周然后用Sprouty2慢病毒对模型组大鼠进行转染,1 × 108 TU慢病毒shRNA溶于50 µLPBS中制成溶液经尾静脉转染,在16周进行超声心动图测定并处死取材。
2.2.2. 空腹血糖测量
将各组大鼠夜间禁食12小时,饮水正常,经尾静脉取血测量并记录。为了比较各组大鼠转染前后血糖,每间隔7天测量一次。
2.2.3. 超声心动图
用水合氯醛腹腔注射对各组大鼠进行麻醉,之后将大鼠置于仰卧位剪去胸毛,采用Esaote超声成像系统,在转染后4周对大鼠进行心功能测量,测量指标包括左心室射血分数(ejection fraction, EF)和左心室短轴缩短(shortening fraction, FS)。
2.2.4. HE染色
将各组大鼠处死后取材,放置在4%多聚甲醛固定,脱水之后进行石蜡包埋,切片烘片:1) 二甲苯浸泡10 min;2) 逆向梯度乙醇脱水各5 min;3) 蒸馏水清洗;4) 苏木素染液10 min;5) 过水,盐酸乙酸稍浸泡;6) 过水3 min;7) 氨水处理30 s;8) 滴加伊红;9) 再次顺浓度酒精脱水;10) 二甲苯浸泡2次;11) 封固并拍照。
2.2.5. Masson染色
切片5μm,烘片3到4小时:1) 二甲苯浸泡10 min;2)逆向梯度乙醇脱水各5 min;3)蒸馏水洗5 min;4)加入Bouin液,于温室作用3 h,蒸馏水冲洗;5) 天青石蓝染色,稍水洗;6) 苏木素染液5 min,水洗数秒;7) 丽春红品红染色液滴染10 min,水洗数秒;8) 滴加磷钼酸溶液10 min;9) 滴入苯胺蓝染色染液5 min;10) 弱酸溶液处理2 min,反复两次;11) 乙醇脱水10 s;12) 二甲苯5 min;13) 中性树胶封固并拍照。
2.2.6. 天狼猩红染色
将心肌组织切片5 μm,烘片4个小时:1) 二甲苯浸泡10 min;2) 梯度酒精脱水各5 min;3) 蒸馏水洗5 min;4) 天狼星红染液浸泡1 h;5) 醋酸溶液浸泡数秒;6) 顺浓度酒精脱水;7) 中性树脂盖片;8) 显微镜下观察并拍照。
2.2.7. 免疫组织化学
将心肌组织切片5 μm,65℃烘片4个小时:1) 二甲苯Ⅰ浸泡5 min,二甲苯Ⅱ浸泡5 min;2) 逆浓度乙醇脱水各5 min;3) 蒸馏水清洗;4) 抗原修复,在3% H2O2溶液中浸泡10 min,一蒸水清洗;5) 80%乙醇溶液5 min;6) 在煮沸的柠檬酸钠溶液中保温15 min,冷却2 h;7) PBS溶液洗2~3次,每次5 min;8) 5% BSA溶液封闭1 h;9) 滴加一抗,4℃冰箱过夜;10) 再次PBS溶液清洗;11) 滴加二抗,PBS溶液清洗3次;12) 显色液显色5~10 min;13) 苏木素染色;14) 顺浓度乙醇脱水,封片并显微镜下观察。
2.2.8. TUNEL染色
1) 二甲苯脱蜡10 min;2) 更换二甲苯脱蜡10 min;3) 100%乙醇浸泡5 min;4) 90%、70%乙醇浸泡5 min;5) 水洗;6) 滴加蛋白酶K溶液,室温30 min;7) PBS溶液清洗3次;8) 滴加TUNEL检测液,室温避光60 min;9) PBS溶液清洗;10) 封片并在荧光显微镜下观察。
2.2.9. 统计学方法
实验数据采用SPSS25.0软件进行分析,多个组别间采用单因素方差分析(One Way ANOVA)。组间比较进行方差分析时,采用LSD检验。认为p < 0.05差异有统计学意义。
3. 结果
3.1. 血糖
正常组大鼠进食量和饮水量均正常,排尿排便正常,生理情况良好。与正常组比较,糖尿病心肌病大鼠后期精神状状态明显欠佳,饮血量增加,排尿量增加,且部分大鼠尿中带有强烈的酮味,生理情况较差。如表1所示,正常组大鼠空腹血糖均维持在正常值范围内(3.9~6.1),并且转染前后血糖无明显波动。与NC组相比,DCM组大鼠空腹血糖在转染前均已大于11.1 mmol/L,符合糖尿病血糖升高的表现,并且在转染后随着时间的进展空腹血糖值一直维持大于11.1 mmol/L,差异有统计学意义(p < 0.05);与DCM组大鼠比较,DCM + Sprouty2慢病毒干扰组在转染后,空腹血糖值有所升高,差异有统计学意义(p < 0.05)说明抑制Sprouty2的表达会加重糖尿病的症状(表1)。
Table 1. Changes of blood glucose in rats of each group
表1. 各组大鼠血糖变化
注:与正常组比较,*p < 0.05有统计学意义;转染前比较,#p < 0.05有统计学意义。
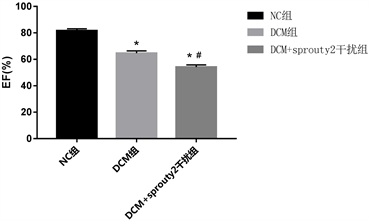
3.2. EF和FS
与正常大鼠相比较,DCM组和DCM + Sprouty2慢病毒干扰组大鼠左心室射血分数EF和左心室短轴缩短率FS有所下降;与DCM组相比,DCM + Sprouty2慢病毒干扰组大鼠心肌左心室射血分数EF和左心室短轴缩短率FS又进一步下降,差异有统计学意义(p < 0.05) (图1,表2)。
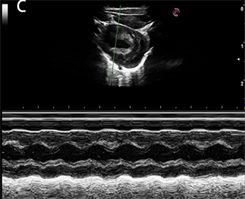



 注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
Figure 1. Echocardiographic changes in each group of rats
图1. 各组大鼠超声心动图变化
Table 2. Changes of cardiac function in each group
表2. 各组大鼠心功能变化情况
注:与正常组比较,*p < 0.05有统计学意义;与DCM组比较,#p < 0.05有统计学意义。
3.3. 心肌组织病理学染色
正常组大鼠心肌细胞胞质染色均匀,心肌纤维排列较为整齐,局部无炎性细胞聚集。而DCM组大鼠出现局部肌纤维断裂且排列紊乱,出现少量炎性细胞;与DCM组大鼠相比较,DCM + Sprouty2慢病毒干扰组会加重肌纤维的断裂,出现坏死的心肌细胞(图2)。进一步通过Masson染色可以观察到蓝色胶原纤维的表达,NC组大鼠心肌组织中几乎没有胶原纤维的表达,而DCM组大鼠局部出现蓝色胶原纤维,且分布于血管周围,DCM + Sprouty2慢病毒干扰组会出现大面积胶原纤维的产生(图3)。在天狼猩红染色上表现出,抑制Sprouty2蛋白的表达会促进胶原纤维的产生,从而加重心肌纤维化(图4)。
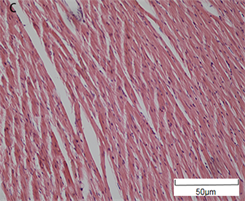
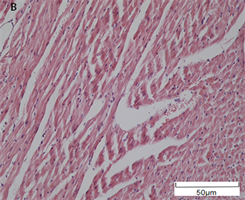
 注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
Figure 2. HE staining was used to observe the changes of myocardial structure
图2. HE染色观察各组大鼠心肌结构变化


 注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
Figure 3. Masson observation of changes in collagen fibers
图3. Masson观察胶原纤维的变化


 注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×200)
Figure 4. Picrosirius red staining was used to observe the changes of collagen fibers
图4. 天狼猩红染色观察胶原纤维的变化
3.4. TUNEL
在TUNEL染色中凋亡细胞表现为荧光绿色,在NC组心肌组织中有少量的凋亡细胞,而在DCM组中凋亡细胞数量有所上升,进一步观察,DCM + Sprouty2慢病毒干扰组中凋亡细胞数量明显增多,说明抑制Sprouty2蛋白的表达会促进心肌细胞的凋亡(图5)。


 注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组
注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组
Figure 5. Changes of TUNEL staining in rats of each group
图5. 各组大鼠TUNEL染色变化情况
3.5. Sprouty2及α-SMA
与正常的心肌组织相比,DCM组和DCM + Sprouty2慢病毒干扰组大鼠心肌组织中α-SMA表达明显增加,Sprouty2蛋白表达量下降,而与DCM组相比较,α-SMA表达有所上调,Sprouty2蛋白进一步下降。以上结果说明DCM + Sprouty2慢病毒干扰组转染成功,并且下调Sprouty2蛋白的表达会导致心肌心肌纤维化的加重(图6)。
 注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×400)
注:图A为NC组;图B为DCM组;图C为DCM + Sprouty2慢病毒干扰组(×400)
Figure 6. Changes of immunohistochemical staining in rats of each group
图6. 各组大鼠免疫组化染色的变化情况
4. 讨论
糖尿病心肌病的发病率和病死率不断上升,已然成为糖尿病患者危及生命的主要原因 [7]。糖尿病心肌病会导致一系列影响心功能的改变,包括早期出现心肌结构和心肌细胞的坏死,会出现左心室心肌肥大,心肌硬度增加,舒张功能障碍,而晚期进展出现收缩功能异常,导致心力衰竭严重的会发生猝死 [8],如今研究认为高血糖导致的心肌细胞凋亡、线粒体结构功能异常导致活性氧的产生而加重心肌损伤 [9],进而促进胶原蛋白的生成引发心肌纤维化,是糖尿病性心肌病最具特征性的病理变化。本实验首先通过对SD大鼠高脂饮食后腹腔注射STZ的方式建造2型糖尿病模型,4周后DCM组大鼠空腹血糖升高,大鼠其他一般情况也符合2型糖尿病的特征,说明糖尿病模型成功。对大鼠心功能进行检测,与正常组相比,DCM组出现心肌肥厚,左心室射血分数和左心室短轴缩短率明显下降,证明发展为糖尿病心肌病。
Sprouty蛋白参与增殖、运动、存活等多种病理过程,可以改善心肌肥大 [10],抑制内皮细胞和血管平滑肌细胞增殖、转化及新生血管形成 [11]。Sprouty蛋白大致分为四种亚型 [12]:Sprouty1-4,Sprouty蛋白最早是在果蝇身上提取得到的,被发现作为抑制Ras/MAPK的信号通路的特异性蛋白,依赖其高度的保守性来参与各种疾病的调控 [13],主要参与肿瘤细胞的产生、迁移、浸润及增殖。同时研究发现Sprouty蛋白对心血管系统具有一定的影响,其家族中Sprouty1通过降低ERK通路去磷酸化修饰程度抑制ERK通路的激活从而阻止心肌肥厚的进一步发展,而Sprouty2过表达抑制血管内皮细胞的增殖。在本研究中,DCM组大鼠Sprouty2蛋白表达降低,说明糖尿病性心肌病的发生影响其表达。为进一步探讨Sprouty2对于DCM纤维化的作用,通过慢病毒转染来抑制Sprouty2蛋白的表达,结果发现DCM + Sprouty2慢病毒干扰组与DCM比较空腹血糖值进一步升高,心功能射血分数和短轴缩短率下降,进而通过病理学染色观察到抑制其表达加重心肌纤维断裂,出现炎性细胞,胶原纤维表达明显增加。在TUNEL凋亡实验中,与DCM组心肌细胞相比,凋亡细胞增多,在免疫组化和蛋白表达水平发现α-SMA表达显著增强。
综上所述,降低Sprouty2的表达会促进糖尿病心肌病的发展,可能通过促进心肌细胞的凋亡和心肌纤维化而发生,本实验结果丰富了Sprouty2蛋白的作用范畴,同时也充实了DCM的发生机制,其中的具体机制有待进一步探究。
基金项目
2019年度牡丹江医学院研究生创新科研项目(2019YJSCX-08MY);2018年度黑龙江省省属高等学校基本科研业务费科研项目(2018-KYYWFMY-0025);2020年度黑龙江省省属高等学校基本科研业务费科研项目(2020-KYYWF-0813, 2020-KYYWF-0780);2020年度牡丹江医学院研究生创新科研项目(2020YJSCX-MY37)。
文章引用
白雨鑫,潘艳明,李欣欣,刘 勇,周 倩,吴 琦,郭素芬,刘贵波,成永霞,孙立新. Sprouty2蛋白在糖尿病性心肌病中表达的研究
The Effect of Sprouty2 Protein on Diabetic Cardiomyopathy[J]. 临床医学进展, 2021, 11(01): 220-228. https://doi.org/10.12677/ACM.2021.111032
参考文献
- 1. Gao, W., Wang, J., et al. (2019) Application of Metabonomics in Diabetic Research. Scientific and Technological Innovation, 10, 47-48.
- 2. Mann, D.L. (2011) The Emerging Role of Innate Immunity in the Heart and Vascular System: for Whom the Cell Tolls. Circulation Research, 108, 1133-1145. https://doi.org/10.1161/CIRCRESAHA.110.226936
- 3. Wang, S., Li, D. and Liu, O. (2019) Progress in Improving Myocardial Fibrosis Caused by Disease by Exercise. Chinese Journal of Sports Medicine, 38, 220-227.
- 4. 王刚, 杨波. 糖尿病心肌纤维化的机制及干预[J]. 中国循证心血管医学杂志, 2013, 5(6): 669-670.
- 5. Xu, N. and Bai, S. (2019) Research Progress on the Pathogenesis of Diabetic Cardiomyopathy. Medical Recapitulate, 25, 520-523.
- 6. 侯丽萍, 宋光耀, 甄云凤. 利拉鲁肽对2型糖尿病大鼠的保护作用[J]. 中国临床药理学杂志, 2020, 22(36): 3734-3738.
- 7. Zimmet, P, Alberti, K.G., Magliano, D.J., et al. (2016) Diabetes Mellitus Statistics on Prevalence and Mortality: Facts and Fallacies. Nature Reviews Endocrinology, 12, 616-622. https://doi.org/10.1038/nrendo.2016.105
- 8. Lee, W.S. and Kim, J. (2017) Diabetic Cardiomyopathy: Where We Are and Where We Are Going. Korean Journal of Internal Medicine, 32, 404-421. https://doi.org/10.3904/kjim.2016.208
- 9. 陈刚, 林丽香, 庄维特, 等. 糖尿病性心肌病大鼠心肌组织中氧化应激相关基因和能量代谢相关基因的表达及意义[J]. 中国糖尿病杂志, 2003, 11(3): 196-199.
- 10. Yuan, Y., Yan, L., et al. (2016) Mnk1(Mitogen-Activated Protein Kinase—Interacting Kinase 1) Deficiency Aggravates Cardiac Remodeling in Mice. Hypertension, 68, 1393-1399. https://doi.org/10.1161/HYPERTENSIONAHA.116.07906
- 11. Mason, J.M., Morrison, D.J., Basson, M.A., et al. (2006) Sprouty Proteins: Multifaceted Negative-Feedback Regulators of Receptor Tyrosine Kinase Signaling. Trends in Cell Biology, 16, 45-54. https://doi.org/10.1016/j.tcb.2005.11.004
- 12. Hacohen, N., Kramer, S., Sutherland, D., et al. (1998) Sprouty Encodes a Novel Antagonist of FGF Signaling That Patterns Apical Branching of the Drosophila Airways. Cell, 92, 253-263. https://doi.org/10.1016/S0092-8674(00)80919-8
- 13. Masoumi-Moghaddam, S., Amini, A. and Morris, D.L. (2014) The Developing Story of Sprouty and Cancer. Cancer and Metastasis Reviews, 33, 695-720. https://doi.org/10.1007/s10555-014-9497-1
