Advances in Clinical Medicine
Vol.
09
No.
04
(
2019
), Article ID:
30047
,
6
pages
10.12677/ACM.2019.94093
Progress on Virulence and Gene Promotion Regulated by lncRNAs of Plasmodium Falciparum
Junjin Jie, Jianfa Liu*, Danni Liu, Qi Liao, Jia Chen, Wenwen Jiang
Medical School of Ningbo University, Ningbo Zhejiang

Received: Apr. 9th, 2019; accepted: Apr. 23rd, 2019; published: Apr. 30th, 2019

ABSTRACT
Long non-coding RNAs (lncRNAs) are a group of RNA molecules, more than 200 nt, which do not have protein coding functions and mostly have a poly A tail structure. By 2016, there were 216 million people suffered from malaria all over the world every year. In recent years, due to the emergence of drug-resistant protozoas and insecticide-resistant mosquitoes, therefore, eliminating the harm of malaria to humans remains an arduous scientific task. Developing effective vaccines and new anti-malarial drugs, and innovating the conventional use of existing antimalarial drugs are pivotal to this challenge. The mechanisms of virulence regulation, gene activation, and metabolism of parasites are still unknown making it difficult to develop effective vaccines and new anti-malarial drugs. However, lncRNAs play an important role in the development, metabolism, and pathogenesis of plasmodium falciparum. Having a good understanding of the virulence regulation mechanism and gene activation process of lncRNAs will help us to understand the pathogenic mechanism of plasmodium falciparum. Then, we can develop specific diagnosis, treatment strategies and more effective antimalarial methods. This paper reviews the progress of lncRNAs in regulating the virulence of plasmodium falciparum and its gene activation.
Keywords:Plasmodium Falciparum, lncRNAs, VAR Gene
长非编码RNA调节恶性疟原虫的毒力及其基因激活研究进展
揭君津,柳建发*,刘丹妮,廖奇,陈佳,蒋雯雯
宁波大学医学院,浙江 宁波

收稿日期:2019年4月9日;录用日期:2019年4月23日;发布日期:2019年4月30日

摘 要
长链非编码RNA (long non-coding RNAs, lncRNAs)为一类长度大于200 nt,不具有蛋白质编码功能且大多具有polyA尾巴结构的RNA分子。截止2016年,全球每年疟疾发病病例高达2.16亿例,近年来,由于耐药性原虫和耐杀虫剂蚊的出现,消除疟疾对人类的危害仍是一项艰巨的科学任务。应对这一挑战的关键在于研制有效的疫苗、开发新的抗疟药物以及创新使用现有抗疟药物,而疟原虫的毒力调节机制、基因激活、代谢等过程尚有许多未知的方面,为疫苗研发和药物开发带来许多困难。lncRNAs在恶性疟原虫发育、代谢、致病机制中可能发挥重要作用,进一步了解lncRNAs的毒力调节机制、基因激活过程,有利于对恶性疟原虫的致病机制有更清晰的了解,以便有针对性地制定诊疗策略,开发有效的抗疟方法。本文就lncRNAs调节恶性疟原虫的毒力及其基因激活研究进展作一综述。
关键词 :恶性疟原虫,长链非编码RNA,VAR基因

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
根据2017年世界疟疾报告发布的数据,截止2016年,全球每年疟疾发病病例高达2.16亿例,其中非洲是疟疾的主要发生地,其死亡病例占2016年全球疟疾死亡病例的91%,紧随其后的是占比6%的亚洲东南亚区域。在非洲,将近60%的人口受到疟疾威胁,其中80%的感染者是儿童,疟疾是撒哈拉以南非洲地区儿童的第二位死亡原因 [1] 。目前,已有抗疟药抗药性问题严峻,寻找新的恶性疟原虫诊疗手段和药物作用靶标显得十分迫切 [2] 。最近研究表明,基因组中的lncRNAs在恶性疟原虫发生发展中扮演着重要角色 [3] ,因此,更深刻地了解lncRNAs与恶性疟原虫的毒力调节机制、基因激活过程之间的关系,有助于阐明恶性疟原虫的致病机制,以便有针对性地制定策略,为恶性疟原虫预防、早期诊断以及有效抗疟方法的开发服务。
近年来,研究表明寄生虫感染引起宿主lncRNA的表达变化,而lncRNAs表达的失调也与多种寄生虫疾病存在紧密的联系。恶性疟原虫具有复杂的基因表达调控系统,因此开展lncRNAs调节恶性疟原虫的毒力及其基因激活的研究,对揭示恶性疟原虫的病理生理学和发病机理具有重要意义。
2. lncRNAs概述
人类基因组计划表明,人类基因组有30亿个碱基对,其中1.5%为蛋白质编码基因,98.5%为不能编码蛋白质,这些不具有蛋白质编码潜能的基因序列曾被认为是“垃圾基因” [4] 。约75%的人类基因组能被转录成RNA,其中约74%的转录产物为非编码RNA (non-coding RNA, ncRNA),且绝大多数被转录为长链非编码RNA [5] 。lncRNAs转录本长度超过200 nt,无蛋白质编码能力,缺乏开放阅读框。大多数lncRNAs是由RNA聚合酶II转录,与含5,7-甲基鸟苷帽和3,多聚(A)尾的信使RNA (mRNA)有相似性,不同的是lncRNAs缺乏编码能力。ENCODE计划收录接近16,000个lncRNAs基因,产生了超过28,000个不同的转录物 [4] 。数量种类丰富、核苷酸序列长、作用方式多、功能多样化、特异性强和明显的时空与组织特异性决定了lncRNAs丰富多样的生物学功能。lncRNAs在表观遗传水平、转录水平和转录后水平等多个层面对基因的表达进行调控。各类生物体中都存在大量的lncRNAs.,尽管大部分lncRNAs的功能尚未清楚,但大量研究显示,lncRNAs广泛参与细胞增殖、分化、代谢、凋亡等生理活动,在代谢性疾病、神经退行性病变、心脑血管疾病、恶性肿瘤发生和寄生虫感染等多种生物学进程中均发挥重要功能 [6] 。
3. 恶性疟原虫概述
疟疾以昆虫和蚊为主要传播媒介,是热带和亚热带地区广泛流行的以发热、贫血和脾肿大为主要症状的感染性疾病。疟疾是世界上100多个国家所共同面临的公共卫生问题,根据2017年世界疟疾报告发布的数据,截止2016年,全球每年疟疾发病病例高达2.16亿例,其中非洲是疟疾的主要发生地,占2016年全球疟疾死亡病例的91%,紧随其后的是占比6%的亚洲东南亚区域。在非洲,将近百分之六十的人口受到疟疾威胁,其中80%的感染者是儿童,疟疾是撒哈拉以南非洲地区儿童第二位死亡原因 [1] 。
在感染人的4种疟疾病原体间日疟原虫、三日疟原虫、恶性疟原虫和卵形疟原虫中,恶性疟原虫是对人危害最大也是致死率最高的的一种。免疫力低下患者和妊娠期妇女由于机体免疫力下降,抵抗力降低,易发生感染,甚至可能发展成致命的脑型疟等凶险型疟疾。此外,寄生虫感染对初次妊娠的妇女会造成更严重的后果,可能与初次妊娠孕妇的孕期子娴有关 [7]。
当携带有恶性疟原虫子孢子的雌性按蚊叮吸人血时,每次约有20个子孢子随唾液注入人体内。子孢子大部分停留在皮肤,部分进入淋巴结,其余则经血流侵入肝细胞。未成熟疟疾孢子虫迁移到人类肝脏,它们通过吸取肝细胞内营养进行裂体增殖,发育为红外期裂殖体,裂殖体成熟后胀破肝细胞,裂殖子释放入血液,进入血液循环的裂殖子侵入红细胞内进行发育 [8] ,见图1。
受恶性疟原虫感染的宿主红细胞会进行细胞重建,其中最明显的改变就是受感染红细胞表面出现很多疣状突起(Knob)。恶性疟红细胞膜蛋白1s (PFEMP1s)是由疟原虫基因组编码产生的毒性蛋白,是疟原虫毒性的决定性因素,也是疟原虫进入人体后免疫应答的主要抗原靶点 [9] 。PFEMP1s以相互排斥的方式表达,向红细胞表面转移,通过受感染红细胞表面的疣状突起被粘附在红细胞表面,介导红细胞与宿主内皮细胞受体结合,从而使微血管系统中被感染的红细胞隐蔽。疟原虫通过免疫抑制方式参与免疫逃避,使它能够逃避宿主的清除,延长了感染期,使恶性疟原虫产生能够感染蚊子的雌配子。免疫逃避使被感染的红细胞在微血管系统中聚集,并因阻塞作用致宿主脉管系统破裂和出血,脏器功能受损 [10] 。
PFEMP1s由Var基因编码,Var基因是由60个高度可变的基因家族组成的基因簇,位于染色体末端亚端粒区。恶性疟原虫每次只能表达一个Var基因,而其余的基因家族成员则保持沉默 [11] 。这种不同基因之间的切换抗原变异机制有助于寄生虫实现免疫逃避。寄生虫转录沉默的机制尚未被阐明,但现有研究表明寄生虫转录沉默的机制与表观遗传机制相关。
4. lncRNAs与恶性疟原虫
4.1. lncRNAs在调节Var基因激活和相互排斥性表达中发挥关键作用
lncRNAs在调节Var基因激活和相互排斥性表达中发挥关键作用 [12] 。Var基因相互排斥性表达机制的关键是Var基因家族的60余个基因只有一个能够被表达,其余皆被沉默,这种抗原变异机制,交替表达由多拷贝Var基因家族成员编码的多种抗原,有助于寄生虫实现免疫逃避。抗原变异产生的免疫逃避
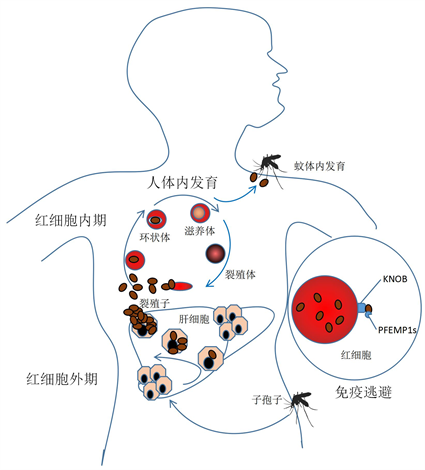
Figure 1. Life cycle of plasmodium
图1. 疟原虫在生活史
依赖于对Var基因表达过程的严格调控,这一调控确保只有一种Var基因在同一时期内被表达,而其余的基因家族成员则保持沉默 [11] 。近年来,关于Var基因独特的转录调控机制研究已取得了重大进展。结果显示,Var基因激活和相互排斥性表达是由多个因素参与的复杂体系调控的,涉及Var基因lncRNAs的调控、转录调控蛋白、核染色质结构、基因位点的迁移等,且与表观遗传机制相关 [3] 。
表观遗传(epigenetics)是指非基因序列改变所致基因表达水平的变化,且这种改变在细胞发育和增殖过程中能稳定传递。近年来诸多研究表明,无论是疟原虫生命阶段,还是在宿主体内的适应过程,lncRNA编辑、组蛋白修饰、DNA甲基化等表观遗传学的调控都发挥了重要作用 [13] 。Broadbent等人发现一类22个lncRNAs与染色体末端碱基互补,互补位置在Var基因位点附近,提示lncRNAs可能是Var基因表观遗传调控基础的机制 [14] 。
lncRNAs通过活化特定Var基因上游启动子,以序列和浓度依赖的方式启动沉默的Var基因,反之,机体产生补体肽核酸分子干扰lncRNAs,下调了活性Var基因含量,消除了表观遗传记忆,并诱导表达转换 [12] 。这些反义lncRNAs在调节Var基因激活和相互排斥性表达中发挥关键作用。
4.2. 疟原虫毒力调控
寄生虫毒力调控表观遗传学机制通常是修饰控制异染色质形成的组蛋白,已知恶性疟原虫有一套完整的真核生物组蛋白修饰基因 [3] 。
目前,对Var基因激活和相互排斥性表达的表观遗传改变进行深入研究发现,调节恶性疟原虫激活和沉默的Var基因的表观遗传机制已经被研究清楚,与之相关的关键蛋白质和DNA元件也已经确定。
Var基因的激活通过组蛋白H3第9位赖氨酸残基(H3K9)乙酰化和组蛋白第三亚基四号赖氨酸的二、三甲基化(H3K4me2/me3)实现,H3K4me3作为组蛋白密码或组蛋白标识识别基因启动子启动基因激活,而Var基因抑制则通过上调抑制性表观遗传标记物H3K9me3实现,H3K9me3与恶性疟原虫异染色质蛋白1 (PfHP1)结合从而形成核异染色质,H3K9me3和PfHP1结合不仅发生在Var基因位点上,还发生在所有染色体与Var基因相邻的端粒相关重复元件区域(TARE)上。TARE和子端粒区域的Var基因被称为ups-B型Var基因 [3] 。
Broadbent等人通过转录分析验证了872个蛋白质编码基因和60个lncRNAs与恶性疟原感染毒力调控的关系。他们发现了一类lncRNA与染色体末端TARE区域特定结合,被称为lncRNA-TARE。一方面,lncRNA-TARE可能调控疟原虫Var基因,lncRNA-TARE与upsB型var基因座毗邻,并在寄生虫分裂期间协调表达 [14] 。另一方面,顺式作用元件SPE2是Var基因沉默调控的关键序列,由12个碱基对组,lncRNAs-TARE含有大多数SPE2结合位点,而除lncRNAs-TARE外的所有SPE2结合位点存在于upB型Var基因的启动子中 [15] 。
综上所述,基因组内的排列位置、lncRNAs-TAREs的转录模式、lncRNAs-TARE含有大多数SPE2结合位点、Var基因的激活等过程说明lncRNA可能是通过调控异染色质形成,调控Var基因发挥作用,从而调控基因表达,达到调节寄生虫毒力的目的。
5. 讨论
随着对lncRNAs的研究日益增多,发现lncRNAs广泛参与有机体增殖、分化、代谢、凋亡等重要的生理活动,在多种生物学进程中发挥重要的调节功能。其在恶性疟原虫的毒力调节机制、基因激活过程中的作用也逐渐被揭开,有利于我们对恶性疟原虫的致病机制有更清晰的了解,以便有针对性地制定诊疗策略,为开发出更有效的抗疟方法服务。但lncRNAs在其他类型寄生虫领域的研究还很少,lncRNAs与各种寄生虫的关系尚未完全清楚。据最新研究,有179个Vir样基因和3018个ncRNA等基因或转录物在间日疟原虫转录调节中发挥重要作用 [16] 。曼氏血吸虫感染者五种lncRNA:Sm-lncRNA 5,Sm-lncRNA 6,Sm-lncRNA 9,Sm-lncRNA 10和Sm-lncRNA 12表达量较高,而表达量最高的Sm-lncRNA 5可能成为筛选曼氏血吸虫感染的有效标志物 [17] 。日本血吸虫、间日疟原虫、阴道毛滴虫等寄生虫的病理生理学和发病机理可能与lncRNAs紧密相关 [18] [19] ,lncRNAs与各种类型的寄生虫之间的联系还有待进一步研究和探讨,lncRNAs可能不仅对毒力调节机制以及基因激活过程至关重要,也可能在作为寄生虫疾病早期诊断及有效治疗的靶标中扮演着重要角色。然而是否所有的lncRNAs均发挥作用,这些发挥作用的lncRNAs是否可以被检测到,通过何种方法可以简单易行地检测lncRNA的表达,lncRNAs是否可以成为寄生虫疾病预防信号、诊疗靶点等问题,还有待进一步研究。随着基因组学、蛋白质组学、生物信息学等的发展,高通量测序技术的进一步完善,以及对lncRNAs研究的深入,lncRNAs与各种类型寄生虫感染之间的关系将逐渐被揭开 [20] 。
文章引用
揭君津,柳建发,刘丹妮,廖 奇,陈 佳,蒋雯雯. 长非编码RNA调节恶性疟原虫的毒力及其基因激活研究进展
Progress on Virulence and Gene Promotion Regulated by lncRNAs of Plasmodium Falciparum[J]. 临床医学进展, 2019, 09(04): 613-618. https://doi.org/10.12677/ACM.2019.94093
参考文献
- 1. WHO (2017) World Malaria Report 2017. Geneva.
- 2. Kumar, S., Bhardwaj, T.R., Prasad, D.N., et al. (2018) Drug Targets for Resistant Malaria: Historic to Future Perspectives. Biomedicine & Pharmacotherapy, 104, 8-27. https://doi.org/10.1016/j.biopha.2018.05.009
- 3. Bright, A.T. and Winzeler, E.A. (2011) Noncoding RNA, An-tigenic Variation, and the Virulence Genes of Plasmodium falciparum. BMC Biology, 9, 50. https://doi.org/10.1186/1741-7007-9-50
- 4. Consortium, E.P., et al. (2007) Identification and Analysis of Func-tional Elements in 1% of the Human Genome by the Encode Pilot Project. Nature, 447, 799-816. https://doi.org/10.1038/nature05874
- 5. Ma, L., Bajic, V.B. and Zhang, Z. (2013) On the Classification of Long Non-Coding RNAs. RNA Biology, 10, 925-933. https://doi.org/10.4161/rna.24604
- 6. Cipolla, G.A. and de Oliveira, J.C. (2018) Long Non-Coding RNAs in Multifactorial Diseases: Another Layer of Complexity. Noncoding RNA, 4, pii: E13. https://doi.org/10.3390/ncrna4020013
- 7. Muehlenbachs, A., Mutabingwa, T.K., Edmonds, S., Fried, M. and Duffy, P.E. (2006) Hypertension and Maternal-Fetal Conflict during Placental Malaria. PLoS Medicine, 3, e446. https://doi.org/10.1371/journal.pmed.0030446
- 8. Belachew, E.B. (2018) Immune Response and Evasion Mechanisms of Plasmodium falciparum Parasites. Journal of Immunology Research, 2018, Article ID: 6529681. https://doi.org/10.1155/2018/6529681
- 9. Horrocks, P., Pinches, R.A., Chakravorty, S.J., Papakrivos, J., Chris-todoulou, Z., Kyes, S.A., et al. (2005) PfEMP1 Expression Is Reduced on the Surface of Knobless Plasmodium falci-parum Infected Erythrocytes. Journal of Cell Science, 118, 2507-2518. https://doi.org/10.1242/jcs.02381
- 10. Rogerson, S.J., Grau, G.E. and Hunt, N.H. (2004) The Microcirculation in Severe Malaria. Microcirculation, 11, 559-576. https://doi.org/10.1080/10739680490503311
- 11. Chen, Q., Fer-nandez, V., Sundstr?m, A., Schlichtherle, M., Datta, S., Hagblom, P., et al. (1998) Developmental Selection of Var Gene Expression in Plasmodium falciparum. Nature, 394, 392-395. https://doi.org/10.1038/28660
- 12. Amit-Avraham, I., Pozner, G., Eshar, S., Fastman, Y., Kolevzon, N., Yavin, E., et al. (2015) Antisense Long Noncoding RNAs Regulate Var Gene Activation in the Malaria Parasite Plasmodium falciparum. Proceedings of the National Academy of Sciences of the United States of America, 112, 982-991. https://doi.org/10.1073/pnas.1420855112
- 13. Ap, W. and Ma, M. (1999) Epigenetics: Regulation through Repression. Science, 286, 481-486. https://doi.org/10.1126/science.286.5439.481
- 14. Broadbent, K.M., Park, D., Wolf, A.R., Van, T.D., Sims, J.S., Ribacke, U., et al. (2011) A Global Transcriptional Analysis of Plasmodium falciparum Malaria Reveals a Novel Family of Telomere-Associated lncRNAs. Genome Biology, 12, R56. https://doi.org/10.1186/gb-2011-12-6-r56
- 15. Witmer, K., Schmid, C.D., Brancucci, N.M., Luah, Y.H., Preiser, P.R., Bozdech, Z., et al. (2012) Analysis of Subtelomeric Virulence Gene Families in Plasmodium falciparum by Comparative Transcriptional Profiling. Molecular Microbiology, 84, 243-259. https://doi.org/10.1111/j.1365-2958.2012.08019.x
- 16. Zhu, L., Mok, S., Imwong, M., Jaidee, A., Russell, B., Nosten, F., et al. (2016) New Insights into the Plasmodium vivax Transcriptome Using RNA-Seq. Scientific Reports, 6, Article No. 20498. https://doi.org/10.1038/srep20498
- 17. Oliveira, V.F., Moares, L.A.G., Mota, E.A., Jannot-ti-Passos, L.K., Coelho, P.M.Z., Mattos, A.C.A., et al. (2018) Identification of 170 New Long Noncoding RNAs in Schistosoma mansoni. BioMed Research International, 2018, Article ID: 1264697. https://doi.org/10.1155/2018/1264697
- 18. Ejr, V., Dasilva, L.F., Pires, D.S., Lavezzo, G.M., Asa, P., Amaral, M.S., et al. (2017) The Schistosoma mansoni Genome Encodes Thousands of Long Non-Coding RNAs Predicted to Be Functional at Different Parasite Life-Cycle Stages. Scientific Reports, 7, Article No. 10508. https://doi.org/10.1038/s41598-017-10853-6
- 19. Woehle, C., Kusdian, G., Radine, C., Dan, G., Landan, G. and Gould, S.B. (2014) The Parasite Trichomonas vaginalis Expresses Thousands of Pseudogenes and Long Non-Coding RNAs Independently from Functional Neighbouring Genes. BMC Genomics, 15, 906. https://doi.org/10.1186/1471-2164-15-906
- 20. Lee, C. and Kikyo, N. (2012) Strategies to Identify Long Noncoding RNAs Involved in Gene Regulation. Cell & Bioscience, 2, 37. https://doi.org/10.1186/2045-3701-2-37
NOTES
*通讯作者。