 Optoelectronics 光电子, 2011, 1, 11-15 http://dx.doi.org/10.12677/oe.2011.12003 Published Online December 2011 (http://www.hanspub.org/journal/oe) Copyright © 2011 Hanspub OE ROS Detection in HL60 Based on ALA-PDT Lili Li, Zelin Zheng, Kangqiang Huang, Jianwen Xiong*, Jian Wang Laboratory of Quantum Information Technology, School of Physics and Telecommunication Engineering, South China Normal University, Guangzhou Email: lillianlee@126.com; jwxiong@snu.edu.cn Received: Oct. 5th, 2011; revised: Oct. 28th, 2011; accepted: Nov. 12th, 2011. Abstract: With the development of the basic research of photodynamic therapy (PDT) and a wide range of potential clinical applications have be carried out. The monitoring of reactive oxygen species (ROS) which produced in PDT has become a hot issue of PDT research in recent years. In the paper, the status of ROS in HL60 cells were investigated by fluorescence spectra acquired during PDT. The results showed that the largest number of ROS in PDT was achieved at the optimized conditions(the cells incubation time is 4 hours, the added concentration of ALA is 10 mM/L), in which up to 93.2% PDT efficiency for the HL60 Cells can be obtained within 60 minutes. Keywords: Reactive Oxygen Species (ROS); 5-Aminolevulinic Acid (ALA); Photodynamic Therapy (PDT); Fluorescent Probe 基于 ALA-PDT 的HL60 细胞中活性氧的检测 李莉莉,郑泽鳞,黄康强,熊建文*,王 健 广东省高等学校量子信息技术重点实验室,华南师范大学物理与电信工程学院,广州 Email: lillianlee@126.com; jwxiong@snu.edu.cn 收稿日期:2011 年10 月5日;修回日期:2011 年10月28 日;录用日期:2011 年11 月12日 摘 要:随着光动力学疗法(photodynamic therapy, PDT)基础研究的不断深入和临床应用的广泛开展, 对PDT 过程中产生的活性氧的实时监测近年来已成为 PDT 研究的热点问题。实验采用荧光探针技术, 通过获得的荧光光谱研究了基于 ALA-PDT的HL60 细胞中活性氧产生的情况。实验结果表明在 ALA 浓度为 10 mM/L,孵育时间为 4 h,光照剂量为 60 min的光学参数下,光动力反应中产生的活性氧是 最多,HL60细胞灭活效果最佳,PDT 效率达 93.2%。 关键词:活性氧;氨基乙酰丙酸(ALA);光动力疗法(PDT);荧光探针 1. 引言 光动力疗法(Photodynamic Therapy, PDT),又称光 辐照疗法(Photoradiation Therapy, PRT)或光化学疗法 (Photochemotherapy)[1,2],是利用光敏剂分子接受特定 波长的光能后通过光化学反应和能量传递将光能转化 为分子内能[3-5],在有氧条件下,产生多种活性氧物质 (reactive oxygen species, ROS),包括单线态氧、氧自 由基、羟自由基、超氧阴离子等,具有细胞毒作用[5-7], 它们可进一步与细胞内成分发生光敏化反应,从而对 蛋白质、核酸和脂类等生物大分子产生破坏作用,使 细胞的结构和功能受到严重影响,导致细胞凋亡或死 亡,起到治疗作用[8,9],同时光敏剂自身也会发生光敏 化自敏化反应[10-12]。目前相关研究已证实基于 PDT 过 程中的光敏剂光敏反应生成的活性氧是细胞杀伤的主 要媒介。光敏剂的光漂白也是由活性氧物质所引起的 [13-15]。因 此 ,对PDT 过程中活性氧的检测对于PDT原理 的研究以及光漂白现象的理解有着重要的意义[16,17]。 *基金项目:国家自然科学基金项目(61072029);广东省自然科学基 金项目(10151063101000025);广州市科技计划项目(2010Y1-C111)。 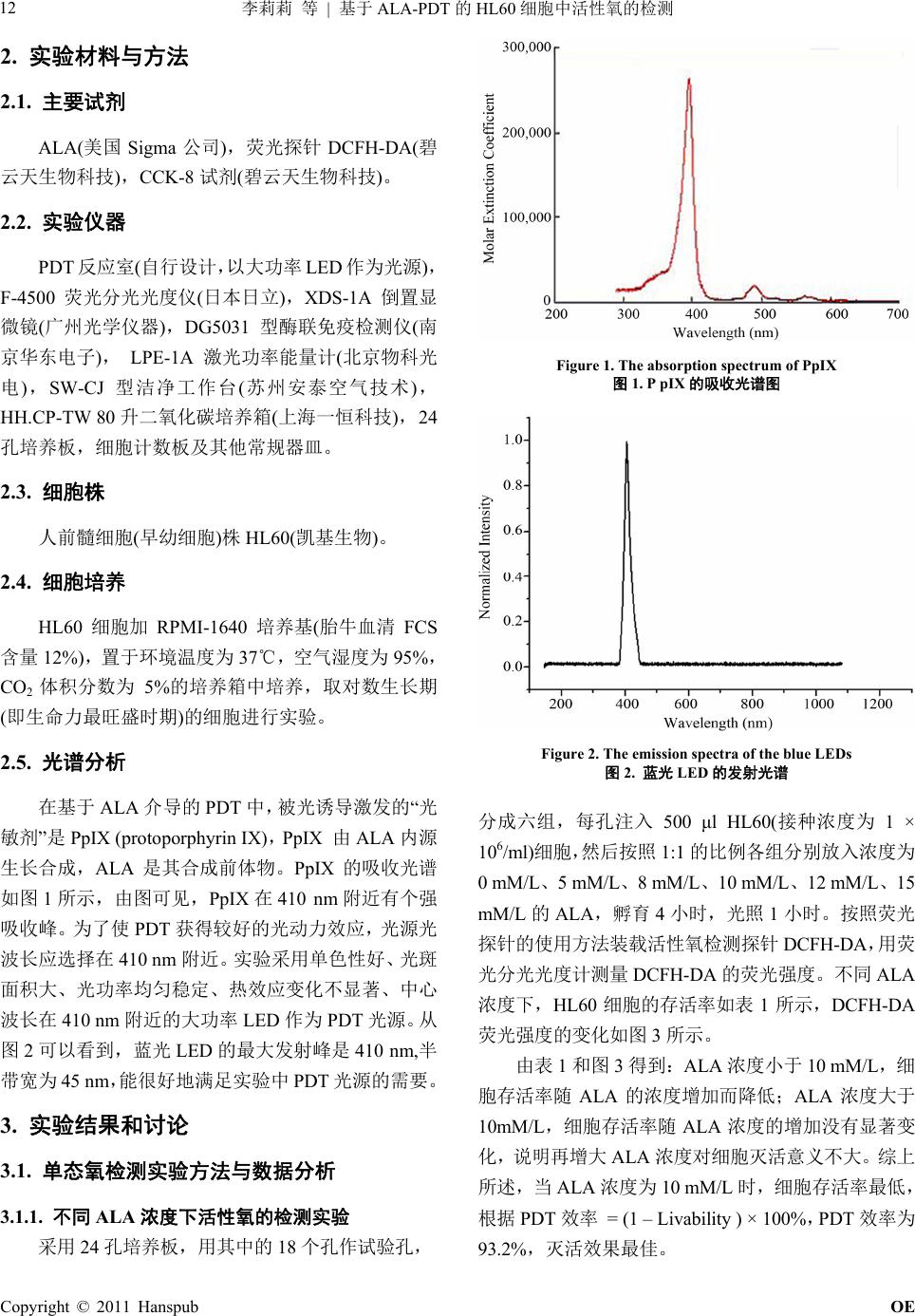 李莉莉 等 基于的 细胞中活性氧的检测 ALA-PDT HL60 12 2. 实验材料与方法 2.1. 主要试剂 ALA(美国 Sigma 公司),荧光探针 DCFH-DA(碧 云天生物科技),CCK-8 试剂(碧云天生物科技)。 2.2. 实验仪器 PDT 反应室(自行设计,以大功率LED 作为光源), F-4500 荧光分光光度仪(日本日立),XDS-1A 倒置显 微镜(广州光学仪器),DG5031 型酶联免疫检测仪(南 京华东电子), LPE-1A 激光功率能量计(北京物科光 电),SW-CJ 型洁净工作台(苏州安泰空气技术), HH.CP-TW 80 升二氧化碳培养箱(上海一恒科技), 24 孔培养板,细胞计数板及其他常规器皿。 2.3. 细胞株 人前髓细胞(早幼细胞)株HL60(凯基生物)。 2.4. 细胞培养 HL60 细胞加 RPMI-1640 培养基(胎牛血清 FCS 含量 12%),置于环境温度为 37℃,空气湿度为 95%, CO2体积分数为 5%的培养箱中培养,取对数生长期 (即生命力最旺盛时期)的细胞进行实验。 2.5. 光谱分析 在基于 ALA 介导的PDT 中,被光诱导激发的“光 敏剂”是PpIX (protoporphyrin IX),PpIX 由ALA 内源 生长合成,ALA 是其合成前体物。PpIX 的吸收光谱 如图 1所示,由图可见,PpIX 在410 nm附近有个强 吸收峰。为了使 PDT 获得较好的光动力效应,光源光 波长应选择在 410 nm 附近。实验采用单色性好、光斑 面积大、光功率均匀稳定、热效应变化不显著、中心 波长在 410 nm 附近的大功率 LED 作为 PDT光源。从 图2可以看到,蓝光LED 的最大发射峰是 410 nm,半 带宽为 45 nm,能很好地满足实验中 PDT 光源的需要。 3. 实验结果和讨论 3.1. 单态氧检测实验方法与数据分析 3.1.1. 不同 ALA 浓度下活性氧的检测实验 采用 24 孔培养板,用其中的 18 个孔作试验孔, Figure 1. The absorption spectrum of PpIX 图1. P pIX的吸收光谱图 Figure 2. The emission spectra of the blue LEDs 图2. 蓝光 LED 的发射光谱 分成六组,每孔注入 500 μl HL60(接种浓度为 1 × 106/ml)细胞,然后按照1:1 的比例各组分别放入浓度为 0 mM/L、5 mM/L、8 mM/L、10 mM/L、12 mM/L、15 mM/L 的ALA,孵育4小时,光照 1小时。按照荧光 探针的使用方法装载活性氧检测探针 DCFH-DA,用荧 光分光光度计测量 DCFH-DA 的荧光强度。不同 ALA 浓度下,HL60 细胞的存活率如表 1所示,DCFH-DA 荧光强度的变化如图 3所示。 由表 1和图 3得到:ALA 浓度小于 10 mM/L,细 胞存活率随 ALA 的浓度增加而降低;ALA浓度大于 10mM/L,细胞存活率随 ALA浓度的增加没有显著变 化,说明再增大 ALA 浓度对细胞灭活意义不大。综上 所述,当 ALA 浓度为 10 mM/L 时,细胞存活率最低, 根据 PDT 效率 = (1 – Livability ) × 100%,PDT 效率为 93.2%,灭活效果最佳。 Copyright © 2011 Hanspub OE 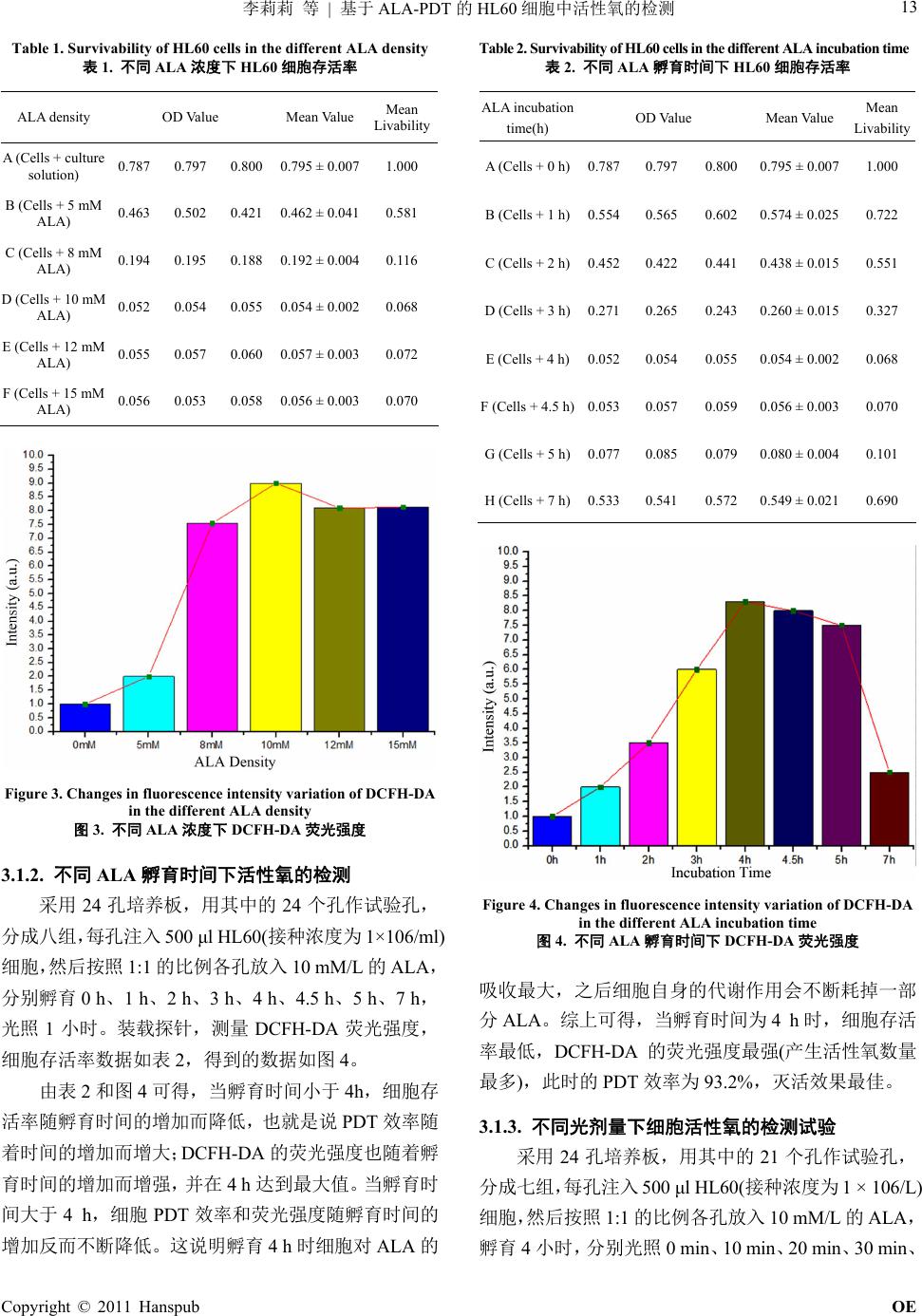 李莉莉 等 基于的 细胞中活性氧的检测13 ALA-PDT HL60 cells in the different ALA density ALA density OD Value Mean Value Mean Liva Table 1. Survivability of HL60 表1. 不同 ALA 浓度下 HL60 细胞存活率 bility A (C solution) 0.787 0.797 0.800 0.795 ± 0.007 ells + culture1.000 B (M ALA) 0.463 0.502 0.421 0.462 ± 0.041 0.581 C (CmM 0.194 0.195 0.188 0.192 ± 0.004 0.116 D (CemM 0.052 0.054 0.055 0.054 ± 0.002 0.068 E (CemM ALA) 0.055 0.057 0.060 0.057 ± 0.003 0.072 F (CemM ALA) 0.056 0.053 0.058 0.056 ± 0.003 0.070 Cells + 5 m ells + 8 ALA) lls + 10 ALA) lls + 12 lls + 15 Figure 3. Changes in fluorescence intensity variation of DCFH-DA 3.1.2. 不同 A孵 时间 试验孔, 分成 细胞存 活率 ALA incubaOD Value Mean Value Mean L in the different ALA density 图3. 不同 ALA 浓度下 DCFH-DA 荧光强度 AL 育 活性氧的检测下 采用 24 孔培养板,用其中的24 个孔作 八组,每孔注入 500 μl HL60(接种浓度为 1×106/ml) 细胞,然后按照 1:1 的比例各孔放入 10 mM/L的ALA, 分别孵育 0 h、1 h、2 h、3 h、4 h、4.5 h、5 h、7 h, 光照 1小时。装载探针,测量 DCFH-DA荧光强度, 细胞存活率数据如表 2,得到的数据如图 4。 由表 2和图 4可得,当孵育时间小于 4h, 随孵育时间的增加而降低,也就是说 PDT 效率随 着时间的增加而增大;DCFH-DA 的荧光强度也随着孵 育时间的增加而增强,并在 4 h 达到最大值。当孵育时 间大于 4 h,细胞 PDT 效率和荧光强度随孵育时间的 增加反而不断降低。这说明孵育 4 h 时细胞对 ALA 的 Table 2. Survivability of HL60 cells in the different ALA incubation time 表2. 不同 ALA 孵育时间下 HL60 细胞存活率 tion time(h) ivability A (h)0.7870.7970.800 0.795 ± 0.007Cells + 0 1.000 B (Cells + 1 h)0.5540.5650.602 0.574 ± 0.0250.722 C (Cells + 2 h)0.4520.4220.441 0.438 ± 0.0150.551 D (Cells + 3 h)0.2710.2650.243 0.260 ± 0.0150.327 E (Cells + 4 h)0.0520.0540.055 0.054 ± 0.0020.068 F (Cells + 4.5 h)0.0530.0570.059 0.056 ± 0.0030.070 G (Cells + 5 h)0.0770.0850.079 0.080 ± 0.0040.101 H (Cells + 7 h)0.5330.5410.572 0.549 ± 0.0210.690 Figure 4. Changes in fluorescence intensity variation of DCFH-DA 收最大,之后细胞自身的代谢作用会不断耗掉一部 3.1.3. 不同光剂 胞活性 测试验 验孔, 分成 in the different ALA incubation time 图4. 不同 ALA 孵育时间下 DCFH-DA 荧光强度 吸 分ALA。综上可得,当孵育时间为 4 h时,细胞存活 率最低,DCFH-DA 的荧光强度最强(产生活性氧数量 最多),此时的 PDT 效率为 93.2%,灭活效果最佳。 量下细 氧的检 采用 24 孔培养板,用其中的21 个孔作试 七组,每孔注入 500 μl HL60(接种浓度为1 × 106/L) 细胞,然后按照 1:1 的比例各孔放入 10 mM/L的ALA, 孵育 4小时,分别光照 0 min、10 min、20 min、30 min、 Copyright © 2011 Hanspub OE 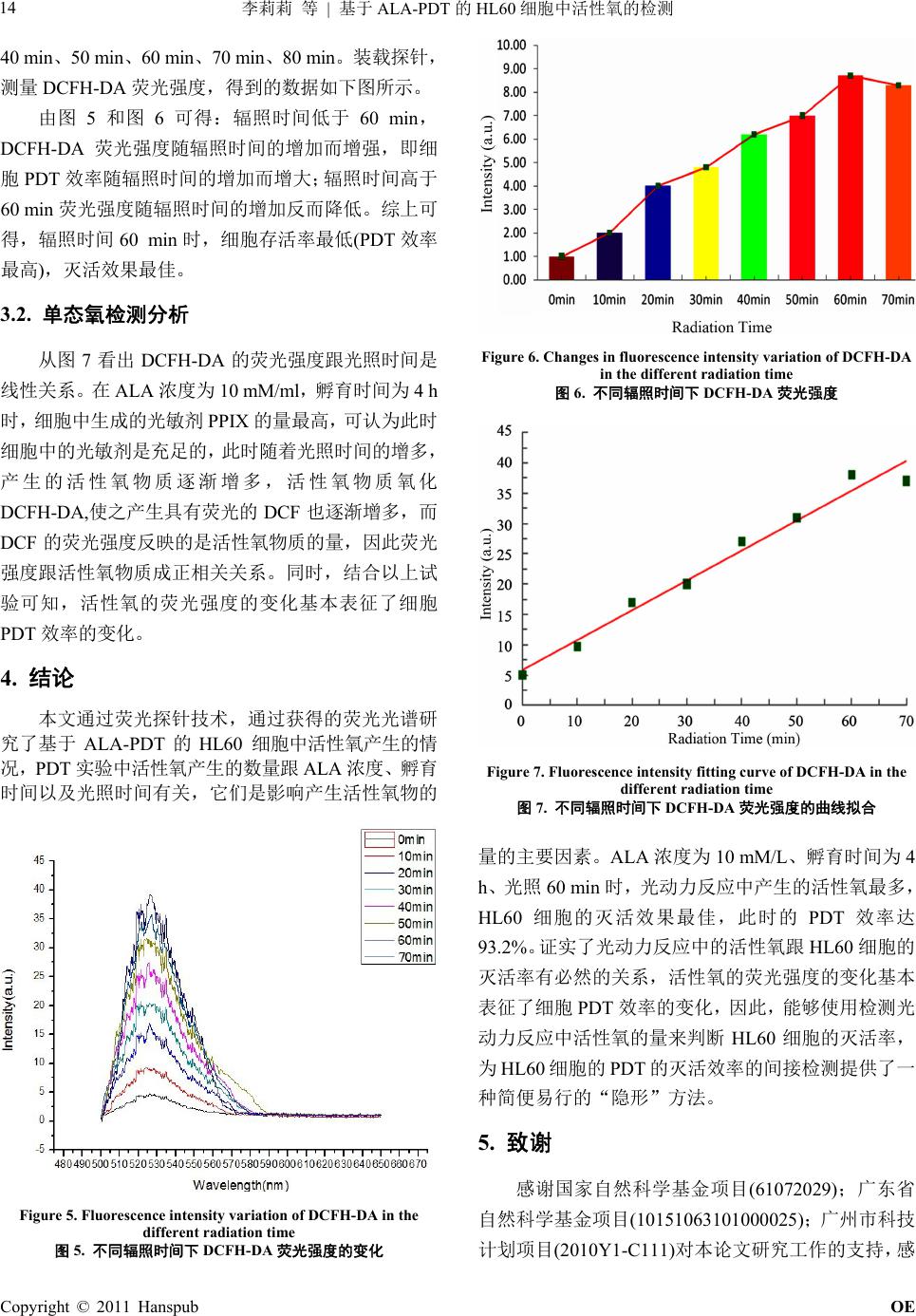 李莉莉 等 基于的 细胞中活性氧的检测 ALA-PDT HL60 14 DCF 从图 DA 的荧光强度跟光照时间是 线性 过荧光探针技术,通过获得的荧光光谱研 究了 40 min、50 min、60 min、70 min、80 min。装载探针, 测量 DCFH-DA 荧光强度,得到的数据如下图所示。 由图 5和图 6可得:辐照时间低于 60 min, H-DA 荧光强度随辐照时间的增加而增强,即细 胞PDT 效率随辐照时间的增加而增大;辐照时间高于 60 min 荧光强度随辐照时间的增加反而降低。综上可 得,辐照时间 60 min时,细胞存活率最低(PDT 效率 最高),灭活效果最佳。 3.2. 单态氧检测分析 7看出 DCFH- 关系。在 ALA 浓度为 10 mM/ml,孵育时间为 4 h 时,细胞中生成的光敏剂 PPIX 的量最高,可认为此时 细胞中的光敏剂是充足的,此时随着光照时间的增多, 产生的活性氧物质逐渐增多,活性氧物质氧化 DCFH-DA,使之产生具有荧光的 DCF也逐渐增多,而 DCF 的荧光强度反映的是活性氧物质的量,因此荧光 强度跟活性氧物质成正相关关系。同时,结合以上试 验可知,活性氧的荧光强度的变化基本表征了细胞 PDT 效率的变化。 4. 结论 本文通 基于 ALA-PDT 的HL60 细胞中活性氧产生的情 况,PDT 实验中活性氧产生的数量跟 ALA 浓度、孵育 时间以及光照时间有关,它们是影响产生活性氧物的 Figure 6. Changes in fluorescence intensity variation of DCFH-DA in the different radiation time 图6. 不同辐照时间下 DCFH-DA 荧光强度 Figure 7. Fluorescence intensity fitting curve of DCFH-DA in the different radiation time 图7. 不同辐照时间下 DCFH-DA 荧光强度的曲线拟合 量的 4 、光 照60 min 时,光动力反应中产生的活性氧最多, 家自然科学基金项目(610 72029) ;广东省 自然科学基金项目(10151063101000025);广州市科技 计划 主要因素。ALA 浓度为 10 mM/L、孵育时间为 h HL60 细胞的灭活效果最佳,此时的 PDT 效率达 93.2%。证实了光动力反应中的活性氧跟 HL60 细胞的 灭活率有必然的关系,活性氧的荧光强度的变化基本 表征了细胞 PDT 效率的变化,因此,能够使用检测光 动力反应中活性氧的量来判断 HL60 细胞的灭活率, 为HL60细胞的 PDT 的灭活效率的间接检测提供了一 种简便易行的“隐形”方法。 5. 致谢 感谢国 Figure 5. Fluorescence intensity variation of DCFH-DA in the different radiation time 图5. 不同辐照时间下 DCFH-DA 荧光强度的变化 项目(2010Y1-C111)对本论文研究工作的支持,感 Copyright © 2011 Hanspub OE  李莉莉 等 基于ALA-PDT 的HL60 细胞中活性氧的检测 Copyright © 2011 Hanspub OE 15 献 (References) [1] 吴继明, 熊建文, 肖化. 用于肿瘤治疗的光动力学疗法[J] [2] B. Z. Zhao, advances in the prevention and 比较[J]. 激光生物学报, 2007, 16(5): 559-562. pplied secondary sources. chemistry 1, 57(47): 9513-9547. - etection and hydroxyl radical formation with fluorescent probes protoporphyrin IX in murine leukemia 谢熊建文教授对本论文研究工作的悉心指导,感谢郑 泽鳞、黄康强两位师兄对本论文成文后的修改提供的 帮助。 参考文 . 激[1 光杂志, 2003, 24(1): 70-74. Y. Y. He. Recent treatment of skin cancer using photodynamic therapy. Expert Review of Anticancer Therapy, 2010, 10(11): 1797-1809. [3] 熊建文, 肖化, 陈丽等. 基于 ALA-PDT 体外灭活HL60 细胞 的实验研究[J]. 光电子激光, 2004, 15(9): 1180-1183. [4] 吴继明, 熊建文, 肖化等. 普通白光光源应用于 ALA-PDT 的[1 实验研究[J]. 激光杂志, 2004, 5(5): 231-234. [5] J. H. Park, Y. H. Moon, D. J. Kim, et al. Photodynamic therapy with hexenyl ester of 5-aminolevulinic acid induces necrotic cell death in salivary gland adenocarcinoma cells. Oncology Reports, 2010, 24(1): 177-181. [6] C. Kim, C. W. Chung, K. H. Choi, et al. Effect of 5-aminolevuli- nic acid-based photodynamictherapy via reactive oxygen species in human cholangiocarcinoma cells. International Journal of Na- nomedicine, 2011, 6: 1357-1363. http://www.dovepress.com/effect-of-5-aminolevulinic-acid-base d-photodynamic-therapy-via-reactiv-a7775 [7] V. Nadeau, M. O. Dwyer, K. Hamdan, et al. In vivo mea- surement of 5-aminolaevulinic acid-induced protoporphyrin IX photobleaching: A comparison of red and blue light of various cell intensities. Photodermatol Photoimmunol Photomed, 2004, 20: 170-174. [8] 熊建文, 肖化, 张镇西. MTT法和 CCK-8 法检测细胞活性之 测试条件 [9] R. Traystmn, J. Kirsch, R. Koehler. Oxygen radical mechanisms of brain injury following ischemia and reperfusion. A Physiology, 1991, 71(4): 1185-1195. [10] 邢达, 谭石慈等. 植物体应激反应中生物光子发射的实验观 测[J]. 科学通报, 1999, 44 (21): 2299-2302. 1] V. Verma, Z. Ning, A. K. Cho, et al. Redox activity of urban quasi-ultrafine particles from primary and Atmospheric Environment, 2009, 43(40): 6360-6368. [12] D. Sutoa, Y. Ikeda, K. Stato, et al. Nactivation of cysteine and serine proteases by singlet oxygen. Archives of Bio and Biophysics, 2007, 461(2): 151-158. [13] R. Bonnett, G. Martinez. Photobleaching of sensitisers used in photodynamic therapy. Tetrahedron, 200 4] C. L. Yu, S. Chen and M. Zhang. Spectroscopic studies and pho- todynamic actions of hypocrellin B in liposomes. Photo chemistry and Photobiology, 2001, 73(4): 482-488. [15] W. Zhong, J. P. Celli, I. Rizvi, et al. In vivo high-resolution fluorescence microendoscopy for ovarian cancer d treatment monitoring. British Journal of Cancer, 2009, 101(12): 2015-2022. [16] M. Price, J. J. Reiners, A. M. Santiago, et al. Monitoring singlet oxygen and during photodynamic therapy. Photochemistry and Photobiology, 2009, 85(5): 1177-1181. [17] B. Diez, R. C. Russo, M. J. Teijo, et al. ROS production by endogenously generated s. Cellular and Molecular Biology, 2009, 55(2): 15-19. |