Traditional Chinese Medicine
Vol.
12
No.
05
(
2023
), Article ID:
66587
,
17
pages
10.12677/TCM.2023.125172
滋阴和温阳方剂对帕金森病小鼠 神经损伤及肠道炎症 和肠微生态的影响
代素娥1,李迎丽1,苏咏梅2,贾燕1,肖虹1,高洁莹1,唐勇3*,白群华1*
1重庆医科大学公共卫生学院,重庆
2重庆中医药学院中医系,重庆
3重庆市中医骨科医院骨伤科,重庆
收稿日期:2023年4月1日;录用日期:2023年5月22日;发布日期:2023年5月31日

摘要
目的:探索滋阴和温阳方剂(六味地黄丸与肾气丸)对帕金森病小鼠神经损伤及肠道炎症和肠微生态的影响。方法:将小鼠随机分为对照组、MPTP处理组、补脾组、滋阴组、温阳组,用MPTP诱导的亚急性帕金森病小鼠模型,观察滋阴和温阳方剂对帕金森病小鼠纹状体多巴胺含量、运动能力、回肠和纹状体中的细胞炎性因子的表达、肠道微生态的影响作用。结果:滋阴和温阳方剂可明显促进帕金森病小鼠神经损伤的恢复,促进多巴胺的含量增加(p < 0.05),并且温阳方剂较滋阴方剂效果更明显(p < 0.05),增加纹状体中酪氨酸羟化酶基因的表达(p < 0.05),且温阳方剂效果更明显(p < 0.001),运动能力较MPTP组也有显著的恢复(p < 0.05)并且温阳方剂较滋阴方剂效果更明显(p < 0.05);抑制纹状体中IL-1β基因的表达(p < 0.05),且温阳方剂效果更明显(p < 0.05),抑制回肠中IL-1β基因的表达(p < 0.0001),并促进回肠中IL-22基因的表达(p < 0.05);促进回肠中的粘膜屏障结构修复;在门、科、属水平上,各组肠道微生物中优势物种类似,但丰度有所不同,滋阴组chao指数显著升高(p < 0.05),PCoA分析中各组肠道微生物的群落组成均存在显著的差异(R = 0.2942, p =0.003)。讨论:滋阴方与温阳方(六味地黄丸与肾气丸)可以改善帕金森病小鼠所产生的运动症状、肠道菌群失调、肠道炎症、肠粘膜屏障受损、DA能神经细胞损伤的情况,且温阳配方较滋阴配方效果稍强。
关键词
滋阴方,温阳方,六味地黄丸,肾气丸,MPTP,肠道菌群

Effects of Zi Yin and Wen Yang Formulas on Nerve Damage and Intestinal Inflammation and Intestinal Microecology in Mice with Parkinson’s Disease
Su’e Dai1, Yingli Li1, Yongmei Su2, Yan Jia1, Hong Xiao1, Jieying Gao1, Yong Tang3*, Qunhua Bai1*
1School of Public Health, Chongqing Medical University, Chongqing
2Department of Traditional Chinese Medicine, Chongqing College of Traditional Chinese Medicine, Chongqing
3 Department of Orthopedic Surgery, Chongqing Orthopedics Hospital of Traditional Chinese Medicine, Chongqing
Received: Apr. 1st, 2023; accepted: May 22nd, 2023; published: May 31st, 2023

ABSTRACT
Objective: To explore the effects of Zi Yin and Wen Yang formulas (Liu Wei Di Huang Wan and Ren Qi Wan) on nerve injury and intestinal inflammation and intestinal microecology in mice with Parkinson’s disease. Methods: Mice were randomly divided into control group, MPTP-treated group, spleen tonic group, Zi yin group and Wen yang group with MPTP-induced subacute Parkinson’s disease mouse model to observe the effects of Zi Yin and Wen Yang formulas on striatal dopamine content, motility, expression of cellular inflammatory factors in ileum and striatum, and intestinal microecology in mice with Parkinson’s disease. Results: Zi Yin and Wen Yang formulas significantly promoted the recovery of nerve damage in Parkinson's disease mice, increased the content of dopamine (p < 0.05), and Wen Yang formulae were more effective than Zi Yin formulae (p < 0.05), increased the expression of tyrosine hydroxylase gene in the striatum (p < 0.05), and Wen Yang formulae were more effective (p < 0.001), and motor ability was also significantly restored compared with the MPTP group (p < 0.05). There was a significant recovery of motility (p < 0.05) and the effect of the Wen Yang formula was more pronounced than that of the Zi Yin formula (p < 0.05); inhibited the expression of IL-1β gene in the striatum (p < 0.05), and the effect of the Wen Yang formula was more pronounced (p < 0.05), inhibited the expression of IL-1β gene in the ileum (p < 0.0001), and promoted the expression of IL-22 gene in the ileum (p < 0.05); promoted the repair of mucosal barrier structure in ileum; at the level of phylum, family and genus, the dominant species were similar in each group of intestinal microorganisms, but the abundance was different, and the chao index was significantly higher in the Zi Yin group (p < 0.05), and there were significant differences in the community composition of intestinal microorganisms in each group in PCoA analysis (R = 0.2942, p = 0.003). Conclusion: The Zi Yin formula and the Wen Yang formula (Liu Wei Di Huang Wan and Ren Qi Wan) can improve the motor symptoms, intestinal flora dysbiosis, intestinal inflammation, intestinal mucosal barrier damage, and DAergic nerve cell damage produced by mice with Parkinson’s disease, and the Wen Yang formula is slightly more effective than the Zi Yin formula.
Keywords:Zi Yin Formula, Wen Yang Formula, Liu Wei Di Huang Wan, Shen Qi Wan, MPTP, Intestinal Flora

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
帕金森病(Parkinson’s disease, PD)是一种常见的神经系统变性疾病,其典型的临床症状主要表现为静止性震颤、运动迟缓、肌强直和姿势异常 [1] [2] ,其主要病理特征是中脑黒质中多巴胺能神经元出现异常的α突触核蛋白聚集和多巴胺(DA)神经元丧失 [3] 。确切病因目前仍不清楚,多种因素均可能参与帕金森多巴胺能神经元的变性死亡过程,包括年龄老化、遗传因素、环境因素以及其它因素等 [4] [5] 。目前,没有还没有有效的疗法能治愈,药物治疗是治疗该病的首选,现阶段西药左旋多巴制剂仍为临床的主要用药,但只能缓解临床症状同样也不能阻止神经元退化,且长期使用具有较大的副作用如运动障碍、恶心和低血压 [6] [7] 。中药是中国最古老且仍大量使用的传统药物。目前研究发现中医药在治疗和预防PD领域具有一定的发展前景,如研究发现,肾气丸、洋金花、银杏提取物、人参皂苷、黄芩苷、芝麻素、姜黄素、天麻素、白藜芦醇、葛根异黄酮以及六味地黄丸、真武汤、舒筋解毒方、补肾活血饮等中药成分和复方具有抗氧化及抗自由基损伤 [8] ,以及提高纹状体多巴胺含量的作用 [9] 。中西药联合治疗,在减轻帕金森病症状方面比单药治疗更有效,如一项meta分析显示中药联合西医常规是治疗帕金森患者安全、有效的途径 [10] 。但是中医药治疗帕金森病发展缓慢,不仅是由于中医药理论对治疗帕金森病的机理和其微观细节不清楚,而且还因为中药具有多组分、作用多途径,多靶点等特点 [11] ,导致中医药对帕金森病的治疗还有待进一步研究发展。
从中医理论出发,根据中老年人群帕金森病的临床症状,在中医学中帕金森病属于“颤症”的范畴 [12] ,中医认为该病主要以肝肾亏虚为病机之基础,以淤血阻络为病机之要,以脾胃虚弱为病机关键 [12] 。因此,帕金森病的治疗主要以滋补肝肾、调理脾胃等为着力点,用药以补脾方剂为主。近年来随着中医学者对帕金森病长期的临床实践和深入研究,认为帕金森病的“肝肾亏虚”发病机制,肾虚是根本 [13] 。肾虚最基本的证型又可分为“肾阴虚”和“肾阳虚” [14] ,因此中医学家对本病的治疗认识存在争议,分为滋阴和温阳两种不同的治疗方法。结合现代医学理论和技术,针对“阴虚”和“阳虚”不同证型的“滋阴”和“温阳”的疗法对机体免疫系统和能量代谢状态确实具有不同的调节作用,如对细胞能量代谢和免疫调节作用具有明显差异。但要完全了解两种方剂治疗差异,还需要现代科学技术深入明确其确切的治疗机制。
帕金森病患者早期症状表现在肠道,且与健康人相比,PD患者的肠道常伴有菌群失调 [15] 。已有研究发现PD的发病及进展和肠道功能紊乱以及肠道菌群密切相关。肠道菌群失衡可以通过影响肠道黏膜屏障、以及肠–脑轴的相互作用等导致胃肠功能障碍,促进多巴胺能神经元变性s,促进PD的发生发展 [16] [17] 。PD患者肠杆菌科细菌水平与PD患者姿势不稳和步态困难的严重程度呈正相关 [18] ;粪便中普雷沃菌科的丰度明显降低可能与黑质多巴胺活性相关 [18] ;粪便产短链脂肪酸菌的减少可与肠道通透性的改变联合作用诱发肠道炎症和神经免疫反应,并通过α-突触核蛋白与肠神经系统使病变蔓延至脑 [19] ;丁酸产生菌(例如布劳特菌属、罗氏菌属和粪球菌属)的减少以及产LPS菌计数的增多都可能进一步增强炎性反应 [20] 。肠道菌群失调是PD发生的潜在因素 [15] ,但其如何触发PD发病的潜在致病机制仍需进一步研究。
近年来,研究肠道菌群的影响成为研究的热点。传统中医药常口服给药,当中药进入机体后,在一定程度上通过对肠道菌群的相互作用,进而影响肠黏膜免疫屏障的功能,对肠道免疫系统的调节作用是多途径、多层次的 [21] 。研究表明,传统中药剂型中的多种有效成分可以通过口服的方式进入胃肠道影响肠道菌群 [22] ,调节肠道菌群的代谢物 [23] ,增强免疫细胞活化,促进肠道组织免疫球蛋白生成,调节肠道细胞因子表达,从而影响肠道菌群的稳态,参与肠黏膜免疫屏障功能建设及保护肠道 [24] [25] [26] 。
基于我们先前的研究 [27] ,小鼠帕金森病亚急性模型可以更好的模拟帕金森病病人神经系统渐进式损伤发展的情况。因此,本次研究是通过MPTP诱导亚急性帕金森病小鼠模型,并在应用补脾方剂的基础上,分别对帕金森病小鼠模型给予滋阴和温阳方剂,观察对其神经损伤的保护作用、对肠道微生态、炎症因子的影响,来探索滋阴与温阳方剂对帕金森病的治疗作用与机制。
2. 材料与方法
2.1. 实验动物
SPF级雄性C57/BL6小鼠,共25只,均由重庆医科大学动物实验中心提供。所有涉及动物的实验治疗均经过重庆医科大学动物护理和使用委员会的仔细审查和批准(IACUC-CQMU-2022-0010),并尽一切努力将动物痛苦降至最低。
2.2. 主要试剂
滋阴方剂:六味地黄丸(配方:熟地黄24 g,山药和山茱萸各12 g,茯苓、盐泽泻和杜丹皮各9 g);温阳方剂:肾气丸(配方:熟地黄24 g,山药和山茱萸各12 g,茯苓、盐泽泻和牡丹皮各9 g,桂枝和制白附子各3 g);补脾方剂(配方:陈皮、北柴胡和酒川穹各6 g,粉葛15 g,石菖蒲9 g,麸炒枳实、红花各6 g,黄芩9 g),均购于重庆市普通中药房。
1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP,Sigma公司);反转录等分子生物学相关试剂购于商业试剂公司;甲醇为色谱纯,柠檬酸、乙酸钠、1-庚烷磺酸钠、乙二胺四乙酸二钠、三乙胺、L-半胱氨酸、高氯酸均为分析纯,水为超纯水。
2.3. 实验方法
2.3.1. 方剂和试剂的制备
中药熬制:1 L超纯水浸泡1 h,大火煮沸后,转至小火持续30 min,重复三次。收集所有液体,离心(12,000 rpm, 15 min, 4℃),取上清液,过滤纸,收集滤液,50℃减压浓缩至100 mL。隔水煮沸20 min灭菌,分装于灭菌的微型离心管内,于−20℃保存。按照相关标准要求准备测定多巴胺含量所需试剂。
2.3.2. 小鼠PD模型构建及分组给药
适应性喂养C57/BL6雄性小鼠一周后,每只小鼠称重并记录重量,随机分为以下5组:Con:对照组;M:MPTP模型组;CY:MPTP造模,补脾方灌胃组;AC:MPTP造模,滋阴方 + 补脾方灌胃组:BC:MPTP造模,温阳方 + 补脾方灌胃组。亚急性PD模型构建与给药(图1)如下,而中药及单体的动物灌胃剂量根据动物间剂量换算表计算。
MPTP造模方法:腹腔注射MPTP,25 mg/kg,连续注射5天诱导亚急性模型;对照组腹腔连续注射5天等量的生理盐水;在注射MPTP或生理盐水第2天起,Con组和MPTP组用生理盐水灌胃,BP组用补脾方灌胃,ZY组用补脾方和滋阴方灌胃,WY组用补脾方和温阳方灌胃,连续灌胃至第15天,第16天用安乐死处死。
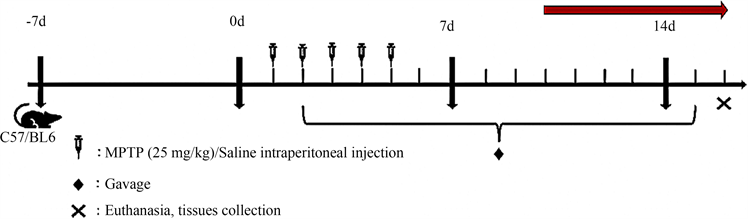
Figure 1. Animal model construction
图1. 动物模型构建
2.3.3. 样品的收集
于实验第15天,把每只小鼠单独放在干净的无菌鼠笼内,让其自由活动,排出粪便后,立即收集到无菌的1.5 mLEP管中,−80˚保存。每组随机各取4个样本,共20个样本,进行粪便16s rRNA和非靶向代谢物相关检测。
小鼠被戊巴比妥钠(Lethobarb, Virbac, Australia)深度麻醉后,我们收集了以下样本:新鲜纹状体和新鲜回肠。快速剥离出完整的小鼠脑组织,分离出纹状体后于4%甲醛溶液固定,共25个样本。将头剪下,去除多余的皮肤和肌肉,打开颅后部颅骨取出整脑,分出纹状体,立即在液氮中冷冻组织,并在−80℃下储存,用于多巴胺含量测定和PCR测定。小鼠被麻醉处死后分离收集回肠(5 cm)段,立即在液氮中冷冻组织,并在−80℃下储存,用于PCR测定。
2.3.4. 高效液相色谱法测定纹状体多巴胺含量
制备0.1 mg/mL DA标准储备溶液(中国北京国家食品药品监督管理机构)并在4℃下储存。如前所述,我们使用HPLC (1260 Infinity Agilent Technologies, Wilmington, DE, USA)和荧光检测器测量纹状体中的多巴胺。该系统使用Eclipse XDB-C18柱(250 × 4.6 mm,5 μm,美国安捷伦)。纹状体用裂解液(含0.6 M高氯酸和0.5 mM Na2EDTA)均质,离心(14,000 r/min, 4˚C)。加入等体积的高氯酸沉淀剂。用0.22 μm滤膜过滤,滤液用于分析。在35℃下用柠檬酸–醋酸钠缓冲液和甲醇(87:13, v/v, PH 3.8)的流动相以0.5 mL·min−1的流速洗脱柱。激发波长为280 nm,发射波长为330 nm。注射量为20 μL,测定多巴胺标准曲线,计算样品中多巴胺的含量。
2.3.5. 定量实时PCR (qRT-PCR)
使用TRIzol试剂(Thermo Fisher Scientific, Waltham, MA, USA)从样品中提取总RNA,并使用PrimeScriptTM RT Master Mix (Perfect Real Time) (Takara, Dalian, China)将其逆转为cDNA。在CFX ConnectTM Real-Time System (Bio-Rad, CA, USA)上使用SYBR® Premix Ex TaqTM II (Tli RNaseH Plus)进行qRT-PCR。引物是由Sangon Biotech (中国上海)合成的。PCRs在以下条件下进行。所有的mRNA表达数据都用2-ΔΔCt方法计算,并与β-肌动蛋白标准化。
2.3.6. 基于16s rRNA基因的粪便微生物组分析
使用E.Z.N.A.®土壤DNA试剂盒(Omega Biotek, Norcross, GA, U.S.)从粪便样品中提取微生物DNA。用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA基因的V3-V4高变异区。) PCR在以下程序下进行:95℃下变性3分钟,然后进行27个循环,95℃30秒,55℃30秒,72℃45秒,72℃10分钟。使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences, Union City, CA, USA)纯化得到的PCR产物,并根据制造商的说明使用QuantiFluor™-ST (Promega, USA)进行定量。然后根据Majorbio生物医药技术有限公司的标准程序在Illumina Miseq平台(Illumina, San Diego, USA)上对16S rRNA基因扩增子进行测序。实验结果显示,在Illumina Miseq平台(Illumina, San Diego, USA)上按照标准程序进行测序(Shanghai, China)。数据分析在I-Sanger平台上进行。α-多样性通过Chao和Shannon指数评估,该指数由操作分类单位(OTU)的数量计算得出。β-多样性使用加权Bray-Curtis距离测量,并使用主坐标分析(PCoA)表示。此外,我们分析了所有群体的微生物组成和相对丰度的差异。
2.3.7. 运动协调性测试
在最后一次灌胃处理后一天进行运动协调性测试。运动协调性是通过使用rotarod (Ugo Basile, Gemonio, ITALY)测试的。在300秒内以从5到40 r/min的速度进行转体测试,记录小鼠跌落时间以评估小鼠运动协调能力的恢复情况。
2.3.8. 图像处理与统计分析
所有图像均使用Adobe Photoshop CS 8.0 (Adobe Systems)处理,而分析则使用Image Pro®Plus和ImageJ (W.Rasband, NIH)进行。所有结果均以平均值 ± 标准差(SD)表示。统计分析采用单因素方差分析(ANOVA),采用Bonferroni校正对正态分布和方差均匀化数据进行多重比较,其他数据采用SPSS 22.0软件(IBM Corporation,Armonk,NY,USA)进行非参数检验。p < 0.05的值被认为具有统计学意义。所有数据均使用GraphPad Prism 9.0版统计软件(GraphPad, Inc., La Jolla, USA)呈现。数据表示为平均值±标准误(mean ± SEM)。
3. 结果
3.1. 滋阴和温阳方剂促进PD小鼠纹状体多巴胺含量增加和运动能力的恢复
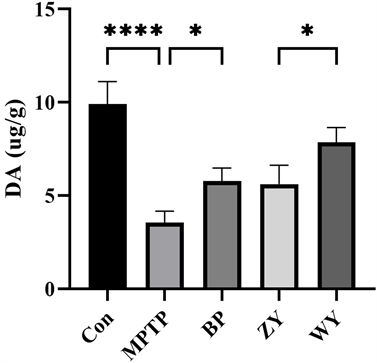
PD的主要病理改变是多巴胺能神经元的变性和死亡 [28] ,采用高效液相色谱法检测纹状体中DA的含量,可以反应多巴胺能神经元细胞的损伤和恢复情况。结果如图2所示,MPTP给药后纹状体中DA的含量明显下降(p < 0.0001),采用补脾方和滋阴方后DA含量有显著恢复(p < 0.05),温阳方的DA恢复效果显著高于滋阴方(p < 0.05)。
运动功能障碍是PD的重要症状之一 [29] ,可以反应神经细胞受损情况。我们使用rotarod对小鼠的运动协调能力进行测试,结果如图3所示,与Con组相比,MPTP组时间缩短(p < 0.0001),说明MPTP处理会加重运动障碍的情况。BP,ZY和WY组较MPTP组时间延长,且WY组较ZY组延长时间更明显(p < 0.05),结果表明,温阳和滋阴方有助于PD小鼠多巴胺含量和运动能力的恢复,且温阳方的效果更好。
3.2. 滋阴和温阳方剂促进PD小鼠纹状体酪氨酸羟化酶基因的表达, 抑制炎性细胞因子基因的表达
酪氨酸羟化酶作为合成多巴胺过程中的限速酶,是能反应多巴胺能神经元功能的重要标志。我们采用了qRT-PCR法测定纹状体中酪氨酸羟化酶基因的表达情况,基因表达的升高则可能导致相应的蛋白表达升高。结果如图4显示,纹状体中酪氨酸羟化酶基因的表达,MPTP组明显低于Con组(p < 0.0001),而BP组明显高于MPTP组(p < 0.05)。BP组和ZY组无显著差别,WY组显著高于ZY (p < 0.0001)。结果表明,在MPTP处理的PD小鼠的纹状体中,酪氨酸羟化酶基因的表达受到抑制;而滋阴和温阳方均可以促进TH表达的恢复,温阳方的效果更显著。
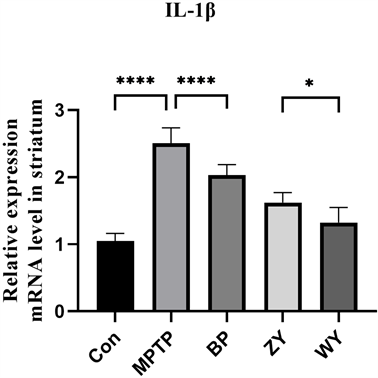
当纹状体多巴胺神经细胞受到损伤时,TNF-α及IL-1β等炎性因子的表达也会增加 [30] 。因此,我们还对纹状体中炎性细胞因子IL-1β基因的表达进行了测定。结果如图5所示,纹状体中IL-1β的含量MPTP组显著高于Con组(p < 0.0001),而BP,ZY,WY组显著低于MPTP组,且WY组显著低于ZY组(p < 0.05)。结果表明,MPTP的处理会导致纹状体中IL-1β表达增加,而滋阴和温阳方可以导致IL-1β表达减少,且温阳方效果更好。以上结果提示,对PD小鼠的滋阴和温阳方治疗具有修复MPTP造成的纹状体多巴胺能神经细胞损伤的作用。
 *P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
*P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
Figure 2. Effect of Zi Yin and Wen Yang formulae on DA content of striatum (mean ± SEM, n = 8)
图2. 滋阴方、温阳方对纹状体DA含量的影响(mean ± SEM, n = 8)
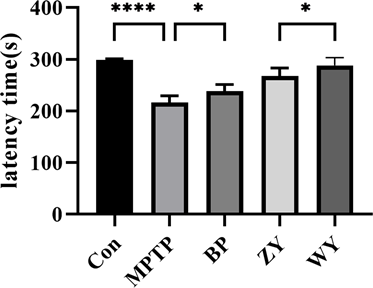 *P < 0.05 **P < 0.01 *** P < 0.001 ****P < 0.0001
*P < 0.05 **P < 0.01 *** P < 0.001 ****P < 0.0001
Figure 3. Effect of Zi Yin and Wen Yang formulae on the locomotor ability of mice (mean ± SEM, n = 8)
图3. 滋阴方、温阳方对小鼠运动能力的影响(mean ± SEM, n = 8)
 *P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
*P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
Figure 4. Effect of Zi Yin and Wen Yang formulae on tyrosine hydroxylase mRNA expression in mice (mean ± SEM, n = 8)
图4. 滋阴方、温阳方对小鼠酪氨酸羟化酶mRNA表达的影响(mean ± SEM, n = 8)
 *P < 0.05 ** P < 0.01 *** P < 0.001 **** P < 0.0001
*P < 0.05 ** P < 0.01 *** P < 0.001 **** P < 0.0001
Figure 5. Effect of Zi Yin and Wen Yang formulae on IL-1β mRNA expression in mice (mean ± SEM, n = 8)
图5. 滋阴方、温阳方对小鼠IL-1βmRNA表达的影响(mean ± SEM, n = 8)
3.3. 滋阴和温阳方剂减少PD小鼠回肠炎性细胞因子基因的表达
活化的小胶质细胞可以分泌多种炎症介质如IL-22,IL-1β和TNFα,参与PD的神经炎症的发生 [31] [32] 。因此,我们测定了小鼠的IL-22和IL-1β基因的表达水平。结果如图6所示,MPTP处理会使IL-22和IL-1β基因的表达增加,而滋阴和温阳方剂促进了IL-22基因的表达,减少了IL-1β基因的表达。因此我们认为,滋阴和温阳方剂对PD小鼠粘膜屏障功能的修复有一定的促进作用,可能通过抑制肠道内的炎症反应,进而影响肠–脑轴,促进中脑神经细胞损伤的修复。
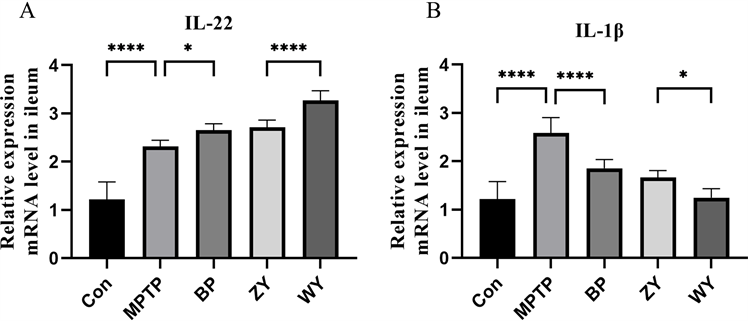
Figure 6. Inflammatory cytokine mRNA expression levels in ileum by Zi Yin and Wen Yang formulae (mean ± SEM, n = 8). (A) IL-22 mRNA expression level (B) IL-1β mRNA expression level. *P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
图6. 滋阴方、温阳方对回肠中炎性细胞因子mRNA表达水平(mean ± SEM, n = 8)。A.IL-22 mRNA表达水平B.IL-1βmRNA表达水平。*P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
3.4. 滋阴和温阳方剂改变了小鼠肠道菌群
多种疾病的发生被证实与肠道微生物群有关,肠道菌群失调发挥重要的作用 [33] 。中医的脾胃学说也认为通过调理脾胃可以调节肠道菌群 [34] ,为了进一步验证滋阴和温阳方剂对肠道菌群的影响,我们通过16s rRNA技术对各组小鼠粪便肠道菌群进行了检测。
在此分析中,首先使用classify-sklearn (Naive Bayes)算法对物种种类扩增子序列变异ASV代表序列进行分类学分析,样本序列抽平按最小样本序列数进行,获得有效序列数22,079条序列,AVS种类有1229个。
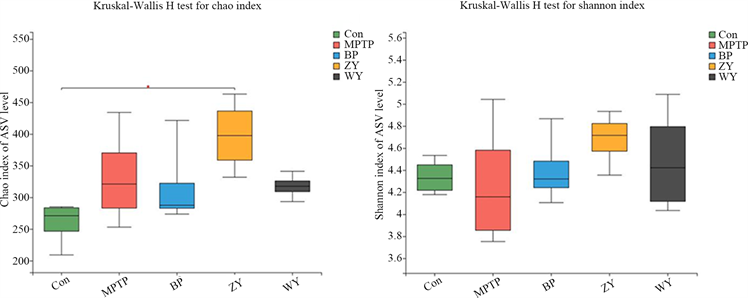
对反映群落物种α-多样性指标进行分析,在种水平上采用chao指数来观察物种的丰富度,用shannon指数来观察物种的多样性(图7)。分析结果表明,对于chao指数,滋阴组较对照组显著升高(p < 0.05);对于shannon指数,几组小鼠间无显著差异。结果提示,滋阴方剂可以增加小鼠肠道菌群群落丰富度,对多样性没有影响。
β-多样性分析中的PCoA分析可用来研究样本群落组成的相似性或差异性,两样本点越接近,表明两样本物种组成越相似。我们采用PCoA分析研究各组之间的肠道微生物的群落组成的差异情况。结果如图8所示,在ASV水平,各组肠道微生物的群落组成均存在显著的差异(R = 0.2942, P = 0.003),提示了滋阴和温阳方剂对PD小鼠肠道菌群产生了明显影响。
为了了解各组肠道菌群的结构情况,使用群落Bar图分析了各样本在某一分类学水平上微生物种类和各微生物的相对丰度。结果如图9所示,在门水平,Bacteroidota (拟杆菌门)、Actinobacteriota (放线菌门)、
 *P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
*P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.0001
Figure 7. Mouse intestinal flora species alpha-diversity index (mean ± SEM, n = 8)
图7. 小鼠肠道菌群物种α-多样性指标(mean ± SEM, n = 8)
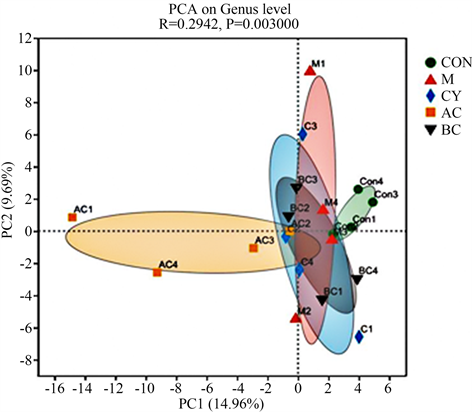
Figure 8. 2D-PCA analysis based on Bray-Curtis distance at the genus level (mean ± SEM, n = 8)
图8. 属水平上基于Bray-Curtis距离的2D-PCA分析(mean ± SEM, n = 8)
Proteobacteria (变形菌门)为小鼠的主要优势物种。在科水平上,Muribaculaceae、Lachnospiraceae (毛螺菌科)、Lactobacillaceae (乳杆菌科)、Erysipelotrichaceae、Ruminococcaceae (疣微菌科)、Prevotellaceae (普雷沃氏菌科)、Bacteroidaceae (拟杆菌科)、Rikenellaceae (理研菌科)、Helicobacteraceae、norank_o__Clostridia_UCG-014、Oscillospiraceae (颤螺菌科)、Saccharimonadaceae、Marinifilaceae、Bacillaceae (芽胞杆菌科)、Bifidobacteriaceae、Eggerthellaceae、Desulfovibrionaceae、Deferribacteraceae、unclassified_c__Bacilli、Erysipelatoclostridiaceae、Akkermansiaceae在小鼠的肠道菌群中占优势。在属水平上,主要由norank_f__Muribaculaceae、Lactobacillus (乳酸菌)、Lachnospiraceae_NK4A136_group、unclassified_f__Lachnospiraceae、Allobaculum、norank_f__ Ruminococcaceae、Bacteroides (拟杆菌)、Candidatus_Saccharimonas、unclassified_f__Prevotellaceae、Helicobacter (螺杆菌)、norank_f__norank_o__Clostridia_UCG-014、Odoribacter、Tyzzerella、Bacillus (芽孢杆菌)、Dubosiella、Bifidobacterium、Alistipes、Rikenella (理研菌属)、Anaerobiospirillum、Alloprevotella (拟普雷沃氏菌属)、Mucispirillum、Ruminococcus_torques_group、unclassified_f__Oscillospiraceae、Roseburia (氏菌属)、Eubacterium_xylanophilum_group、norank_f__Oscillospiraceae、Eubacterium_siraeum_group、Parasutterella、Streptococcus (链球菌属)、GCA-900066575构成。从群落物种组成和相对丰度来看,各组优势物种类似,但丰度有所不同,滋阴和温阳方剂对PD小鼠肠道菌群产生了明显的影响。
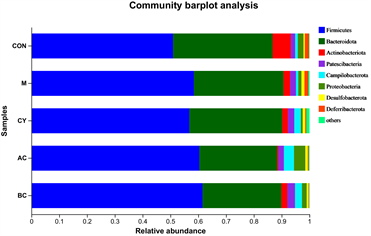
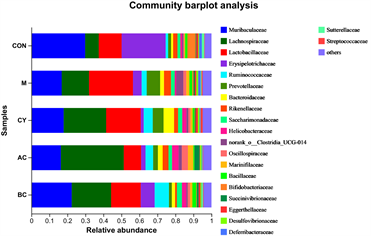
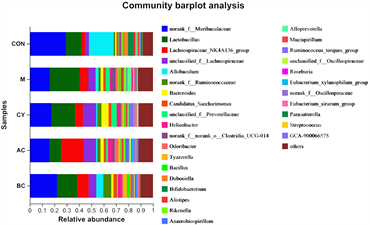
Figure 9. Composition of mouse intestinal flora at the taxonomic level of phylum, family and genus
图9. 门、科、属分类水平上的小鼠肠道菌群组成
为了了解各组肠道微生物群落之间的差异,我们在科、属水平对不同组别的样本进行方差分析比较,结果如图10所示。我们发现,在科水平上,Lachnospiraceae和Erysipelotrichaceae在各组间存在显著差异(p < 0.05);在属水平上,Allobaculum和Dubosiella的丰度具有显著性差异(p < 0.05)。
然后为了更好的研究不同方剂对MPTP小鼠肠道微生物菌群的影响情况,我们对各组之间的微生物进行了成对比较,结果如图11所示,在科水平上的两两比较发现,与Con组相比,MPTP组在Muribaculaceae和Erysipelotrichaceae(韦荣球菌科)存在显著性降低(p < 0.05);与MPTP组相比,BP组和WY组的菌科无显著性差异,ZY组则Lachnospiraceae上存在显著性增高(p < 0.05);与BP组相比,ZY组的菌科无显著性差异,WY组的Erysipelotrichaceae显著性增高(p < 0.05);与ZY组相比,WY组的Rikenellaceae(理研菌科)显著性降低(p < 0.05)。
从属分类水平上的两两比较(图12),与Con相比,MPTP组的norank_f__Muribaculaceae和Dubosiella出现显著性降低(p < 0.05),Allobaculum则出现显著性增高(p < 0.05)。BP组、ZY组和WY组分别与M组相比均无显著性差异。与BP组相比,ZY组的Lachnospiraceae_NK4A136_group显著性增高(p < 0.05),Ruminococcus_torques_group显著性降低(p < 0.05);WY组则是Allobaculum显著性增高(p < 0.05)。ZY

Figure 10. Analysis of variance for differences in mouse intestinal flora at the family and genus levels
图10. 科、属水平上的小鼠肠道菌群差异的方差分析
组与WY组相比,WY组的Allobaculum比ZY组的显著性增高(p < 0.05)。
4. 讨论
帕金森病是一种常见的神经系统退行性疾病,中老年群体中较为常见,且患病率逐年攀升,但目前暂无有效的治疗方法。中医药对帕金森病的认识和治疗不仅能弥补西药治疗的缺陷,而且与西药的联合使用能提高帕金森病的临床治疗效果,同时也能降低西药带来的不良副作用 [35] 。目前,中医主要以调整脾胃作为治疗帕金森病的常用疗法,但随着对帕金森病的深入研究,中医药专家认为“肾虚”也是帕金森病发病机制,“肾虚”又分为“肾阴虚”和“肾阳虚”两种基本证型,所以争论的论点主要围绕的是采用滋阴还是温阳的治疗方法来治疗帕金森病。
近年来,随着肠道微生态研究的发展,发现帕金森病不仅会影响动物的脑黑质纹状体中多巴胺的含量,还会导致肠道微生物群紊乱 [36] ,因此中药干预肠道菌群与帕金森病关系已成为研究热点。但关于中药干预肠道菌群与帕金森病发病机制的因果关系尚未阐明,有待进一步研究 [37] 。所以本实验利用MPTP构建亚急性帕金森病模型,在给予补脾方剂的基础上,分别使用滋阴方六味地黄丸和温阳方肾气丸来评估两种方剂对帕金森病小鼠神经损伤的保护作用和对肠道菌群的影响。
帕金森病对中枢神经系统的损伤恢复情况可以表现在酪氨酸羟化酶(TH),多巴胺转运蛋白(DAT)和神经营养因子表达增加,例如脑源性神经营养因子(BDNF)或神经胶质衍生的神经营养因子(GDNF) [38] 。我们的研究中也发现了滋阴和温阳方剂可以使PD小鼠纹状体中DA的含量增加,同时酪氨酸羟化酶基因的表达也会增加,这些改变表明滋阴和温阳方剂促进了DA神经细胞的增殖。
同时,在帕金森病病人身上可见异常的免疫反应,如免疫细胞和细胞因子的改变 [39] ,进而导致慢性炎症的发生,而肠道菌群与细胞因子浓度的改变也有关联性 [40] 。先天淋巴细胞(ILC)和CD4+T细胞可以产生IL-22,对肠道粘膜屏障的保护具有积极的作用 [41] [42] 。IL-1β可以通过多条通路诱导的肠道通透性
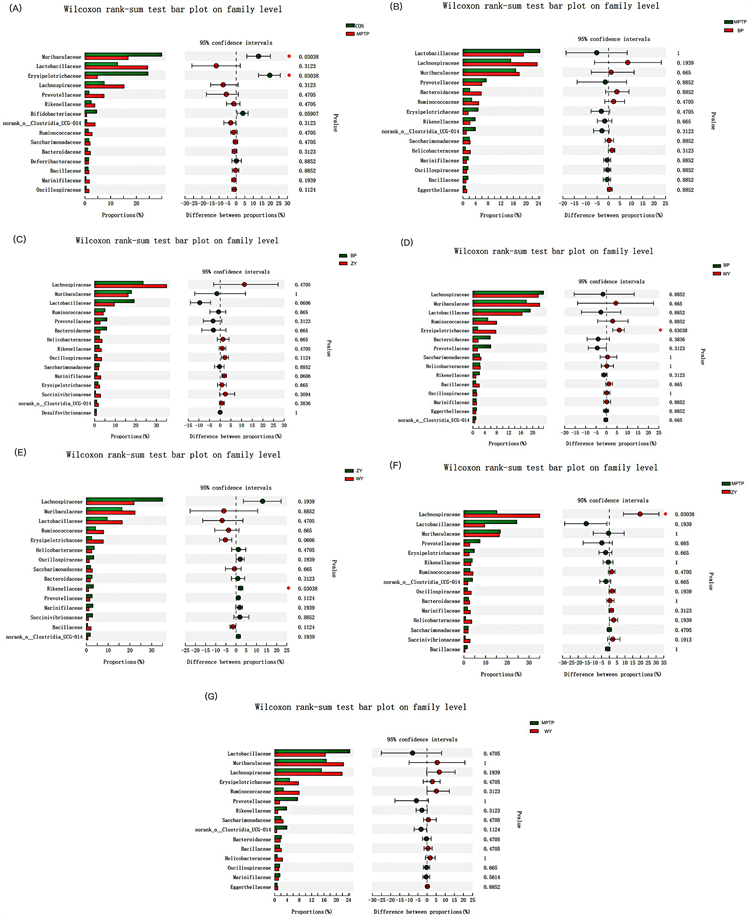
Figure 11. Two-by-two comparison at the family classification level
图11. 科分类水平上的两两比较

Figure 12. Two-by-two comparison at the taxonomic level of the genus
图12. 属分类水平上的两两比较
增加,这有助于肠道炎症反应的发生 [43] 。我们的研究发现,滋阴和温阳方剂可以抑制纹状体和回肠中IL-1β基因的表达,增加了回肠中IL-22基因的表达。
此外,滋阴和温阳方剂还可以影响小鼠肠道菌群的组成和丰度。目前认为肠道菌群的变化可以通过肠–脑轴导致α-突触核蛋白的异常聚集,进而引发帕金森病 [16] 。我们本次的研究中同样发现了滋阴和温阳方剂可以调整PD小鼠肠道菌群的丰度和多样性,并导致一些特定菌群的改变,而这些改变与健康有一定关联性。例如毛螺菌科(Lachnospiraceae)作为益生菌,能产生丁酸盐等短链脂肪酸 [44] ,在炎症疾病中会表现出丰度减少,如炎症性肠炎 [45] ,滋阴方剂则可以使其显著升高,证明炎症有所缓解。我们的研究结果说明中药方剂能缓解症状但不能完全恢复。
综上所述,我们的研究提示肾气丸的温阳配方和六味地黄丸的滋阴配方均可以改善帕金森病小鼠所产生的运动症状、肠道菌群失调、肠道炎症、肠粘膜屏障受损、DA能神经细胞损伤的情况,并且温阳配方较滋阴配方效果稍强。虽然我们的研究证明了中药方剂的疗效,但其中具体的作用机制仍有待研究,该方剂是通过什么通路发挥作用的仍需进一步实验。不同的剂量是否会对疗效有影响仍不清楚。
文章引用
代素娥,李迎丽,苏咏梅,贾 燕,肖 虹,高洁莹,唐 勇,白群华. 滋阴和温阳方剂对帕金森病小鼠神经损伤及肠道炎症和肠微生态的影响
Effects of Zi Yin and Wen Yang Formulas on Nerve Damage and Intestinal Inflammation and Intestinal Microecology in Mice with Parkinson’s Disease[J]. 中医学, 2023, 12(05): 1138-1154. https://doi.org/10.12677/TCM.2023.125172
参考文献
- 1. 左琦, 郑乾, 焦玲, 等. 特发性震颤发展为帕金森病研究进展[J]. 中国现代神经疾病杂志, 2022, 22(4): 237-242.
- 2. 何江, 刘春杰, 周灵羽, 等. 幽门螺杆菌感染对帕金森病影响的研究进展[J]. 西藏科技, 2022(4): 34-38.
- 3. Marogianni, C., Sokratous, M., Dardiotis, E., et al. (2020) Neurodegeneration and Inflammation—An Interesting Interplay in Parkinson’s Disease. International Journal of Molecular Sciences, 21, Article No. 8421. https://doi.org/10.3390/ijms21228421
- 4. Trist, B.G., Hare, D.J. and Double, K.L. (2019) Oxidative Stress in the Aging Substantia Nigra and the Etiology of Parkinson’s Disease. Aging Cell, 18, e13031. https://doi.org/10.1111/acel.13031
- 5. Dorsey, E.R., Sherer, T., Okun, M.S., et al. (2018) The Emerging Evidence of the Parkinson Pandemic. Journal of Parkinson’s Disease, 8, S3-S8. https://doi.org/10.3233/JPD-181474
- 6. Pessoa, R.R., Moro, A., Munhoz, R.P., et al. (2018) Apomorphine in the Treatment of Parkinson’s Disease: A Review. Arquivos de Neuro-Psiquiatria, 76, 840-848. https://doi.org/10.1590/0004-282x20180140
- 7. Jiménez-Urbieta, H., Gago, B., De La Riva, P., et al. (2015) Dyskinesias and Impulse Control Disorders in Parkinson’s Disease: From Pathogenesis to Potential Therapeutic Approaches. Neuroscience and Biobehavioral Reviews, 56, 294-314. https://doi.org/10.1016/j.neubiorev.2015.07.010
- 8. 米文静, 孙灵芝. 线粒体功能障碍与帕金森病的相关性及中医药对其干预作用研究进展[J]. 实用心脑肺血管病杂志, 2022, 30(6): 125-130.
- 9. 郭云霞, 杨明会. 中医药干预帕金森病实验研究进展[J]. 环球中医药, 2013, 6(10): 773-778.
- 10. 甘盼盼, 刘玲, 全毅红. 中药联合西医常规治疗帕金森病伴轻度认知功能障碍的临床有效性及安全性的Meta分析[J]. 广州中医药大学学报, 2022, 39(8): 1938-1946. https://doi.org/10.13359/j.cnki.gzxbtcm.2022.08.038
- 11. 万叶, 郭春燕, 李永民. 中药在帕金森病领域的研究进展[J]. 神经药理学报, 2017, 7(4): 36-42.
- 12. 林沛. 中医治疗帕金森病抑郁的研究进展[J]. 大众科技, 2022, 24(7): 106-108+91.
- 13. 徐展铄, 李雪蓉. 帕金森病的药物治疗进展[J]. 临床合理用药杂志, 2016, 9(25): 180-181. https://doi.org/10.15887/j.cnki.13-1389/r.2016.25.114
- 14. 叶承莉, 白群华, 苏咏梅, 等. 滋阴方与温阳方对鱼藤酮诱导PC12细胞损伤的保护作用[J]. 中医学报, 2018, 33(11): 2164-2171. https://doi.org/10.16368/j.issn.1674-8999.2018.11.511
- 15. 刘欣, 刘忠于, 陈晖娟, 等. 肠道菌群与帕金森病相关性的研究进展[J]. 结直肠肛门外科, 2020, 26(4): 410-413. https://doi.org/10.19668/j.cnki.issn1674-0491.2020.04.005
- 16. 方家瑞, 李喆, 任邑昆, 等. 肠道菌群-肠脑轴在神经退行性疾病发生和防治中的作用[J]. 郑州大学学报(医学版), 2021, 56(3): 327-331. https://doi.org/10.13705/j.issn.1671-6825.2020.06.006
- 17. 周佳文, 王正波. 基于肠脑轴传播α-突触核蛋白诱发帕金森病的研究进展[J]. 生物工程学报, 2022, 38(6): 2120-2127. https://doi.org/10.13345/j.cjb.210822
- 18. Scheperjans, F., Aho, V., Pereira, P., et al. (2015) Gut Microbiota Are Related to Parkinson’s Disease and Clinical Phenotype. Movement Disorders: Official Journal of the Movement Disorder Society, 30, 350-358. https://doi.org/10.1002/mds.26069
- 19. Unger, M.M., Spiegel, J., Dillmann, K.-U., et al. (2016) Short Chain Fatty Acids and Gut Microbiota Differ between Patients with Parkinson’s Disease and Age-Matched Controls. Parkinsonism & Related Disorders, 32, 66-72. https://doi.org/10.1016/j.parkreldis.2016.08.019
- 20. Keshavarzian, A., Green, S.J., Engen, P.A., et al. (2015) Colonic Bacterial Composition in Parkinson’s Disease. Movement Disorders: Official Journal of the Movement Disorder Society, 30, 1351-1360. https://doi.org/10.1002/mds.26307
- 21. 段智璇, 田维毅. 中药对肠道菌群及肠黏膜屏障功能的影响[J]. 内蒙古医学杂志, 2016, 48(9): 1053-1057. https://doi.org/10.16096/J.cnki.nmgyxzz.2016.48.09.010
- 22. 殷琳, 夏文睿, 黄国鑫, 等. 中药-肠道菌群互作与宿主自身代谢免疫稳态相关性的研究进展[J]. 中草药, 2022, 53(8): 2526-2538.
- 23. 柯群华, 彭晶, 王胜义. 中药与肠道菌群及其代谢相关研究进展[J]. 中兽医医药杂志, 2022, 41(2): 35-40. https://doi.org/10.13823/j.cnki.jtcvm.2022.02.007
- 24. 王丝雨, 陆艳, 何玲, 等. 中药对肠黏膜免疫调节作用的研究进展[J]. 贵州中医药大学学报, 2021, 43(6): 70-73+87. https://doi.org/10.16588/j.cnki.issn2096-8426.2021.06.015
- 25. 梁小瑞, 王丹阳, 乔彦杰, 等. 三味清热类中药水提物对肉仔鸡肠道菌群和黏膜屏障功能的影响[J]. 中国畜牧兽医, 2020, 47(7): 2043-2054. https://doi.org/10.16431/j.cnki.1671-7236.2020.07.009
- 26. 边甜甜, 司昕蕾, 牛江涛, 等. 脾气虚证与肠道菌群的相关性及健脾益气中药对肠道菌群的调节作用研究进展[J]. 中药药理与临床, 2022, 38(5): 212-217. https://doi.org/10.13412/j.cnki.zyyl.20210924.002
- 27. Xie, W., Gao, J., Jiang, R., et al. (2020) Twice Subacute MPTP Administrations Induced Time-Dependent Dopaminergic Neurodegeneration and Inflammation in Midbrain and Ileum, as Well as Gut Microbiota Disorders in PD Mice. Neurotoxicology, 76, 200-212. https://doi.org/10.1016/j.neuro.2019.11.009
- 28. 曹凌晓, 董威, 李渊, 等. 帕金森病合并脑小血管病人脑组织病理学分析: 附一例报告并文献复习[J]. 中国现代神经疾病杂志2021, 21(4): 255-261.
- 29. 张杨, 蒋森, 刘娜, 等. 早期帕金森病患者步态特征定量分析[J]. 中国实用神经疾病杂志, 2021, 24(24): 2145-2151.
- 30. 王蓉, 欧阳敏, 张萍, 等. 帕金森病小鼠黑质纹状体小胶质细胞活化表达的炎性因子与多巴胺含量的关系[J]. 中国老年学杂志, 2014, 34(10): 2768-2770.
- 31. 邵方泽, 梁世倩, 秦鸿雁. 小胶质细胞在帕金森病中的作用及其研究进展[J]. 神经解剖学杂志, 2020, 36(5): 565-569. https://doi.org/10.16557/j.cnki.1000-7547.2020.05.015
- 32. Morel, L., Domingues, O., Zimmer, J., et al. (2020) Revisiting the Role of Neurotrophic Factors in Inflammation. Cells, 9, Article No. 865. https://doi.org/10.3390/cells9040865
- 33. 秦丽清, 吴林, 潘艺彬, 等. 基于肠道菌群探讨从脾胃论治帕金森病[J]. 辽宁中医药大学学报, 2022, 24(10): 98-102. https://doi.org/10.13194/j.issn.1673-842x.2022.10.020
- 34. 张佳丽, 梁翌, 赵晓峰. 基于肠道菌群探讨脾胃为后天之本[J]. 中国中医药信息杂志, 2020, 27(10): 21-25. https://doi.org/10.19879/j.cnki.1005-5304.201905247
- 35. Yang, Y., Qiu, W.Q., Hao, Y.L., et al. (2015) The Efficacy of Traditional Chinese Medical Exercise for Parkinson’s Disease: A Systematic Review and Meta-Analysis. PLOS ONE, 10, e0122469. https://doi.org/10.1371/journal.pone.0122469
- 36. Nielsen, S.D., Pearson, N.M. and Seidler, K. (2021) The Link between the Gut Microbiota and Parkinson’s Disease: A Systematic Mechanism Review with Focus on α-Synuclein Transport. Brain Research, 1769, Article ID: 147609.
- 37. 路晓娟, 李会芳, 李东明, 等. 地黄饮子对肾虚证帕金森病小鼠的肠道菌群调节作用研究[J]. 时珍国医国药, 2021, 32(6): 1316-1320.
- 38. 常学辉, 张良芝, 黎民. 龟羚帕安丸对帕金森病大鼠神经干细胞移植后中脑黑质TH、GDNF、Ptx3表达的影响[J]. 中成药, 2018, 40(8): 1681-1686.
- 39. 贺燕. 外周血免疫相关细胞及细胞因子与帕金森病相关性分析[D]: [硕士学位论文]. 南昌: 南昌大学, 2021.
- 40. 王雅萍, 王晓丹, 叶佳. 首发抑郁症中青年患者肠道菌群与细胞因子的关联性研究[J]. 山西医药杂志, 2021, 50(8): 1303-1305.
- 41. Keir, M., Yi, T., Lu, T., et al. (2020) The Role of IL-22 in Intestinal Health and Disease. The Journal of Experimental Medicine, 217, e20192195. https://doi.org/10.1084/jem.20192195
- 42. Yang, W., Yu, T., Huang, X., et al. (2020) Intestinal Microbiota-Derived Short-Chain Fatty Acids Regulation of Immune Cell IL-22 Production and Gut Immunity. Nature Communications, 11, Article No. 4457. https://doi.org/10.1038/s41467-020-18262-6
- 43. Kaminsky, L.W., Al-Sadi, R. and Ma, T.Y. (2021) IL-1β and the Intestinal Epithelial Tight Junction Barrier. Frontiers in Immunology, 12, Article ID: 767456. https://doi.org/10.3389/fimmu.2021.767456
- 44. Li, H., Xiang, Y., Zhu, Z., et al. (2021) Rifaximin-Mediated Gut Microbiota Regulation Modulates the Function of Microglia and Protects against CUMS-Induced Depression-Like Behaviors in Adolescent Rat. Journal of Neuroinflammation, 18, Article No. 254. https://doi.org/10.1186/s12974-021-02303-y
- 45. Romano, S., Savva, G.M., Bedarf, J.R., et al. (2021) Meta-Analysis of the Parkinson’s Disease Gut Microbiome Suggests Alterations Linked to Intestinal Inflammation. NPJ Parkinson’s Disease, 7, Article No. 27. https://doi.org/10.1038/s41531-021-00156-z