Hans Journal of Biomedicine
Vol.
09
No.
01
(
2019
), Article ID:
28514
,
7
pages
10.12677/HJBM.2019.91004
bFGF-Chitosan Accelerates Its Differentiation into Nerve Cells by Recruiting Bone Marrow Mesenchymal Stem Cells
Manli Li, Xiaoguang Li*
Beijing Key Laboratory for Biomaterials and Neural Regeneration, School of Biological Science and Medical Engineering, Beihang University, Beijing

Received: Dec. 28th, 2018; accepted: Jan. 11th, 2019; published: Jan. 18th, 2019

ABSTRACT
Objective: To investigate the induction of MSC into nerve cells and its process by bFGF-chitosan. Methods: Adult rat bone marrow mesenchymal stem cells were cultured with bFGF-chitosan and soluble bFGF respectively, and their differentiation behavior was analyzed by means of nestin, Tuj-1 and MAP2. Calcium imaging technique was used to identify its nerve cell function. Results: At 19 days of induction, a large number of neurospheres could be found in the bFGF-chitosan group, and a small amount of neurospheres could be observed in the single soluble bFGF and conditional culture group. Continued culture was able to observe a large number of Tuj-1 positive cells in the bFGF-chitosan group and concentrate near bFGF-chitosan. MAP2 positive cells can be observed at 40 days of culture and calcium transient phenomena can be observed. Conclusion: bFGF-chitosan can induce MSC as a functional nerve cell by inducing it as a neurosphere structure.
Keywords:Bone Mesenchymal Stem Cells, Neurosphere, Neuron, bFGF-Chitosan, Calcium Imaging
bFGF-Chitosan通过招募骨髓间充质干细胞加速其向神经细胞分化进程
李曼丽,李晓光*
北京航空航天大学生物医学工程学院生物材料与神经再生北京重点实验室,北京

收稿日期:2018年12月28日;录用日期:2019年1月11日;发布日期:2019年1月18日

摘 要
目的:探讨bFGF-chitosan将MSC诱导为神经细胞及其过程。方法:成年大鼠骨髓间充质干细胞分别与bFGF-chitosan和单纯可溶性bFGF共培养,利用nestin,Tuj-1,MAP2等指标分析其分化行为。并利用钙成像技术鉴定其具有神经细胞功能。结果:在诱导19天时在bFGF-chitosan组中能够发现大量神经球样结构,在单纯可溶性bFGF和条件培养基组中能够观察到少量神经球样结构。继续培养能够在bFGF-chitosan组中观察到大量Tuj-1阳性细胞存在并聚集在bFGF-chitosan附近。培养40天时能够观察到MAP2阳性细胞,并能够观察到钙瞬变现象。结论:bFGF-chitosan能够通过将MSC诱导为神经球样结构诱导为具有功能的神经细胞。
关键词 :骨髓间充质干细胞,神经球,神经元,bFGF-Chitosan,钙成像

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
神经元丢失,失能的不可逆一直以来是导致神经系统损伤或是神经退行性疾病不能治愈的最关键原因。近年来,人们尝试使用细胞移植的方法,替代丢失或是失能的神经元。这种替代细胞一般来自胚胎干细胞,诱导多能干细胞或是神经干细胞。但上述细胞的来源及其免疫,伦理等问题一直没有得到解决 [1] [2] 。
MSC作为中胚层起源的细胞,具有多向分化潜能。能够分化为骨,脂肪和软骨细胞 [3] [4] [5] [6] 。能够在β-巯基乙醇(β-mercaptoethanol, BME)的诱导条件下分化为NSE,NF阳性细胞 [7] [8] 。其来源广泛,可以取自自体。这就解决了免疫,伦理等问题 [9] [10] 。
bFGF为成纤维细胞生长因子(fibroblast growth factor, FGF)家族中的一员,在促进神经发育,伤口愈合,血管生成等方面发挥着重要作用。先前有报道称,外源添加bFGF能够将人源MSC诱导分化为神经细胞,并具有电生理特性。但其添加bFGF的方式为通过外源直接添加bFGF,这种给药方式显然不适用于临床。并且,诱导分化比例较低。这也是导致这种技术不能应用于临床的主要原因 [11] 。
我们的研究拟采用bFGF-chitosan载体将bFGF于生物可降解材料chitosan结合,使其适用于临床研究。并研究了其分化过程。并将利用钙成像技术证实其是否具有神经元特有的钙瞬变现象。
2. 材料方法
2.1. 骨髓间充质干细胞的提取和纯化
无菌条件下取成年大鼠股骨和胫骨,去除肌肉筋膜等剪断骨两端暴露骨髓,利用注射器吸取含10% FBS的DMEM冲洗骨髓。将骨髓冲出后吹打数次,使细胞分散成单细胞为P0代。24小时后全换液。此后每三天换液一次,待细胞生长至80%~90%时,用胰酶消化传代,传代比例为1传2,为P2代。待传至P3待备用。
2.2. 神经谱系细胞诱导
取P3代细胞,以105密度种植于多聚赖氨酸包被的盖玻片上,更换培养基为DMEM/F12含有B27和bFGF,EGF。分三组诱导分别为,bFGF-chitosan组为在培养体系中添加20 ng bFGF-chitosan,bFGF组为在培养体系中一次性添加20 ng bFGF,条件培养基组为不添加其他诱导条件。每2~3天半量换液。
2.3. 免疫细胞化学
相应诱导时间点时,PBS缓冲液清洗细胞3次每次5分钟。之后用4%的多聚甲醛于4˚条件下固定30分钟。PBS洗掉多余多聚甲醛后,0.3% PBST处理5分钟破膜。10% NGS于37˚条件下封闭细胞30分钟。10% NGS稀释抗体至工作浓度滴加至细胞上于4˚条件下孵育过夜。恢复室温后,PBS洗掉多余一抗,10% NGS稀释二抗至工作浓度并滴加至细胞上于37度条件下孵育60分钟。恢复室温后,PBS洗掉多余二抗后DAPI染核。于显微镜下观察并拍照。
2.4. 钙成像检测
诱导后的细胞用HBSS溶液洗3次,洗掉培养基。去掉HBSS溶液后加入2 ml fluo-4AM溶液于37℃下孵育40分钟。HBSS洗掉多余染料后避光条件下静置30 min后于激发光488下观察绿色钙信号变化。
3. 结果
3.1. 不同诱导条件下MSC向神经球发育的情况
我们将P3代MSC分别在不同的诱导条件下诱导19天,观察其向神经球样结构分化的表现。图1中可以发现其中bFGF-chitosan诱导条件下神经球的数目有所增加相比soluble bFGF组和CM组。其中bFGF诱导条件下并没有增加神经球的数目,而是增加了神经球最大直径。综上,bFGF-chitosan 结合了bFGF的诱导功能,即能够将MSC诱导为神经球样结构,同时还控制了神经球的大小,是的更多的细胞走向分化。
3.2. bFGF-chitosan能够招募Tuj-1阳性细胞
随着诱导时间的增加,我们检测了各培养条件下幼稚神经元标志物Tuj-1的表达情况。从图2中可以看出,soluble bFGF处理MSC 21天时,能够检测到Tuj-1阳性细胞的存在,开始细胞分散存在,bFGF-chitosan处理MSC时细胞同样开始分散存在,开始失去神经球样结构但细胞还是在载体附近聚集。说明载体具有招募细胞的功能。这对细胞功能的实现是非常重要的。神经球中细胞的分散是细胞开始分化的标志,细胞分散状态一定程度上代表了细胞分化能力。从C中可以看到Soluble bFGF和bFGF-chitosan处理MSC时细胞其细胞分化能力还是有区别的,bFGF-chitosan中Tuj-1阳性细胞明显要比soluble bFGF组数量要多,且差异明显。当然Tuj-1为幼稚神经元marker,随着发育的进展,幼稚神经元趋于成熟,其表达量将有所降低。从D中可以看出随着诱导时间的增加Tuj-1的RNA水平在诱导4 w时都开始有所降低。但从总量看,bFGF-chitosan组要比soluble bFGF组要多。数据未统计。
3.3. bFGF加速了MSC向神经细胞分化的进程
根据上述结果在培养四周后能同时检测到nestin和Tuj-1阳性的细胞存在,这其中存在nestin单阳性,即只表达nestin不表达Tuj-1的细胞,Tuj-1单阳性即只表达Tuj-1的细胞,还存在有能够同时表达nestin和Tuj-1的细胞。但比较A,B两图可以发现,soluble bFGF组大部分细胞即80%以上的细胞是表达nestin,而bFGF-chitosan组的细胞只有不到40%的细胞表达nestin,soluble bFGF组有不到20%的细胞表达幼稚神经元marker Tuj-1,而这个数量在bFGF-chitosan组中则达到了40%以上,nestin和Tuj-1双阳性细胞在soluble bFGF组中为20%左右,而bFGF-chitosan组中只有10%左右。这些结果说明,MSC在向神经细胞分化的过程中是具有异质性的,其分化是不均衡的。bFGF-chitosan组的分化进程要明显快于soluble bFGF组的(图3)。
 A:不同诱导条件下MSC分化为神经球样结构的不同表现。B:不同诱导条件下神经球样结构的数量统计。C:不同诱导条件下神经球样结构的最大直径的数量统计。A图中从左至右scale bar分别为500 μm,200 μm,100 μm,50 μm。
A:不同诱导条件下MSC分化为神经球样结构的不同表现。B:不同诱导条件下神经球样结构的数量统计。C:不同诱导条件下神经球样结构的最大直径的数量统计。A图中从左至右scale bar分别为500 μm,200 μm,100 μm,50 μm。
Figure 1. MSC differentiation into neurosphere-like structures at different induction conditions after 19 days
图1. 不同诱导条件诱导19天MSC分化为神经球样结构的不同表现
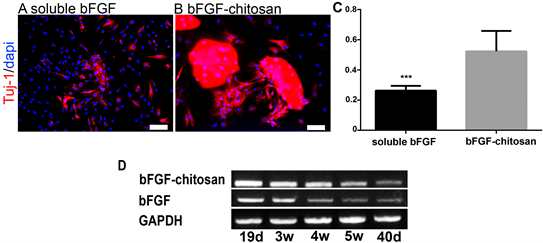 A:soluble bFGF处理21天时幼稚神经元marker Tuj-1的表达水平。B:bFGF-chitosan处理20天时Tuj-1表达水平。Scale bar 100 μm。C:soluble bFGF和bFGF-chitosan处理MSC时Tuj-1阳性细胞的数据统计。D:RT-PCR检测soluble bFGF和bFGF-chitosan处理时19 d,3 w,4 w,5 w,40 d时Tuj-1RNA水平的表达。
A:soluble bFGF处理21天时幼稚神经元marker Tuj-1的表达水平。B:bFGF-chitosan处理20天时Tuj-1表达水平。Scale bar 100 μm。C:soluble bFGF和bFGF-chitosan处理MSC时Tuj-1阳性细胞的数据统计。D:RT-PCR检测soluble bFGF和bFGF-chitosan处理时19 d,3 w,4 w,5 w,40 d时Tuj-1RNA水平的表达。
Figure 2. bFGF-chitosan has the function of recruiting cells to differentiate cells
图2. bFGF-chitosan具有招募细胞分化细胞的功能
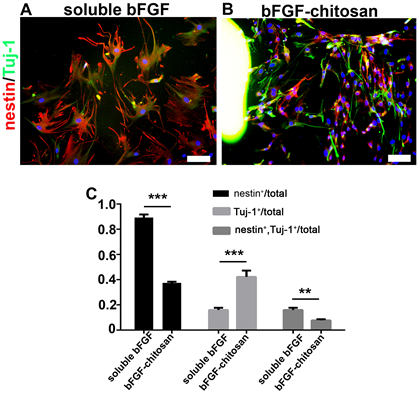 A:soluble bFGF 处理细胞4 w条件神经干细胞marker nestin和幼稚神经元marker Tuj-1的表达情况。B:bFGF-chitosan处理细胞4 w条件下神经干细胞marker nestin和幼稚神经元marker Tuj-1的表达情况。bFGF-chitosan处理条件能够加速MSC向神经细胞分化进程。Scale bar 100 μm。
A:soluble bFGF 处理细胞4 w条件神经干细胞marker nestin和幼稚神经元marker Tuj-1的表达情况。B:bFGF-chitosan处理细胞4 w条件下神经干细胞marker nestin和幼稚神经元marker Tuj-1的表达情况。bFGF-chitosan处理条件能够加速MSC向神经细胞分化进程。Scale bar 100 μm。
Figure 3. bFGF-chitosan accelerates the differentiation process
图3. bFGF-chitosan加速了分化进程
3.4. bFGF-chitosan能够将MSC诱导分化为成熟神经元
接下来我们又研究了MSC在不同诱导条件下分化为成熟神经元marker MAP2的情况。图4中我们发现,bFGF和bFGF-chitosan组都能够诱导成熟神经元marker MAP2表达,但从数量上看,bFGF-chitosan组要比bFGF组要多,且差异显著。我们又检测了各组中MAP2阳性细胞的钙信号的变化。bFGF-chitosan中在相差显微镜下可以看到部分细胞具有神经元形态,具有较长突起。钙信号在较短时间内有较大变化,出现了钙瞬变这种神经细胞特有的钙信号变化特征。说明bFGF-chitosan诱导的MAP2为功能性神经元。Soluble bFGF组中没有观察到钙瞬变现象。这表明,bFGF对于MSC分化为神经元为必须,但bFGF-chitosan能够诱导MSC为功能性神经元。
4. 讨论
神经元丢失,失能的不可逆一直以来是导致神经系统损伤或是神经退行性疾病不能治愈的最关键原因。近年来,人们尝试使用细胞移植的方法,替代丢失或是失能的神经元。这种替代细胞一般来自胚胎干细胞,诱导多能干细胞或是神经干细胞。但上述细胞的来源及其免疫,伦理等问题一直没有得到解决。MSC作为中胚层起源的细胞,具有多向分化潜能。能够分化为骨,脂肪和软骨细胞。先前有报道称MSC能够在bFGF的诱导条件下分化为神经细胞。其来源广泛,可以取自自体。这就解决了免疫,伦理等问题。但先前的报道中通过外源直接添加bFGF,这种给药方式不适用于临床。并且,诱导分化比例较低。我们的研究采用bFGF-chitosan载体将bFGF于生物可降解材料chitosan结合,使其适用于临床研究。并研究了其分化过程,发现bFGF-chitosan能够将MSC诱导为神经球样细胞,进而分化为神经元,并且通过钙成像技术,观察到了钙瞬变这种神经细胞特有的现象。我们的研究解决了外源bFGF给药不便的难题,并阐明了MSC分化为神经细胞的过程。为MSC应用临床治疗神经系统损伤和神经退行性疾病提供了理论和现实依据。
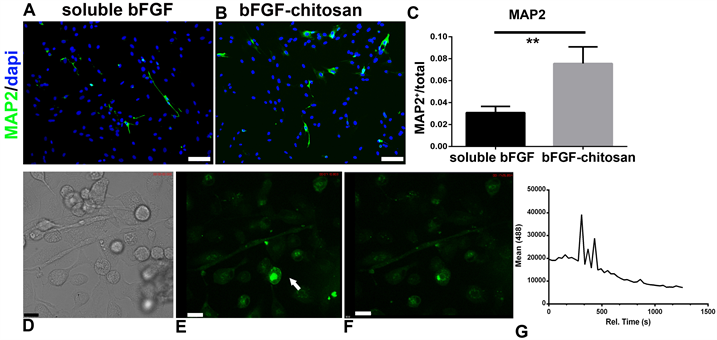 A:MSC在soluble bFGF诱导40天时MAP2表达情况。B:MSC在bFGF-chitosan诱导40天时MAP2表达情况。C:各组诱导条件下MAP2阳性细胞统计结果。D~G:钙成像技术检测神经元功能。D:相差显微镜下细胞形态。E~F:不同时间下细胞钙信号强度。G:不同时间下该信号强度的统计。Scale bar:A~B,100 μm,D~F:16微米。D,E:图中白色箭头所示为钙信号有明显变化的细胞。
A:MSC在soluble bFGF诱导40天时MAP2表达情况。B:MSC在bFGF-chitosan诱导40天时MAP2表达情况。C:各组诱导条件下MAP2阳性细胞统计结果。D~G:钙成像技术检测神经元功能。D:相差显微镜下细胞形态。E~F:不同时间下细胞钙信号强度。G:不同时间下该信号强度的统计。Scale bar:A~B,100 μm,D~F:16微米。D,E:图中白色箭头所示为钙信号有明显变化的细胞。
Figure 4. Differentiation of MSC into functional mature neurons under different induction conditions
图4. MSC在不同诱导条件下分化为功能性成熟神经元的情况
发现bFGF-chitosan能够将MSC诱导为神经球样细胞,进而分化为神经元,并且通过钙成像技术,观察到了钙瞬变这种神经细胞特有的现象。我们的研究解决了外源bFGF给药不便的难题,并阐明了MSC分化为神经细胞的过程。为MSC应用用临床治疗神经系统损伤和神经退行性疾病提供了理论和现实依据。
神经球样细胞是神经干细胞在体外存在的一种非粘附性聚集体方式,具有分化为神经元,星形胶质细胞,少突胶质细胞等神经细胞的能力 [12] [13] 。不同的培养方法,诱导方式都能够将其诱导分化。Nestin和sox2通常作为神经干细胞的marker被用来检测其是否为神经干细胞。神经球样结构直径的增加从一定程度上增加了聚集细胞的数量,必然会导致处于球状结构中间的细胞由于接触不到营养物质导致死亡,这一点由图A中神经球样结构内部细胞染色结构可以看出,中间细胞大多数是nestin阴性的结果,这些细胞由于接触不到营养物质导致不能分化为nestin阳性细胞,随着时间的发展可能会导致细胞死亡。另外,神经球样结构数目的增多可能会从物理空间上使得更多的分化细胞之间能够建立连接,这也为后来形成突触样结构建立了基础。Andreas Hermann等人于2016年总结了几种不同的方法来培养MSC向神经内皮细胞分化。其中方法4采用了低氧结合20 ng EGF和bFGF的培养10~20天的方法(5% CO2, 92% N2, and 3% O2 (protocol 4))将MSC分化为神经球样结构并能检测到Tuj-1,GFAP阳性细胞但是并不能检测到MAP2阳性的细胞 [14] 。
我们在条件培养基组,可溶性bFGF组和bFGF-chitosan组中都检测到了神经干细胞标志物nestin阳性的细胞,说明在正常培养状态下,MSC能够自发的分化为神经干细胞。bFGF能够诱导形态特征更明显的神经球的产生。其直径有了明显的增加,随着诱导时间的增加,这些神经球样结构在可溶性bFGF诱导组同样也能够检测到极少量幼稚神经元的标志物Tuj-1阳性细胞和少量成熟神经元特征物MAP2阳性细胞,而在bFGF-chitosan诱导下,检测到了大量Tuj-1阳性和MAP2阳性细胞并且应用钙成像技术检测到了神经元特异性的钙瞬变现象。这说明bFGF-chitosan能够将骨髓间充质干细胞诱导为具有功能的神经细胞。其诱导过程遵循了干细胞,幼稚神经元,成熟神经元的发育规律。为细胞移植治疗神经退行性疾病和神经损伤提供了理论基础。
基金项目
国家自然科学基金资助项目(31730030, 31650001, 31670988, 31320103903, 31771053)。
文章引用
李曼丽,李晓光. bFGF-Chitosan通过招募骨髓间充质干细胞加速其向神经细胞分化进程
bFGF-Chitosan Accelerates Its Differentiation into Nerve Cells by Recruiting Bone Marrow Mesenchymal Stem Cells[J]. 生物医学, 2019, 09(01): 23-29. https://doi.org/10.12677/HJBM.2019.91004
参考文献
- 1. Yang, Z.Y., Zhang, A.F., Duan, H.M., Zhang, S., Hao, P., Ye, K.Q., Sun, Y.E. and Li, X.G. (2015) NT3-Chitosan Elicits Robust Endogenous Neurogenesis to Enable Functional Recovery after Spinal Cord Injury. Proceedings of the National Academy of Sciences of the United States of America, 112, 13354-13359. https://doi.org/10.1073/pnas.1510194112
- 2. Duan, H.M., Ge, W.H., Zhang, A.F., Xi, Y., Chen, Z.H., Luo, D.D., Cheng, Y., Fan, K.S., Horvath, S., Sofroniew, M.V., Cheng, L.M., Yang, Z.Y., Sun, Y.E. and Li, X.G. (2015) Transcriptome Analyses Reveal Molecular Mechanisms Underlying Functional Recovery after Spinal Cord Injury. Proceedings of the National Academy of Sciences of the USA, 112, 13360-13365. https://doi.org/10.1073/pnas.1510176112
- 3. Pittenger, M.F., Mackay, A.M., Beck, S.C., et al. (1999) Multilineage Potential of Adult human Mesenchymal Stem Cells. Science, 284, 143-147. https://doi.org/10.1126/science.284.5411.143
- 4. Ding, Z., Liu, X., Ren, X., et al. (2016) Galectin-1-Induced Skeletal Muscle Cell Differentiation of Mesenchymal Stem Cells Seeded on an Acellular Dermalmatrix Improves Injured Anal Sphincter. Discovery Medicine, 21, 331-340.
- 5. Özdal-Kurt, F., Tuğlu, I., Vatansever, H.S., et al. (2016) The Effect of Different implant Biomaterials on the Behavior of Canine Bone Marrow Stromal Cells during Their Dif-ferentiation into Osteoblasts. Biotechnic & Histochemistry, 91, 412-422. https://doi.org/10.1080/10520295.2016.1183819
- 6. Zhang, L.Y., Xue, H.G. and Chen, J.Y. (2016) Genistein Induces Adipogenic Differentiation in Human Bone Marrow Mesenchymal Stem Cells and Suppressestheir Osteogenic Potential by Upregulating PPARγ. Experimental and Therapeutic Medicine, 11, 1853-1858. https://doi.org/10.3892/etm.2016.3120
- 7. Kokai, L.E., Rubin, J.P. and Marra, K.G. (2005) The Potential of Adipose-Derived Adultstem Cells as a Source of Neuronal Progenitor Cells. Plastic and Reconstructive Surgery, 116, 1453-1460. https://doi.org/10.1097/01.prs.0000182570.62814.e3
- 8. Zhou, S., Eid, K. and Glowacki, J. (2004) Cooperation between TGF-Beta and Wntpathways during Chondrocyte and Adipocyte Differentiation of Human Marrow Stromal Cells. Journal of Bone and Mineral Research, 19, 463-470. https://doi.org/10.1359/JBMR.0301239
- 9. Oliveira, J.M., Rodrigues, M.T., Silva, S.S., et al. (2006) Novel Hy-droxyapatite/Chitosan Bilayered Scaffold for Osteochondral Tissue-Engineering Applications: Scaffold Design and Its Performance When Seeded with Goat Bonemarrow Stromal Cells. Biomaterials, 27, 6123-6137. https://doi.org/10.1016/j.biomaterials.2006.07.034
- 10. Traktuev, D.O., Parfenova, E.V., Tkachuk, V.A., et al. (2006) Adipose Stromalcells-Plastic Type of Cells with High Therapeutic Potential. Tsitologiia, 48, 83-94.
- 11. Woodbury, D., Schwarz, E.J., Prockop, D.J., et al. (2000) Adult Rat and Humanbone Marrow Stromal Cells Differentiate into Neurons. Journal of Neuroscience Research, 61, 364-370. https://doi.org/10.1002/1097-4547(20000815)61:4<364::AID-JNR2>3.0.CO;2-C
- 12. Reynolds, B.A. and Weiss, S. (1992) Generation of Neurons and Astrocytesfrom Isolated Cells of the Adult Mammalian Central Nervous System. Science, 255, 1707-1710. https://doi.org/10.1126/science.1553558
- 13. Reynolds, B.A. and Weiss, S. (1996) Clonal and Population Analyses Demonstrate That an EGF-Responsive Mammalian Embryonic CNS Precursor Is a Stem Cell. Developmental Biology, 175, 1-13. https://doi.org/10.1006/dbio.1996.0090
- 14. Hermann, A., Liebau, S., Gastl, R., Fickert, S. and Schwarz, J. (2006) Comparative Analysis of Neuroectodermal Differentiation Capacity of Human Bone Marrow Stromal Cells Using Various Conversion Protocols. Journal of Neuroscience Research, 83, 1502-1514. https://doi.org/10.1002/jnr.20840
NOTES
*通讯作者。