Hans Journal of Biomedicine
Vol.
09
No.
04
(
2019
), Article ID:
32720
,
8
pages
10.12677/HJBM.2019.94025
Eukaryotic Expression and Purification of Mature Bovine Neutrophil β-Defensins 4
Jingjing Kang, Yuchen Wu, Zhengxing Yin, Qin Luo, Jun Huo*
Department of Veterinary Medicine, Henan University of Animal Husbandry and Economy (Longzihu Campus), Zhengzhou Henan

Received: Oct. 9th, 2019; accepted: Oct. 22nd, 2019; published: Oct. 29th, 2019

ABSTRACT
Bovine neutrophil β-defensins 4 (BNBD4) is one of the antimicrobial peptides which naturally exists in bovine pulmonary alveolar macrophages. In this study we will clone the CDs sequence of mature BNBD4 gene, and connect it to the eukaryotic expression vector pPIC9K to construct recombinant plasmid mBNBD4-pPIC9K, and purify it by Ni-sepharose after inducing expression. Finally, we can successfully obtain the recombinant protein mBNBD4 by Tricine SDS-PAGE detection and Western Blot identify, therefore to provide the experimental materials for the further study of mature BNBD4.
Keywords:Defensins, BNBD4, Mature Peptide, Eukaryotic Expression, Purification
牛防御素BNBD4成熟肽的真核表达及纯化
康静静,吴玉臣,阴正兴,罗琴,霍军*
河南牧业经济学院动物医药学院(龙子湖校区),河南 郑州

收稿日期:2019年10月9日;录用日期:2019年10月22日;发布日期:2019年10月29日

摘 要
牛β防御素4 (BNBD4)是一种天然存在于牛肺脏肺泡巨噬细胞内的抗菌肽,本研究拟通过克隆BNBD4成熟肽片段的编码区序列,连接至真核表达载体pPIC9K构建重组质粒mBNBD4-pPIC9K,转化至毕赤酵母菌株GS115诱导表达,镍柱纯化后,经Tricine-SDS-PAGE检测和Western Blot鉴定,成功获取重组蛋白mBNBD4,为进一步研究牛防御素BNBD4的作用机制提供试验材料。
关键词 :防御素,BNBD4,成熟肽,真核表达,纯化

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
防御素是阳离子抗菌肽(Antimicrobial peptides, AMPs)中最常见的类型之一 [1] [2] ,和其它抗菌分子一起存储于嗜中性粒细胞和巨噬细胞的细胞质颗粒中,通过上皮细胞被分泌至细胞外环境中发挥作用,因此防御素作为宿主早期防御系统的成员具有重要的抗感染作用 [3] 。1991年,β-防御素在牛舌上皮细胞中被首次发现 [4] ,随后又从牛中性粒细胞中分离到其它13种β-防御素 [5] 。研究已证实牛肺泡巨噬细胞中共检测到4种β-防御素基因的表达,其中就包括BNBD4 [6] ,并且关于抗菌肽在分枝杆菌感染患者中的表达情况也说明抗菌肽类物质(包括防御素)具有发展成为新型抗结核药物的可能性 [7] [8] [9] 。
本研究拟采用真核表达的方法获取重组蛋白mBNBD4,并通过镍柱纯化,以及Tricine-SDS-PAGE和Western Blot方法检测验证,为后续进一步研究BNBD4的作用机制提供试验材料。
2. 材料和方法
2.1. 材料
毕赤酵母宿主菌株GS115,购自中国质粒载体菌株细胞株基因保藏中心;pPIC9K毕赤酵母表达载体,购自美国invitrogen公司;无内毒素质粒DNA大量提取试剂盒,购自美国OMEGA公司;遗传霉素G418 (Geneticin),购自美国INALCO公司;镍离子琼脂糖蛋白纯化柱,购自美国GE Healthcare公司;TOP10大肠杆菌感受态细胞,购自北京天根生化科技有限公司。
2.2. 引物设计
根据GenBank上公布的BNBD4基因的CDs序列,以及真核表达载体pPIC9K上的酶切位点EcoR I和Not I设计PCR引物,为了方便以后的蛋白纯化,设计时需在下游引物中插入一个6 × His·tag序列 [10] [11] ,因此,获得的PCR引物序列如表1所示。
Table 1. Primers for mature BNBD4 gene clone
表1. BNBD4成熟肽基因克隆引物序列
2.3. BNBD4基因扩增
以正常牛肺脏RNA反转录后获得的DNA为模板进行PCR反应,反应条件:95℃,1 min;95℃,20 sec,62℃,20 sec,72℃,30 sec (35 cycles);72℃,5min。琼脂糖凝胶电泳分析之后,试剂盒回收PCR产物。
2.4. 真核表达载体的构建
使用内切酶EcoR I和Not I分别对PCR产物和表达载体pPIC9K进行双酶切后,使用T4 DNA连接酶将PCR产物导入载体中,并将连接产物转化至TOP10大肠杆菌感受态细胞,转化完成后涂布200 μL转化产物于平衡至室温的LB/Amp+固体培养基培养板,37℃培养14~16 h,挑取LB/Amp+固体培养基上的单克隆菌落,大量培养后提取重组质粒DNA,进行双酶切鉴定后,送检测序,同时将构建好的重组载体命名为pPIC9K-mBNBD4。
2.5. 阳性转化子的筛选及PCR鉴定
采用电转化方法分别将5~20 μg纯化后的线性化质粒DNA (pPIC9K-mBNBD4和pPIC9K)转化至100 μL新鲜制备的GS115感受态细胞中,将转化液涂布于MD平板后置于28℃恒温培养箱中培养,2天以后观察转化子的生长情况,生长出的单克隆即为His+转化子。然后再依次对His+转化子进行G418抗性(高拷贝转化子)筛选和Mut+转化子(甲醇诱导型)筛选。筛选完成后,根据真核表达载体pPIC9K上的通用引物序列和插入片段mBNBD4的引物序列合成两对引物,以提取的毕赤酵母阳性转化子DNA为模板进行PCR鉴定。
2.6. 重组蛋白mBNBD4的诱导表达
将PCR鉴定后的阳性转化子首先接种于10 mL的YPD液体培养基中,28℃培养16~18 h;收集菌体后接种至25 mL的BMGY诱导表达前培养基中,28℃培养18~24 h;离心收集菌体接种至200 mL的BMMY诱导表达培养基中,28℃连续培养4天,每隔24 h需补充甲醇至终浓度为1%;每隔12 h收集1 mL表达培养液,离心取上清,Tricine-SDS-PAGE [12] 鉴定蛋白表达结果。
2.7. 重组蛋白mBNBD4的纯化及Western Blot鉴定
将大量诱导表达后的重组蛋白mBNBD4培养液离心取上清后,通过镍离子琼脂糖蛋白纯化柱进行纯化。纯化后的mBNBD4重组蛋白首先使用Tricine-SDS-PAGE电泳进行分离检测,然后再使用鼠抗6 × His·tag单克隆抗体进行Western Blot鉴定。
3. 结果
3.1. mBNBD4基因的PCR扩增结果
以正常牛肺脏组织RNA反转录后获得的DNA为模板,以mBNBD4基因的上游引物和下游引物进行PCR扩增,获得的PCR产物经1%琼脂糖凝胶电泳检测,结果发现在158 bp处有一与mBNBD4大小一致的特异性条带(见图1)。
3.2. mBNBD4目的基因和真核表达载体pPIC9K的双酶切结果
分别将mBNBD4的特异性PCR产物和真核表达载体pPIC9K使用限制性内切酶EcoR I和Not I进行双酶切,酶切完成后使用琼脂糖凝胶对酶切产物进行电泳检测,结果发现凝胶上均有与目的大小一致的特异性条带(见图2)。
 M:DNA marker;1、2:mBNBD4的PCR扩增产物
M:DNA marker;1、2:mBNBD4的PCR扩增产物
Figure 1. PCR amplification of mBNBD4 gene
图1. mBNBD4基因的PCR扩增结果
 M1:Trans2000 DNA marker;1:mBNBD4双酶切产物;M2:BM15000 DNA marker;2:pPIC9K双酶切产物
M1:Trans2000 DNA marker;1:mBNBD4双酶切产物;M2:BM15000 DNA marker;2:pPIC9K双酶切产物
Figure 2. Identification of mBNBD4 and pPIC9K by restriction enzyme digestion
图2. mBNBD4和pPIC9K的双酶切鉴定结果
3.3. 重组质粒pPIC9K-mBNBD4的酶切鉴定结果和测序结果
分别将双酶切鉴定后的mBNBD4目的基因和真核表达载体pPIC9K切胶回收,再进行连接转化,构建重组质粒pPIC9K-mBNBD4。然后将筛选出来的阳性克隆(共4个)提取质粒DNA,并使用EcoR I限制性内切酶进行单酶切鉴定,同时以空载体作对照,酶切后的产物使用琼脂糖凝胶电泳检测,结果在预期位置有目的条带存在(见图3)。
选取酶切鉴定后的重组质粒pPIC9K-mBNBD4的菌液送至测序公司测序,所用测序引物为表达载体pPIC9K的通用引物3’AOX1和5’AOX1。测序完成后,使用DNAMAN软件将测序结果与Genbank上公布的mBNBD4基因序列进行比对分析,结果发现二者的核苷酸序列同源性为100%,无错配现象,表明目的基因克隆成功(见图4)。
根据重组质粒pPIC9K-mBNBD4的测序结果,可知目的基因牛防御素4成熟肽已经成功插入真核表达载体pPIC9K的酶切位点EcoR I和Not I之间,表明真核重组质粒pPIC9K-mBNBD4已构建成功(见图5)。
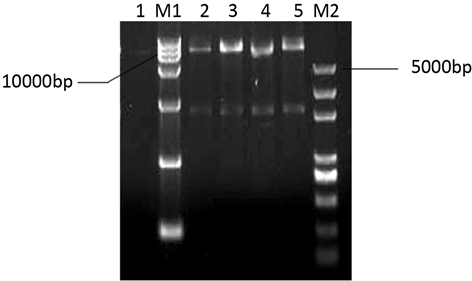 M1:BM15000 DNA marker;M2:Trans2000 DNA marker;1:空载体对照;2~6:pPIC9K-mBNBD4单酶切产物。
M1:BM15000 DNA marker;M2:Trans2000 DNA marker;1:空载体对照;2~6:pPIC9K-mBNBD4单酶切产物。
Figure 3. Identification of recombinant expression vector pPIC9K-mBNBD4 by restriction enzyme EcoR I
图3. 重组表达质粒pPIC9K-mBNBD4的单酶切鉴定
 实线框:限制性内切酶(EcoR I和Not I)序列;虚线框:6 × His·tag序列。
实线框:限制性内切酶(EcoR I和Not I)序列;虚线框:6 × His·tag序列。
Figure 4. Sequencing result of recombinant plasmid pPIC9K-mBNBD4
图4. 重组质粒pPIC9K-mBNBD4的测序结果
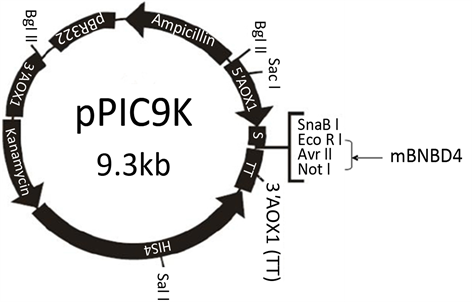
Figure 5. Construction of recombinant plasmid pPIC9K-mBNBD4
图5. 重组质粒pPIC9K-mBNBD4的构建图示
3.4. 毕赤酵母His+Mut+高拷贝转化子的筛选及PCR鉴定结果
通过筛选,我们共得到6株pPIC9K-mBNBD4的His+Mut+高拷贝转化子,同时也筛选到了2株pPIC9K的His+Mut+高拷贝转化子作为对照,将筛选到的菌株记录编号后,接种于YPD液体培养基中扩大培养,并保存菌种。
然后将筛选到的6株pPIC9K-mBNBD4的His+Mut+高拷贝转化子扩大培养,提取酵母基因组,进行PCR鉴定,凝胶电泳检测结果发现在预期大小有目的条带存在(见图6),说明转化至酵母基因组中的重组质粒是完整的,且目的基因mBNBD4已经被整合至酵母基因组。
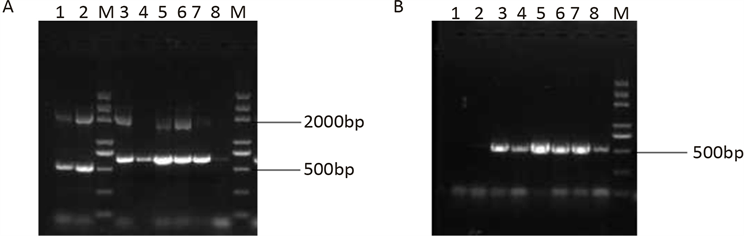 A:使用pPIC9K通用引物的PCR验证结果;M:Trans2000 DNA marker;1、2:空载体对照;3~6:含有重组质粒pPIC9K-mBNBD4的基因组;B:使用mBNBD4特异性引物的PCR验证结果;M:Trans2000 DNA marker;1、2:空载体对照;3~6:含有重组质粒pPIC9K-mBNBD4的基因组
A:使用pPIC9K通用引物的PCR验证结果;M:Trans2000 DNA marker;1、2:空载体对照;3~6:含有重组质粒pPIC9K-mBNBD4的基因组;B:使用mBNBD4特异性引物的PCR验证结果;M:Trans2000 DNA marker;1、2:空载体对照;3~6:含有重组质粒pPIC9K-mBNBD4的基因组
Figure 6. PCR results of Pichia genome containing recombinant plasmid pPIC9K-mBNBD4
图6. 含有重组质粒pPIC9K-mBNBD4的毕赤酵母基因组PCR鉴定结果
3.5. 重组蛋白mBNBD4的Tricine-SDS-PAGE分析结果
将诱导表达后的重组蛋白表达上清离心后进行Tricine-SDS-PAGE分析,同时以含有空载体pPIC9K的酵母菌作为诱导表达对照。结果发现,从诱导表达后48 h开始,重组质粒酵母表达上清中多出一条分子量大约为7 KDa大小的条带(见图7)。该条带大小与预测的重组蛋白mBNBD4表达产物大小一致,说明重组蛋白mBNBD4在毕赤酵母GS115中以分泌形式表达至培养基上清中。同时,根据结果可知重组蛋白在72 h表达量最高。
 A:含有空载体对照pPIC9K的酵母菌株的诱导表达结果;M:蛋白marker;1~4:分别为诱导表达后48 h、60 h、72 h、84 h的表达上清;B:含有重组质粒pPIC9K-mBNBD4的酵母菌株的诱导表达结果;M:蛋白marker;1~4:分别为诱导表达后48 h、60 h、72 h、84 h的表达上清
A:含有空载体对照pPIC9K的酵母菌株的诱导表达结果;M:蛋白marker;1~4:分别为诱导表达后48 h、60 h、72 h、84 h的表达上清;B:含有重组质粒pPIC9K-mBNBD4的酵母菌株的诱导表达结果;M:蛋白marker;1~4:分别为诱导表达后48 h、60 h、72 h、84 h的表达上清
Figure 7. Analysis of recombinant mBNBD4 protein expression by Tricine-SDS-PAGE
图7. 重组蛋白mBNBD4的Tricine-SDS-PAGE分析
3.6. 重组蛋白mBNBD4的纯化结果和Western Blot鉴定结果
按照3.5中的重组蛋白诱导表达条件,28℃条件下大量诱导表达重组蛋白。镍柱纯化后将蛋白进行Tricine-SDS-PAGE分析,结果发现纯化后的重组蛋白mBNBD4仅呈现一条与目的蛋白大小一致的特异性蛋白条带(见图8A),说明重组蛋白纯化效果良好。为了进一步对重组蛋白的准确性进行鉴定,使用鼠源抗6 × His·tag单抗检测纯化后的重组蛋白mBNBD4。结果发现,与空载体样品对照相比,重组蛋白mBNBD4 (见图8B)样品能检测到单一条带。
 A:Tricine-SDS-PAGE分析结果。M:蛋白marker;1~8:重组蛋白纯化样品;9:重组蛋白纯化前对照;B:Western Blot鉴定结果。1:纯化后重组蛋白;2:空载体诱导表达对照
A:Tricine-SDS-PAGE分析结果。M:蛋白marker;1~8:重组蛋白纯化样品;9:重组蛋白纯化前对照;B:Western Blot鉴定结果。1:纯化后重组蛋白;2:空载体诱导表达对照
Figure 8. Analysis of purified recombinant proteins by Tricine-SDS-PAGE and Western Blot
图8. 重组蛋白mBNBD4纯化后的鉴定结果
4. 讨论
鉴于防御素的性质和结构特点,本研究中我们选择了更接近于真核细胞天然结构的毕赤酵母表达系统用于重组蛋白BNBD4的表达 [13] [14] 。此外,由于防御素在机体中发挥活性的主要为其成熟肽,本研究通过构建牛防御素4成熟肽的真核表达质粒,诱导表达后,获得了含有重组蛋白mBNBD4的表达上清。将收集的表达上清通过镍柱纯化去除表达上清中的杂蛋白,经Tricine-SDS-PAGE检测和Western Blot鉴定后,发现只有单一目的条带存在,说明重组蛋白纯化效果良好,且纯化后的重组蛋白总量可达到15~20 mg/L,能够满足后续试验的需求。
综上所述,本研究通过构建重组质粒pPIC9K-mBNBD4,并将其转化入毕赤酵母GS115细胞,经过His+转化子筛选,高拷贝转化子筛选和Mut+转化子筛选成功获得了含有目的基因mBNBD4的His+Mut+高拷贝转化子。通过PCR鉴定了转化子的完整性和特异性,成功获得了含有重组质粒pPIC9K-mBNBD4的毕赤酵母菌株。通过对重组菌株的诱导表达,成功获得了重组蛋白mBNBD4,从而为进一步研究牛防御素4的作用机制提供了实验材料。
基金项目
河南省高等学校重点科研项目计划(18A230005);河南牧业经济学院学术带头人(14021321)。
文章引用
康静静,吴玉臣,阴正兴,罗 琴,霍 军. 牛防御素BNBD4成熟肽的真核表达及纯化
Eukaryotic Expression and Purification of Mature Bovine Neutrophil β-Defensins 4[J]. 生物医学, 2019, 09(04): 169-176. https://doi.org/10.12677/HJBM.2019.94025
参考文献
- 1. Ganz, T. (2003) Defensins: Antimicrobial Peptides of Innate Immunity. Nature Reviews Immunology, 3, 710-720. https://doi.org/10.1038/nri1180
- 2. Ganz, T., et al. (1985) Defensins. Natural Peptide Antibiotics of Human Neutrophils. Journal of Clinical Investigation, 76, 1427-1435. https://doi.org/10.1172/JCI112120
- 3. Hi, Z. and Spitznagel, J.K. (1966) Cationic Proteins of Polymorphonuclear Leukocyte Lysosomes. I. Resolution of Antibacterial and Enzymatic Activities. Journal of Bacteriology, 91, 750-754.
- 4. Hi, Z. and Spitznagel, J.K. (1966) Cationic Proteins of Polymorphonuclear Leukocyte Lysosomes. II. Composition, Properties, and Mechanism of Antibacterial Action. Journal of Bacteriology, 91, 755-762.
- 5. Ri, L. and Ganz, T. (2002) Defensins of Vertebrate Animals. Current Opinion in Immunology, 14, 96-102. https://doi.org/10.1016/S0952-7915(01)00303-X
- 6. Ganz, T. (2004) Defensins: Antimicrobial Peptides of Vertebrates. Comptes Rendus Biologies, 327, 539-549. https://doi.org/10.1016/j.crvi.2003.12.007
- 7. Mendez-Samperio, P. (2008) Role of Antimicrobial Peptides in Host Defense against Mycobacterial Infections. Peptides, 29, 1836-1841. https://doi.org/10.1016/j.peptides.2008.05.024
- 8. Shin, D.M. and Jo, E.K. (2011) Antimicrobial Peptides in Innate Immunity against Mycobacteria. Immune Network, 11, 245-252. https://doi.org/10.4110/in.2011.11.5.245
- 9. Dong, H., Lv, Y., Zhao, D., Barrow, P. and Zhou, X.M. (2016) Defensins: The Case for Their Use against Mycobacterial Infections. Journal of Immunology Research, 2016, Article ID: 7515687. https://doi.org/10.1155/2016/7515687
- 10. 牛明福, 李翔, 邢广旭, 等. 6 × His-Tag在抗菌肽表达纯化中的应用及其对抗菌肽活性的影响[J]. 河南农业科学, 2008(12): 121-124.
- 11. Patoli, A.A. and Patoli, В.В. (2019) The N-Terminal 6 x His Tag on β-Clamp Processivity Factor Occludes Gly66 and Affects the Growth of Escherichia coli B834 (DE3) Cells. Molekuliarnaia Biologiia, 53, 32-37. https://doi.org/10.1134/S0026893319010126
- 12. Schagger, H. (2006) Tricine-SDS-PAGE. Nature Protocols, 1, 16-22. https://doi.org/10.1038/nprot.2006.4
- 13. Gasser, B., et al. (2013) Pichia pastoris: Protein Production Host and Model Organism for Biomedical Research. Future Microbiology, 8, 191-208. https://doi.org/10.2217/fmb.12.133
- 14. Daly, R. and Hearn, M.T. (2005) Expression of Heterologous Proteins in Pichia pastoris: A Useful Experimental Tool in Protein Engineering and Production. Journal of Molecular Recognition, 18, 119-138. https://doi.org/10.1002/jmr.687
