Hans Journal of Biomedicine
Vol.
11
No.
02
(
2021
), Article ID:
41510
,
8
pages
10.12677/HJBM.2021.112008
盐霉素对胶质母细胞瘤U87细胞抑制作用的 研究
乔健英1,田金成2,曹相玫1*
1宁夏医科大学基础医学院病理学系,宁夏 银川
2宁夏医科大学临床医学院,宁夏 银川

收稿日期:2021年3月10日;录用日期:2021年3月24日;发布日期:2021年4月13日

摘要
目的:观察盐霉素对人胶质母细胞瘤(U87)细胞增殖、凋亡的影响,检测盐霉素对凋亡相关基因表达影响以探究对U87细胞抑制机制。方法;分别用高浓度(SH, 4 μmol/L)、低浓度盐霉素(SL, 2 μmol/L)处理U87细胞,分为空白对照组(NC组)、SH组、SL组,48小时后,通过集落形成实验观察盐霉素对U87细胞的集落形成能力的影响。通过RT-PCR检测SENP2等33个凋亡相关下调基因RNA的表达水平。结果:集落形成实验结果显示,SH和SL组均能抑制U87的增殖,且成浓度依赖性(P < 0.05)。PCR结果得到SENP2等33个凋亡相关基因表达下调。结论;盐霉素对U87细胞增殖具有明显抑制作用,并促进细胞凋亡。
关键词
盐霉素,胶质母细胞瘤,凋亡
Studying of Inhibitory Effect of Salinomycin on Glioblastoma U87 Cells
Jianying Qiao1, Jincheng Tian2, Xiangmei Cao1*
1Department of Pathology, Basic Medical College of Ningxia Medical University, Yinchuan Ningxia
2Clinical Medicine College of Ningxia Medical University, Yinchuan Ningxia

Received: Mar. 10th, 2021; accepted: Mar. 24th, 2021; published: Apr. 13th, 2021

ABSTRACT
Objective: To observe the effect of salinomycin on the proliferation and apoptosis of human glioblastoma U87 cells, and to detect the effect of salinomycin on the expression of apoptosis-related genes to explore the mechanism of inhibition on U87 cells. Methods: U87 cells were treated with high concentration (SH, 4 μmol/L) and low concentration salinomycin (SL, 2 μmol/L), and divided into NC group, SH group, and SL group. After 48 hours, observe the effect of salinomycin on the colony forming ability of U87 cells through the colony formation experiment. RT-PCR was used to detect the RNA expression level of 33 apoptosis-related down-regulated genes such as SENP2. Results: The results of MTT and colony formation experiments showed that both SH and SL groups could inhibit the proliferation of U87 in a concentration-dependent manner (P < 0.05). Flow cytometry results showed that the apoptosis rate in SH group increased. PCR results showed that the expression of 33 apoptosis-related genes such as SENP2 was down-regulated. Conclusion: Salinomycin can significantly inhibit the proliferation of U87 cells and promote cell apoptosis.
Keywords:Salinomycin, Glioblastoma, Apoptosis

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
有报道显示,中枢神经系统恶性肿瘤正以1%~2%的增长率逐年递增,尤以老年人群多见 [1]。而胶质母细胞瘤是最常见的中枢神经系统原发肿瘤,恶性程度高,预后差。流行病学资料显示,胶质瘤在全部中枢神经系统肿瘤中占比为27%,在恶性肿瘤中占比高达80% [2]。WHO (世界卫生组织)将胶质瘤分为I~IV四个等级,其中III级和IV级预后极差,称为高级别胶质瘤(high grade gliomas, HGG),其中IV级胶质瘤在恶性脑肿瘤中占比45.2%,平均诊断年龄64岁 [3],既使实施标准化治疗,即手术结合替莫唑胺同步放化疗,其中位生存期也仅为12~18个月 [4]。
盐霉素(Salinomycin, Sal),又名沙利霉素,是聚醚类一元羧酸抗生素,过去几十年曾被用做抗球虫病的药物一直用做动物饲料添加剂使用以促进营养吸收,提高饲料利用率 [5]。2009年,美国研究人员第一次发现盐霉素具有抗癌效应,例如,盐霉素能选择性杀伤乳腺癌肿瘤干细胞,且药效是紫杉醇的百倍。盐霉素能有效降低乳腺癌干细胞的比例,抑制在体乳腺癌细胞的生长 [6],抑制淋巴结转移 [7]。在2013年已经开始了盐霉素治疗乳腺癌的I和II期临床试验 [8]。此外,研究证明盐霉素对于神经系统肿瘤同样具有杀伤、抑制作用。当前研究主要集中在胶质瘤,特别是盐霉素对高级别胶质瘤的作用研究。现已证实盐霉素对原代胶质瘤细胞有很强的选择性杀伤作用,能引起细胞的凋亡和死亡,而且以后者占主导 [9]。但现有文献就盐霉素对胶质母细胞瘤具体作用报道有限,其机制尚未完全阐明。鉴于现有治疗手段对于胶质瘤治疗的局限性,深入研究盐霉素对胶质细胞瘤选择性杀伤及其作用机制,可能成为突破胶质瘤治疗瓶颈的新希望。本实验将观察盐霉素对胶质瘤U87细胞体外生长的抑制作用,并检测相关基因在盐霉素作用下的表达改变。
2. 材料与方法
2.1. 材料
盐霉素购于Sigma公司;DMEM培养液、PBS溶液购于北京Hyclon公司;胰蛋白酶购于美国Invitrogen公司;胎牛血清、青链霉素为购于Gibco公司产品;Millex-HV0 45 μm PVDF膜和化学发光试剂盒购于美国Millipore公司;MTT检测试剂盒购自上海同仁化学科技有限公司;甲紫溶液购于河北建宁药业有限公司;4%多聚甲醛购自北京雷根生物技术有限公司;Amersham Imager 600凝胶成像分析系统购于美国General Electric公司;OlympusBH2生物光学显微镜日本奥林巴斯集团;MultiskanGO型酶标仪购于美国Thermo Scientific公司。
2.2. 方法
2.2.1. 盐霉素药物配制、保存及使用
实验中用到的受试药物为:盐霉素,纯度98%,分子量751。将盐霉素使用甲醇充分溶解并制备成10 μmol/L浓度母液,保存在4℃冰箱。后续实验均用10 μmol/L的母液使用培养基按比例配成适当浓度工作液,确定后续实验的实验组盐霉素浓度分别为2 μmol/L和4 μmol/L (低浓度组(SL)和高浓度组(SH)),根据MTT法结果确定培养时间为48 h。
2.2.2. 细胞培养
1) 细胞复苏:提前准备好37℃水浴锅,打开超净台,快速将冻存管从液氮罐中取出放入水浴锅,轻晃细胞使其均匀解冻;将细胞吸到离心管中再补充新的培养基后,混匀并1000 rpm离心5 min;弃上清,加入新鲜培养基吹打混匀后,接种于培养瓶内,放入37℃,5% CO2细胞培养箱培养,根据细胞贴壁情况换液。2) 细胞传代:当细胞长满培养瓶70%~80%时,弃旧培养基,用PBS冲洗两次,加1 ml胰酶,放入培养箱内培养2 min,在显微镜下观察细胞间隙明显、细胞呈流沙状时,加入1 ml培养基终止消化(可以轻轻拍打细胞使漂浮),1000 rpm离心5 min;弃旧培养基加入新的培养基吹打混匀细胞,按需传代(可1:2、1:4或1:8传代),4~6小时观察贴壁情况。3) 细胞冻存:取对数生长期细胞,消化,制成细胞悬液,调节细胞密度为5 × 106/ml,加入冻存液(20% DMSO + 10% FBS + 70%细胞培养液)分装与冻存管中,封口并标记,放入梯度冻存盒后,第二天放入液氮罐中保存。4) 细胞计数:将贴壁细胞消化后制成细胞悬液,擦拭细胞计数板和盖玻片,用10 μl移液器在盖玻片和计数板之间加入一滴细胞悬液,显微镜下计算4个大方格的平均数,细胞数(个/ml) = 四格细胞总数/4 × 104。
2.2.3. 集落形成实验
将细胞消化离心后,弃旧培养基,加入新鲜培养基制成细胞悬液,反复吹打使细胞均匀分散,用细胞计数板进行细胞计数,根据细胞的增殖能力接种细胞,接种后可向四周轻晃培养皿,使细胞均匀分散于培养皿内,按实验分组加药,培养48 h后,弃旧培养基,用PBS洗两次,细胞换液后继续放置在37℃、5% CO2培养箱培养7~10天,期间根据培养基颜色换液。当培养皿内出现肉眼可见集落时,终止培养,弃旧培养基,PBS缓冲液冲洗2次后,用4%多聚甲醛固定15 min后,固定液回收,在烘箱中晾干后加入甲紫药水染色10 min后,自来水冲洗甲紫药水,待皿晾干后拍照、计数统计结果。
2.2.4. Real Time PCR实验步骤
1) 提取总RNA:加1 ml的Trizol加入细胞培养皿中,在涡旋混合器上震荡20 sec,转速12,000 rpm,离心10 min;吸上清于新的1.5 ml离心管中,加氯仿200 μl,4℃离心机12,000 rpm,10 min;取上清液加上等体积的异丙醇于1.5 ml离心管,静置后加入1 ml 75%酒精,4℃,7500 rpm,5 min后弃上清,离心去上清;再加1 ml 75%酒精漂洗沉淀,弃上清,干燥10 min后加入1 ml DEPC水溶解RNA,置于−80℃保存。2) cDNA第一条链的合成:依次除去总RNA中的DNA和DNADNase1,再进行反转录。3) 最后进行扩增。
2.2.5. MTT法实验步骤
将生长良好的贴壁细胞用胰酶消化后吹打混匀制成单个细胞悬液,以每孔5000个接种于96板中,待细胞次日贴壁后,按实验分组,加盐霉素分别处理1、2、3、4、5、6天后,(培养时间超过48 h的96孔板,48 h后进行细胞换液),每孔加MTT溶液20 μl,继续孵育4小时后终止培养,用移液器将孔内液体小心吸出,;每孔内加入150 μl DMSO,为使结晶物充分融解在摇床上晃10 min。在酶标仪的490 nm波长处测定各孔光吸收值,比较各组吸光度值后发现盐霉素对细胞增殖抑制呈浓度依赖作用,在48 h药效最好。
2.2.6. 统计学分析
所有实验重复三次,采用SPSS 21.0统计软件进行统计学分析,以均数 ± 标准差( )表示,后采用单因素方差分析判断总体显著性,并用t检验分析组间差异有无显著性。
3. 结果
3.1. 盐霉素抑制胶质母细胞瘤U87细胞的集落形成能力
平板克隆形成实验显示,盐霉素处理使细胞集落形成能力降低,细胞形态不规则,SH组细胞数量明显小于SL组和对照组,说明抑制细胞增殖具有浓度依赖性。差异具有统计学意义(P < 0.05,图1)。
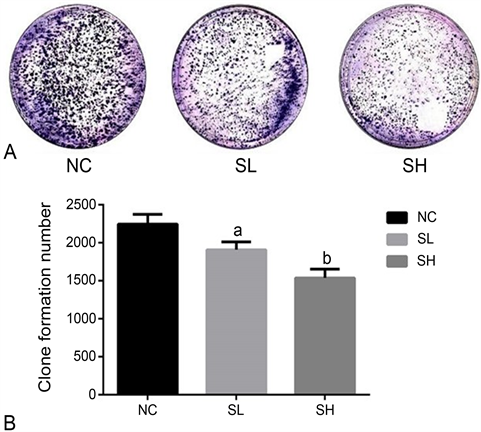
Figure 1. Effects of salinomycin on the proliferation of U87 cells
图1. 盐霉素对U87细胞增殖能力的影响
3.2. 盐霉素对凋亡相关基因表达的影响
如图2所示,盐霉素处理对众多信号通路有激活作用,通过测定这些通路所涉及的凋亡相关基因表达量,在表1中列举了部分上调基因和下调基因,表达上调的基因有Fas、FOXO3、GATA6等,表达下调基因有CAT、PIK3CA、VEGFA等。

Figure 2. The activating effect of salinomycin on signal pathway
图2. 盐霉素对信号通路的激活作用
Table 1. Partial gene expression regulation
表1. 部分基因表达调节情况
3.3. PCR检测凋亡相关基因表达水平
我们通过基因芯片技术对下调基因进行检测,对比GeneCards数据库中凋亡相关下游基因,筛选出重复率高且与数据库基因相一致的33个表达下调基因,通过PCR检测了ADCY7等基因的表达水平,所有基因表达量如下表2所示(CT = 2−△△CT),其中CD47、ADCY7、PPP2R5C、SENP2基因表达下调大于4。通过SPSS21.0软件进行t检验得到P < 0.05,具有统计学意义,并做柱状图(见图3)。
Table 2. Gene expression measured by PCR
表2. PCR测得基因表达量

Figure 3. Apoptosis-related gene expression level
图3. 凋亡相关基因表达水平
4. 讨论
目前的治疗手段对于胶质瘤尤其是高级别胶质瘤的治疗效果有限,即使用标准化治疗方案,患者生存率仍然很低,因此开发新的治疗药物仍具有很大意义。
盐霉素在1974年由Miyazaki等从发酵白色念珠菌获得 [10],具有杀伤多种革兰氏阳性菌和防治家禽球虫病的作用,最早作为抗球虫药物被用做家禽饲料添加剂 [11]。Mitani等研究发现盐霉素可以将细胞外阳离子转入细胞内,破坏细胞膜和线粒体膜内外离子平衡,发挥抗菌、抗球虫的作用 [12]。根据Lavine等报道,盐霉素可以激活线粒体DNA修复酶TgMSH-1,是弓形虫细胞周期S期停滞,起到抗球虫功效 [13]。近年来人们发现其具有广谱抗癌功效,盐霉素逐渐开始用于人体范围内的实验。在小部分人群测试中,包括患有头颈部非浸润性癌,乳腺癌和卵巢癌的患者,患者的病情都有所缓解。抑制其分化,延缓肿瘤生长的速度 [14],还有文献证实盐霉素可以引起卵巢癌细胞的凋亡和自噬 [15]。盐霉素具有广谱的抗癌功效,也包括对胶质瘤的抑制作用。对胶质瘤的抗肿瘤作用机制中,目前报道可能具有相关性的机制有:盐霉素联合组蛋白去乙酰化酶抑制剂能够增强elF20a磷酸化,减少McL-1表达以及减弱mTOR和p70s6K磷酸化,增强对GBM细胞杀伤力 [16];盐霉素能增强TRAIL (肿瘤坏死因子相关调亡诱导配体)导致胶质瘤细胞凋亡的作用。体内实验证实SAL与TRAIL联合明显抑制了胶质瘤细胞在裸鼠身上的移植瘤生长 [17];盐霉素促使p53转导进入线粒体,而后再与亲环素D相结合形成复合体。此复合体诱导线粒体通透性转换孔开放,导致细胞坏死 [18]。
本实验分辨用高浓度(SH)、低浓度(SL)和空白对照组(NC)处理U87细胞,可以观察到SH组U87细胞大量死亡,盐霉素处理组较NC组细胞不规则,狭长,容易脱壁。集落形成实验显示细胞增殖明显抑制。证明盐霉素能明显抑制肿瘤细胞的增殖,且具有浓度依赖性。
相关文献报道盐霉素可选择性地通过诱导凋亡而抑制胶质瘤干细胞的生长 [19],本实验中也观察到盐霉素处理U87细胞集落形成能力降低,细胞形态不规则,且呈现浓度依赖性。为探究盐霉素对细胞凋亡影响机制,我们选择了部分信号通路进行检测,发现AKT1、FOXO3等凋亡相关基因表达明显上调,CAT、CAMK2D等凋亡抑制基因表达下调。通过PCR对部分凋亡相关基因表达水平进行检测,其中CD47、ADCY7、PPP2R5C、SENP2基因表达下调明显。
目前关于盐霉素对胶质瘤的抗肿瘤作用的研究并不十分深入。结合文献报道以及本实验研究结果我们发现,盐霉素通过特异性的诱导肿瘤细胞凋亡来发挥其抗肿瘤作用,目前仅可检测到盐霉素具备对部分凋亡相关基因的调节能力,而其具体信号通路尚不明晰。本实验对盐霉素抗肿瘤作用做了初步研究,验证了盐霉素对胶质瘤细胞的抑制增殖和促进凋亡作用。其具体作用机制有待于我们继续探索。
基金项目
宁夏回族自治区大学生创新训练项目(NXCX2018144)。
文章引用
乔健英,田金成,曹相玫. 盐霉素对胶质母细胞瘤U87细胞抑制作用的研究
Studying of Inhibitory Effect of Salinomycin on Glioblastoma U87 Cells[J]. 生物医学, 2021, 11(02): 55-62. https://doi.org/10.12677/HJBM.2021.112008
参考文献
- 1. Sautès-Fridman, C., Cherfils-Vicini, J., et al. (2011) Tumor Microenvironment Is Multifaceted. Cancer and Metastasis Reviews, 30, 13-25. https://doi.org/10.1007/s10555-011-9279-y
- 2. Clement, J.P., Aceti, M., Creson, T.K., et al. (2012) Pathogenic SYNGAP1 Mutations Impair Cognitive Development by Disrupting Maturation of Dendritic Spine Synapses. Cell, 151, 709-723. https://doi.org/10.1016/j.cell.2012.08.045
- 3. Ostrom, Q.T. Haley, G., Lindsay, S., et al. (2015) Epidemiology of Gliomas. Cancer Treatment and Research, 163, 1-14. https://doi.org/10.1007/978-3-319-12048-5_1
- 4. Umang, S. and Tara, M. (2013) A Review of the Symptomatic Management of Malignant Gliomas in Adults. Journal of the National Comprehensive Cancer Network, 11, 424-429. https://doi.org/10.6004/jnccn.2013.0057
- 5. 周青, 程越, 陶国娟, 倪月秋. 盐霉素抗肿瘤作用与细胞自噬[J]. 沈阳医学院学报, 2019, 21(6): 568-571.
- 6. 张春影, 李奕. 盐霉素与Wnt/β-Catenin信号通路对乳腺癌干细胞的作用研究进展[J]. 临床与实验病理学杂志, 2018, 34(12): 1359-1361.
- 7. 甘生敏, 罗超, 李娟等. 盐霉素对低分化鼻咽癌干细胞放疗敏感性的影响[J]. 中国老年学杂志, 2015, 35(10): 2601-2603.
- 8. Naujokat, C., Steinhart, R. and Huczynski, A. (2012) Salinomycin as a Drug for Targeting Human Cancer Stem Cells. Journal of Biomedicine and Biotechnology, 2012, Article ID: 950658. https://doi.org/10.1155/2012/950658
- 9. 李蕴潜, 赵丽艳, 李才. 选择性靶向肿瘤干细胞药物的研究现状[J]. 中国新药杂志, 2013, 22(24): 2903-2908
- 10. Miyazaki, Y., Shibuya, M., Sugawara, H., Kawaguchi, O., Hirose, C., Nagatsu, J. and Esumi, S. (1974) Salinomycin, A New Polyether Antibiotic. Journal of Antibiotics, 27, 814-821. https://doi.org/10.7164/antibiotics.27.814
- 11. 陈思远, 胡济安. 盐霉素诱导的细胞自噬机制在抗癌治疗中的应用进展[J]. 浙江大学学报(农业与生命科学版), 2016, 42(6): 694-702.
- 12. Mitani, M., Yamanishi, T., Miyazaki, Y. and Otake, N. (1976) Salinomycin Effects on Mitochondrial Ion Translocation and Respiration. Antimicrobial Agents and Chemotherapy, 9, 655-660. https://doi.org/10.1128/AAC.9.4.655
- 13. Lavine, M.D. and Gustavo, A. (2011) The Antibiotic Monensin Causes Cell Cycle Disruption of Toxoplasma gondii Mediated through the DNA Repair Enzyme TgMSH-1. Antimicrobial Agents and Chemotherapy, 55, 745-755. https://doi.org/10.1128/AAC.01092-10
- 14. Gupta, P.B., Onder, T.T., Jiang, G.Z., et al. (2009) Identification of Selective Inhibitors of Cancer Stem Cells by High-Throughput Screening. Cell, 138, 645-659. https://doi.org/10.1016/j.cell.2009.06.034
- 15. Zhu, L.-Q., Zhen, Y.-F., Zhang, Y., et al. (2018) Salinomycin Activates AMP-Activated Protein Kinase-Dependent Autophagy in Cultured Osteoblastoma Cells: A Negative Regulator against Cell Apoptosis. PLoS ONE, 8, e84175.
- 16. Booth, L., Roberts, J.L., Conley, A., et al. (2014) HDAC Inhibitors Enhance the Lethality of Low Dose Salinomycin in Parental and Stem-Like GBM Cells. Cancer Biology & Therapy, 15, 305-316. https://doi.org/10.4161/cbt.27309
- 17. Calzolari, A., Saulle, E., De Angelis, M.L., Pasquini, L., et al. (2017) Salinomycin Potentiates the Cytotoxic Effects of TRAIL on Glioblastoma Cell Lines. PLoS ONE, 9, e94438. https://doi.org/10.1371/journal.pone.0094438
- 18. Qin, L.-S., Jia, P.-F., Zhang, Z.-Q. and Zhang, S.-M. (2015) ROS-p53-Cyclophilin-D Signaling Mediates Salinomycin-Induced Glioma Cell Necrosis. Journal of Experimental & Clinical Cancer Research, 34, 57. https://doi.org/10.1186/s13046-015-0174-1
- 19. Chen, T.N., Yi, L., Li, F., et al. (2015) Salinomycin Inhibits the Tumor Growth of Glioma Stem Cells by Selectively Suppressing Glioma-Initiating Cells. Molecular Medicine Reports, 11, 2407-2412. https://doi.org/10.3892/mmr.2014.3027
NOTES
*通讯作者。
