Advances in Clinical Medicine
Vol.05 No.04(2015), Article ID:16732,6
pages
10.12677/ACM.2015.54035
The Expression and Clinical Significance of miR-183 in Gastric Cancer of Different Tumor Stages
Wei Gu, Meijie Hu, Xiaoying Hu, Ying Sun, Jin Ma*
Department of Gastroenterology, Luwan Branch, Ruijin Hospital, Shanghai Jiaotong University School of Medicine, Shanghai

Received: Dec. 5th, 2015; accepted: Dec. 28th, 2015; published: Dec. 31st, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To quantitate expression of miR-183 in gastric cancer of different tumor stages and discuss their significances. Methods: Real-time PCR was used to detect the miR-183 expressions between gastric cancer tissues and matched adjacent tissues. The correlations of miR-183 expression with clinic-pathological features and clinical prognosis were analyzed. Results: The significant overexpression of miR-183 was observed in the rectal cancer tissues (2.12 ± 0.24 versus 1.04 ± 0.15, p < 0.01) as compared with the corresponding adjacent normal tissues. Up-regulation of miR-183 is associated with advanced clinical stage, positive lymph node, deep stromal invasion, and distant metastasis in gastric cancer patients. Conclusion: The expression of miR-183 is associated with clinic-pathological features and patient’s clinical prognosis, so it may be used as a potential diagnostic biomarker and a prognostic predictor in patients with gastric cancer.
Keywords:micro-RNA, miR-183, Gastric Cancer, TNM Stage

miR-183在不同分期胃癌中的表达及意义
顾玮,胡梅洁,胡晓莹,孙颖,马瑾*
上海交通大学医学院附属瑞金医院卢湾分院消化内科,上海

收稿日期:2015年12月5日;录用日期:2015年12月28日;发布日期:2015年12月31日

摘 要
目的:检测miR-183在不同分期胃癌中的表达量并讨论其临床意义。方法:实时定量PCR(real-time PCR,RT-PCR)法检测100例胃癌组织与其中20例相应癌旁组织中miR-183的表达水平,分析miR-183表达水平与胃癌患者临床病理特征及预后的关系。结果:胃癌组织中miR-183表达量明显高于相对应癌旁正常组织(2.12 ± 0.24比1.04 ± 0.15,p < 0.01) miRNA-183表达水平与临床病理肿瘤MTN分型,淋巴结转移,远处转移及肿瘤浸润程度有关(p < 0.05),与性别、年龄、肿瘤大小、分化程度无关(p > 0.05)。ROC曲线分析显示,miR-183在预测肿瘤转移时,其AUC值为0.74 (95% CI为0.530~0.865),敏感度为50.0%,特异性为90.0%;结论:miR-183在胃癌组织中的表达上调与胃癌的临床病理特征及患者预后密切相关,miR-183可能成为胃癌诊断及预后判断的新的分子标志。
关键词 :微小RNA,miR-183,胃癌,TNM分期

1. 引言
我国是胃癌发病率和死亡率最高的国家之一[1] ,全世界约 42%的胃癌发生在我国[2] 。在中国,胃癌的发生率与病死率均居恶性肿瘤之首[3] 。胃癌的预后很差,5 年生存率不足20%。癌细胞侵袭转移是造成胃癌死亡的主要原因[4] 。因此,为了更加有效地制定术前新辅助放化疗的方案,早期诊断和明确肿瘤分期显得尤为重要。临床上术前通常采用影像学检查如增强 CT、MRI 等估计肿瘤转移情况,但由于各种主、客观因素的影响,其准确度存在较大差异。因此,探寻一种客观、准确的预测胃癌分期的指标具有重要的临床价值。近年来,研究发现微小RNA (Micro RNA)也参与了许多恶性肿瘤的发生和发展过程,它们通过调控其靶基因的表达在细胞增殖、凋亡、迁移和转移等很多过程中发挥作用[5] -[7] 。本课题组前期通过miRNA芯片检测了胃癌miRNA表达谱,发现很多miRNA出现了显著的差异性表达,可能与胃癌的发生发展有一定的关系[8] 。在这些差异性表达的miRNA中包括了miRNA-183,其表达显著上调。很多研究表明miRNA-183在不同类型恶性肿瘤中的表达丰度差异很大,具有一定的组织特异性[9] [10] 。但目前尚缺乏miRNA-183在不同分期胃癌中的表达及意义的报道,miRNA-183能否作为术前预测胃癌分期的指标也值得探讨。故本研究旨在检测miRNA-183在不同分期胃癌中的表达量并讨论其临床意义及价值。
2. 材料与方法
2.1. 材料
收取2011年~2013年上海交通大学医学院附属瑞金医院卢湾分院普外科手术切除的胃癌标本100例,其中20例标本均留取肿瘤组织和距肿瘤5 cm以上的配对癌旁组织。手术标本离体后,遵循无菌原则,于5分钟内取材并迅速存放入液氮中,长期在−80℃冰箱保存。所有病例均得到病理确认,术前均未行放化疗。本研究获得我院伦理委员会批准并征得患者及家属的知情同意。TRIzol试剂购自美国Invitrogen公司;实时定量PCR(real-time PCR RT-PCR)试剂盒All-in-OneTM miRNA q RT-PCR检测试剂盒、U6、miR-183引物购自美国复能基因有限公司;无水乙醇、甲醇、异丙醇、氯仿、盐酸均购自国药集团化学试剂有限公司;枪头,EP管,离心管均购自AXYGEN公司。
2.2. 方法
2.2.1. 总RNA的提取
将收集的胃癌及癌旁组织标本从液氮罐中取出,剪切成小块状,放入研钵中研磨,随后装入加有1 mL TRIzol的EP管,静置5 min,加氯仿0.2 mL,混匀静置5 min,离心(4℃, 12000 × g, 15 min),吸取上清液,加入0.5 mL异丙醇,静置15 min,离心(4℃, 12000 × g, 15 min),可见RNA沉淀,弃上液,加750 mL/L乙醇1 mL混匀,离心(4℃, 7500 × g, 5 min),弃上清液,加入RNase free water溶解RNA沉淀。1%琼脂糖凝胶电泳检测RNA质量、紫外分光光度计检测RNA浓度及纯度[11] 。
2.2.2. RT-PCR检测miR-183的表达
取总RNA 2 μg进行逆转录反应,反应条件:16℃,30 min,42℃,30 min,85℃,10 min。取2 μL逆转录产物c DNA进行实时定量PCR反应,反应条件:50℃预热2 min;95℃预变性10 min(95℃变性15 s;60℃延伸1 min)共40个循环;95℃终延伸15 s。以上各步骤中,反应体系以及试剂用量均严格按照说明书进行。RT-PCR结果以Ct值表示,采用2-ΔΔCt比较各样品间miR-183的表达差异[12] ,ΔCt = 待检样品的miR-183 Ct值 − 该样品的U6 Ct值,ΔΔCt值 = 肿瘤组织的ΔCt值 − 癌旁组织的ΔCt值。
2.3. 统计学方法
采用Graghpad Prism 6统计软件进行统计,胃癌组织和配对癌旁组织miR-183表达比较采用成组t检验,miR-183表达和胃癌临床参数相关分析采用Mann-Whitney U检验分析,p < 0.05表示差异具有统计学意义。受试者操作特征(ROC)曲线用于分析miR-183在预测胃癌转移时的敏感度及特异性。
3. 结果
3.1. miR-183在胃癌组织和相应癌旁正常组织中的表达量
miR-183在胃癌组织中的表达量明显高于相应癌旁正常组织(2.12 ± 0.24比1.04 ± 0.15,p < 0.01),差异有统计学意义,有转移患者(淋巴结转移及远处转移者)明显高于无转移患者(如图1A所示)。
3.2. miR-183预测胃癌转移的评价
为了进一步评价miR-183预测肿瘤转移的价值,ROC曲线分析(如图1B所示)结果显示:miR-183在预测转移(淋巴结转移及远处转移)时,其AUC值为0.74 (95%CI为0.63~0.85)。
3.3. miR-183的表达与胃癌临床病理特征间的关系
以胃癌组织中miR-183表达量的中位数(2.67)为分界点将其分为低表达组和高表达组[13] ,分析两组与临床病理特征间的关系(如表1所示)。结果表明,miR-183表达与肿瘤侵犯层次、淋巴结转移有关、远处转移及TNM分期有(p < 0.05),与性别、年龄、肿瘤大小、分化程度无关(p > 0.05)。
4. 讨论
自1993年文献首次报道miRNA以来,对miRNA的研究不断深入。癌基因或抑癌基因的mRNA能够成为miRNA的靶点,因此miRNA的失调会影响基因的表达,从而参与肿瘤的发生、发展过程。大量研究证实miRNA在乳腺癌[14] 、肝癌[15] 、胃癌[16] 、胰腺癌[17] 、结直肠癌[18] 等多种恶性肿瘤中表达失调。一种miRNA往往可以调控多个靶基因,一个靶基因又可以被多种miRNA所调控,在肿瘤形成过
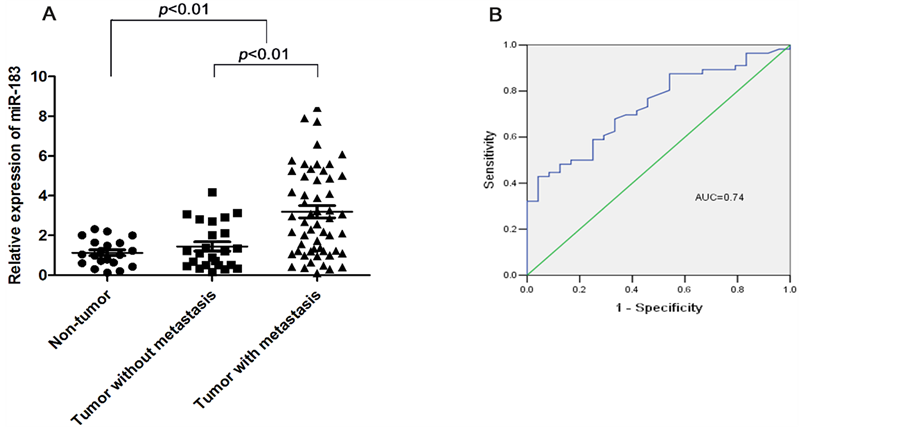
Figure 1. (A) Comparison of levels of miR-183 in samples from gastric cancer patients without metastasis (n = 24), gastric cancer with metastasis (lymph node and distant metastasis) (n = 56), and normal controls (n = 20). Data are expressed as the mean ± standard error (SE). Expression of miR-183 in tumor tissues was significantly higher than that in normal tissues (p < 0.001), especially higher in metastatic tissues (p < 0.001). The miR-183 expression levels were tested by qRT-PCR and normalized to U6. Statistical analysis was performed using the paired t-test. (B) To test the ability of miR-183 in gastric cancer as a biomarker for metastasis, ROC curves were established. We observed clear separations between the patients with and without lymph node and distant metastasis, with an AUC of 0.74, 95% CI, 0.63 - 0.85
图1. (A) 组间比较无转移胃癌患者组(24例)、有转移胃癌患者组(56例)、正常对照组(20例)miR-183表达水平,结果提示胃癌患者中miR-183表达水平明显高于正常对照组(p < 0.001),有转移患者明显高于无转移者。(B) ROC曲线分析结果显示:miR-183在预测转移时,其AUC值为0.74 (95% CI为0.63~0.85)
程中,多条信号通路交错形成复杂的信息网络,因此不同肿瘤的miRNA的表达谱往往不同[19] 。miRNA表达谱的特异性为肿瘤的筛查、诊断、治疗提供了新的思路[20] 。
人miR-183定位于染色体7q32.3,是miR-183家族(包括miR-183、miR-182和miR-196)成员,与多种恶性肿瘤的病理生理过程密切相关。但很多研究表明,miR-183在不同类型恶性肿瘤中的表达丰度差异很大,具有一定的组织特异性[9] 。而miR-183在不同肿瘤组织或细胞中的调控基因及调控作用的报道亦不一致,如Li等[21] 报道miR-183在肝癌Huh7细胞系中通过下调PDCD4表达以拮抗TGF-β1介导的细胞凋亡,而Wang等[10] 的研究显示肺癌细胞中miR-183呈低表达且与Ezrin蛋白上调及肺癌细胞转移能力密切相关。这些资料表明,miR-183可能调控多个靶基因或靶蛋白的表达,在不同的肿瘤组织或肿瘤细胞中发挥不同的调控功能,对肿瘤细胞的多种生物学行为产生重要影响。但对其在胃癌的作用机制尚缺乏深入研究。
在本研究中,miR-183在胃癌组织中的表达水平明显高于相应癌旁正常组织中的表达水平,本研究结果显示胃癌组织中miR-183的表达水平较癌旁组织显著增高,提示miR-183的表达上调可能参与了胃癌的发生,miR-183在胃癌发生中可能起癌基因的作用;miR-183在T3~T4期、淋巴结转移、远处转移以及TNM分期III、IV期胃癌组织中的表达明显高于T1~T2期、无转移以及 TNM分期I、II期,结果提示,miR-183高表达可能与肿瘤浸润和转移有潜在关联。miR-183表达与肿瘤分化程度无关。另外,为了进一步评价miR-183预测肿瘤转移的价值,ROC曲线分析结果显示其AUC值为0.74,敏感度为50.0%,特异性为90.0%,有一定的诊断价值。
综上所述,本研究证实miR-183在胃癌组织中表达显著上调,与胃癌的TNM分期、淋巴结转移和远处转移密切相关。提示miR-183可以作为临床评估胃癌侵袭、转移的潜在新型肿瘤标志物,但是miR-183
Table 1. Relationship between miR-183 expression level and clinical pathological characteristics in gastric cancer patients
表1. 胃癌患者miR-183表达水平与临床病理特征的关系
*p < 0.05,**p < 0.01。
调控胃癌的分子机制尚不明确。因此,研究miR-183在胃癌中调控的相关靶基因及其信号通路将是我们下一步的研究重点。
文章引用
顾 玮,胡梅洁,胡晓莹,孙 颖,马 瑾. miR-183在不同分期胃癌中的表达及意义
The Expression and Clinical Significance of miR-183 in Gastric Cancer of Different Tumor Stages[J]. 临床医学进展, 2015, 05(04): 219-224. http://dx.doi.org/10.12677/ACM.2015.54035
参考文献 (References)
- 1. Varadhachary, G. and Ajani, J.A. (2005) Gastric Cancer. Clinical Advances in Hematology & Oncology, 3, 118-124.
- 2. Parkin, D.M., Bray, F., Ferlay, J., et al. (2005) Global Cancer Statistics, 2002. CA: A Cancer Journal for Clinicians, 55, 74-108. http://dx.doi.org/10.3322/canjclin.55.2.74
- 3. 孙秀娣, 牧人, 周有尚, 等. 中国胃癌死亡率20年变化情况分析及其发展趋势预测[J]. 中华肿瘤学杂志, 2004, 26(1): 4-9.
- 4. Wu, W., Sun, M., Zou, G.M., et al. (2007) Micro RNA and Cancer: Current Status and Prospective. International Jour- nal of Cancer, 120, 953-960. http://dx.doi.org/10.1002/ijc.22454
- 5. Baranwal, S. and Alahari, S.K. (2010) miRNA Control of Tumor Cell in Vasion and Metastasis. International Journal of Cancer, 126, 1283-1290.
- 6. Bartel, D.P. (2009) MicroRNAs: Target Recognition and Regulatory Functions. Cell, 136, 215-233. http://dx.doi.org/10.1016/j.cell.2009.01.002
- 7. Bartels, D.P. and Tsongalis, G.J. (2009) MicroRNAs: Novel Biomarkers for Human Cancer. Clinical Chemistry, 55, 623-631. http://dx.doi.org/10.1373/clinchem.2008.112805
- 8. 顾玮, 胡梅洁, 孙颖, 等. 胃癌外周血微小核糖核酸表达谱的初步分析[J]. 中华消化杂志, 2012, 32(4): 222-225.
- 9. Ladeiro, Y., Couchy, G., Balabaud, G., et al. (2008) MicroRNA Profiling in Hepatocellular Tumors Is Associated with Clinical Features and Oncogene/Tumor Suppressor Gene Mutations. Hepatology, 47, 1955-1963. http://dx.doi.org/10.1002/hep.22256
- 10. Wang, G., Mao, W. and Zheng, S. (2008) MicroRNA-183 Regulates Ezrin Expression in Lung Cancer Cells. FEBS Letters, 582, 3663-3668. http://dx.doi.org/10.1016/j.febslet.2008.09.051
- 11. Davoren, P.A., McNeill, R.E., Lowery, A.J., Kerin, M.J. and Miller, N. (2008) Identification of Suitable Endogenous Control Genes for microRNA Gene Expression Analysis in Human Breast Cancer. BMC Molecular Biology, 9, 76. http://dx.doi.org/10.1186/1471-2199-9-76
- 12. Livak, K.J. and Schmittgen, T.D. (2001) Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2(-Delta Delta C (T)) Method. Methods, 25, 402-408. http://dx.doi.org/10.1006/meth.2001.1262
- 13. Shibuya, H., Iinuma, H., Shimada, R., Horiuchi, A. and Watanabe, T. (2010) Clinicopathological and Prognostic Value of microRNA-21 and microRNA-155 in Colorectal Cancer. Oncology, 79, 313-320. http://dx.doi.org/10.1159/000323283
- 14. Corcoran, C., Rani, S., Breslin, S., et al. (2014) miR-630 Targets IGF1R to Regulate Response to HER-Targeting Drugs and Overall Cancer Cell Progression in HER2 Over-Expressing Breast Cancer. Molecular Cancer, 13, 71-81. http://dx.doi.org/10.1186/1476-4598-13-71
- 15. Jung, H.S., Seo, Y.R., Yang, Y.M., et al. (2014) Gα12 Gep On-cogene Inhibits FOXO1 in Hepatocellular Carcinoma as a Consequence of miR-135b and miR-194 Dysregulation. Cell Signalling, 26, 1456-1465. http://dx.doi.org/10.1016/j.cellsig.2014.02.022
- 16. Yang, T.S., Yang, X.H., Wang, X.D., et al. (2013) MiR-214 Regulate Gastric Cancer Cell Proliferation, Migration and Invasion by Targeting PTEN. Cancer Cell International, 13, 68-78. http://dx.doi.org/10.1186/1475-2867-13-68
- 17. Wang, P., Chen, L., Zhang, J., et al. (2014) Methyla-tion-Mediated Silencing of the miR-124 Genes Facilitates Pancreatic Cancer Progression and Metastasis by Targeting Rac1. Oncogene, 33, 514-524. http://dx.doi.org/10.1038/onc.2012.598
- 18. Shang, J., Yang, F., Wang, Y., et al. (2014) Micro RNA-23a Antisense Enhances 5-Fluorouracil Chemosensitivity through APAF-1/Caspase-9 Apoptotic Pathway in Colorectal Cancer Cells. Journal of Cellular Biochemistry, 115, 772-784. http://dx.doi.org/10.1002/jcb.24721
- 19. Gyugos, M., Lenvai, G., Kenessey, I., et al. (2014) Micro RNA Expres-sion Might Predict Prognosis of Epithelial Hepatoblastoma. Virchows Archiv, 464, 419-427. http://dx.doi.org/10.1007/s00428-014-1549-y
- 20. Piva, R., Spandidos, D.A. and Gambambari, R. (2013) From Micro RNA Functions to Micro RNA Therapeutics: Novel Targets and Novel Drugs in Breast Cancer Research and Treatment (Review). International Journal of Oncology, 43, 985-994.
- 21. Li, J., Fu, H., Xu, C., et al. (2010) miR-NA-183 Inhibits TGF-Beta 1 Induced Apoptosis by Downregulation of PDCD4 Expression in Human Hepatocellular Carcinoma Cells. BMC Cancer, 10, 354. http://dx.doi.org/10.1186/1471-2407-10-354.
