Pharmacy Information
Vol.
10
No.
03
(
2021
), Article ID:
42394
,
10
pages
10.12677/PI.2021.103013
海洋来源曲霉属真菌天然产物及其生物活性研究现状
李欢欢,杜新阳,陈超逸,祁江峰,王颖
中国药科大学生命科学与技术学院,江苏 南京

收稿日期:2021年4月17日;录用日期:2021年5月12日;发布日期:2021年5月19日

摘要
海洋覆盖了地球表面70%以上的区域,与陆地相比,呈现出许多不同的特定恶劣环境条件。具体而言,海洋包含温度,静水压力和盐度水平范围广等的特征。响应海洋环境,海洋微生物如真菌逐渐进化出许多特殊的适应机制,包括产生特定的次生代谢产物作为生物分子。海洋生态系统中存在的巨大生物多样性为寻找具有众多有价值生物活动的新化合物提供了有希望的资源。因此,对海洋真菌尤其是曲霉属中次生代谢产物的探索研究为先导药物的开发提供了重要的资源。本文对近年来从海洋来源曲霉属真菌中获得的天然产物以结构的不同进行了列举,并指出了其生物活性,暗示着曲霉属真菌在海洋微生物高效活性乃至药用价值的天然产物的挖掘工作中值得重视。
关键词
海洋微生物,曲霉属真菌,生物活性,天然产物,次级代谢产物
Current Research on Natural Products and Biological Activities of Aspergillus Fungi from Marine Sources
Huanhuan Li, Xinyang Du, Chaoyi Chen, Jiangfeng Qi, Ying Wang
School of Life Science and Technology, China Pharmaceutical University, Nanjing Jiangsu
Received: Apr. 17th, 2021; accepted: May 12th, 2021; published: May 19th, 2021

ABSTRACT
The ocean covers more than 70% of the Earth’s surfaces exhibiting have many different specific harsh environmental conditions compared to land. Specifically, oceans contain characterized by a wide range of temperatures, hydrostatic pressure and levels of salinity. In response to the marine environment, microorganisms have gradually evolved many special different adaptation mechanisms, including the production of specific secondary metabolites as biomolecules. The enormous biodiversity present in marine ecosystems provides a promising resource to find new compounds with numerous worthwhile biological activities. Therefore, the exploration of marine fungi, especially the secondary metabolites of Aspergillus, has formed a powerful driving force for drug discovery. This article enumerates the natural products obtained from marine-sourced Aspergillus fungi in recent years in terms of structural differences, and points out their biological activities, implying that Aspergillus fungi may play an important role in the excavation of natural products with high-efficiency activity and medicinal value from marine microorganisms.
Keywords:Marine Microorganisms, Aspergillus Fungi, Biological Activity, Natural Products, Secondary Metabolites

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
海洋占地球面积70%以上,拥有比陆地更广阔的面积和更丰富的生物资源,在资源枯竭和环境保护日益被关注的今日,物产富饶的海洋为更多科研资源的发现和利用提供了发挥思路。海洋微生物是生物圈中进化最多样化的生物 [1],与陆地真菌相比,其生存环境具有特殊性,具有高盐度、压力大、少营养、紫外线辐射、温度范围广、较大的静水压力等特点,导致了与其它微生物不同的生长和代谢途径机制,赋予其代谢产物独特的生物学活性 [2],因此有望从中寻找到更多结构新颖、高效活性的天然产物 [3]。实际上,这也已被多项研究证实:目前已发现的海洋微生物天然产物包括酚酸、类黄酮、醌、类固醇、苯并吡喃酮、四氢萘酮、吨酮、多肽等,具有抗细菌、抗真菌、抗肿瘤、抗病毒、抗氧化等活性,在医药和农业中具有广泛的生物活性,一直是药物先导化合物或天然药物等的研究热点 [4]。其中,海洋真菌具有生长速度快、易培养、可大规模发酵、不受季节的影响以及资源可持续性等特点受到人们的广泛关注,其次级代谢产物类型众多,主要包括聚酮类、萜类、甾体、生物碱、肽类及其它含氮化合物等 [5]。
2. 海洋来源曲霉属真菌天然产物及其生物活性研究现状
2.1. 海洋曲霉属真菌是海洋微生物重要组成部分
海洋微生物广泛存在于每个海洋栖息地中,地下深海沉积物,退潮时的地表水,盐沼和沙滩等,包括细菌,微藻,真菌等。海水中发现的主要细菌种类为假单胞菌属,弧菌属,杆菌属和微球菌,其次还有较特殊的放线菌,扁平菌和蓝细菌等 [4] [6],海洋细菌是检测具有抗菌特性的新型分子的潜在途径,其中链霉菌是主要提供者 [7]。海洋微藻是微小的单细胞植物,形成浮游植物,可用于生物质生产,类胡萝卜素等初级代谢产物的生产,重金属的生物吸附剂等 [8]。海洋真菌在海洋微生物的药理学,生物活性天然产物的发掘上占据主要地位。海洋真菌尤其擅长寄生在其他生物如藻类,珊瑚,海绵甚至其他真菌上或内部,甚至连鞭毛藻和硅藻这样的初级生产者也普遍感染了海洋真菌,其中青霉属(Penicillium)和曲霉属(Aspergillus)是研究最广泛的两类 [9]。据《Marine natural products》统计,在2018年新增海洋来源天然产物中,真菌来源有617个(40%),细菌来源有240个,显示真菌在海洋来源天然产物的发现,活性分子的发掘以及后续可能的药理学作用研究中有着突出的地位(图1) [10]。

Figure 1. Distribution map of the types of newly added natural product-derived microorganisms in sea samples (2018)
图1. 海样新增天然产物来源微生物的种类分布图(2018年)
2.2. 海洋曲霉属真菌天然产物及生物活性
海洋曲霉属真菌天然产物主要来自于以下几类:红树林,是来源地最大类群之一;海藻,目前报道的海藻来源约占全部海洋真菌的三分之一;海水;海洋沉积物如海泥;海洋动物,主要包括在海洋动物内部组织寄生的内生真菌、体表附着的附生真菌、在海洋动物肠道、外骨骼等处寄生的真菌 [9]。本文描述了海洋真菌来源的天然产物,并按化学结构分类:生物碱,萜类,肽,固醇、内酯、聚酮类、及其它化合物等。
2.2.1. 生物碱类化合物
生物碱是存在于自然界中的一类含氮的碱性有机化合物。海洋曲霉属真菌是是海洋生物碱类天然产物的重要来源(图2)。
11个吡咯烷生物碱类化合物,preussins C-I (1~19)和(11R)/(11S)-preussins J和K (10和11),从海绵衍生的菌曲霉Aspergillus flocculosus 16D-1中分离得到。这些化合物在脂多糖诱导的THP-1细胞中表现出对IL-6产生的强至中等抑制活性,最大抑制浓度(IC50值)为0.11至22 μM,但对正常的肿瘤细胞系和真菌无活性 [11]。
深海来源真菌Aspergillus fumigatus SCSIO 41012分离出吲哚生物碱,fumigatosides E (12)和F (13),Fumiquinazoline C (14),Fumiquinazoline G (15)和Epi-Aszonalenin A (16)。化合物12对Fusarium oxysporum f. sp. momordicae显示出显著的抗真菌活性,MIC为1.56 µg/mL。化合物15对金黄色葡萄球菌表现出明显更高的活性,MIC值分别为1.56和0.78 µg/mL,化合物13对鲍曼不动杆菌ATCC 19606表现出显著活性,MIC值为6.25 µg/mL [12]。
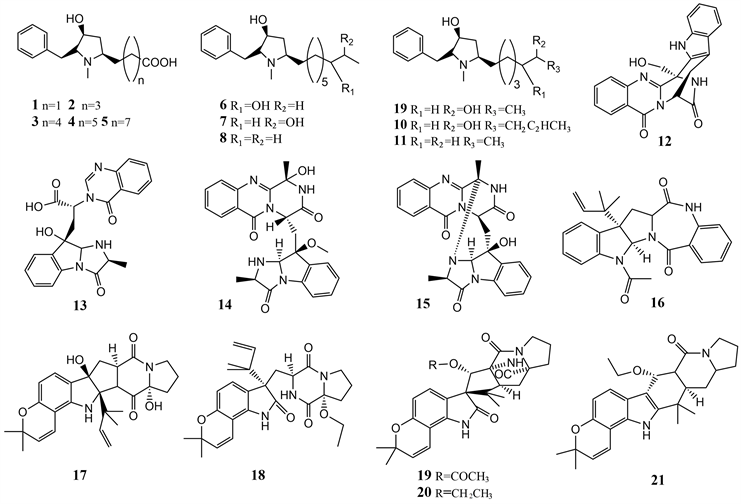
Figure 2. Natural products of marine Aspergillus fungal alkaloids
图2. 海洋曲霉属真菌生物碱类天然产物
值得注意的是,从Aspergillus sulphureus KMM 4640和Isariafelina KMM 4639的共培养物中分离得到了五个新的炔丙基吲哚生物碱,17-hydroxynotoamide D (17),17-O-ethylnotoamide M (18),10-O-acetylsclerotiamide (19),10-O-ethylsclerotiamide (20),and 10-O-ethylnotoamide R (21)。单一物种均无法产生上述化合物。化合物18能够以10 μm的非细胞毒性浓度抑制人前列腺癌细胞22Rv1的集落形成 [13]。
此外,从中国南海海泥中分离出来的真菌Aspergillus versicolor中分离到了与化合物17~21相似的一系列化合物,stephacidins,paraherquamides,notoamides,and brevianamides,这些炔丙基吲哚生物碱类化合物除了色氨酸和脯氨酸部分外还包含一个或两个异戊二烯基单元,其具有较明显的结构单元,且在LPS诱导的Raw264.7细胞中,化合物paraherquamides,notoamides表现出潜在的iNOS抑制活性,并抑制NO的释放,结合它们对Raw264.7细胞的弱活性,这些化合物的抑制作用应独立于细胞生存力,揭示着吲哚生物碱是潜在的抗炎物质 [14]。
2.2.2. 类固醇类化合物及其衍生物
对海洋藻类内生真菌Aspergillus alabamensis EN-547的研究从而分离出了一系列类固醇衍生物22~25,其中24,即25,28-dihydroxyergosta-4,6,8(14),22-tetraen-3-one是一种高度共轭的麦角甾烷型类固醇。化合物22~25表现出对人类病原体(大肠杆菌和黄曲霉)和水生细菌(溶藻弧菌)的抑制作用,MIC值为16至64 μg/mL [15]。
渤海来源Aspergillus flavus分离出了四种类固醇化合物26~29,aspersteroid A (26),化合物26对安圭拉菌,副溶血性弧菌和溶藻性弧菌表现出抗菌活性(MIC值为12.5 μM),对A-549细胞的选择性细胞毒性IC50值为14.6 μM。27表现出弱的抗细胞毒性作用HeLa细胞系的IC50值为32.7 μM [16]。
从源自水母的Aspergillus species进行培养过程中发现了3,7-diketo-cephalosporin P1 (30),对鲍曼不动杆菌,金黄色葡萄球菌和肺炎克雷伯菌和真菌菌株Fusarium oxysporum f. sp. cucumerinu显示出中等至较高的抗菌活性,MIC值范围为1.5至25 µg/mL [12]。
海绵来源Aspergillus flocculosus 16D-1得到asperflosterol (31),对LPS刺激的THP-1细胞中的TNF-α和IL-6产生抑制作用,显示其潜在的抗炎活性 [17] (图3)。
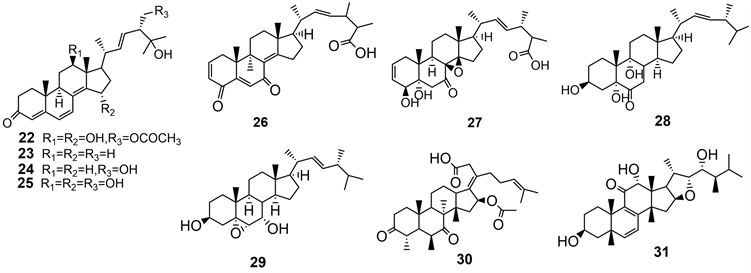
Figure 3. Natural products of marine Aspergillus fungal sterols and their derivatives
图3. 海洋曲霉属真菌固醇类天然产物及其衍生物
2.2.3. 萜类化合物及其衍生物
硝基苯甲酰倍半萜类化合物很少来自天然来源。从Aspergillus ochraceus Jcma1F17中分离到了6个倍半萜类化合物,insulicolide B (32),insulicolide C (34),6β,9α-dihydroxy-14-p-nitrobenzoylcinnamolide (35),insulicolide A (36),(2~4) and 9-deoxyinsulicolide A (37),此外还得到了衍生物6β,14-dihydroxy-7α-methoxyconfertifolin (38),38是化合物36的衍生物。化合物33、35和36对三种肾癌细胞系ACHN,OS-RC-2和786-O细胞表现出活性,IC50值为0.89至8.2 μM,进一步的研究表明33在786-O细胞处理72小时后以1 μM的浓度将细胞周期阻滞在G0/G1期,并诱导了2 μM的晚期细胞凋亡 [18]。
Brasilanones A-F (39~44)倍半萜类化合物从Aspergillus terreus CFCC 81836中纯化得到,是具有α,β-不饱和酮单元的高度氧化的Brasil型倍半萜类化合物,5/6双环碳骨架是这类型倍半萜的结构基础,Brasilanones A和E在40 μM浓度下表现出对五种人类癌细胞系(HL-60,SW-480,A-549,MCF-7和SMMC-7721)中等抑制作用,NO抑制率分别为47.7%和37.3%,重要的是,这是曲霉属中的Brasil型倍半萜类化合物的首次报道 [19]。
Asperversins A (45) and B (46),两个新的类金属萜类化合物具有罕见的5/6/6/6环系统,且具有具有四氢呋喃环,以及六个新的类似物(47~52),是从南海的泥浆中真菌Aspergillus versicolor的代谢物。其中化合物52对乙酰胆碱酯酶(AChE)表现出中等抑制活性,IC50值为13.6 μM [20]。
从深海沉积物来源的真菌曲霉Aspergillus wentii SD-310中分离出四种新的不常见的20-正二十二碳三异戊烷二萜差向异构体,即Aspewentins I-L (化合物53及两个羟基的四种异构体),以及一种新的甲基化衍生物Aspewentin M (54),这些代谢物代表了具有cyclohexa-2,5-dien-1-one模体的20-nor-isopimarane类似物的稀有实例,化合物53对人畜共患病的病原菌(如E. coli,E. tarda,V. harveyi,和V. parahaemolyticus)表现出抑制活性,对大肠杆菌的MIC为32 μg/mL,而对其他几株菌的MIC均为8.0 μg/mL,而化合物54对植物病原体Fusarium graminearum表现出有效的活性,其MIC值为4.0 μg/mL,与阳性对照两性霉素B (MIC 4.0 μg/ mL)相当 [21] (图4)。
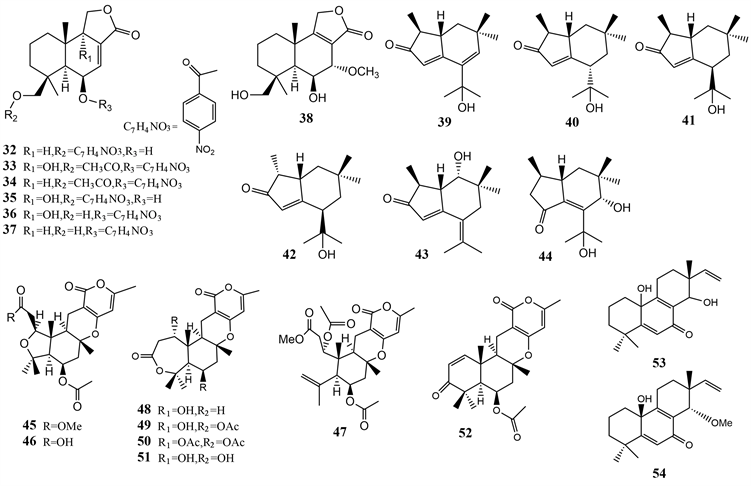
Figure 4. Natural products of marine Aspergillus fungal terpenoid and their derivatives
图4. 海洋曲霉属真菌萜类天然产物及其衍生物
2.2.4. 内酯类化合物及其衍生物
在南海沿海沉积物真菌Aspergillus terreus Y10中分离到了典型的新丁烯内酯Asperteretal F (55)和三种具有新型开环丁烯内酯骨架的新化合物(56~58)。Asperteretal F剂量依赖性地抑制肿瘤坏死因子(TNF-α)的产生,IC50为7.6 μg/mL,揭示了具有五元内酯轴承两个芳环的基骨架丁烯羟酸内酯是土曲霉属重要的生物活性代谢物,同时暗示丁烯内酯如55是一种有望用于神经退行性疾病的新型抗神经炎药物 [22]。
对另一株Aspergillus terreus提取物的化学研究分离了一些丁烯内酯衍生物(59~66),其中有3种为新发现的内酯类化合物asperlides A-C (59~61)。结果显示butyrolactone II (62)和versicolactone B (64)表现出PANC-1细胞系较强的细胞毒性,IC50值分别为5.3和9.4 μM。在62和64处理的PANC-1细胞中观察到凋亡小体形成,膜起泡,细胞收缩和核浓缩等凋亡的形态学特征,此外发现62通过诱导G2/M和S期阻滞,而64通过诱导S期停滞而抑制PANC-1细胞的增殖。这些发现表明62和64可能作为开发用于治疗胰导管腺癌的抗癌药的潜能 [23]。另外,珊瑚样品来源Aspergillus terreus分离得到了十种丁烯内酯衍生物,其中有一种化合物与上述化合物65一样,65对脂多糖(LPS)诱导的RAW 264.7小鼠巨噬细胞中一氧化氮产生量的抑制作用比阳性对照indomethacin强,其可作为开发新型抗炎药的有前途的先导化合物 [24]。
含有稀有的2-苄基-3-苯基取代的内酯核的两种新的丁烯内酯衍生物67和68,以及九种已知的类似物,是从一种海洋海绵中真菌Aspergillus terreus中分离得到的。上述化合物对α-葡萄糖苷酶表现出强大的抑制活性,IC50值为8.65至20.3 µM (阳性对照阿卡波糖,IC50值为320 µM)。此外,部分衍生物也显示出轻微的抗氧化活性 [25]。
另一珊瑚样品中分离到真菌Aspergillus terreus并鉴定了九种新颖的丁烯酸内酯衍生物,包括四对对映异构体(69~72),值得指出的是化合物70~72代表了带有2-苯基-3-苄基-4 H-呋喃-1-酮基序的烯丙基化γ-丁烯化物的第一个实例,所有这些化合物均表现出对α-葡萄糖苷酶的有效抑制作用,IC50值范围为15.7 ± 1.1至53.1 ± 1.4 μM,使它们成为发现用于治疗2型糖尿病的α-葡萄糖苷酶抑制剂的有前途的活性分子 [26] (图5)。

Figure 5. Natural products of marine Aspergillus fungal lactones
图5. 海洋曲霉属真菌内酯类天然产物
2.2.5. 聚酮化合物及其衍生物
海藻来源的Aspergillus alliaceus菌株产生了两种在发育和形态学上截然不同的形式,无性即营养阶段(the asexual morph)和硬化形态即有性发育阶段(the sclerotial morph),蒽醌色素nalgiovensin (73)主要是在无性形态产生的;将处于两个不同发育阶段的菌株进行共培养代谢谱产生了很大的变化,nalgiolaxin (74)含量大幅增加,产生了新化合物氯化联蒽酮(75~77),后两个可能是由于联蒽酮在酸性条件下的不稳定性而形成的化合物。75~77对HCT-116结肠癌和SK-Mel-5黑色素瘤细胞株显示弱的细胞毒活性,此外这项研究提出了通过同培养曲霉属物种的两个不同发育阶段的共培养方法引发新真菌化学的第一例 [27]。
从海洋海绵中纯化的真菌Aspergillus europaeus WZXY-SX-4-1培养过程中,分离出20种聚酮化合物衍生物,包括6种新化合物,即eurobenzophenones A-C (78~80),euroxanthones A-B (86~88),和(+)1-O-demethylvariecolorquinones A (89)。80对DPPH表现出有效的自由基清除活性。79、86在LPS诱导的SW480细胞中显着下调NF-κB,同时对NO生成和DPPH自由基清除活性有轻微抑制作用,提示这些化合物可能起抗炎作用 [28]。
海绵衍生的另一株真菌Aspergillus sp. F40的液体培养物中分离出两种新的聚酮衍生物oxisterigmatocystin I (90)和versiconol B (91),化合物91对金黄色葡萄球菌ATCC25923和副溶血性弧菌ATCC17802显示出中等的抗菌活性,MIC值分别为 48 μg/mL和 24 μg/mL [29]。
从深海沉积物来源真菌Aspergillus versicolor中分离到了聚酮化合物衍生物,其中averantin (92)和averythrin (93)表现出中等的抗氧化活性,具体而言可能激活Nrf2调控基因的表达 [30] (图6)。

Figure 6. Natural products of marine Aspergillus fungal polyketone
图6. 海洋曲霉属真菌聚酮类天然产物
2.2.6. 其他类型化合物
使用一株菌株多种化合物(One Strain MAny Compounds, OSMAC)方法对Aspergillus carneus进行发育条件的筛选,肽类化合物isoterrelumamide A (94)仅当真菌在改良的Czapek培养基上生长时才分离得到 [31]。
从珊瑚来源Aspergillus terreus中得到新化合物,包括烯丙基化的色氨酸衍生物,luteoride E (95),和线性脂肪醇(3E,7E)-4,8-dimethyl-undecane-3,7-diene-1,11-diol (96),化合物95具有一个不寻常的(E)-肟基团,这种结构的化合物很少在天然产物中出现,显示出对NO产生的抗炎活性,IC50值分别为24.64和18.62 μM [32]。
此外,还有很多众多的结构类型不同的天然产物起着各种各样的生理功能(图7)。

Figure 7. Other types of natural products of marine Aspergillus fungi
图7. 海洋曲霉属真菌其他类型天然产物
2.3. 总结
海洋微生物尤其是曲霉属真菌作为海洋巨大生物多样性的重要组成部分,其独特的生存环境赋予了其产生结构新颖、活性优良的次级代谢产物的潜能,从红树林,海藻,海水,海洋沉积物,海洋动物中分离得到的曲霉属真菌也表现出了其丰富次级代谢产物的能力,化学种类多样,化合物类型广泛,具体包括生物碱类,类固醇类,萜类,内酯类,聚酮类,以及肽类,脂肪醇等。其次表现出多种多样的生物活性,包括抗菌,抗真菌,抗肿瘤,抗炎,抗寄生虫,抗氧化,等。总体来说,海洋来源曲霉属真菌得到的次级代谢产物种类繁多,功能多样,是值得研究的重点和热点,真菌尤其是曲霉属真菌在海洋来源天然产物的发现,活性分子的发掘以及后续可能的药理学作用研究中可能会发挥更重要的作用。
致谢
感谢生活。
基金项目
国家重点研发计划“深海关键技术与装备”专项“海洋微生物候选药物的高效发现与创新”项目的子课题“深海药源微生物优质菌株的发现与高产育种”(NO:2018YFC0311001)。
文章引用
李欢欢,杜新阳,陈超逸,祁江峰,王 颖. 海洋来源曲霉属真菌天然产物及其生物活性研究现状
Current Research on Natural Products and Biological Activities of Aspergillus Fungi from Marine Sources[J]. 药物资讯, 2021, 10(03): 92-101. https://doi.org/10.12677/PI.2021.103013
参考文献
- 1. Collins, S., Boyd, P.W. and Doblin, M.A. (2020) Evolution, Microbes, and Changing Ocean Conditions. Annual Review of Marine Science, 12, 181-208. https://doi.org/10.1146/annurev-marine-010318-095311
- 2. Xie, C.L., Xia. J.-M., Wang, J.-S., Lin, D.-H. and Yang, X.-W. (2018) Metabolomic Investigations on Nesterenkonia flava Revealed Significant Differences between Marine and Terrestrial Actinomycetes. Marine Drugs, 16, Article No. 356. https://doi.org/10.3390/md16100356
- 3. Giordano, D. (2020) Bioactive Molecules from Extreme Environments. Marine Drugs, 18, Article No. 640. https://doi.org/10.3390/md18120640
- 4. Ameen, F., AlNadhari, S. and Al-Homaidan, A.A. (2021) Marine Mi-croorganisms as an Untapped Source of Bioactive Compounds. Saudi Journal of Biological Sciences, 28, 224-231. https://doi.org/10.1016/j.sjbs.2020.09.052
- 5. Kiuru, P., Valeria DʼAuria, M., Muller, C.D., Tammela, P., Vuorela, H. and Yli-Kauhaluoma, J. (2014) Exploring Marine Resources for Bioactive Compounds. Planta Medica, 80, 1234-1246. https://doi.org/10.1055/s-0034-1383001
- 6. Catania, V., Sarà, G., Settanni, L. and Quatrini, P. (2017) Bacterial Communities in Sediment of a Mediterranean Marine Protected Area. Canadian Journal of Microbiology, 63, 303-311. https://doi.org/10.1139/cjm-2016-0406
- 7. Yang, Z., He, J., Wei, X., Ju, J. and Ma, J. (2020) Explora-tion and Genome Mining of Natural Products from Marine Streptomyces. Applied Microbiology and Biotechnology, 104, 67-76. https://doi.org/10.1007/s00253-019-10227-0
- 8. Barra, L., Chandrasekaran, R., Corato, F. and Brunet, C. (2014) The Challenge of Ecophysiological Biodiversity for Biotechnological Applications of Marine Microalgae. Marine Drugs, 12, 1641-1675. https://doi.org/10.3390/md12031641
- 9. Gladfelter, A.S., James, T.Y. and Amend, A.S. (2019) Marine Fungi. Current Biology, 29, R191-R195. https://doi.org/10.1016/j.cub.2019.02.009
- 10. Carroll, A.R., Copp, B.R., Davis, R.A., Keyzers, R.A. and Prinsep, M.R. (2020) Marine Natural Products. Natural Product Reports, 37, 175-223. https://doi.org/10.1039/C9NP00069K
- 11. Gu, B.B., Jiao, F.-R., Wu, W., Jiao, W.-H., Li, L., Sun, F., et al. (2018) Preussins with Inhibition of IL-6 Expression from Aspergillus flocculosus 16D-1, a Fungus Isolated from the Marine Sponge Phakellia fusca. Journal of Natural Products, 81, 2275-2281. https://doi.org/10.1021/acs.jnatprod.8b00662
- 12. Limbadri, S., Luo, X., Lin, X., Liao, S., Wang, J., Zhou, X., et al. (2018) Bioactive Novel Indole Alkaloids and Steroids from Deep Sea-Derived Fungus Aspergillus fumigatus SCSIO 41012. Molecules, 23, Article No. 2379. https://doi.org/10.3390/molecules23092379
- 13. Afiyatullov, S.S., Zhuravleva, O.I., Antonov, A.S., Berdyshev, D.V., Pivkin, M.V., Denisenko, V.A., et al. (2018) Prenylated Indole Alkaloids from Co-Culture of Marine-Derived Fungi Aspergillus sulphureus and Isaria felina. The Journal of Antibiotics, 71, 846-853. https://doi.org/10.1038/s41429-018-0072-9
- 14. Li, H., Sun, W., Deng, M., Zhou, Q., Wang, J., Liu, J., et al. (2018) Asperversiamides, Linearly Fused Prenylated Indole Alkaloids from the Marine-Derived Fungus Aspergillus ver-sicolor. The Journal of Organic Chemistry, 83, 8483-8492. https://doi.org/10.1021/acs.joc.8b01087
- 15. Yang, S.Q., Li, X.-M., Li, X., Chi, L.P. and Wang, B.-G. (2018) Two New Diketomorpholine Derivatives and a New Highly Conjugated Ergostane-Type Steroid from the Marine Algal-Derived Endophytic Fungus Aspergillus alabamensis EN-547. Marine Drugs, 16, Article No. 114. https://doi.org/10.3390/md16040114
- 16. Yang, M.-Y., Yang, J.-K., Yang, J.-K., Hu, L.-D., Zhu, H.-J. and Cao, F. (2018) New Oxygenated Steroid from the Marine-Derived Fungus As-pergillus flavus. Natural Product Communications, 13, 949-951. https://doi.org/10.1177/1934578X1801300807
- 17. Gu, B.B., et al. (2018) Aspersecosteroids A and B, Two 11 (9→10)-abeo-5,10-Secosteroids with a Dioxatetraheterocyclic Ring System from Aspergillus flocculosus 16D-1. Organic Letters, 20, 7957-7960. https://doi.org/10.1021/acs.orglett.8b03530
- 18. Tan, Y., Yang, B., Lin, X., Luo, X., Pang, X., Tang, L., et al. (2018) Nitrobenzoyl Sesquiterpenoids with Cytotoxic Activities from a Marine-Derived Aspergillus ochraceus Fungus. Journal of Natural Products, 81, 92-97. https://doi.org/10.1021/acs.jnatprod.7b00698
- 19. Wu, Z., Li, D., Zeng, F., Tong, Q., Zheng, Y., Liu, J., et al. (2018) Brasilane Sesquiterpenoids and Dihydrobenzofuran Derivatives from Aspergillus terreus [CFCC 81836]. Phyto-chemistry, 156, 159-166. https://doi.org/10.1016/j.phytochem.2018.10.006
- 20. Li, H., Sun, W., Deng, M., Qi, C., Chen, C., Zhu, H., Luo, Z., Wang, J., Xue, Y. and Zhang, Y. (2018) Asperversins A and B, Two Novel Meroterpenoids with an Unusual 5/6/6/6 Ring from the Marine-Derived Fungus Aspergillus versicolor. Marine Drugs, 16, Article No. 177. https://doi.org/10.3390/md16060177
- 21. Li, X.D., Li, X., Li, X.-M., Xu, G.-M., Liu, Y. and Wang, B.-G. (2018) 20-Nor-Isopimarane Epimers Produced by Aspergillus wentii SD-310, a Fungal Strain Obtained from Deep Sea Sedi-ment. Marine Drugs, 16, Article No. 440. https://doi.org/10.3390/md16110440
- 22. Yang, L.H., Ou-Yang, H., Yan, X., Tang, B.-W., Fang, M.-J., Wu, Z., et al. (2018) Open-Ring Butenolides from a Marine-Derived Anti-Neuroinflammatory Fungus Aspergillus terreus Y10. Marine Drugs, 16, Article No. 428. https://doi.org/10.3390/md16110428
- 23. Qi, C., Gao, W., Guan, D., Wang, J., Liu, M., Chen, C., et al. (2018) Butenolides from a Marine-Derived Fungus Aspergillus terreus with Antitumor Activities against Pancreatic Ductal Ad-enocarcinoma Cells. Bioorganic & Medicinal Chemistry, 26, 5903-5910. https://doi.org/10.1016/j.bmc.2018.10.040
- 24. Liu, M., Zhou, Q., Wang, J., Qi, C., Lai, Y., Zhu, H., Xue, Y., et al. (2018) Anti-Inflammatory Butenolide Derivatives from the Coral-Derived fungus Aspergillus terreus and Structure Revisions of Aspernolides D and G, Butyrolactone VI and 4’,8’’-diacetoxy Butyrolactone VI. RSC Advances, 8, 13040-13047. https://doi.org/10.1039/C8RA01840E
- 25. Sun, Y., Liu, J., Li, L., Gong, C., Wang, S., Yang, F., et al. (2018) New Butenolide Derivatives from the Marine Sponge-Derived Fungus Aspergillus terreus. Bioorganic & Me-dicinal Chemistry Letters, 28, 315-318. https://doi.org/10.1016/j.bmcl.2017.12.049
- 26. Liu, M., Qi, C., Sun, W., Shen, L., Wang, J., Liu, J., et al. (2018) α-Glucosidase Inhibitors from the Coral-Associated Fungus Aspergillus terreus. Frontiers in Chemistry, 6, Article No. 422. https://doi.org/10.3389/fchem.2018.00422
- 27. Mandelare, P.E., Adpressa, D.A., Kaweesa, E.N., Zakharov, L.N. and Loesgen, S. (2018) Coculture of Two Developmental Stages of a Marine-Derived Aspergillus alliaceus Results in the Production of the Cytotoxic Bianthrone Allianthrone A. Journal of Natural Products, 81, 1014-1022. https://doi.org/10.1021/acs.jnatprod.8b00024
- 28. Du, X., Liu, D., Huang, J., Zhang, C, Proksch, P. and Lin, W. (2018) Polyketide Derivatives from the Sponge Associated Fungus Aspergillus europaeus with Antioxidant and NO In-hibitory Activities. Fitoterapia, 130, 190-197. https://doi.org/10.1016/j.fitote.2018.08.030
- 29. Tian, Y.-Q., Lin, S.-T., Kumaravel, K., Zhou, H., Wang, S.-Y. and Liu, Y.-H. (2018) Polyketide-Derived Metabolites from the Sponge-Derived Fungus Aspergillus sp. F40. Phyto-chemistry Letters, 27, 74-77. https://doi.org/10.1016/j.phytol.2018.06.009
- 30. Wu, Z.-H., Liu, D., Xu, Y., Chen, J.-L. and Lin, W.-H. (2018) Antioxidant Xanthones and Anthraquinones Isolated from a Marine-Derived Fungus Aspergillus versicolor. Chinese Journal of Natural Medicines, 16, 219-224. https://doi.org/10.1016/S1875-5364(18)30050-5
- 31. Ozkaya, F.C., Ebrahim, W., El-Neketi, M., Tansel Tanrıkul, T., Kalscheuer, R., Müller, W.E.G., et al. (2018) Induction of New Metabolites from Sponge-Associated Fungus Asper-gillus carneus by OSMAC Approach. Fitoterapia, 131, 9-14. https://doi.org/10.1016/j.fitote.2018.10.008
- 32. Liu, M., Sun, W., Wang, J., He, Y., Zhang, J., Li, F., et al. (2018) Bioactive Secondary Metabolites from the Ma-rine-Associated Fungus Aspergillus terreus. Bioorganic Chemistry, 80, 525-530. https://doi.org/10.1016/j.bioorg.2018.06.029