Hans Journal of Food and Nutrition Science
Vol.07 No.01(2018), Article ID:23808,9
pages
10.12677/HJFNS.2018.71004
Application Study on Alginate Lyase Enhancing the Degradation Effect of Kelp
Yanyan Yao1, Lirong Chang1, Yongqing Li1, Xiaohui Wang1, Xiangzhong Zhao2*
1Weihai Changqing Ocean Science Technology Co., Ltd., Rongcheng Shandong
2College of Food Science and Engineering, Qilu University of Technology, Jinan Shandong

Received: Feb. 7th, 2018; accepted: Feb. 17th, 2018; published: Feb. 26th, 2018

ABSTRACT
In this study, dry kelp was as raw material to explore the catalytic effect on alginate lyase enhancing the degradation of kelp. Four groups of experiments, including alginate lyase, complex enzyme, alginate lyase-complex enzyme and no enzyme, were designed. Viscosity reducing effect, total sugar content, reducing sugar content, enzymatic hydrolysis yield and the nutritional components were compared and analyzed. The results showed that kelp degradation effect of alginate lyase-complex enzyme was the best. Compared with alginate lyase group, compound enzyme group and no enzyme group, the rates of enzymatic hydrolysis yield using alginate lyase-complex enzyme increased by 53.2%, 174.5% and 245.1%, respectively. Na+ and Mg2+can raise efficiency on enzymatic hydrolysis yield of kelp. The soluble solids of kelp enzymatic hydrolysate can be increased to 61.3 g/L. In the process of kelp hydrolysis reaction, alginate lyase played a very important role in promoting the degradation effect of kelp. Alginate lyase can increase the content of total sugar, reducing sugar, organic matter and various minerals.
Keywords:Alginate Lyase, Kelp, Degradation
褐藻胶裂解酶提高海带降解效果的应用研究
姚艳艳1,常丽荣1,李永青1,王晓辉1,赵祥忠2*
1威海长青海洋科技股份有限公司,山东 荣成
2齐鲁工业大学食品科学与工程学院,山东 济南

收稿日期:2018年2月7日;录用日期:2018年2月17日;发布日期:2018年2月26日

摘 要
本研究以干海带为原料,通过褐藻胶裂解酶、复合酶、褐藻胶裂解酶 + 复合酶、未加酶四组实验,对海带降解的降粘效果、总糖含量、还原糖含量、酶解得率、营养成分进行对比分析,探究褐藻胶裂解酶对海带降解的促进作用。结果表明褐藻胶裂解酶 + 复合酶组的海带降解效果最佳,海带酶解得率分别比褐藻胶裂解酶组、复合酶组和未加酶组提高53.2%、174.5%和245.1%,且Na+、Mg2+对海带酶解得率具有促进作用,最终获得的海带酶解液的初始干基可达61.3 g/L,总糖、还原糖、有机质及多种矿物质含量也有提高。
关键词 :褐藻胶裂解酶,海带,降解

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
海带是我国重要的大型经济藻类,除直接食用外,还用于褐藻酸钠提取 [1] 、海藻肥 [2] 、饲料 [3] 、保健品及化妆品 [4] 等化工生产和加工。尤其是随着海带加工水平的提高,海带的精细化加工方法也在不断改进 [5] 。褐藻胶裂解酶是近年来用于海带精深加工的重要工具酶。褐藻胶裂解酶的相关研究早已成为国内外研究者关注的热点 [6] [7] [8] 。褐藻胶裂解酶是以褐藻胶为作用底物,通过β消去机制催化褐藻胶裂解,生成以甘露糖醛酸或古罗糖醛酸为基本单元的寡糖或单糖。随着褐藻寡糖活性研究的不断深入及其应用价值的广泛开发,褐藻胶裂解酶的应用研究也成为了目前研究的重要方向。据报道,褐藻胶裂解酶已应用于制备低粘度褐藻胶 [9] 、生物乙醇 [10] [11] 、药物物质或中间体 [12] [13] [14] [15] 、褐藻废渣利用 [16] 等,而直接应用于海带精深加工的报道很少。陈利梅 [17] 曾利用复合酶降解海带用于制备酸奶,马栋等人 [2] 利用复合酶降解海带和浒苔用于制备海藻肥。
本研究通过海带酶解的过程监控、海带酶解得率及海带酶解液的营养成分分析,探讨了褐藻胶裂解酶提高海带降解效率的作用。通过褐藻胶裂解酶 + 复合酶的酶解可进一步提高海带降解效率,对实现海带精深加工及综合开发利用的产业化具有重要的应用价值。
2. 材料与方法
2.1. 材料与试剂
干海带由威海长青海洋科技股份有限公司提供。
褐藻胶裂解酶:1000 U/mL,国家海产贝类工程技术研究中心。
海带降解复合酶(果胶酶、纤维素酶、蛋白酶):2万U/mL,诺维信创新与发展中心。
硫酸亚铁、邻菲罗啉、重铬酸钾、碘化钾、硫代硫酸钠、水溶性淀粉、钼酸铵、柠檬酸、喹啉、丙酮、四硼酸钠、氢氧化钠、硫酸铜、硫酸钾、次氯酸钠、EDTA、氢氧化钠、四苯硼酸钠、氯化镁、氯化铯、高碘酸、高氯酸、硼酸、盐酸、草酸、磷酸、硝酸、硫酸:国药集团化学制剂有限公司;铁标准液、铜标准液、锌标准液、锰标准液:国家有色金属及电子材料分析测试中心;间羟基联苯:美国sigma-Aldrich公司。
2.2. 仪器与设备
AL104分析天平:梅特勒-托利多仪器有限公司;PHS-3C实验室pH计:上海仪电科学仪器股份有限公司;DK-S24水浴锅:上海森信实验仪器有限公司;JJ-1搅拌器:精密增力电动搅拌器;L535-1低速离心机:湖南湘仪实验室仪器开发有限公司;UV2800S紫外分光光度计:上海舜宇恒平科学仪器有限公司;RE-5203旋转蒸发仪:上海亚荣生化仪器厂;KDN-2008凯氏定氮仪:上海纤检仪器有限公司;HYP-320消化炉:上海纤检仪器有限公司;HY-4调速多用振荡器:上海双捷实验设备有限公司;DB-3A电热板:金坛市科兴仪器厂;TAS-990AFG原子吸收分光光度计:北京普析通用仪器有限责任公司;KQ-50B超声清洗仪:昆山市超声仪器有限公司。
2.3. 方法
2.3.1. 海带酶解工艺
称取600 g水,用NaOH或KOH调节pH至8.5以上,水浴加热至45℃,称取60 g干海带全部浸入已预热好的碱性水中,45℃保温1 h,充分搅拌10 min,然后再保温1 h,充分搅拌10 min,如此循环操作,直至海带全部软化成海带浆,然后加入海带重量的0.1%褐藻胶裂解酶或2%复合酶或0.1%褐藻胶裂解酶 + 2%复合酶,45℃条件下300 r/min搅拌反应8 h,反应结束后,升温至90℃灭酶30 min,冷却至室温后,4200 r/min 离心10 min,收集上清液与海带渣。
2.3.2. 海带酶解过程中的体系参数监控
降粘效果监控 [18] :每隔1 h取10 mL的海带酶解液,于14,000 rpm下离心5 min后,取离心上清液,用蒸馏水稀释60倍,使用石英比色皿检测稀释上清液中酶解产物在235 nm的紫外吸收值。以未加酶的样品作为参照。
总糖及还原糖含量监控:每隔1 h取样10 mL,水浴煮沸5 min,冷却至室温后离心(4200 r/min,10 min)分离渣液,取样品上清液,分别采用苯酚-硫酸法和DNS法测定酶解液中总糖和还原糖含量 [19] 。以未加酶的样品作为参照。
2.3.3. 海带酶解得率计算
海带酶解的率是指干海带酶解后溶于水的物质百分含量,计算公式如下:
w:海带酶解得率,%;m0:酶解用的干海带干重,g;m:酶解后所得海带渣的干重,g。
2.3.4. 不同离子对海带酶解得率的影响
按照“2.3.1 海带酶解工艺”对海带进行软化处理后,在加酶前,先分别加入水质量1.5%的NaCl、MgCl2、KCl、Na2SO4、FeSO4、CuSO4,搅拌至溶解,然后加入海带重量的0.1%褐藻胶裂解酶或0.1%褐藻胶裂解酶 + 2%复合酶,45℃下300 r/min搅拌反应8 h,反应结束后,升温至90℃灭酶30 min,冷却至室温后,4200 r/min离心10 min,收集上清液与海带渣,计算海带酶解得率。两组分别以加0.1%褐藻胶裂解酶和0.1%褐藻胶裂解酶 + 2%复合酶,不加离子的实验组作为参照。
2.3.5. 海带酶解液营养成分分析
按照“2.3.1 海带酶解工艺”,海带酶解结束后收集海带酶解液,并浓缩至可溶性固形物约10%左右,然后检测其中的营养成分,主要包括有机质 [20] ,甘露醇 [21] ,海藻酸 [22] ,葡聚糖 [23] ,岩藻糖 [24] ,蛋白质 [25] ,灰分 [26] ,碘 [27] ,氮、磷、钾 [28] ,钠 [29] ,铁、铜、锌、锰 [30] 。
3. 结果与分析
3.1. 海带酶解过程中的体系参数变化
3.1.1. 降粘效果监控
海带中的褐藻胶、果胶在降解过程会产生含有糖醛酸的寡糖或单糖,在紫外235 nm处具有吸光值,且随着反应体系粘度的降低,OD235值逐渐升高,因此以海带酶解上清液的OD235值作为海带酶解过程降粘效果的监控,结果见图1。
由图1可知,加入褐藻胶裂解酶的两个实验组,在酶解进行1 h时,OD235值迅速上升,酶解3 h之后OD235值开始变化缓慢,褐藻胶裂解酶组的OD235值最大为0.861,褐藻胶裂解酶 + 复合酶组的OD235值最大为0.922;复合酶实验组的OD235值在整个酶解过程的变化都很缓慢,OD235值最大为0.179;未加酶实验组的OD235值在整个过程中基本没有变化。褐藻胶裂解酶组和褐藻胶裂解酶 + 复合酶组分别比复合酶组的OD235值提高381%和415%。
由图1的结果可以看出高粘度的大分子褐藻胶在褐藻胶裂解酶的作用下,可以在较短的时间内(3 h左右)被降解成粘度低的寡糖或单糖。当大部分褐藻胶被降解,之后(4 h~8 h)检测的OD235值变化缓慢且趋于平衡,复合酶组则变化不大,说明褐藻胶裂解酶是海带酶解过程中降低粘度的重要工具酶。
3.1.2. 总糖及还原糖含量监控
海带在酶的作用下,褐藻胶、果胶、纤维素、褐藻多糖等糖类物质被降解,海带酶解过程中总糖含量及还原糖含量的变化,结果见图2。除未加酶组,其他三组的总糖和还原糖含量随酶解时间延长而增加。在整个酶解过程中,总糖和还原糖含量最高的是褐藻胶裂解酶+复合酶组,最高分别可达5.41 mg/mL和3.41 mg/mL,比复合酶组分别提高42.7%和306%;褐藻胶裂解酶组的总糖和还原糖含量也比复合酶组的高,分别提高24.7%和266%。

Figure 1. Changes of viscosity reduction under different enzymes
图1. 不同酶条件下降粘效果的变化
 (a)
(a) (b)
(b)
Figure 2. Changes of total sugar content (a) and reducing sugar content (b) under different enzymes
图2. 不同酶条件下总糖(a)和还原糖(b)含量的变化
由图2结果可以看出,在褐藻胶裂解酶的作用下,总糖和还原糖含量积累较快,当大部分褐藻胶被降解后,总糖和还原糖含量增加缓慢。由图2(a)的褐藻胶裂解酶 + 复合酶和复合酶条件下的总糖含量变化曲线可知,褐藻胶裂解酶+复合酶组的总糖快速积累一直持续了5 h,可能原因是复合酶在酶解后期发挥作用。
综上结果说明褐藻胶裂解酶在海带降解过程中对总糖和还原糖含量积累起到了增速、促进作用。
3.2. 褐藻胶裂解酶对海带酶解得率的影响
干海带在加入不同酶,45℃酶解8 h后,测得海带酶解得率,结果见图3。褐藻胶裂解酶 + 复合酶组的海带酶解得率最高,可达71.1%,其次是褐藻胶裂解酶组(46.4%)、复合酶组(25.9%)。复合酶组的海
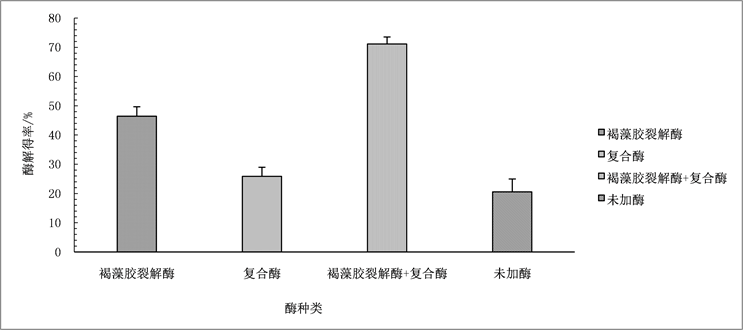
Figure 3. Kelp enzymolysis rates under different enzymes
图3. 不同酶条件下海带酶解得率
带酶解得率只比未加酶组高5%左右。褐藻胶裂解酶组和褐藻胶裂解酶+复合酶组分别比复合酶组的海带酶解得率提高79.2%和174.5%,说明褐藻胶裂解酶可有效提高海带降解得率。
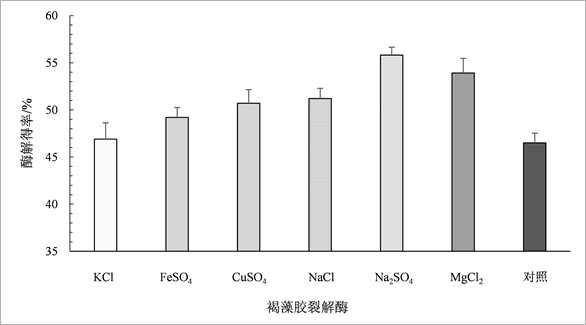
3.3. 不同离子对海带酶解得率的影响
在海带酶解过程中加入不同的化合物,研究不同离子对海带酶解得率的影响,结果见图4。由图4(a)和图4(b)中结果可知,所添加的化合物对海带酶解得率均有不同程度的促进作用。图4(a)化合物的促进作用由高到低依次为Na2SO4 > MgCl2 > NaCl > CuSO4 > FeSO4 > KCl,其中Na+、Mg2+对海带酶解得率的促进作用最大,酶解得率分别可提高20%和15.9%,与Fu XT [31] 等研究结果一致;而K+对海带酶解得率的影响最小,Fe2+对褐藻胶裂解酶的降解也起到促进作用,这与李丽妍 [9] 的结果不同,可能是由于褐藻胶裂解酶来源或结构不同,与离子的相互作用存在差异性。图4(b)中,Na2SO4对褐藻胶裂解酶+复合酶作用的海带酶解得率的促进作用最大,酶解得率可提高12.5%,Cu2+也对酶解有促进作用,而KCl和FeSO4与对照相比,酶解得率相差不大。
综上结果说明,Na+、Mg2+、Cu2+对褐藻胶裂解酶参与的海带降解具有促进作用,尤其是Na+、Mg2+。在实际生产应用中可根据需要,添加含有这些离子的化合物,促进酶活,提高海带酶解得率。
3.4. 海带酶解液营养成分分析
海带中含有丰富的碘、褐藻胶、甘露醇、蛋白质、矿物质等营养元素 [32] ,海带通过生物酶的酶解作用,可将海带中不溶于水的大分子营养物质降解成可溶于水的小分子物质,提高海带营养成分的利用率。
各组海带酶解液营养成分检测结果见表1,褐藻胶裂解酶 + 复合酶组的初始干基最大(61.3 g/L),说明海带被降解溶于水的营养物质比其他两组高,其中有机质含量比褐藻胶裂解酶组和复合酶组分别高7.1 g/L和22.7 g/L。褐藻胶裂解酶组和褐藻胶裂解酶+复合酶组的海藻酸、葡聚糖、岩藻糖、蛋白质比复合酶组分别高39.6%~52%、100.4%~149.6%、105.8%~98.8%、27.2%~51.5%。褐藻胶裂解酶组和褐藻胶裂解酶+复合酶组中的N、P、K、I、Fe、Zn含量也比复合酶组高。
综合以上结果表明,褐藻胶裂解酶不仅可以降解褐藻胶,提高海带酶解液中的有机质,促进其他小分子或无机物质的释放,同时还可以增强其他酶与其相应底物的相互作用,提高海带降解得率。
 (a)
(a) (b)
(b)
Figure 4. Effect of kelp enzymolysis rates of alginate lyase (a) and alginate lyase + complex enzyme (b) under different ions
图4. 不同离子对褐藻胶裂解酶(a)和褐藻胶裂解酶 + 复合酶(b)条件下海带酶解得率的影响
4. 结论
本研究探讨了褐藻胶裂解酶在海带降解过程中的重要促进作用。褐藻胶裂解酶 + 复合酶组的海带降解效果最佳,所有检测指标都优于其他组,其中比复合酶组的OD235值、总糖含量、还原糖含量、酶解得率、海带酶解液的初始干基分别提高了415%、42.7%、306%、174.5%、151%,而且酶解液中的有机质和多种矿物质元素含量丰富。Na+、Mg2+、Cu2+对褐藻胶裂解酶参与的海带酶解得率都具有一定的促进作用,尤其是Na+、Mg2+。
本研究结果表明褐藻胶裂解酶在海带酶解过程中可快速降解褐藻胶,降低反应体系粘度,增强果胶酶、蛋白酶、纤维素酶与底物的相互作用,对提高海带降解效果具有非常重要的作用。下一步还将继续
Table 1. Nutrient composition of different kelp hydrolysates
表1. 不同海带酶解液的营养成分表
注:初始干基是指海带酶解后离心获得的海带酶解原液的可溶性固形物含量。
优化褐藻胶裂解酶 + 复合酶对海带酶解的最佳酶解工艺,并根据不同的产品需求探索褐藻胶裂解酶在海带精深加工及综合利用的应用研究。
致谢
感谢本文参与的所有人员,尤其是赵祥忠老师对本文的指导。
基金项目
山东省重点研发计划(015GSF115033)。
文章引用
姚艳艳,常丽荣,李永青,王晓辉,赵祥忠. 褐藻胶裂解酶提高海带降解效果的应用研究
Application Study on Alginate Lyase Enhancing the Degradation Effect of Kelp[J]. 食品与营养科学, 2018, 07(01): 26-34. http://dx.doi.org/10.12677/HJFNS.2018.71004
参考文献 (References)
- 1. 贾福强. 褐藻酸钠生产过程中废渣及废水回收利用[D]: [硕士学位论文]. 青岛: 青岛科技大学, 2013.
- 2. 马栋, 刘海燕, 单俊伟, 等. 海带与浒苔混合提取液对草莓生长及品质的影响[J]. 中国土壤与肥料, 2017(5): 129-134.
- 3. 孙永泰. 海带粉在饲料中的应用[J]. 江西饲料, 2015(4): 23-25 + 32.
- 4. 杨会成. 海带(Laminaria japonica Aresch)多酚的提取、分离及其抗肿瘤、抗菌活性研究[D]: [硕士学位论文]. 青岛: 中国海洋大学, 2008.
- 5. 宋武林. 海带的主要功能及加工利用研究现状[J]. 渔业研究, 2016, 38(1): 81-86.
- 6. 韩伟, 林娟, 谢勇, 等. 褐藻胶裂解酶基因的克隆表达及重组酶酶学性质[J]. 微生物学通报, 2017, 44(5): 1074-1080.
- 7. Mohapatra, B.R. (2017) Kinetic and Thermodynamic Properties of Alginate Lyase and Cellulase Co-Produced by Exiguobacterium Species Alg-S5. International Journal of Biological Macromolecules, 5, 103-110. https://doi.org/10.1016/j.ijbiomac.2017.01.091
- 8. Montanari, E., Di Meo, C., Sennato, S., et al. (2017) Hyaluronan-Cholesterol Nanohydrogels: Characterisation and Effectiveness in Carrying Alginate Lyase. New Biotechnology, 25, 80-89. https://doi.org/10.1016/j.nbt.2016.08.004
- 9. 李丽妍. 褐藻胶裂解酶系的酶化学、产物分析及应用研究[D]: [博士学位论文]. 青岛: 中国海洋大学, 2011.
- 10. Takeda, H., Yoneyama, F., Kawai, S., et al. (2011) Bioethanol Production from Arine Biomass Alginate by Metabolically Engineered Bacteria. Energy & Environmental Science, 4, 2575-2581. https://doi.org/10.1039/c1ee01236c
- 11. Song, M., Duc Pham, H., Seon, J., et al. (2015) Marine Brown Algae: A Conyndrum Answer for Sustainable Biofuels Production. Renewable and Sustainable Energy Reviews, 50, 782. https://doi.org/10.1016/j.rser.2015.05.021
- 12. Falkeborg, M., Cheong, L.Z., Gianfico, C., et al. (2014) Alginate Oligosaccharides: Enzymatic Preparation and Antioxidant Property Evaluation. Food Chemistry, 164, 185-194. https://doi.org/10.1016/j.foodchem.2014.05.053
- 13. Khan, S., Powell, L., Pritchard, M., et al. (2013) The Ability of a Novel Alginate Oligosaccharide to Impair Fungal Growth and Biofilm Fromation in Vitro Is Related to Impaired Hyphae Formation. Wound Repair and Regeneration, 21, A69.
- 14. Kawai, S., Ohashi, K., Yoshida, S., et al. (2014) Bacterial Pyruvate Production from Alginate, a Promising Carbon Source from Marine Brown Macroalgae. Journal of Bioscience and Bioengineering, 117, 269-274.
- 15. Hodges, L., MacGregor, G., Stevens, H., et al. (2014) An Open Label Randomised Two-Way Crossover Scintigraphic Study to Investigate Lung Deposition of Radiolabelled Alginate Oligosaccharide Delivered as a Dry Powder and as a Nebulised Solution in Cystic Fibrosis Patients. Pediatric Pulmonology, 49, 305.
- 16. Kim, E.J., Fathoni, A., Jeong, G.T., et al. (2013) Microbacterium oxydans, a Novel Alginate- and Laminarin-Degrading Bacterium for the Reutilization of Brown-Seaweed Waste. Journal of Environmental Management, No. 130, 153-159. https://doi.org/10.1016/j.jenvman.2013.08.064
- 17. 陈利梅, 戴桂芝. 富含褐藻酸寡糖酸奶的研制[J]. 食品与药品, 2006, 8(12A): 50-52.
- 18. 张香治. 发酵法生产褐藻胶寡糖的工艺研究[D]: [硕士学位论文]. 青岛: 中国海洋大学, 2005.
- 19. 孙文, 巢志茂, 王淳, 等. 瓜蒌饮片中总糖及还原糖的含量测定[J]. 中国实验方剂学杂志, 2013, 19(9): 96-99.
- 20. NY/T 1976-2010水溶肥料有机质含量的测定[S].
- 21. 范晓. 海藻化学分析方法[M]. 北京: 学苑出版社, 1996.
- 22. 陈巧巧, 万琴, 王振中, 等. 人参多糖中糖醛酸含量测定方法的建立[J]. 中国实验方剂学杂志, 2012, 18(8): 121-124.
- 23. 于雅娟, 戴军, 朱松, 等. 酸酶水解-HPLC法检测香菇多糖中β-D-葡聚糖含量[J]. 食品与发酵工业, 2012(7): 148-151.
- 24. 尹宗美, 王春霞, 王小霞, 等. 海带渣中L-岩藻糖的含量测定方法探讨[J]. 山东化工, 2017, 21(35): 90-93.
- 25. GB 5009.5-2016食品安全国家标准食品中蛋白质的测定[S].
- 26. GB 5009.4-2016食品安全国家标准食品中灰分的测定[S].
- 27. GB 5009.267-2016食品安全国家标准食品中碘的测定[S].
- 28. NY/T 1977-2010水溶肥料总氮、磷、钾含量的测定[S].
- 29. GB 5009.91-2017食品安全国家标准食品中钾、钠的测定[S].
- 30. NY/T 1974-2010水溶肥料铜、铁、锰、锌、硼、钼含量的测定[S].
- 31. Fu, X.T., Lin, H. and Kim, S.M. (2007) Purification and Characterization of a Na+/K+ Dependent Alginate Lyase from Turban Shell Gut Vibrio sp. YKW-34. Enzyme and Microbial Technology, 41, 828-834. https://doi.org/10.1016/j.enzmictec.2007.07.003
- 32. 仇哲, 孙跃春, 吴海歌. 酶解海带产物的营养成分分析[J]. 黑龙江八一农垦大学学报, 2016, 28(2): 60-63.
