Medical Diagnosis
Vol.07 No.03(2017), Article ID:22045,8
pages
10.12677/MD.2017.73011
Expression of TGF-β1 and ALDH1 and Their Clinical Significance in Patients with Intrahepatic Cholangiocarcinoma
Zeyu Shuang, Shengping Li
State Key Laboratory of Oncology in Southern China, Sun Yat-sen University Cancer Center, Guangzhou Guangdong

Received: Aug. 25th, 2017; accepted: Sep. 11th, 2017; published: Sep. 14th, 2017

ABSTRACT
Background: Aldehyde dehydrogenase 1 (ALDH1) has been proved to be the marker of cancer stem cells (CSCs) in different types of tumors. However, the research of its source is rare. Recent studies showed that transforming growth factor β1 (TGF-β1) could induce the generation of CSCs. However, the correlation of TGF-β1 and ALDH1 expression in patients with intrahepatic cholangiocarcinoma (ICC) is unclear. Method: Expression of TGF-β1 and ALDH1 were detected in seven normal bile duct and eighteen cholangiocarcinoma tissues by quantitative PCR. Expression of TGF-β1 and ALDH1 were detected in fifty eight ICC tissues by using immunohistochemistry (IHC) technique. Results: Quantitative PCR showed that the expression of TGF-β1 in cholangiocarcinoma patients was higher than normal bile duct (P = 0.046). Immunohistochemical staining showed that the expression of TGF-β1 was correlated with the expression of ALDH1 in ICC patients (P < 0.001). Both of TGF-β1 and ALDH1 expression were correlated with tumor differentiation (P = 0.003 or P = 0.011) and ALDH1 expression was correlated with the level of CA199 (P = 0.041). Both of TGF-β1 and ALDH1 expression were prognostic factors in ICC patients (P = 0.012 or P = 0.033). Cox multivariate model showed that TGF-β1 expression was independent prognostic factors in ICC patients (P = 0.014). Conclusion: The expression of TGF-β1 is related to the expression of ALDH1 in ICC patients. And the expression of TGF-β1 can be used as the independent predictor for the prognosis of patients with ICC.
Keywords:Intrahepatic Cholangiocarcinoma, TGF-β1, ALDH1, Prognosis
转化生长因子β1与乙醛脱氢酶1在肝内胆管细胞癌的表达及其临床意义
双泽宇,李升平
华南肿瘤学国家重点实验室,中山大学肿瘤防治中心,广东 广州
收稿日期:2017年8月25日;录用日期:2017年9月11日;发布日期:2017年9月14日

摘 要
背景:乙醛脱氢酶1 (ALDH1)可作为多种肿瘤干细胞的标志,而对其来源报道较少。体外研究表明转化生长因子β1( transforming growth factorβ1, TGF-β1)能诱导肿瘤干细胞的产生,而胆管细胞癌组织中TGF-β1表达与ALDH1的关系尚未阐明。方法:采用定量PCR检测7例正常胆管、18例胆管细胞癌新鲜组织中TGF-β1和ALDH1 mRNA的表达,免疫组织化学染色的方法检测58例肝内胆管细胞癌石蜡组织中TGF-β1和ALDH1蛋白的表达。结果:胆管细胞癌组织中TGF-β1的mRNA水平明显高于正常胆管(P = 0.046),ALDH1的mRNA水平无统计学差异。肝内胆管细胞癌组织中TGF-β1低表达组28例,高表达组30例,高表达阳性率为51.72%,ALDH1低表达组23例,高表达组35例,高表达阳性率为60.34%,TGF-β1与ALDH1的表达呈正相关(r = 0.583, P < 0.001)。肝内胆管癌组织中TGF-β1及ALDH1表达在肿瘤低分化组高于高分化组(P值分别为0.003、0.011),ALDH1表达在术前血浆CA199浓度高水平组高于低水平组(P = 0.041)。肝内胆管细胞癌组织中TGF-β1及ALDH1高水平组患者的总生存率低于低水平组(P值分别为0.012、0.033)。多因素Cox回归模型分析显示TGF-β1表达量是影响肝内胆管细胞癌患者预后的独立危险因素(P = 0.014)。结论:肝内胆管细胞癌组织中TGF-β1表达与ALDH1表达有关;肝内胆管细胞癌组织中TGF-β1表达量可作为预测患者术后预后的指标。
关键词 :肝内胆管细胞癌,转化生长因子β1,乙醛脱氢酶1,预后

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肝内胆管细胞癌在肝胆恶性肿瘤中发病率仅次于肝细胞癌,近年来发病率逐渐升高 [1] 。目前治疗肝内胆管细胞癌最有效的方法是手术切除,但多数患者并不具备手术的指征和条件。然而即使手术,术后的复发转移率也极高,导致肝内胆管细胞癌患者的总体5年生存率处于较低水平 [2] 。因此,阐明复发和转移的机制对于肝内胆管细胞癌的诊治具有重要的意义。
肿瘤的复发和转移是约90%的肿瘤患者治疗无效及死亡的主要原因,肿瘤干细胞(Cancer stem cells, CSCs)可能是其中的“源头”细胞。乙醛脱氢酶1 (Aldehyde dehydrogenase, ALDH1)是一种组织的代谢功能分子,能催化细胞内的乙醛氧化成乙酸,参与组织的分化与多种基因表达。近年来研究表明,ALDH1是组织中CSCs生长、分化的必需物质。ALDH1被鉴定为乳腺癌、头颈癌、肺癌、前列腺癌、胰腺癌、结直肠癌及卵巢癌干细胞的标记物 [3] ,是目前最具应用前景的干细胞通用标记物之一。转化生长因子( transforming growth factor β1, TGF-β1)在是诱导细胞发生上皮间质转化(EMT)的关键分子。近年来研究也表明TGF-β1诱导EMT的过程中能使肿瘤获得干细胞的特性 [4] 。肝内胆管细胞癌易复发和转移的特性可能与肿瘤的EMT机制形成的CSCs有关。然而,肝内胆管细胞癌组织中TGF-β1表达与ALDH1表达的关系尚不明确。
基于此,为了探讨TGF-β1与ALDH1的关系及在肝内胆管细胞癌中临床意义,我们收集了7例正常胆管和18例胆管细胞癌组织,检测了TGF-β1与ALDH1 mRNA水平的表达。同时,我们收集了58例肝内胆管细胞癌石蜡标本,通过免疫组化检测了TGF-β1与ALDH1在组织中蛋白水平的表达,并分析他们与患者预后的关系。
2. 材料与方法
2.1. 患者一般资料和组织标本
本研究选取2000年1月至2009年12月,在中山大学肿瘤防治中心肝胆科行手术切除并且临床和随访资料完整的58例肝内胆管细胞癌患者。术后病理诊断均为胆管癌。标本获取均通过中山大学肿瘤防治中心伦理委员会讨论,符合伦理学要求。肿瘤分化程度根据Edmondson. Steiner分级标准。肿瘤分期采用国际抗癌联盟(Intemational Union Against Cancer, UICC)和美国癌症联合委员会(American Joint Committee on Cancer, AJCC)制订的第七版TNM分期标准。
另外收集7例正常胆管(取自胰头癌手术的远端胆管)、18例胆管癌新鲜标本进行了研究,所有的组织标本均归档和储存在组织标本库中,−80℃保存到使用。所有的组织学诊断经H&E染色证实。
2.2. 定量PCR检测
将−80℃保存的正常胆管和胆管癌组织置于1 ml Trizol中,使用提RNA专用的组织搅碎机搅拌5分钟,沉淀5分钟后取上层液体提取RNA,逆转录为cDNA,用Invitrogen公司的SYBER green 试剂盒进行实时荧光PCR实验。PCR条件为:95℃ 5分钟预变性后,95℃ 15秒、65℃ 35秒(荧光检测),40个循环。PCR结束后,根据反应得到的Cp值,使用2−ΔΔCT法的分析计算相对表达水平,以标准曲线进行校正。引物TGF-β1为F: TGGCGATACCTCAGCAACC、R: CTAAGGCGAAAGCCCTCAAT;ALDH1为F: GGGCAGCCATTTCTTCTCAC、R: ATTGTCCAAGTCGGCATCAG。
2.3. 免疫组化染色
所有收集的组织均经过HE染色证实为肝内胆管细胞癌。免疫组化染色采用二步法进行:组织切片脱蜡、水化、枸橼酸盐修复抗原,PBS洗4次后加入3%过氧化氢阻断内源性过氧化物酶,反应10分钟,一抗4℃孵育过夜,PBS洗4次后二抗室温孵育室温30分钟,二氨基联苯氨(DAB)染色,苏木素复染细胞核。结果判断由2名病理科医师双盲阅片。主要抗体包括:TGF-β1鼠抗人单克隆抗体(Acris公司,德国),ALDH1鼠抗人单克隆抗体(BD公司,美国)。
2.4. 结果评定
TGF-β1和ALDH1的免疫组化结果采用十三分法进行评价。阳性强度计为0分(−)、1分(+)、2分(++)、3分(+++);阳性比率计为0分(<5%)、1分(5%~25%)、2分(25%~50%)、3分(50%~75%)、4分(>75%)。将两者分数相乘得总分。根据阳性强度和阳性比例评分乘积,其表达可分为2个等级,0~4分定为低表达,5~12分定为高表达以进行预后分析。
2.5. 统计学分析
应用SPSS18.0软件(SPSS Inc. Chicago, IL)进行统计分析。计数资料用平均数 ± 标准差表示,组间比较采用Student’s t检验,p < 0.05认为有差异,相关性采用Spearman分析。定性资料组间比较采用c2检验或Fisher精确检验。生存分析采用Kaplan-Meier分析,单因素分析采用log-rank检验,将有意义的单因素引入Cox模型多因素分析,p < 0.05认为有统计学意义。
3. 结果
3.1. 胆管细胞癌组织中TGF-β1和ALDH1 mRNA水平的表达
为了研究TGF-β1和ALDH1在胆管细胞癌组织中的表达情况,我们首先用定量PCR检测了7例正常胆管和18例胆管细胞癌组织中TGF-β1和ALDH1的mRNA水平。胆管细胞癌组织中TGF-β1比正常胆管中高,两者之间具有统计学差异(P = 0.046) (图1(A))。胆管细胞癌组织中ALDH1比正常胆管中稍高,但无统计学差异(P = 0.157) (图1(B))。通过Spearman相关性分析,TGF-β1和ALDH1的表达水平正相关(P = 0.012) (图1(C))。
3.2. 肝内胆管细胞癌组织中TGF-β1和ALDH1蛋白水平的表达
我们用免疫组化检测了58例肝内胆管细胞组织中TGF-β和ALDH的表达情况。TGF-β1在胆管癌组织中主要定位于胞浆和胞膜,低表达组28例,高表达组30例,高表达阳性率为51.72% (图2(A),图2(B))。ALDH1在胆管癌细胞中主要定位于胞浆,ALDH1低表达组23例,高表达组35例,高表达阳性率为60.34% (图2(C),图2(D))。相关性分析提示TGF-β1与ALDH1的表达呈正相关(χ2 = 77.632, P < 0.001) (表1)。
3.3. TGF-β1和ALDH1表达与肝内胆管细胞癌的临床预后分析
将TGF-β1和ALDH1分为低表达和高表达组,在肝内胆管细胞癌进行临床病理特征的相关性分析,结果提示:TGF-β1和ALDH1的表达水平都与肿瘤分化相关(P = 0.003或P = 0.011) (表2)。进一步进行预后分析发现:TGF-β1低表达组的中位生存时间为31.0个月,TGF-β1高表达组的中位生存时间为10.7个月,高表达组总体生存时间短于低表达组(P = 0.012) (图3(A));ALDH1低表达组的中位生存时间为28.7个月,ALDH1高表达组的中位生存时间为14.5个月,高表达组总体生存时间短于低表达组(P = 0.033) (图3(B))。进行Cox回归模型分析,结果提示:TGF-β1表达水平、ALDH1表达水平、肿瘤数目、TNM分期是影响预后的相关因素,多因素回归模型分析显示,TGF-β1表达水平(HR = 2.258, P = 0.014)、肿瘤数目以及TNM分期是预后的独立影响因素(表3)。
4. 讨论
TGF-β1在肿瘤中的作用复杂,既可抑制肿瘤生长,也可促进肿瘤生长 [5] 。有研究发现肿瘤中TGF-β1表达降低,低于正常组织 [6] 。也有研究发现肿瘤中TGF-β1表达增加,高于正常组织 [7] 。我们的研究与后者一致,胆管细胞癌组织中TGF-β1的mRNA表达水平要高于正常胆管,说明TGF-β1可能是胆管细胞癌发生的一个重要因素。TGF-β1既可以由肿瘤细胞本身所分泌,也有一部分来源于肿瘤间质细胞,两者共同发挥作用 [8] 。目前,TGF-β1表达与患者预后的关系尚存在争议。在肺腺癌组织中的免疫组化检测发现,TGF-β1表达水平与患者的预后呈负相关,TGF-β1高表达的患者生存率要低于低表达者 [9] 。而在宫颈癌组织的PCR检测,未发现TGF-β1表达水平与患者的临床预后有明显的相关 [10] 。另外有研究发现在肝癌组织中TGF-β1的mRNA表达水平与患者总体预后正相关,TGF-β1高表达组临床预后更好 [11] 。以上结果的差异可能与各研究者所采用的检测方法不一致有关。我们的研究发现肝内胆管细胞癌组织中的TGF-β1表达水平与术后总体生存成负相关,低表达组生存时间较长,而且TGF-β1表达水平是肝内胆管细胞癌患者术后总体生存的独立预后指标,提示TGF-β1可促进肝内胆管细胞癌的发展。
同时,我们也相应的检测了ALDH1在肝内胆管细胞癌组织中的表达水平。ALDH1在胆管癌组织中mRNA的表达和正常胆管无明显差异,可能是因为ALDH1是正常组织和肿瘤通用的干细胞标记,而正

Figure 1. The expression levels of the mRNAs encoding TGF-β1 and ALDH1 in normal bile ducts and CCA tissues
图1. 定量PCR检测正常胆管和胆管细胞癌中TGF-β1和ALDH1的表达。(A) TGF-β1,(B) ALDH1,(C) 相关性
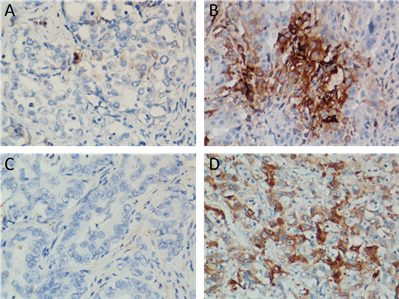
Figure 2. Representative images of TGF-β1and ALDH1 staining in ICC
图2. 免疫组化检测TGF-β1和ALDH1在肝内胆管细胞癌组织中的表达。(A) TGF-β1低表达,(B) TGF-β1高表达,(C) ALDH1低表达,(D) ALDH1高表达
Table 1. The relationship between TGF-β1 and ALDH1 expression in ICC
表1. 肝内胆管细胞癌组织中TGF-β1与ALDH1的相关性
Table 2. Clinicopathological characteristics of TGF-β1 and ALDH1 in ICC patients
表2. TGF-β1和ALDH1的表达与肝内胆管细胞癌临床病理特征的关系
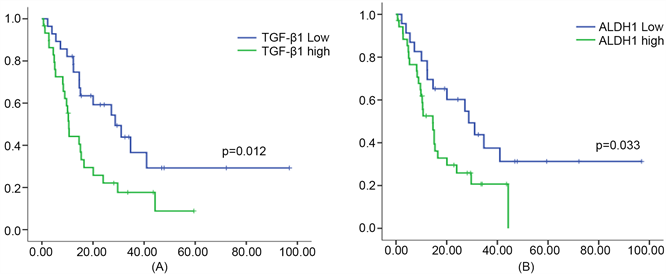
Figure 3. Kaplan-Meier plots of patient overall survival in ICC
图3. TGF-β1和ALDH1在ICC中的总体生存曲线。(A) TGF-β1,(B) ALDH1
Table 3. Univariate and multivariate analyses associated with survival in ICC
表3. 肝内胆管细胞癌预后因素的Cox回归模型因素分析
TNM = tumor-node-metastasis; HR = hazard ratio; CI = confidence interval; NA = not applicable; NS = not significant.
常的胆管干细胞也会有ALDH1的表达。我们通过连续切片的免疫组化发现ALDH1和TGF-β1可以表达在组织中共同的区域内,并且相关性分析也证明两者密切相关。同时,我们发现TGF-β1和ALDH1在分化程度较低的癌组织中表达更高,反映它们主要表达在恶性程度较高的细胞群中。基于干细胞理论,CSCs是维持肿瘤恶性行为和持续生长的主要根源,那么其细胞形态结构将更加原始且处于细胞周期外的静止期,在免疫组化染色下这些细胞就可能会表现为分化较低的细胞群。因此,以上结果也进一步证实了TGF-β1和ALDH1与CSCs关系密切。另外,预后分析表明ALDH1在肝内胆管细胞癌组织中的表达与患者术后总体生存呈负相关。此结果也与其他类型肿瘤中的研究结果保持一致 [12] [13] [14] 。
综上所述,本文对肝内胆管细胞癌组织中TGF-β1和ALDH1表达水平的检测发现:TGF-β1在胆管细胞癌组织中的表达高于正常胆管,提示其可能是胆管细胞癌潜在的肿瘤标志物;TGF-β1与ALDH1表达具有相关性,并且均与肝内胆管细胞癌的患者术后总体生存呈负相关;TGF-β1可作为肝内胆管细胞癌患者术后独立的预后预测指标。
文章引用
双泽宇,李升平. 转化生长因子β1与乙醛脱氢酶1在肝内胆管细胞癌的表达及其临床意义
Expression of TGF-β1 and ALDH1 and Their Clinical Significance in Patients with Intrahepatic Cholangiocarcinoma[J]. 医学诊断, 2017, 07(03): 65-72. http://dx.doi.org/10.12677/MD.2017.73011
参考文献 (References)
- 1. Shaib, Y. and El-Serag, H.B. (2004) The Epidemiology of Cholangiocarcinoma. Seminars in Liver Disease, 24, 115- 125. https://doi.org/10.1055/s-2004-828889
- 2. Blechacz, B.R. and Gores, G.J. (2008) Cholangiocarcinoma. Clinical Liver Disease, 12, 131-150. https://doi.org/10.1016/j.cld.2007.11.003
- 3. Tomita, H., Tanaka, K., Tanaka, T. and Hara, A. (2016) Aldehyde Dehydrogenase 1A1 in Stem Cells and Cancer. Oncotarget, 7, 11018-11032. https://doi.org/10.18632/oncotarget.6920
- 4. Bellomo, C., Caja, L. and Moustakas, A. (2016) Transforming Growth Factor β as Regulator of Cancer Stemness and Metastasis. British Journal of Cancer, 115, 761-769. https://doi.org/10.1038/bjc.2016.255
- 5. Shi, Y. and Massagué, J. (2003) Mechanisms of TGF-Beta Signaling from Cellmembrane to the Nucleus. Cell, 113, 685-700. https://doi.org/10.1016/S0092-8674(03)00432-X
- 6. Paik, S.Y., Park, Y.N., Kim, H. and Park, C. (2003) Expression of Transforming Growth Factor-Beta1 and Transforming Growth Factor-Beta Receptors in Hepatocellular Carcinoma and Dysplastic Nodules. Modern Pathology, 16, 86- 96. https://doi.org/10.1097/01.MP.0000047308.03300.9C
- 7. Bedossa, P., Peltier, E., Terris, B., Franco, D. and Poynard, T. (1995) Transforming Growth Factor-Beta 1 (TGF-Beta 1) and TGF-Beta 1 Receptors in Normal, Cirrhotic, and Neoplastic Human Livers. Hepatology, 21, 760-766.
- 8. Tirado-Rodriguez, B., Ortega, E., Segura-Medina, P. and Huerta-Yepez, S. (2014) TGF-β1: An Im-portant Mediator of Allergic Disease and a Molecule with Dual Activity in Cancer Development. Journal of Immunology Research, Artical ID: 318481. https://doi.org/10.1155/2014/318481
- 9. Takanami, I., Imamura, T., Hashizume, T., Kikuchi, K., Yamamoto, Y. and Kodaira, S. (1994) Transforming Growth Factor Beta 1 as a Prognostic Factor in Pulmonary Adenocarcinoma. Journal of Clinical Pathology, 47, 1098-1100. https://doi.org/10.1136/jcp.47.12.1098
- 10. Hazelbag, S., Kenter, G.G., Gorter, A. and Fleuren, G.J. (2004) Prognostic Relevance of TGF-Beta1 and PAI-1 in Cervical Cancer. International Journal of Cancer, 112, 1020-1028. https://doi.org/10.1002/ijc.20512
- 11. Ikeguchi, M., Iwamoto, A., Taniguchi, K., Katano, K. and Hirooka, Y. (2005) The Gene Expression Level of Transforming Growth Factor-Beta (TGF-Beta) as a Biological Prognostic Marker of Hepatocellular Carcinoma. Journal of Experimental & Clinical Cancer Research, 24, 415-421.
- 12. Ginestier, C., Hur, M.H., Charafe-Jauffret, E., Monville, F., Dutcher, J., Brown, M., Jacquemier, J., Viens, P., Kleer, C.G., Liu, S., Schott, A., Hayes, D., Birnbaum, D., Wicha, M.S. and Dontu, G. (2007) ALDH1 Is a Marker of Normal and Malignant Human Mammary Stem Cells and a Predictor of Poor Clinical Outcome. Cell Stem Cell, 1, 555-567. https://doi.org/10.1016/j.stem.2007.08.014
- 13. Minato, T., Yamamoto, Y., Seike, J., Yoshida, T., Yamai, H., Takechi, H., Yuasa, Y., Furukita, Y., Goto, M., Bando, Y. and Tangoku, A. (2013) Aldehyde Dehydrogenase Expression Is Associated with Poor Prognosis in Patients with Esophageal Squamous Cell Carcinoma. Annals of Surgical Oncology, 20, 209-217. https://doi.org/10.1245/s10434-012-2535-8
- 14. Wu, A., Luo, W., Zhang, Q., Yang, Z., Zhang, G., Li, S. and Yao, K. (2013) Aldehyde Dehydrogenase, a Functional Marker for Identifying Cancer Stem Cells in Human Carcinoma. Cancer Letter, 330, 181-189. https://doi.org/10.1016/j.canlet.2012.11.046
