Hans Journal of Agricultural Sciences
Vol.
11
No.
07
(
2021
), Article ID:
43856
,
8
pages
10.12677/HJAS.2021.117086
利用微滴式数字PCR技术检测初榨菜籽油中的转基因成分
龙云凤1,王宇1,马丽1,王毅谦1*,刘二龙2,陈君义3,吕永生1,刘芸1,沈伟健1, 刘津4,高东微4,王茂华5
1南京海关动植物与食品检测中心,江苏 南京
2黄埔海关,广东 广州
3徐州海关,江苏 徐州
4广州海关技术中心,动植物与食品进出口技术措施研究重点实验室,广东 广州
5国家认证认可监督管理委员会认证认可技术研究所,北京
收稿日期:2021年6月10日;录用日期:2021年7月6日;发布日期:2021年7月14日

摘要
我国是食用植物油脂、油料进口大国,鉴于全球转基因油菜种植现状,由转基因油菜籽加工而成的菜籽油已经成为了消费者生活中的食用油,判定食用的菜籽油是否含有转基因成分,是国家监管部门和公众消费者密切关注的问题。食用植物油转基因成分检测技术长期以来受限于油脂中的核酸分离纯化,目前为止暂无现行有效的检测标准。本研究同时采用实时荧光PCR技术和微滴式数字PCR (ddPCR)技术检测初榨菜籽油中的外源基因成分,初探ddPCR技术用于检测食用植物油中转基因成分的可行性,结果显示,ddPCR检测结果与实时荧光PCR结果一致,均能检出转基因初榨菜籽油中的转基因成分,为后续开展食用植物油中转基因成分精准定量检测奠定了基础。
关键词
初榨菜籽油,转基因,DNA,微滴式数字PCR

Detection of Genetically Modified Virgin Colza Oil by Droplet Digital PCR
Yunfeng Long1, Yu Wang1, Li Ma1, Yiqian Wang1*, Erlong Liu2, Junyi Chen3, Yongsheng Lv1, Yun Liu1, Weijian Shen1, Jin Liu4, Dongwei Gao4, Maohua Wang5
1Animal, Plant and Food Inspection Center of Nanjing Customs, Nanjing Jiangsu
2Huanpu Customs, Guangzhou Guangdong
3Xuzhou Customs, Xuzhou Jiangsu
4Guangdong Key Laboratory of Import and Export Technical Measures of Animal, Plant and Food, Guangzhou Customs Technology Center, Guangzhou Guangdong
5Chian Certification & Accreditation Institute, Beijing
Received: Jun. 10th, 2021; accepted: Jul. 6th, 2021; published: Jul. 14th, 2021

ABSTRACT
China is one of the biggest importers of edible vegetable oils and oilseeds. The oil made from transgenic rapeseed has become cooking oil in consumers’ daily life if we look in view of the status of transgenic rape planting scale, thus, whether cooking oil contains transgenic ingredients concerns national regulators and the public. For a long time, detection of transgenic components in edible vegetable oil has been limited by the separation and purification of nucleic acids, and there is no effective detection standard currently. In present study, we detected exogenous transgenic components of rapeseed oil by using real-time fluorescent PCR and droplet digital PCR at the same time to see if ddPCR technology is suitable for detection of genetically modified ingredients in edible vegetable oil. The results showed that ddPCR test result is consistent with real-time fluorescence PCR, modified ingredients in virgin rapeseed oil are all detected genetically. This result laid a groundwork for accurate quantitative detection of transgenic components in edible oil in the near future.
Keywords:Virgin Rapeseed Oil, Transgene, DNA, Droplet Digital PCR

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
食用植物油是极为重要的民生必需物资。菜籽油是我国第二大食用植物油,在我国食用植物油消费中占比超过25%。根据《农业转基因生物标识管理办法》,食用植物油脂中大豆油、菜籽油和玉米油属于农业转基因生物目录中规定实施标识管理的种类 [1]。随着经济的快速发展和人们生活水平的不断提高,中国食用油消费呈稳步上升的趋势。据测算,中国食用油年人均消费量已经从1990年代初的不足6公斤猛增至22.5公斤 [2]。目前,中国已经成为世界上最大的油料生产国、最大的食用油生产国、最大的食用油进口国和最大的食用油消费国,2020年,我国进口食用油籽10,614万吨,进口食用植物油1170万吨,创历史最高纪录 [3]。我国的食用油及油料严重依赖进口,食用油自给率仅约为30%,其中我国进口菜籽油来源呈现单一化格局,近十年加拿大进口菜籽油长期占比在70%以上,全球现有商业化转基因油菜品系46个,其中加拿大批准种植用途23个。根据加拿大油菜籽协会的统计数据,加拿大种植的油菜籽中超过95%为转基因产品,约85%加拿大油菜籽作物以各种形式出口,转基因油菜籽是带有“加拿大制造”标签的标志性农产品。与此同时,我国批准进口加工用途的转基因油菜籽品系9个,未批准任何品系进行商业化种植。因此,国内市场上的菜籽油存在转基因产品标识管理和配套转基因成分鉴别检测的需要。
微滴数字PCR (droplet digital PCR, ddPCR)是20世纪90年代末发展起来的一种核酸分子绝对定量技术 [4] [5]。数字PCR的工作原理在于将DNA样品分割为许多单独、平行的PCR反应单元,每个反应单元中不包含或包含一个到多个目的核酸序列,独立地进行PCR扩增,当PCR扩增完成后,利用微滴读取仪逐个对每个微滴进行检测,再根据统计学中的泊松分布原理分析阳性微滴的个数与比例,即可得出靶分子的起始拷贝数或浓度,从而实现对低至单个拷贝的核酸分子的绝对定量。数字PCR对核酸分子进行定量检测时不依赖标准曲线和标准物质,在转基因定量检测中可直接计算出模板中外源基因的拷贝数浓度值和转基因含量,近年来不少国内外学者将数字PCR方法运用于转基因成分检测分析。Corbisier等 [6] 最先将数字PCR方法应用在转基因成分的定量中,其建立的检测品系Mon810数字PCR方法定量结果与实时荧光PCR方法结果较为一致。梁文等 [7] 建立了转基因玉米MON89034、MON810和MIR162数字PCR定量检测方法。Dobnik等 [8] 利用微滴数字PCR分别建立两套多重定量方法,可对DAS1507、DAS59122等12个品系的转基因玉米进行定量,其检出限、重复性和真实性均符合国际标准中的GMO的定量要求。
本研究选取花椰菜花叶病毒35S启动子基因(pCaMV35S)、农杆菌的胭脂碱合成酶基因终止子基因(tNOS)、玄参花叶病毒35S启动子基因(pFMV35S)以及豌豆二磷酸核酮糖羧化酶基因的终止子基因(tE9)为检测靶标,并以磷酸烯醇式丙酮酸羧化酶基因(PEP)作为油菜内参照基因,同时采用ddPCR方法和qPCR方法检测4份初榨菜籽油,初步探索ddPCR技术用于食用植物油中转基因成分检测的可行性。
2. 材料与方法
2.1. 材料
本实验检测的4份初榨菜籽油样品由江苏某粮油公司提供,是采用压榨法获得的初榨菜籽油,样品编号分别为183、234、301、300;食用植物油DNA提取试剂盒购于宁波市重鼎生物技术有限公司;实时荧光PCR预混液购自上海辉睿生物科技有限公司,ddPCR Supermix for Probes、Droplet Generation Oil、Droplet Reader Oil购于美国Bio-Rad公司。
2.2. 仪器
QX200TM Droplet DigitalTMPCR系统(Bio-Rad,美国,包括PCR扩增仪、微滴生成仪和微滴读取仪),ABI VIIA7荧光定量PCR仪(Applied Biosystem,美国),Nanodrop ND-1000核酸蛋白定量仪(Thermo Scientific,美国)。
2.3. 实验方法
2.3.1. 初榨菜籽油核酸提取
本实验采用试剂盒法提取初榨菜籽油中的DNA,该试剂盒主要的原理是通过一种含有DNA亲和配体脂溶性载体,可以特异性结合食用植物油中的游离DNA,通过离心过柱,载体-DNA复合物吸附在离心柱内膜,再通过工具酶A切割释放DNA,最后使用微量离心柱对DNA进行浓缩纯化。
2.3.2. 引物和探针
数字PCR和实时荧光PCR反应涉及的引物和探针序列参照SN/T 1204-2016《植物及其加工产品中转基因成分实时荧光PCR定性检验方法》,由生工生物工程(上海)股份有限公司合成,选择PEP基因作为菜籽油中转基因成分检测的内源参基因,具体序列见表1。
Table 1. Sequence of primers and probes
表1. 引物和探针序列
2.3.3. 实时荧光PCR反应体系和反应条件
实时荧光PCR反应体系为:HR qPCR Master Mix 12.5 μL,上、下游引物各1 μL (浓度为10 μmoL/L),探针0.7 μL (浓度10 μmoL/L),DNA模板5 μL,加ddH2O至25 μL。PCR反应条件:95℃热激活及变性5 min,95℃变性18 s,60℃退火55 s,42个循环,退火时采集FAM荧光信号。
2.3.4. ddPCR反应体系及反应条件
ddPCR反应体系为:上、下游引物各1.8 μL (浓度为10 μmoL/L),探针0.5 μL (浓度10 μmoL/L),ddPCR Super mix for Probes 10 μL,DNA模板5 μL,加ddH2O至20 μL。将配制好的20 μL反应液和70 μL微滴生成油分别加入微滴生成卡的对应位置,盖上一次性胶垫,放入微滴生成仪中生成微滴,将40 μL微滴全部转移至96孔板中,盖上专用铝膜后放进预热至180℃的PX1热封仪中封膜5 s,取出后利用普通PCR仪进行扩增。PCR反应参数:95℃热激活及变性10 min,95℃变性30s,60℃退火1 min,40个循环,98℃酶失活10 min,4℃保存,整个扩增过程升降温速度设置为2℃/S。PCR反应结束后,将96孔板平缓地放入微滴读取仪(QX200 droplet reader)中收集微滴信号,采用QuantaSoft Version 1.7.4.0917软件分析数据。每个样品ddPCR反应设置2个平行。
2.3.5. ddPCR结果判定
空白对照无扩增信号,各目标基因阳性对照均有扩增,说明ddPCR实验有效,可进行检测样品结果判定。ddPCR采用直接计数的方法进行拷贝数分析,认为有荧光信号反应单元中至少包含一个拷贝的目标分子,整体符合泊松分布。
3. 结果与分析
3.1. 初榨菜籽油样品DNA提取
本实验取样量为50 mL,提取过程按照试剂盒说明书进行。提取后采用超微量分光光度计测定DNA的浓度,提取的各油样DNA浓度见表2。实时荧光PCR扩增结果显示(图1):183、234、300、301四个待测样本的内参照PEP基因扩增Ct值依次为29.47、32.01、31.64、34.69,均小于35。ddPCR扩增结果显示(图2):183、234、300、301四个待测样本的内参照PEP基因拷贝数依次为:17.9、16.4、14.7、9.2 copies/μL,两个实验的结果均表明此次实验采用的DNA提取试剂盒从4份初榨的菜籽油中提取到了有效核酸,可继续进行外源基因的检测。
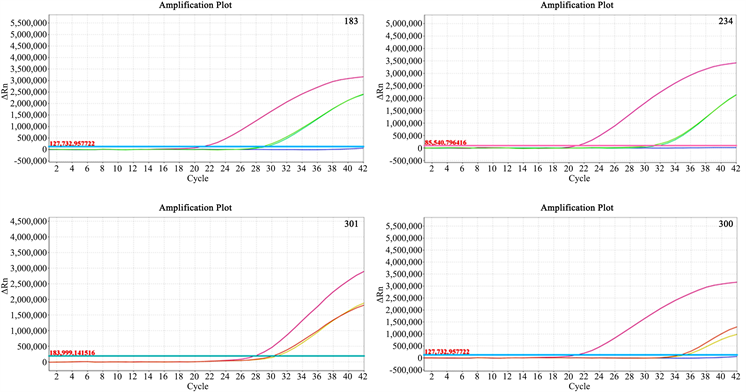
Figure 1. Results of qPCR amplification of PEP gene in rape
图1. 实时荧光PCR扩增油菜内参照PEP基因结果
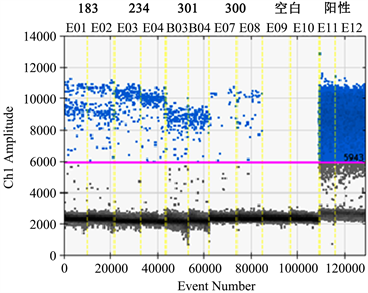
Figure 2. Results of ddPCR amplification of PEP gene in rape
图2. ddPCR扩增油菜内参照PEP基因结果
3.2. ddPCR检测初榨菜籽油中转基因成分
ddPCR对4个油样外源基因的检测结果见图3,从检测结果可以看出183和234号样品的pCaMV35S、tNOS、pFMV35S、tE9四种外源基因均检出,301号样品pCaMV35S、tNOS检出,pFMV35S、tE9未检出,300号样品四个外源基因均未检出。
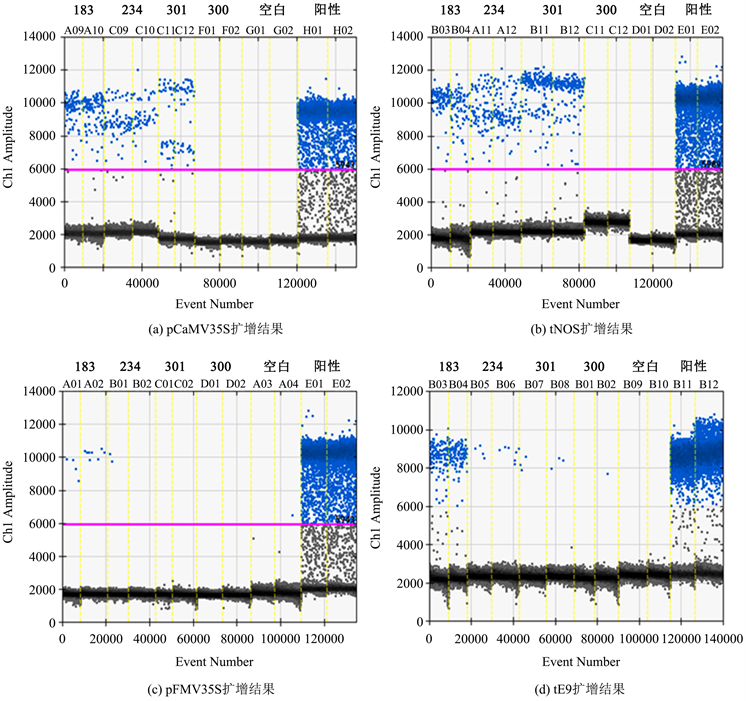
Figure 3. Results of ddPCR amplification
图3. ddPCR方法检测结果
3.3. 初榨菜籽油中转基因成分分析
同时采用qPCR和ddPCR方法对四份初榨菜籽油进行转基因成分检测,检测结果见表2。qPCR检测结果中,184的pFMV35S、234的pFMV35S和tE9基因扩增Ct值介于36~40之间,不能立即判定结果,需进行复测。而ddPCR方法检测对应的3个基因的拷贝数分别为0.65、0.25和0.52 copies/μL,均可判为检出。其余的指标二种检测方法的检测结果一致。
Table 2. Analysis of genetically modified components in virgin oil
表2. 初榨菜籽油中转基因成分分析表
4. 讨论
利用PCR方法检测加工食品中的转基因成分,主要依赖于分离DNA质量、纯度和总量 [9],食用植物油生产过程中的高温高压对DNA的破坏,以及DNA在食用油中的溶解度非常小,因此如何富集和提取纯化油脂中残存的痕量核酸成为这类样品中转基因成分鉴别检测的关键点。现有研究表明,食用植物油脂中核酸的提取成功率与自身含水量有关,而油料含水量通常在自身质量的5%以下,导致油料中基本不含有核酸类物质。此外,不同加工工艺和质量等级的食用植物油残余核酸存在状况差别很大,浸出工艺制得的油料因蒸馏原因残留的水分极少,核酸残余更差;精炼工艺步骤和程度越高对核酸造成的破坏越大;油脂中残余的各种植物代谢物质在核酸提取纯化的过程中会伴随核酸得到富集浓缩,这些代谢物质包括蛋白质、多酚、脂类和色素等,对下游的基因扩增等核酸检测造成干扰。本实验室一直在探索食用植物油中DNA的提取技术,本研究中使用的食用植物油DNA提取试剂盒,可以从50~100 mL初榨的菜籽油或者大豆毛油中获得有效核酸量,即内标基因PEP和Lectin能够有效扩增,保证了后续转基因成分检测的顺利进行。
目前已有70多个国家和地区出台了关于转基因产品标识管理的法规 [9] [10],对含有转基因成分的产品实施标识管理,我国目前对转基因产品实施的是定性标识,但随着检测技术的不断完善和国际贸易的需求,我国的管理法规必将与世界其他国家接轨,对转基因产品实施定量标识管理。qPCR目前是最常用的转基因成分检测技术,当进行定量检测时,需依赖标准品或标准质粒的构建,相比较而言,ddPCR不需要制作标准曲线,也避免了昂贵的标准物质的使用,以及PCR扩增效率差异对实验结果的影响 [11]。本研究采用ddPCR对初榨菜籽油的转基因成分进行了检测,检测的4份初榨菜籽油中,3份检出外源基因成分,1份未检出,检测结果与实时荧光PCR一致,为后续深入开展ddPCR检测食用植物油中转基因成分奠定了基础。
基金项目
国家重点研发计划项目(2018YFF0215605);南京海关科技计划项目(2021KJ18)。
文章引用
龙云凤,王 宇,马 丽,王毅谦,刘二龙,陈君义,吕永生,刘 芸,沈伟健,刘 津,高东微,王茂华. 利用微滴式数字PCR技术检测初榨菜籽油中的转基因成分
Detection of Genetically Modified Virgin Colza Oil by Droplet Digital PCR[J]. 农业科学, 2021, 11(07): 622-629. https://doi.org/10.12677/HJAS.2021.117086
参考文献
- 1. 中华人民共和国农业农村部. 政策解读农业转基因生物标识管理办法[EB/OL]. http://www.kjs.moa.gov.cn/zcjd/201904/t20190418_6184800.htm, 2021-06-12.
- 2. 李忠远. 中国食用油安全规制研究[D]: [博士学位论文]. 沈阳: 辽宁大学, 2015.
- 3. 张立伟. 2020年我国油脂油料进口特点及2021年进口展望[J]. 黑龙江粮食, 2021(4): 32-34.
- 4. Sykes, P.J., Neoh, S.H., Brisco, M.J., et al. (1992) Quantitation of Targets for PCR by Use of Limiting Dilution. BioTechniques, 13, 444-449.
- 5. Vogelstein, B. and Kinzler, K.W. (1999) Digital PCR. PNAS, 96, 9236-9241. https://doi.org/10.1073/pnas.96.16.9236
- 6. Corbisier, P., Bhat, S., Partis, L., et al. (2010) Absolute Quantification of Genetically Modified MON810 Maize (Zea mays L.) by Digital Polymerase Chain Reaction. Analytical and Bioanalytical Chemistry, 396, 2143-2150. https://doi.org/10.1007/s00216-009-3200-3
- 7. 梁文, 杨镇州, 李妍, 等. 转基因玉米MON89034、MON810、MIR162 双重数字PCR 定量方法的建立[J]. 中国测试, 2019, 45(6): 70-76.
- 8. Dobnik, D., Spilsberg, B., Bo-gozalec, K.A., et al. (2015) Multiplex Quantitative of 12 European Union Authorized Genetically Modified Maize Lines with Droplet Digital Polymerase Chain Reaction. Analytical and Chemistry, 87, 8218-8226. https://doi.org/10.1021/acs.analchem.5b01208
- 9. Nicolas, G. (2010) Effect of Food Processing on Plant DNA Degradation and PCR-Based GMO Analysis: A Review. Analytical and Bioanalytical Chemistry, 396, 2003-2022. https://doi.org/10.1007/s00216-009-3343-2
- 10. Wang, X., Chen, X., Xu, J., et al. (2012) Degradation and Detec-tion of Transgenic Bacillus Thuringiensis DNA and Proteins in Flour of Three Genetically Modified Rice Events Sub-mitted to a Set of Thermal Processes. Analytical and Bioanalytical Chemistry, 405, 6831-6844.
- 11. 郑子繁, 柳方方, 刘卫晓, 等. 数字PCR技术在核酸标准物质研制中的应用[J]. 生物技术进展, 2020, 10(6): 579-584.
NOTES
*通讯作者。
