Traditional Chinese Medicine
Vol.05 No.04(2016), Article ID:19025,7
pages
10.12677/TCM.2016.54020
Chemical Constituents from the Root of Heterosmilax yunnanensis Gagnep.
Aigang Yang1,2, Ji Ye1, Lijuan Mei1, Lina Hai2, Wenjie Qin2, Minghua Li2, Weidong Zhang1*
1School of Pharmacy, Second Military Medical University, Shanghai
2Beijing Zhendong Guangming Pharmaceutical Institute Co., Ltd., Beijing

Received: Oct. 29th, 2016; accepted: Nov. 20th, 2016; published: Nov. 23rd, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The root of Heterosmilax yunnanensis Gagnep. is the main component of anti-cancer drug Compound Kushen Injection. The chemical constituents in its high polarity fraction were investigated in this research. Twelve compounds were isolated from 30% ethanol macroporous resin fractions of the root of Heterosmilax yunnanensis Gagnep. and identified as: macrozamin (1), cycasin (2), 3,4,5-trihydroxy benzaldehyde (3), 3,4-dihydroxy benzaldehyde (4), 4-hydroxy benzoic acid (5), 3,4-dihydroxy benzoic acid (6), 2,5-dihydroxy-benzoic acid (7), 3,5-dimethoxyl -4-hydroxy benzoic acid (8), trans-Cinnamic acid (9), 4-ethyoxyl-Cinnamic acid (10), 4-(dimeth-oxymethyl)-phenol (11), N-3-(3,5-dihydroxy-4,4-dimethyl-1-oxopentyl)-β-Alanine (12) respectively. All compounds except 1 are firstly isolated from the Heterosmilax yunnanensis Gagnep. These compounds can support abundant material basis for the further research of Heterosmilax yunnanensis Gagnep.
Keywords:Rhizoma heterosmilacis, Heterosmilax yunnanensis Gagnep., Macrozamin, Cycasin, Compound Kushen Injection

中药短柱肖菝葜根部位化学成分的研究
杨爱岗1,2,叶霁1,梅丽娟1,海丽娜2,秦文杰2,李明花2,张卫东1*
1第二军医大学药学院,上海
2北京振东光明药物研究院有限公司,北京

收稿日期:2016年10月29日;录用日期:2016年11月20日;发布日期:2016年11月23日

摘 要
短柱肖菝葜根部入药,习称“白土苓”,是抗肿瘤药物复方苦参注射液的味药之一,对其的化学成分和药理活性研究较少。本文主要对中药短柱肖菝葜根部位中的高极性化学成分展开研究,从中共分离和鉴定了12个化合物:大泽明素(1)、苏铁素(2)、3,4,5-三羟基苯甲醛(3)、3,4-二羟基苯甲醛(4)、4-羟基苯甲酸(5)、3,4-二羟基苯甲酸(6)、2,5-二羟基苯甲酸(7)、3,5-二甲氧基-4-羟基苯甲酸(8)、反式桂皮酸(9)、4-乙氧基-苯丙烯酸(10)、4-(二甲氧基甲基)-苯酚(11)和N-3-(3,5-dihydroxy-4,4-dimethyl-1-oxopentyl)- β-Alanine (12)。除化合物1以外,其他化学成分均是首次从该属植物中分离得到,该项研究丰富了短柱肖菝葜的物质基础。
关键词 :白土苓,短柱肖菝葜,大泽明素,苏铁素,复方苦参注射液

1. 研究背景
复方苦参注射液是以苦参为君药,短柱肖菝葜为臣药,将二者经现代科学方法精制而成的中药注射液,具有抗癌止血、治疗癌肿疼痛、抑制癌细胞扩散、改善患者生存质量、调节机体免疫力等明显效果。目前岩舒已经广泛应用于肺癌、肝癌、胃癌、乳腺癌、肠癌、食管癌、胰腺癌、宫颈癌、膀胱癌、淋巴瘤、前列腺癌等实体瘤的联合治疗 [1] 。处方中的君药苦参,国内外的学者对其的化学成分以及药理活性等研究较多 [2] [3] ,而臣药短柱肖菝葜的研究却很少。
中药注射液是中医理论与现代科学技术相结合的结晶,因其在使用中起效快,毒副作用小,多成分、多靶点、双向调节的特点,也引起国际社会的极大关注 [4] [5] 。但由于注射剂直接越过人体许多屏障进入组织、器官,使用中的安全性尤其重要。为了使复方苦参注射液的生产工艺更加完善、生产过程更加可控、活性成分更加明确、作用机理更加清楚、质量标准更加严格、临床使用更加安全有效,本文对复方苦参注射液对短柱肖菝葜开展物质基础研究,为复方苦参注射液的深度研究提供科学依据和技术支撑。
短柱肖菝葜Heterosmilax yunnanensis Gagnep.是百合科(Liliaceae)肖菝葜属Heterosmilax的多年生攀缘灌木,民间习称“白土苓”。其干燥块茎可药用,具有清热、除湿、解毒、通利关节之功能,临床用于湿热淋浊,带下,痈肿,瘰疠,疥癣,梅毒,筋骨挛痛,以及钩端螺旋体病,广泛分布于湖南、湖北、广西、四川、贵州、云南等地 [6] 。现代药理学研究表明短柱肖菝葜具有抗炎镇痛,调节免疫,抑菌解毒以及抗肿瘤等作用 [7] ,文献报道从短柱肖菝葜中分离得到的化合物包括有挥发油,三萜及皂苷类,黄酮,蒽醌及其苷类以及酚酸类等成分 [8] 。苦参和短柱肖菝葜均为根部入药,复方苦参注射液的制备工艺主要是对药材进行1%醋酸水溶液提取,然后乙醇梯度醇沉,因此进入注射液的主要是药材中的高极性成分。基于此,我们对短柱肖菝葜根部的高极性部位展开了研究。
短柱肖菝葜根部药材饮片用95%乙醇回流提取,大孔树脂极性切段,发现中高极性成分主要集中在30%大孔树脂部位,对该段成分进行系统分离。采用大孔树脂、正相及反相硅胶色谱、Sephadex LH-20、半制备液相等色谱方法进行分离纯化,应用质谱、核磁等波谱技术鉴定化合物的结构。从中共分离和鉴定了12个化合物:大泽明素(1)、苏铁素(2)、3,4,5-三羟基苯甲醛(3)、3,4-二羟基苯甲醛(4)、4-羟基苯甲酸(5)、3,4-二羟基苯甲酸(6)、2,5-二羟基苯甲酸(7)、3,5-二甲氧基-4-羟基苯甲酸(8)、反式桂皮酸(9)、4-乙氧基-苯丙烯酸(10)、4-(二甲氧基甲基)-苯酚(11)和N-3-(3,5-dihydroxy-4,4-dimethyl-1-oxopentyl)-β-Ala- nine (12)。化合物2~12均为首次从该属植物中分离得到。
2. 研究方法
2.1. 仪器与材料
柱色谱硅胶(200~300目)和薄层色谱硅胶GF254 (烟台江友硅胶开发有限公司);大孔树脂(SP325,日本三菱化学);SephadexLH-20(40~70 μm)填料,ODS填料(日本YMC公司);ASCEND 500 MHz核磁共振波谱仪(瑞士Bruker公司);Agilent LC/MSD和Agilent Q-TOF高分辨质谱仪(美国Agilent公司);OSB-2100旋转蒸发仪(日本EYELA公司);ALLTECH半制备高效液相(美国奥泰公司);Perkin-Elmer 341数字旋光仪(美国Perkin-Elmer公司);Buchi Sepacore C-615中压制备色谱系统(瑞士Buchi公司)。
短柱肖菝葜药材于2013年7月份采自贵州安顺地区,经中国科学院植物研究所林祁馆长鉴定为百合科肖菝葜属植物短柱肖菝葜Heterosmilax yunnanensis Gagnep.,植物标本现保存在中国科学院植物研究所标本馆。
2.2. 提取与分离
取短柱肖菝葜药材15公斤,经粉碎后以8倍量95%乙醇回流提取2次,每次2 h,合并提取液,滤过,浓缩至无乙醇,上大孔树脂,依次用纯水,30%乙醇,70%乙醇以及95%乙醇洗脱,分别得到水层,30%乙醇层,70%乙醇层以及95%乙醇洗脱成分。对大孔树脂洗脱的各段成分进行薄层分析和HPLC液相分析,分析表明:水层中主要是糖类成分,30%乙醇层为酚酸类、糖苷类成分,而70%和95%乙醇层主要是黄酮和萜类成分,与复方苦参注射液成品的化学成分比对,发现30%乙醇洗脱部位的成分与之相似,因此对该部分成分进行系统分离和纯化。
30%乙醇层110 g,经正相硅胶柱,用二氯甲烷–甲醇梯度洗脱,获得12个组分(F1~F12)。取30%乙醇部位组分F11 (45 g)用水溶解,经反相硅胶柱色谱,用甲醇–水(50%~100%)梯度洗脱,再经凝胶柱色谱,半制备高效液相纯化以及重结晶的方法,分别获得化合物1 (20 g)、2 (300 mg);取30%乙醇部位组分F3、F4、F5 (共12 g),合并3个组分经反相硅胶柱色谱,用甲醇–水(30%~80%)溶剂体系梯度洗脱,再经凝胶色谱、半制备高效液相获得化合物3 (12.4 mg)、4 (16.6 mg)、5 (30.5 mg)、6 (50.4 mg)、7 (11.5 mg)、8 (18.4 mg)、9 (10.3 mg)、10 (12.4 mg)、11 (15.4 mg);取30%乙醇部位组分F8 (共1.2 g),用反相ODS切段后,采用凝胶色谱分离纯化得到化合物12 (300 mg)。化合物1~12结构式见图1。
3. 结果与讨论
3.1. 化合物的结构鉴定
化合物1:白色簇晶,[α] 25D -70.1˚ (c 0.4 in H2O),ESI-MS准分子离子峰m/z 407 [M+Na]+,结合化合物的1H-NMR和13C-NMR谱,确定化合物的分子式:C13H24N2O11,不饱和度为3。1H-NMR(500MHz, DMSO-d6) δ: 4.56 (1H, d, J = 7.9 Hz, H-1), 3.28 (1H, d, J = 8.3 Hz, H-2), 3.40 (1H, m, H-3), 3.38 (1H, m, H-4), 3.48 (1H, m, H-5), 4.04 (1H, d, J = 11.7 Hz, H-6a), 3.73 (1H, m, H-6b), 5.12 (1H, d, J = 16.5 Hz, H-7a), 5.03 (1H, d, J = 16.5 Hz, H-7b), 4.02 (3H, s, H-8), 4.33 (1H, d, J = 7.8 Hz, H-1’), 3.18 (1H, m, H-2’), 3.33 (1H, m, H-4’), 3.51 (1H, m, H-4’), 3.85 (1H, d, J = 16.6 Hz, H-5’a), 4.33 (1H, d, J = 16.6 Hz, H-6’b); 13C-NMR (125MHz, DMSO-d6) δ: 101.2 (C-1), 72.8 (C-2), 75.5 (C-3), 69.1 (C-4), 75.0 (C-5), 68.6 (C-6), 82.2 (C-7), 56.6
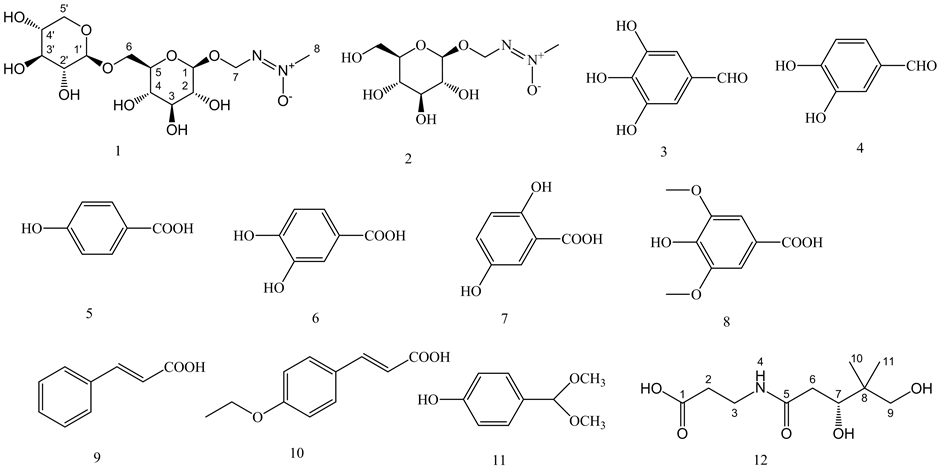
Figure 1. Structures of compounds 1-12
图1. 化合物1~12的结构式
(C-8), 103.5 (C-1’), 72.9 (C-2’), 75.6 (C-3’), 69.2 (C-4’), 65.1 (C-5’)。以上数据和文献报道一致 [9] ,故鉴定化合物为大泽明素(macrozamin)。
化合物2:白色粉末,ESI-MS准分子离子峰m/z 275 [M+Na]+,结合化合物的1H-NMR和13C-NMR谱,确定其分子式:C8H16N2O7,不饱和度为2,易溶于水,UV显示化合物在215 nm处有最大吸收,而且保留时间和紫外图谱都和大泽明素相近,推断为甲基氧化偶氮糖苷类成分。1H-NMR (500 MHz, D2O) δ: 4.61 (1H, d, J = 7.9 Hz, H-1), 3.32 (1H, d, J = 8.3 Hz, H-2), 3.38 (1H, m, H-3), 3.46 (1H, m, H-4), 3.37 (1H, m, H-5), 3.86 (1H, d, J = 12.4 Hz, H-6a), 3.67 (1H, m, H-6b), 5.18 (1H, d, J = 16.6 Hz, H-7a), 5.08 (1H, d, J = 16.6 Hz, H-7b), 4.07 (3H, s, H-8); 13C-NMR (125 MHz, D2O) δ: 99.0 (C-1), 70.7 (C-2), 73.9 (C-3), 73.3 (C-4), 67.2 (C-5), 58.3 (C-6), 80.0 (C-7), 54.3 (C-8)。以上数据和文献报道一致 [10] ,故鉴定化合物为苏铁素Cycasin。
化合物3:白色粉末,ESI-MS m/z 153 [M-H]-,分子组成:C7H6O4,不饱和度为5。1H-NMR (500 MHz, DMSO-d6) δ: 9.62 (1H, s, H-7), 9.41 (3H,brs, 3,4,5-OH), 6.84 (2H, s, H-2,6);13C-NMR (125 MHz, DMSO-d6) δ: 191.8 (C-7), 146.6 (C-3,5), 140.7 (C-4), 127.9 (C-1), 109.2 (C-2, 6)。以上波谱数据与文献报道一致 [11] ,从而确定化合物结构为3,4,5-三羟基苯甲醛(3,4,5-three hydroxy benzaldehyde)。
化合物4:白色粉末,ESI-MS,m/z 137 [M-H]-,分子组成:C7H6O3,不饱和度为5。1H-NMR (500 MHz, DMSO-d6) δ: 12.32 (1H, brs, -COOH), 9.57 (1H, brs, -OH), 9.33 (1H, brs, -OH), 7.34 (1H, d, J = 1.8 Hz, H-6), 7.28 (1H, dd, J = 1.79, 8.2 Hz, H-4), 6.79 (1H, d, J = 8.2 Hz, H-3); 13C-NMR (125 MHz, DMSO-d6) δ: 167.8 (C-7), 150.5 (C-2), 145.3 (C-5), 122.3 (C-4), 122.1 (C-1) 117.0 (C-6), 115.6 (C-3)。以上波谱数据与文献报道一致 [12] ,从而确定化合物结构为3,4-二羟基苯甲醛(3,4-dihydroxy benzaldehyde)。
化合物5:白色粉末,ESI-MS m/z 137 [M-H]-,分子组成:C7H6O3,不饱和度为5。1H-NMR (500 MHz, DMSO-d6) δ: 12.61 (1H, brs, -COOH), 9.21 (1H,brs, 4-OH), 7.79 (2H, d, J = 8.3, H-2, 6),6.83 (2H, d, J = 8.3, H-3, 5); 13C-NMR (125 MHz, DMSO-d6) δ: 167.6 (C-7), 162.1 (C-4), 132.0 (C-2, 6), 121.8 (C-1), 115.6 (C-3, 5)。以上波谱数据与文献报道 [13] 的数据一致,从而确定化合物结构为4-羟基苯甲酸(4-hydroxy benzoic acid)。
化合物6:白色粉末,ESI-MS,m/z 153 [M-H]-,分子组成:C7H6O4,不饱和度为5。1H-NMR (500 MHz, DMSO-d6) δ: 7.17 (1H, d, J = 3.1 Hz), 6.94 (1H, dd, J = 3.1, 8.8 Hz), 6.77 (1H, d, J = 8.8 Hz); 13C-NMR (125 MHz, DMSO-d6) δ: 172.3 (C-7), 154.6 (C-4), 150.0 (C-3), 123.9 (C-6), 118.1 (C-2), 115.1 (C-5), 113.5 (C-1)。以上波谱数据与文献报道一致 [14] ,从而确定化合物结构为3,4-二羟基苯甲酸(3,4-dihydroxy benzoic acid)。
化合物7:白色粉末,ESI-MS m/z 153 [M-H]-,分子组成:C7H6O4,不饱和度为5。1H-NMR (500 MHz, DMSO-d6) δ: 9.70 (1H, s, H-7), 7.27 (1H, dd, J = 1.99, 7.97 Hz), 7.23 (1H, d, J = 1.99 Hz), 6.91 (1H, d, J = 7.97 Hz); 13C-NMR (125 MHz, DMSO-d6) δ: 191.6 (C-7), 152.6 (C-4), 146.4 (C-3), 129.3 (C-1), 125.0 (C-6), 116.0 (C-2), 114.8 (C-5)。以上波谱数据与文献报道一致 [15] ,从而确定化合物结构为2, 5-二羟基苯甲酸(2,5-dihydroxy-benzoic acid)。
化合物8:白色粉末,ESI-MS m/z 197 [M-H]−,分子组成:C9H10O5,不饱和度为5。1H-NMR (500 MHz, DMSO-d6) δ: 12.43 (1H, brs, -COOH), 10.25 (1H, brs, 4-OH), 7.21 (2H, s, H-2, 6), 3.81 (6H, s, -OCH3); 13C-NMR (125 MHz, DMSO-d6) δ: 167.7 (C-7), 147.9 (C-3,5), 140.6 (C-4), 120.8 (C-1), 107.3 (C-2,6), 56.4 (-OCH3)。以上波谱数据与文献报道一致 [16] ,从而确定化合物结构为3,5-二甲氧基4-羟基苯甲酸(3,5-dimethoxyl-4-hydroxy benzoic acid)。
化合物9:白色粉末,ESI-MS m/z 147 [M-H]-,分子组成:C9H8O2,不饱和度为6。1H-NMR (500 MHz, DMSO-d6) δ: 7.69 (2H, m, H-2,6), 7.42 (3H, m, H-3,4,5), 7.59 (1H, d, J = 16.0 Hz, H-7), 6.53 (1H, d, J = 16.0 Hz, H-8); 13C-NMR (125 MHz, DMSO-d6) δ: 134.7 (C-1), 128.7 (C-2,6), 129.4 (C-3,5), 130.7 (C-4), 144.4 (C-7), 119.7 (C-8), 168.1 (C-9)。以上波谱数据与文献报道一致 [17] ,从而确定化合物结构为反式桂皮酸(Trans-cinnamic acid)。
化合物10:白色粉末,ESI-MS m/z 191 [M-H]-,分子组成:C11H12O3,不饱和度为6。1H-NMR (500 MHz, DMSO-d6) δ: 10.05 (1H, brs, -COOH), 7.55 (2H, d, J = 8.64, H-2, 6), 7.55 (1H, d, J = 16.0, H-7), 6.79 (2H, d, J = 8.6, H-3, 5), 6.38 (1H, d, J = 16.0 Hz, H-8), 4.16 (2H, q, J = 7.0 Hz, H-10), 1.24 (3H, t, J = 7.0 Hz, H-11); 13C-NMR (125 MHz, DMSO-d6) δ: 126.8 (C-1), 129.8 (C-2,6), 114.3 (C-3,5), 158.6 (C-4), 144.4 (C-7), 119.7 (C-8), 168.1 (C-9), 60.6 (C-10), 14.8 (C-11)。通过以上的波谱数据,确定化合物结构为4-乙氧基苯丙烯酸(4-ethyoxyl-Cinnamic acid)。
化合物11:白色粉末,ESI-MS m/z 167 [M-H]-,分子组成:C9H12O3,不饱和度为4。1H-NMR (500 MHz, DMSO-d6) δ: 6.84 (2H, d, J = 8.6 Hz, H-2, 6), 7.43 (2H, d, J = 8.6 Hz, H-3, 5), 7.43 (1H, s, H-7), 3.80 (6H, s, H-8, 9); 13C-NMR (125 MHz, DMSO-d6) δ: 151.3 (C-1), 115.4 (C-2,6), 123.8 (C-3,5), 147.6 (C-4), 113.2 (C-7), 56.0 (C-8,9)。通过以上核磁数据,确定化合物结构为4-(二甲氧基甲基)-苯酚4-(dimethoxymethyl)-phenol。
化合物12:无色油状物,ESI-MS- m/z 232[M-H]-,结合1H-NMR和13C-NMR确定化合物的分子组成C10H19NO5,不饱和度为2。1H-NMR (500 MHz, DMSO-d6) δ: 12.07 (1H, brs, H-1), 1.63 (2H, t, J = 7.1 Hz, H-2), 2.21 (2H, t, J = 7.5 Hz, H-3), 7.77 (1H, t, J = 7.1 Hz, H-4), 3.12 (1H, m, H-6a), 3.06 (1H, m, H-6b), 3.71 (1H, d, J = 5.1 Hz, H-4), 3.30 (1H, d, J = 10.5, 3.6 Hz, H-9a), 3.18 (1H, d, J = 10.5, 3.6 Hz, H-9b), 0.81 (3H, s, H-10), 0.80 (3H, s, H-11); 13C-NMR (125 MHz, DMSO-d6) δ: 174.7 (C-1), 25.1 (C-2), 31.6 (C-3), 25.1 (C-2), 173.5 (C-5), 38.0 (C-6), 75.6 (C-7), 39.4 (C-8), 68.5 (C-9), 21.4 (C-10), 20.9 (C-11). 以上波谱数据与文献报道 [18] 数据一致,从而确定化合物为N-3-(3,5-dihydroxy- 4,4-dimethyl-1-oxopentyl)-β-Alanine。
3.2. 讨论分析
本文综合应用大孔树脂、正相及反相硅胶色谱、Sephadex LH-20、半制备液相等色谱方法以及质谱、核磁等波谱技术对短柱肖菝葜根部的30%大孔树脂部位的化学成分进行了分离纯化和结构鉴定。共得到12个化合物:大泽明素(1)、苏铁素(2)、3,4,5-三羟基苯甲醛(3)、3,4-二羟基苯甲醛(4)、4-羟基苯甲酸(5)、3,4-二羟基苯甲酸(6)、2,5-二羟基苯甲酸(7)、3,5-二甲氧基-4-羟基苯甲酸(8)、反式桂皮酸(9)、4-乙氧基-苯丙烯酸(10)、4-(二甲氧基甲基)-苯酚(11)和N-3-(3,5-dihydroxy-4,4-dimethyl-1-oxopentyl)-β-Alanine (12)。化合物2~12均为首次从该属植物中分离得到。
其中大泽明素(1)和苏铁素(2)是短柱肖菝葜中的代表性成分,为甲基氧化偶氮糖苷类化合物。该类成分在自然界的植物中分布较少且具有抗肿瘤的作用 [9] [10] ,是短柱肖菝葜的主要活性成分。化合物3-11为酚酸类成分,一般具有抗氧,抗氧化的药理活性 [19] 。化合物N-3-(3,5-dihydroxy-4,4-dimethyl-1-oxopentyl)- β-Alanine的结构也较为新颖,为β-丙氨酸同异庚酸衍生物形成的酰胺类成分,在自然界也分布较少,有抗维生素的作用 [20] 。
4. 总结和展望
本文从短柱肖菝葜根部位的高极性部位中共分离得到12个化合物,其中11个化合物均是首次从该属植物中分离得到,诸如苏铁素等成分的结构较为新颖。该项研究丰富了中药短柱肖菝葜的物质基础,为复方苦参注射液的质量控制,深度开发也提供了科学依据和技术支撑。
研究中还发现,短柱肖菝葜根部位中还存在大量的微量成分,无法用常规的化学手段将其分离和确定结构。今后可以考虑采用UPLC-Qtof-MSn等质谱分析手段对其微量成分进行指认和鉴别。同时对分离得到的化合物还应该进行抗炎,抗肿瘤等药理活性测试,以评估短柱肖菝葜在复方苦参注射液中的药理作用。
基金项目
中国博士后科学基金资助项目(2015M572741)。
文章引用
杨爱岗,叶 霁,梅丽娟,海丽娜,秦文杰,李明花,张卫东. 中药短柱肖菝葜根部位化学成分的研究
Chemical Constituents from the Root of Heterosmilax yunnanensis Gagnep[J]. 中医学, 2016, 05(04): 125-131. http://dx.doi.org/10.12677/TCM.2016.54020
参考文献 (References)
- 1. 赖云峰, 陆金健, 王一涛, 等. 基于市场状况的抗肿瘤中药注射剂分析[J]. 世界科学技术—中医药现代化, 2012, 14(5): 1958-1962.
- 2. 张文谨, 海丽娜, 连增林. 复方苦参注射液抗肿瘤作用及其机制实验研究进展[J]. 中国中医药信息杂志, 2012, 19(8): 101-103.
- 3. Zhao, Z.Z., Fan, H.T., Lin., H.S., et al. (2014) Fufang Kushen Injection Inhibits Sarcoma Growth and Tumor-Induced Hyperalgesia via TRPV1 Signaling Pathways. Cancer Letters, 355, 232-241. http://dx.doi.org/10.1016/j.canlet.2014.08.037
- 4. Xu, W.R., Lin, H.S., Yang, L.L., et al. (2011) Compound Kushen Injection Suppresses Human Breast Cancer Stem- Like Cells by Down-Regulating the Canonical Wnt/β-Catenin Pathway. Experimental & Clinical Cancer Research, 30, 103. http://dx.doi.org/10.1186/1756-9966-30-103
- 5. 马悦. 复方苦参注射液化学成分及质量控制研究[D]: [硕士学位论文]. 北京: 中国中医科学院, 2012: 1-25.
- 6. 关扎根, 吴尚英, 李安平, 等. 短柱肖菝葜的资源调查及品质分析[J]. 中国现代中药, 2014, 16(6): 444-446.
- 7. 秦文杰, 王钢力, 林瑞超. 短柱肖菝葜化学成分的研究[J]. 中草药, 2007, 38 (10): 1466-1468.
- 8. 蒯玉花, 海丽娜, 菅晓勇, 等. 肖菝葜属药用植物的研究进展[J]. 中国实验方剂学杂志, 2010, 16(11): 207-209.
- 9. Jerald, J.N. and Johannes, V.S. (2012) Isolation and Quantification of the Toxic Methylazoxymethanol Glycoside Macrozamin in Selected South African Cycad Species. South African Journal of Botany, 82, 108-112. http://dx.doi.org/10.1016/j.sajb.2012.07.011
- 10. Nishida, K., Kobayashi, A. and Nagahama, T. (1955) Cycasin, a New Toxic Glycoside of Cycas revoluta Thunb. I. Isolation and Structure of Cycasin. Bulletin of the Agricultural Chemical Society of Japan, 19, 77-84.
- 11. Xu, H.X., Kadota, S., Wang, H., et al. (1994) A New Hydrolyzable Tannin from Geum Japonicum and Its Antiviral Activity. Heterocycles, 38, 167-175. http://dx.doi.org/10.3987/COM-93-6550
- 12. 张雪梅, 李磊, 张刚磊, 等. 3,4-二羟基苯甲醛合成工艺的改进[J]. 徐州师范大学学报, 2006, 24(3): 51-53.
- 13. 毛士龙, 廖时萱, 吴久鸿, 等. 黄花远志根化学成分的分离和结构鉴定[J]. 药学学报, 1996, 31(2): 118-121.
- 14. 张金超, 申勇, 朱国元, 等. 杜鹃兰的化学成分研究[J]. 中草药, 2007, 38(8): 1161-1162.
- 15. Marianna, H., Jean, F.B., Mourad, K., et al. (1988) Monohydroxy- and 2,5-Dihydroxy Terephthalic Acids, Two Unusual Phenolics Isolated from Centaurium erythraea and Identified in Other Gentianaceae Members. Journal of Natural Products, 51, 977-980. http://dx.doi.org/10.1021/np50059a030
- 16. Zhao, Y. and Ruan, J.L. (2006) Chemical Constituents from Piper wallichii. Journal of Chinese Pharmaceutical Sciences, 15, 21-23.
- 17. Ripperger, H., Diaz, M. and Schreiber, K. (1981) Two Cinnamoyl Derivatives from Cinnamomum tripli-nervis. Phytochemistry, 20, 1453-1454. http://dx.doi.org/10.1016/0031-9422(81)80070-2
- 18. Nishizawa, Y. and Kodama, T. (1966) Homopantothenic Acid. Bitamin, 33, 589-602.
- 19. Yumrutas, O., Sokmen, A., Akpulat, H.A., et al. (2012) Phenolic Acid Contents, Essential Oil Compositions and Antioxidant Activities of Two Varieties of Salvia Euphratica from Turkey. Natural Product Research, 26, 1848-1851. http://dx.doi.org/10.1080/14786419.2011.613386
- 20. Smashevskii, N.D., Kopelevich, V.M., Marieva, T.D., et al. (1973) Antivitamin Action of D-, L-, and DL-Homopan- tothenic Acids on Yeasts. Applied Biochemistry & Micro-biology, 9, 659-663.
*通讯作者。