Traditional Chinese Medicine
Vol.06 No.03(2017), Article ID:21315,8
pages
10.12677/TCM.2017.63025
Clinic Observations of Xiaoban Decoction in Preventing Glucocorticoid-Withdrawal Syndrome
Eryun Su1,2, Anna Zhao1
1Hangzhou Zhang Tong Tai Ambulant Clinic of TCM, Hangzhou Zhejiang
2Affiliated Hospital of Zhejiang University of Technology, Hangzhou Zhejiang

Received: Jun. 27th, 2017; accepted: Jul. 4th, 2017; published: Jul. 11th, 2017

ABSTRACT
Objective: To explore the effects of Xiaoban Decoction to prevent the glucocorticoid (GC) withdrawal syndrome. Methods: Xiaoban Decoction was given to 108 immune thrombocytopenia (ITP) patients who have been treated with GCs. Glucocorticoid therapy was then stopped abruptly. Blood samples was taken around 8 am before and after the abruptly termination of glucocorticoid therapy. Adrenocorticotropic hormone (ACTH) and cortisol (Cort) levels were then determined. Clinical manifestations of adrenal crisis, withdrawal symptoms and relapse of ITP were carefully monitored. 37 cases were followed up for theirs ACTH and cortisol levels. Results: Among the 108 cases, 62 cases (57.4 percent) had adrenal insufficiency (AI) before stopping the glucocorticoid therapy (8 am cortisol level less than 30 µg/L). 13 (12 percent) cases had highly suggestive of AI (8 am cortisol level between 30 - 50 µg/L). After treatment with Xiaoban Decoction and termination of glucocorticoid, 66 cases had withdrawal syndrome. Among them, 62 cases were mild, 4 cases moderate and no patient withdrawal crisis. 11 had ITP relapse. Conclusions: Xiaoban Decoction is an independent Chinese medical treatment option for ITP. It doesn’t need to be used with glucocorticoid. It has strong effects in protecting the adrenal glands. Xiaoban Decoction can restore the adrenal gland’s function after it’s suppressed by external glucocorticoid. It can lessen the glucocorticoid withdrawal symptoms and prevent the occurrences of adrenal crisis.
Keywords:Xiaoban Decoction, Plasma Cortisol Level, GCs-Withdrawal, Adrenal Insufficiency, Adrenal Crisis
消斑饮预防撤药综合征临床观察
苏尔云1,2,赵安娜1
1杭州华东医药张同泰中医门诊部,浙江 杭州
2浙江工业大学医院,浙江 杭州
收稿日期:2017年6月27日;录用日期:2017年7月4日;发布日期:2017年7月11日

摘 要
目的:探讨消斑饮对糖皮质激素(GCs)快速撤除的安全性。方法:用消斑饮治疗108例正在接受GCs治疗的免疫性血小板减少症(ITP)患者,用快速法撤除GCs。撤除前后在晨8~9点测定血浆ACTH和皮质醇(Cort)含量。仔细观察撤药后肾上腺危象(AC),撤药症群的发生及ITP的反跳。并随访了37例患者的ACTH和Cort。结果:108例中在撤激素之前确诊有肾上腺机能不全(AI) (8 Am Cort < 30 µg/L)有62例,占57.4%,高度提示AI (8Am Cort 30~50 µg/L) 13例,占12.0%。经消斑饮治疗并撤除GCs一个月后,有撤药综合征66例,轻度者62例,中度4例,无一例发生AC。ITP反跳11例。结论:消斑饮是一种独立的,不需要配合GCs的ITP治疗方案。它之所以不需要GCs,是因为它有很强的保护肾上腺皮质功能作用,能很快恢复被外源性GCs抑制的肾上腺皮质功能。从而减轻了撤药症群的程度,预防了AC发生。
关键词 :消斑饮,糖皮质激素撤除,血浆皮质醇,肾上腺机能不全,肾上腺危象

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
广泛使用糖皮质激素(GCs)是导致继发性(医源性)肾上腺机能不全(SAI)的主要因素。GCs应用的广泛远甚于抗生素的“滥用”。有报道英国一年(2014.4~2015.5)开出的口服GCs处方超过800万张 [1] 。而住院病人更是要求以静脉滴注的形式应用大剂量激素冲击疗法 [2] 。免疫性血小板减少症(ITP)治疗也是首选GCs。用大剂量GCs来治疗ITP,已成为当前普及疗法 [2] 。受GCs治疗的患者是很厌恶GCs治疗的副作用,常会自行中断治疗 [3] 。大剂量或长期应用GCs导致的SAI率大约14%~63%不等 [1] 。而更多副作用早在发生SAI前就困扰着患者。用上GCs后,撤药十分不易,过程漫长,且易出现撤药综合征,ITP反跳及肾上腺危象(AC)的发生 [4] 。如何既能较快地安全撤药,不使ITP反跳,又可以促进AI的恢复,防止撤药综合征发生。这成了医生和患者向往的撤药目标。我们对消斑饮治疗ITP,临床研究长达40年,发现消斑饮不但治疗ITP有较好疗效 [5] 。同时能稳定下丘脑–垂体–肾上腺(HPA)轴的生理功能,减轻撤药综合征发生及减少ITP的反跳,协助GCs快速撤除。现报道如下。
2. 资料与方法
2.1. 诊断标准
2.1.1. ITP诊断标准
参照ITP国际工作组(IWG)提出的诊断标准 [6] 。
2.1.2. AI诊断标准
参照AI诊断治疗指南 [7] ,血浆皮质醇(8 AM) 30~50 µg/L高度提示AI可能,<30 µg/L确诊AI。
2.2. 纳入标准
1) 明确诊断ITP者。2) 年龄3~73岁。3) 就诊时GC应用1个月以上没有中断,剂量大小不限制。4) 签署知情同意书者。
2.3. 排除标准
1) ITP有合并症者,如SLE, Evan’s 综合症。2) 无论应用GC时间有多长,在受试前1周停药者。3) 不按我们的撤药时间要求,擅自服用小剂量GC维持。4) 初诊前连续服药少于1个月者。
2.4. 一般资料
108例ITP为2012年7月~2015年12月我院家庭病床患者。年龄3~73岁,男性36例,女性72例。病程1~264个月,3个月者有20例。应用GC种类(指最近一个月所用药):泼尼松70例,甲泼尼龙33例,地塞米松3例,阿赛松2例。用药剂量(按泼尼松等效剂量) 5 mg~100 mg/日,中位数20 mg/日。连续用药时间1~156个月,中位数9个月。我们将激素所致的副作用按各器官的累及列出6项,即皮肤组织(满月脸),脂肪组织(向心性肥胖),肌肉组织(肌肉萎缩),血管组织(紫纹斑),血液系统(多血质,白细胞 > 10 × 109/L),精神系统(抑郁)。每个系统1分,1~2分为轻度,3~4分为中度,5~6分为重度。108例患者撤药前无明显副作用1例,轻度副作用29例,中度64例,重度14例。
2.5. 治疗与撤药方法
2.5.1. 108例ITP患者一律用消斑饮治疗
鸡血藤30 g,当归身18 g,生地90 g,生晒参10 g,生芪60 g,商陆(先煎3小时) 30 g,墓头回24 g,仙鹤草30 g,侧柏炭30 g,仙灵脾18 g,鹿角霜15 g,炙甘草15 g等。ITP中医辨证归纳为血瘀为其基础,血瘀之下再辨气虚或阴虚,气虚生芪的剂量为90 g。生地剂量为60 g。阴虚生地剂量为90 g,生芪剂量为60 g。其余药物不作增减。
2.5.2. 停用所有中西药
除GC外,其他药物在服消斑饮后立即撤除。糖皮质激素(以泼尼松为例)快速撤除法:消斑饮服用3天后,泼尼松剂量减半,再服3天后,又减半。减到泼尼松只剩3粒时,每3天减半粒,如期撤完。大约15天到24天能将激素撤完。如原剂量泼尼松60 mg/日,消斑饮服3天,泼尼松减为30 mg/日,再服3天,泼尼松15 mg (3粒)/日。然后每3天减半粒。24天撤完。甲基泼尼松龙,地塞米松等糖皮质激素 撤除方法相同。
2.5.3. 撤药要求
开始撤药的第一个月严格卧床治疗,要求一天卧床20小时。
2.6. 观察指标与方法
2.6.1. 肾上腺危象诊断
我们将肾上腺危象分前驱期和危象期 [4] 。前驱期设4项症状,即烦躁,头痛,厌食,腹痛。每项1分,1~2分轻度,3分中度,4分重度,易发生危象。危象期包括收缩压 < 80 mmHg及周围循环衰竭, 且不易被输液和正性收缩压药物所纠正;意识丧失。
2.6.2. 撤药综合征测定 [4]
我们将撤药症群分8项,即神疲乏力,恶心厌食,腹胀,嗜睡,情绪消沉,肌肉僵痛,关节酸痛,肌肉抽搐。每项1分,1~3分轻度,4~6分中度,7~8分为重度。
2.6.3. ITP反跳
1) 出血加重:皮肤出血3级,粘膜出血2级以上,器官出血1级以上(出血严重程度按ITP国际工作组提出的诊断标准 [8] )。2) 血小板计数少于撤药前计数的三分之一。诊断必须符合上述2个条件。
2.6.4. 促肾上腺皮质激素(ACTH)和皮质醇(Cort)的测定
撤药前清晨8点抽血测定ACTH和Cort (不做午后和深夜12点的检查)。一个月后再测ACTH和Cort,两组数据配对比较。在治疗过程中,我们又随访了37例患者的ACTH和Cort,以了解消斑饮对患者垂体-肾上腺轴的稳定性。这37例随访者,中药开始治疗到测定的时间3~36个月,中位数21个月。ACTH和Cort的正常值按照实用内科学给定的:ACTH:晨8点,20.43~81.72 pg/ml (4.5~18 pmol/L)。总皮质醇:晨8点62~194 µg/L (170.5~533.5 nmol/L) [4] 。
2.6.5. 血压测定
撤药前测定血压,一个月后再测定血压。分析低血压(<90/50 mmHg)比率和肾上腺危象期的血压比率(上压 < 80 mmHg)。
2.7. 统计学方法
采用SPSS17.0统计软件进行统计分析,计量资料以 ± s表示,组内比较采用配对样本t检验,两组间比较用独立标本t检验。两个率的比较采用卡方分析,P < 0.05为差异有统计学意义。
± s表示,组内比较采用配对样本t检验,两组间比较用独立标本t检验。两个率的比较采用卡方分析,P < 0.05为差异有统计学意义。
3. 结果
· 108例应用GC的ITP患者在消斑饮治疗前,确诊AI (8 Am Cort < 30 µg/L)有62例,占57.4%,高度提示AI (8Am Cort 30~50 µg/L) 13例,占12.0%。用消斑饮治疗后都能顺利撤除GC,没有肾上腺危象出现;有前驱期轻度症状者11例(10.2%),中度症状者12例(11.1%),没有前驱期症状者85例(78.7%)。这些轻中度前驱症状患者在我们严格卧床休息和消斑饮的治疗下,3~10天内都度过了前驱期,不需再度添加GC治疗,也不需要作急症处理。同时,治疗前后一个月的血象比较,多血质状态有所恢复,而血小板非但不下降,还有上升趋势(见表1)。发生撤药症群者66例,轻度者62例(57.4%),中度4例(3.7%),没有重度撤药症群发生。主要症状有神疲乏力(48例)和恶心厌食(17例),肌肉酸痛(1例)多数在1~2个月内症候消失。没有撤药症群者42例(38.9%),即1/3强的患者在撤药时不但脱离了GC副作用的困境,又没有撤药的牵累。ITP反跳11例(10.2%)。
· 我们对23例前驱症状者做了多种分析,未显示GC 治疗时间,GC剂量大小及GC副作用等因素对前驱期有统计学差异的影响。
· 108例患者撤药前后的ACTH和Cort变化见表2。108例患者在撤药前,晨8点ACTH检测值在正常范围以下(<21 pg/ml) 90例(83.3%);Cort检测值在正常范围以下(<62 µg/L) 83例(76.9%),但用消斑饮治疗一个月后,ACTH和Cort不同程度地上升(见表3)。我们对其中37例做了随访。HPA轴的功能多数处于正常状态,(见表2随访)。1例仍处于IA(Cort < 10µg/L),2例在正常范围以下(Cort < 52 µg/L,Cort < 59.9 µg/L),而这3例的ACTH也在低水平,分别为10; 22.8; 11.5 (pg/L)。37例随访者的ACTH却有13例在正常范围以下(占35.1%)。这13例的随访时间为4-30个月,中位数12个月。
Table 1. Analysis of hemogram before and after glucocorticoid-withdrawal/Xiaoban decoction treatment (± s)
表1. 撤药/消斑饮治疗前后血象分析( ± s)
± s)
Table 2. Analysis of ACTH and Cort before and after withdrawal/Xiaoban decoction treatment at 8 am (± s)
表2. 撤药/消斑饮治疗前后晨8点ACTH和Cort浓度变化(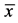 ± s)
± s)
*与撤药后相比。
Table 3. Recovery of HPAA function before and after withdrawal/Xiaoban decoction treatment
表3. 撤药/消斑饮治疗前后HPA轴的功能恢复状况*
*测定时间8am。**正常值下限。#一昼夜中(晚12点)相对最低值。
· 108例撤药前收缩压在88~172 mmHg之间,<100 mmHg 15例,>140 mmHg 54例。治疗一个月后,无一例在90 mmHg以下。90~100 mmHg者6例,>140 mmHg 7例,其余在100~140 mmHg之间。
4. 讨论
ITP用糖皮质激素治疗,虽说是全球性的一线药物 [2] [9] ,但其撤药后能维持疗效仅15%~25% [9] ,而副作用之大且不易撤药是众所周知的 [1] [4] 。我们自创的消斑饮治疗ITP总有效率70.6%,且不需要联合激素治疗 [5] 。我们用40年的时间,研究消斑饮治疗ITP的疗效及防止糖皮质激素撤除时出现的撤药综合征和AC的发生。我们长期的研究,并采用了近年来100例以上的中大型研究结果提示本研究对ITP的糖皮质激素撤除是安全的。对于其他疾病所用糖皮质激素的撤除,有待研究。
众所周知,GCs长期治疗负反馈性抑制HPA轴的功能,发生SAI,在撤药时,由于肾上腺不能分泌足够的皮质醇而发生撤药综合征,撤药综合征的最严重程度是致死性AC发生。有报道,在SAI中AC发生率为5.8次/每100患者年 [7] 。本研究108例ITP无一例出现AC。仅仅只有23例出现前驱症状,经消斑饮和卧床等治疗措施后,3~10天都能度过前驱期,避免进一步发展为AC。卧床治疗是很好的防止AC发生的措施。有报道活动(体力劳动)是发生AC的重要因素,导致AC的发病率是7%~8% [10] 。而且,ACTH和Cort在熟睡时血浓度最低。换言之,在AI状况下,卧床治疗措施能维持最低限度的内环境平衡,而不发生AC。我们治疗前早晨8点的ACTH和Cort分层研究也显示测定值比晚12点的底值(ACTH 9.998 pg/L,Cort 23 µg/L)还低的患者有50%以上(见表3)。在如此低的ACTH和Cort水平上未发生AC,卧床治疗功不可没,另外,熟睡能使肾上腺积累皮质醇的势能,在应激状况下,分泌更多的激素。
发生撤药综合征有66例,只是一些神疲乏力的轻度症状,更可喜的是,有1/3患者没有撤药综合征出现。这与消斑饮对血清ACTH和Cort浓度的影响是分不开的。我们虽然未做动物实验,但治疗中的临床检验明确提示消斑饮能使体内被抑制的HPA轴恢复正常量分泌ACTH和Cort (治疗前后ACTH 12.19 ± 10.10 vs 33.53 ± 27.04 pg/ml; Cort 42.32 ± 45.11 vs 122.51 ± 52.32 µg/L)。我们的撤药速度相当快,有悖于传统理念 [4] 。这是因为HPA轴功能被外源性糖皮质激素抑制和损伤后,自行恢复需要漫长时间 [1] 。在没有药物帮助下,康复滞后于撤药,易发生撤药危象,从而提出了缓慢撤药的传统概念。我们的研究显示,消斑饮能快速恢复HPA轴功能,使ACTH和Cort的分泌正常化。这就是我们可以快速撤药的临床根据。这种效应符合沈自尹提出的阴阳常阈调节效应 [11] 。
沈自尹在早年提出阴阳常阈调节论。指出机体的内环境平衡有无数层次,从维系生命的病态平衡到健康体魄的各种外环境适应。其中HPA轴是稳态体系的重要部分。在治疗中应立足于保护与提高这种调节能力,尽一切力量来避免损害这种调节能力 [11] 。消斑饮遵循了阴阳常阈调节论,较快达到内环境平衡(阴平阳秘),从而较快恢复HPA轴功能正常,避免AC的发生。而大剂量激素治疗恰恰阻滞了这种调节,使内环境平衡倾覆。我们108例患者治疗前的ACTH和Cort测试结果也是佐证:90例的ACTH在正常值以下,83例的Cort在正常值以下。
在国外还未找到现代有效拮抗GCs对HPA轴抑制的药物时 [12] ,我们的治疗方法具有创新性和实用性。我们根据中医的系统生物学理论和辩证施治所拟定的消斑饮,有效拮抗GCs对HPA轴的影响,起着内环境稳定作用。消斑饮遣方下药根据阴根于阳,阳根于阴,凡病有不可正治者,当从阳以引阴,从阴以引阳,各求其属而衰之的理论。这种阴阳盛衰的理论是解决激素引起AI最好的敲门砖。沈氏的工作显示,应用滋阴泻火药,能使激素对HPA轴的抑制减轻60-70%。动物实验也显示滋阴药可保护HPA轴的调节能力。而温补肾阳则提高HPA轴的固有调节能力,可以使低水平的病态平衡恢复到健康的阴阳常阈平衡 [11] 。沈氏理论上的研究,我们在临床实践中给予印证。
方中大剂量的生地,黄芪,当归和人参都是HPA轴功能及形态学的稳定剂,在应激状态,稳定ACTH和Cort水平,防止过度分泌。在AI状况,则防止脑垂体和肾上腺萎缩,提高ACTH和Cort水平,避免AC发生 [13] [14] [15] [16] 。仙灵脾能提高血浆Cort和ACTH水平,进一步研究发现,其淫羊藿总黄酮(EF)促进肾上腺皮质再生。EF能促进肾上腺干细胞向内侧迁移,提高肾上腺皮质本身的储备能力 [17] 。通过基因芯片研究,发现EF能使下丘脑众多神经递质受体及生长素上调。通过下调促凋亡,抗增殖基因,上调抗凋亡,促增殖基因的表达来延缓HPA轴功能衰退 [18] 。鹿角霜补虚助阳,止血治崩漏。有直接作用于腺垂体,促进性激素分泌 [19] 。根据沈自尹的补肾阳提高HPA轴固有调节能力的理论,鹿角霜能促进ACTH和Cort的分泌增加。商陆多糖和墓头回能促进IL-1,IL-2,IL-3,IL-6, TNF-α分泌 [20] [21] 。已知这些细胞因子促使下丘脑CRH合成和释放,促进ACTH和皮质醇的分泌 [4] 。我们了解甘草具有肾上腺皮质激素样作用已有60多年的历史 [22] 。甘草能兴奋垂体-肾上腺皮质功能,使肾上腺重量增加。小剂量甘草有糖皮质激素样作用,大剂量则有盐皮质激素样作用,升高血压。这些正是我们防治撤药危象所需要的效用。进一步研究发现,具有盐皮质激素样作用的成份主要为甘草次酸。甘草次酸还对肝脏中Δ4-5β-还原酶抑制,延缓皮质激素代谢速率,延长皮质激素作用时间和强度 [23] 。
文献报道,GCs治疗所导致的AI,这些患者在撤除GCs后很长一段时间,仍有AI的存在 [1] 。我们的研究也显示,随访的37例患者,即便在消斑饮治疗下,还有3例Cort在正常范围以下(Cort < 62 µg/L),有13例的ACTH在正常范围以下(ACTH < 21 pg/ml)。提示撤药后还会有很长一段时间HPA轴是不稳定的,或倾向于AI的发生。即便如此,我们已经安全地撤除了GCs。当然,临床医生在具体诊疗时,应时时牢记撤药后的HPA轴有长期不稳定倾向。
文章引用
苏尔云,赵安娜. 消斑饮预防撤药综合征临床观察
Clinic Observations of Xiaoban Decoction in Preventing Glucocorticoid-Withdrawal Syndrome[J]. 中医学, 2017, 06(03): 152-159. http://dx.doi.org/10.12677/TCM.2017.63025
参考文献 (References)
- 1. Rebecca, M.J., Ann, L.H., David, W.R. et al. (2016) Systemic Glucocorticoid Therapy and Adrenal Insufficiency in Adults: A Systematic Review. Seminars in Arthritis and Rheumatism, 46,133-141. https://doi.org/10.1016/j.semarthrit.2016.03.001
- 2. Neunert, C., Lim, W., Crowher, M. et al. (2011) The American Society of Hematology 2011 Evidence-Based Practice Guideline for Immune Thrombocytopenia. Blood, 117, 4190-4207. https://doi.org/10.1182/blood-2010-08-302984
- 3. Tiemensma, J., Andela, C.D., Pereira, A.M. et al. (2014) Patients with Adrenal Insufficiency Hate Their Medication: Concerns and Stronger Beliefs about the Necessity of Hydrocortisone Intake Are Associated with More Negative Illness Perceptions. The Journal of Clinical Endocrinology & Metabolism, 99, 3668-3676. https://doi.org/10.1210/jc.2014-1527
- 4. 陈灏珠, 林果为, 王吉耀. 实用内科学[M]. 14版, 北京: 人民卫生出版社, 2013: 1196, 1156-1161, 1191-1197, 1100-1155.
- 5. 苏尔云, 赵毅, 黄丽华, 等. 消斑饮治疗原发性免疫性血小板减少症119例临床观察[J]. 中国中西医结合杂志, 2017, 37(2): 179-183.
- 6. Rodeghiero, F., Stasi, R., Gernsheimer, T., et al. (2009) Standardization of Terminology, Definitions and Outcome Criteria in Immune Thrombocytopenic Purpura of Adults and Children: Report from an International Working Group. Blood, 113, 2386-2393. https://doi.org/10.1182/blood-2008-07-162503
- 7. Novoa, P. de M., Vela, E.T., Garcia, N.P., et al. (2014) Guidelines for Diagnosis and Treatment of Adrenal Insufficiency in Adults. Endocrinología y Nutrición, 61, 1-34.
- 8. Rodeghiero, F., Michel, M., Gernsheimer, T., et al. (2013) Standardization of Bleeding Assessment in Immune Thrombocytopenia: Report from the International Working Group. Blood, 121, 2596-2606. https://doi.org/10.1182/blood-2012-07-442392
- 9. Ronald, H., Edward, J.B.J., Sanford, J.S., et al. (2001) Hematology Basic Principles and Practice. 3rd Edition, Science Press, Beijing, 2096-2114.
- 10. Quinkler, M., Beuschlein, F., Hahner, S., et al. (2013) Adrenal Cortical Insufficiency—A Life Threatening Illness With Multiple Etiologies. Deutsches Ärzteblatt International, 110, 882-888.
- 11. 沈自尹. 从垂体——肾上腺轴讨论阴阳常阈调节论[J]. 上海中医药杂志, 1979(5): 3-7.
- 12. 沈自尹, 黄建华. 从淫羊藿激活内源性干细胞探讨“肾藏精”的科学涵义[J]. 中医杂志, 2010, 51(1): 8-10.
- 13. 查良伦, 沈自尹, 张晓峰, 等. 生地对家兔糖皮质激素受抑模型的实验研究[J]. 中西医结合杂志, 1988, 8(2): 95- 97.
- 14. Zhong, R.Z., Yu, M., Liu, H.W., et al. (2012) Effects of Dietary Astragalus Polysaccharide and Astragalus membranaceus Root Supplementation on Growth Performance, Rumen Fermentation, Immune Responses, and Antioxidant Status of Lambs. Animal Feed Science and Technology, 174, 60-67. https://doi.org/10.1016/j.anifeedsci.2012.02.013
- 15. 邓毅, 张明, 任鹏飞, 等. 甘肃岷归对去卵巢更年期模型大鼠雌性激素的影响[J]. 中药药理与临床, 2013, 29(4): 103-105.
- 16. 柳忠辉, 杨贵贞. 人参皂甙通过垂体——肾上腺轴调整应急期NK细胞的受抑作用[J]. 中国免疫学杂志, 1991, 7(1): 45-48.
- 17. 沈自尹, 董竟成, 蔡定芳, 等. 改善肾上腺皮质功能在某些疾病恢复过程中的重要作用[J]. 中国中西医结合杂志, 2007, 27(4): 364-367.
- 18. 沈自尹, 陈瑜, 黄建华, 等. EF延缓HPAT 轴衰老的基因表达谱研究[J]. 中国免疫学杂志, 2004, 20(1): 59-62.
- 19. 牛晓晖, 李鹏飞, 贾雪婷, 等. 中国鹿科动物源药材药理作用十年研究进展(二) [J]. 吉林中医药, 2012, 32(7): 702-704.
- 20. 王鹏程, 王秋红, 赵珊, 等. 商陆化学成分及药理作用和临床应用研究进展[J]. 中草药, 2014, 45(18): 2722-2731.
- 21. 马海珍, 刘蓓, 郭鸿, 等. 墓头回诱导脐血基质细胞分泌因子的作用[J]. 兰州大学学报(医学版), 2008, 34(2): 8- 10.
- 22. 张宝恒. 甘草药理作用研究的进展[J]. 药学学报, 1963, 10(11): 688-700.
- 23. 吴宗耀, 牛索义, 梁喜爱. 甘草化学成份及药理作用分析[J]. 河南中医, 2010, 30(12): 1235-1236.
