Botanical Research
Vol.3 No.04(2014), Article ID:13863,7 pages
DOI:10.12677/BR.2014.34021
Effects of the Different Factors on Pollen Germination and Pollen Tube Growth in Eriobotrya japonica (Thunb.) L.
School of Life and Science, Hubei University, Wuhan
Email: *tangxingchun@hubu.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Apr. 25th, 2014; revised: May 20th, 2014; accepted: May 28th, 2014
ABSTRACT
In this study, loquat fresh pollens were used as materials to explore the effect of sucrose concentration, pH and gamma-amino butyric acid (GABA) on pollen germination and pollen tube growth in vitro. The basic culture medium consists of 31 mg/L boric acid + 196.8 mg/L MgSO4·7H2O + 7.45 mg/L KCl + 56 mg/L CaCl2. Pollens were cultured in dark at 25°C for 5 h. The results showed that pollen germination rate reached to 60% and pollen tube growth rate was 70.4 µm/h. Given 10% sucrose and pH value 8.0, pollen germination reached the highest ratio of 63%. Moreover, the addition of GABA to the medium can effectively promote the growth rate of pollen tubes.
Keywords:Eriobotrya japonica (Thunb.) L., Pollen Germination, Pollen Tube Growth, GABA

不同理化因子对枇杷(Eriobotrya japonica (Thunb.) L.)花粉体外萌发和花粉管生长的影响
周 娇,葛凌明,胡 欣,汤行春*
湖北大学生命科学学院,武汉
Email: *tangxingchun@hubu.edu.cn
收稿日期:2014年4月25日;修回日期:2014年5月20日;录用日期:2014年5月28日

摘 要
本实验以枇杷花粉为材料,采用花粉离体培养法研究了蔗糖浓度、pH值以及γ-氨基丁酸(GABA)对枇杷花粉萌发和花粉管生长的影响。试验以31 mg/L H3BO3、196.8 mg/L MgSO4·7H2O、7.45 mg/L KCl + 56 mg/L CaCl2为基本培养基组分,在25℃暗条件下培养5 h后统计枇杷花粉萌发率及花粉管的生长速率。结果表明,蔗糖浓度为10%时,花粉萌发率达到最高值60%,同时花粉管生长速率达到最大值70.4 µm/h;pH 8.0时花粉萌发率最高,达63%;此外,添加不同浓度的GABA对花粉萌发的影响不显著,但对花粉管生长的影响有显著作用。
关键词
枇杷,花粉萌发,花粉管生长,GABA

1. 引言
花粉萌发和花粉管生长是高等植物有性生殖过程中的一个重要环节,关系到植物能否正常完成受精过程。花粉管作为雄配子体的一部分,是花粉粒内壁通过花粉外壁上的萌发孔(或沟)向外伸出的细管,主要作用是运送精子到达雌配子完成受精。在整个复杂的细胞系统相互作用下,花粉管的延伸定向地穿透柱头表面的孢子体组织。一进入到柱头的质外体,来自外部细胞环境的信号便引导花粉管从柱头经花柱到子房,再进入胚珠及胚囊,将花粉管中的两个精细胞及全部内含物释放到胚囊中,以便完成受精作用[1] 。花粉萌发和花粉管生长整合了许多来源于本地环境中的不同信号,从而来调节生长和发育的进程。
花粉的育性、群体效应[2] 、硼、蔗糖、温度、矿质元素、pH 值、空气湿度和植物生长调节剂[3] 都对花粉萌发及花粉管生长有着显著地影响。另外,有实验报道,在拟南芥体中γ-氨基丁酸(GABA)在花粉管生长过程中的作用非常重要[4] ,其作为一种信号分子[5] ,通过在子房中形成了一个GABA梯度,引导花粉管向胚珠的生长[6] 。
本实验以枇杷花粉为材料,采用花粉离体培养法研究了培养基不同蔗糖浓度、pH以及不同浓度的γ-氨基丁酸(GABA)对枇杷花粉萌发及花粉管生长的影响,探讨了促进枇杷花粉在体外萌发及花粉管生长的方法,得以使枇杷花粉萌发迅速,促进快速生成较长且形态正常的花粉管。
2. 材料和方法
2.1. 材料
试验所需新鲜枇杷花粉采自湖北大学校园内。2012年11月于盛花期晴天上午8:00~10:00采取枇杷花蕾。
2.2. 花粉萌发培养基
先以30 mmol/L的MES缓冲液(pH 6.5)调配,以31 mg/L H3BO3 + 196.8 mg/L MgSO4·7H2O + 7.45 mg/L KCl + 56 mg/L CaCl2为基本培养基组分。
2.3. 实验处理组
为了探讨蔗糖浓度、pH值以及GABA等理化因子对花粉萌发的影响,实验采取了以下处理组:
① 用蔗糖对培养基的蔗糖浓度进行梯度设置,分别为5%,10%,15%,20%;
② 用1 mol/L NaOH和1 mol/L HC对培养基的pH值进行梯度设置,分别为:5.0、6.0、7.0、8.0、9.0;
③ 用GABA对培养基中GABA分子量浓度进行梯度设定,分别为1.5 mM,2.5 mM,5 mM,8 mM。
2.4. 细胞学观察
花粉活力采用醋酸荧光素(FDA)测定,FDA的终浓度为2 μg/ml。花粉萌发和花粉管的生长采用0.1%的苯胺蓝和荧光染料Calcofluor White染色。花粉用2.5%的戊二醛固定后,用1 µg/ml染核。
2.5. 图像采集与数据处理
用尼康倒置显微镜(TS100)在40 × 10倍下观测萌发花粉数和花粉管长度,以花粉管伸长超过花粉直径作为萌发标准。每处理重复3次,每重复观察5视野,每视野花粉数不少于100粒,每视野随机选取10粒花粉测量花粉管长度。实验重复三次。数据用Excel进行统计分析。
花粉萌发率(%) = (萌发花粉数/总花粉数) × 100%
花粉管生长速率 = 所有花粉管长度之和/萌发花粉数/萌发时间。
3. 结果与分析
3.1. 枇杷花粉萌发过程的细胞学观察
新鲜花粉的活力检测表明花粉的生理状态很好,表现出较强的活力(图2A)。花粉于25℃恒温箱暗培养,每间隔0.5 h用显微镜观察一次。图1显示为花粉萌发的基本时间进程。萌发前花粉成圆形,培养2 h后,花粉有开始萌发的迹象。在花粉萌发处,苯胺蓝显示萌发处的细胞壁成分胼胝质增厚(图2B)。2.5 h后,花粉管伸长已可以超过花粉粒直径。此时的花粉管中的胼胝质分布有明显特征,在花粉管的尖端,胼胝质成分丰富(图2C),在靠近花粉粒端胼胝质呈环状分布(图2C)。用荧光增白剂(CW)染色显示细胞壁的成分没有明显的区域特征(图2D1,图2D2)。花粉萌发起始时,生殖核靠近萌发沟一侧(图2E1,图2E2),随着花粉管的萌发和生长,生殖核在花粉管中移动(图2F1,图2F2)。持续培养3.5 h后,花粉管依旧长势良好且形态笔直。可以用作萌发率及花粉管生长速率的统计。
3.2. 蔗糖浓度对花粉萌发的影响
蔗糖作为重要的营养物质和能量的来源,同时又起到调节渗透势的作用,其在花粉萌发及花粉管生长中起到重要作用。图3和图4表明,随着浓度的升高,蔗糖可以促进枇杷花粉的萌发和花粉管的生长。枇杷花粉在蔗糖浓度为10%和15%时,花粉萌发率和花粉管长度显著高于其他蔗糖浓度。其中在10%浓度蔗糖作用下,花粉萌发率最高,达到60%。20%蔗糖浓度对花粉萌发有强烈的抑制作用,花粉萌发率急剧下降到36%。枇杷花粉在10%和15%蔗糖浓度的培养基上花粉管生长速率显著高于其他蔗糖浓度(图5),分别为70.4 µm/h和68.8 µm/h。超过15%蔗糖浓度后,花粉管的生长速率又呈下降趋势,20%蔗糖浓度时花粉管速率最小,仅为36.6 µm/h,约为最佳蔗糖浓度条件下花粉管生长长度的二分之一,表现出对枇杷花粉管生长的抑制作用。
3.3. pH值对花粉萌发的影响
培养基的pH值对花粉萌发和花粉管生长有显著的影响,在不同的pH值条件下,对枇杷花粉萌发率

Figure 1. Time course of Loquat pollen germination. Bar = 30 μm
图1. 枇杷花粉萌发的时间进程。Bar = 30 μm
A所示荧光二酯酸酯(FDA)对花粉活力测定;B所示花粉萌发2 h后胼胝质分布(箭头);C为花粉萌发2.5 h后,胼胝质在花粉管顶端分布比较密集(箭头);D为花粉萌发2.5 h后用荧光增白剂(CW)染色,D2为荧光图像,花粉管细胞壁成分没有明显分布特征;E-F为花粉萌发前后生殖核的位置变化。E为萌发前,F为萌发4 h后的花粉,可见生殖核已由花粉粒中央移动到花粉管尖端 (Bar = 30 μm)。

Figure 2. Cytological observation of Loquat pollen germination process
图2. 枇杷花粉萌发过程中的细胞学观察
A-C分别显示蔗糖浓度为5 mg/L、10 mg/L、15 mg/L时花粉萌发及花粉管生长情况;D为花粉在蔗糖浓度为10 mg/L培养基中培养4 h后的生长情况。图A、C、D中Bar = 30 μm;图B中Bar = 60 μm。
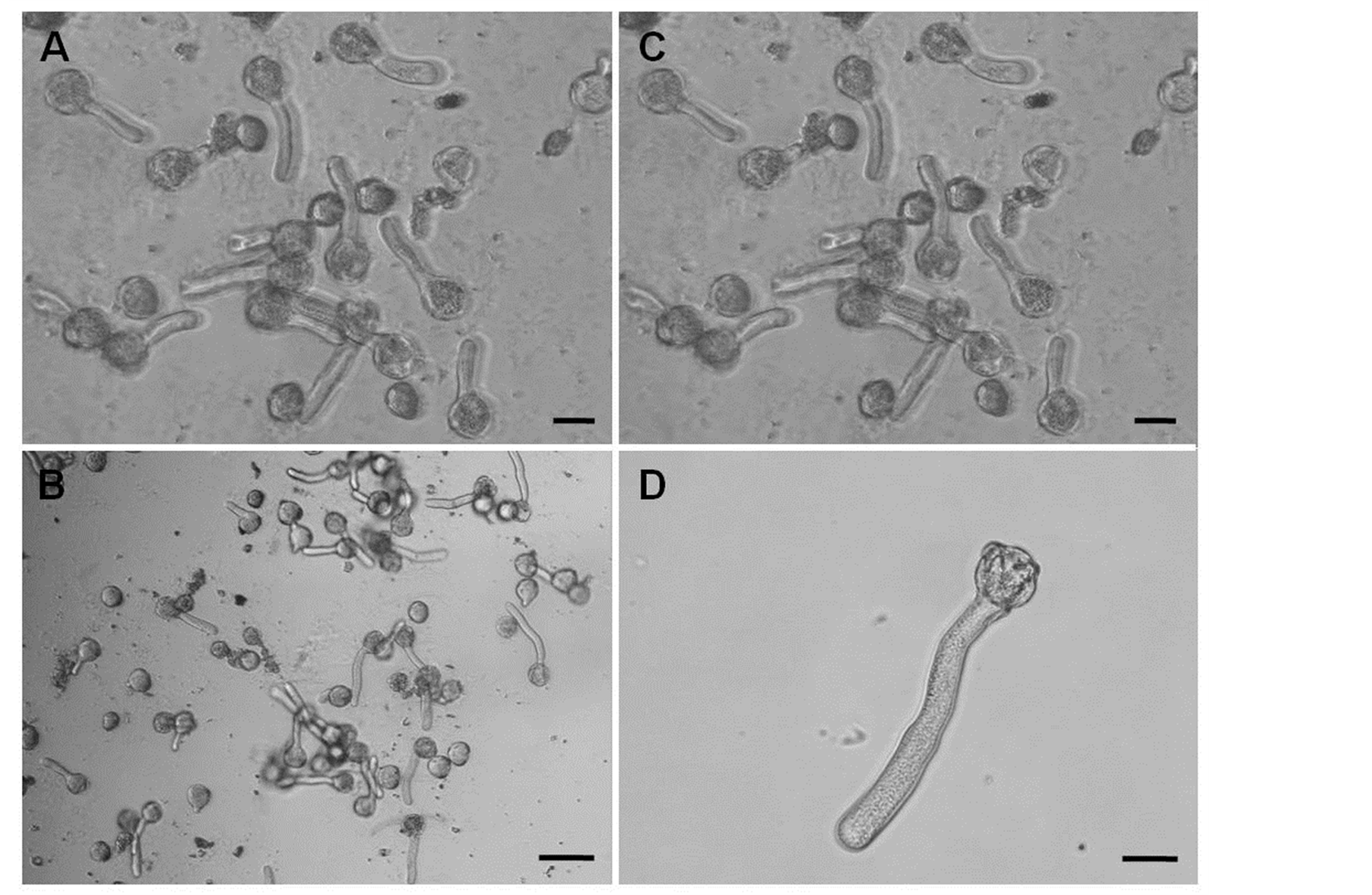
Figure 3. Effects of sucrose concentration on pollen germination and tube growth (3 h later)
图3. 蔗糖浓度对花粉萌发及花粉管生长的影响(3 h后)
Figure 4. Effect of sucrose concentration on Loquat pollen germination (Measured after 5 h, n > 300)
图4. 蔗糖浓度对枇杷花粉萌发的影响(5 h后测定n > 300)
进行了统计(图6)。枇杷花粉适宜在外源pH值为6.0~9.0的条件下萌发,在较为中性或偏碱性的培养基内,花粉萌发率随pH值的升高而逐渐增大,pH值为8.0时达到最大值,为63%。而当培养基偏酸性时,花粉萌发率急剧下降,当pH值为5.0 时萌发率仅为29%。本试验表明,枇杷花粉体外萌发及花粉管生长的最适pH值是8.0。
Figure 5. Effect of sucrose concentration on Loquat tube growth (Measured after 5 h, n > 300)
图5. 蔗糖浓度对枇杷花粉管生长的影响(5 h后测定 n > 300)
Figure 6. Effect of pH on Loquat pollen germination (Measured after 5 h, n > 300)
图6. pH对枇杷花粉萌发的影响(5 h后测定,n > 300)
3.4. GABA对花粉萌发及生长的影响
GABA作为一种信号分子,其浓度对于花粉管的生长具有重要的影响。图7和图8统计分析表明,培养基中添加GABA对枇杷花粉萌发没有显著的促进作用。尽管随着GABA浓度的增加,花粉萌发率差异不显著;但GABA对花粉管的生长明显的促进作用。随着GABA浓度的升高,花粉管生长的长度呈现依次递增的趋势,GABA浓度为8 mM时培养5 h后花粉管的长度可达410 µm。
4. 讨论
花粉作为雄配子的载体,在被子植物受精过程中占有重要地位。自然界中,枇杷有染色体组不同倍性的品种。对于三倍体植株的花粉,由于在减数分裂过程会出现配对的紊乱,会出现较多异常花粉,从而导致花粉败育。而亚整倍体、超整倍体的减数分裂与整倍体相似,因此都能表现出可育性[7] 。本研究以庭院栽培的品种为研究对象,结果证实,该品种的花粉育性较强,FDA活力测定表明,花粉活性接近

Figure 7. Effect of GABA on Loquat pollen germination (Measured after 5 h, n > 300)
图7. GABA浓度对枇杷花粉萌发的影响(5 h后测定n > 300)
Figure 8. Effect of GABA on Loquat tube growth (Measured after 5 h, n > 300)
图8. GABA对枇杷花粉管生长的影响(5 h后测定n > 300)
100%。以此为材料探讨不同理化因子对花粉萌发及其生长的影响提供了良好的材料。
本研究表明,蔗糖浓度是枇杷花粉萌发的一个重要因素。蔗糖既作为碳源,也可作为渗透压调节剂在花粉萌发中其作用。有人在水稻花粉离体萌发研究使用PEG作为渗透调节剂,发现PEG具有促进水稻花粉萌发的作用,但单独使用PEG,则无明显效果[8] 。因此,蔗糖在枇杷花粉萌发中,其功能不是其他因素能代替的。
pH值对花粉萌发、花粉管生长中的作用越来越受到人们重视。不同品种的花粉对pH值的适应性不同[9] -[11] 。适合一个品种花粉萌发的pH范围比较狭窄,低于或高于此范围都会对花粉萌发造成影响。对于枇杷花粉,最适pH值为8.0。pH值与花粉管的生长是否存在相关性,还没有明确的结论[12] 。
本研究已证实GABA可以促进枇杷花粉的萌发和花粉管的生长。到目前为止,人们还为在植物细胞中寻找到其受体,因此,GABA的作用机制仍不是十分清楚[4] 。有研究表明,GABA可能是通过GABA-B受体来调节烟草花粉管的Ca2+、K+通道,导致顶端Ca2+内流、K+外流, 从而调节花粉管的极性生长[13] 。
参考文献 (References)
- Takeuchi, H. and Higashiyama, T. (2011) Attraction of tip-growing pollen tubes by the female gametophyte. Current Opinion in Plant Biology, 14, 614-621.
- 吴举宏 (2003) 影响被子植物花粉管萌发因素的探究. 生物学通报, 38, 55.
- 徐冬青, 储立民, 蔡洁洁 (2004) 七子花花粉萌发的研究. 浙江林业科技, 24, 5-7.
- Palanivelu, R., Brass, L., Edlund, A.F., et al. (2003) Pollen tube growth and guidance is regulated by POP2, an arabidopsis gene that controls GABA levels. Cell, 114, 47-59.
- 张瑞琦, 赵丽, 覃永华, 徐鑫, 余光辉 (2012) γ-氨基丁酸促进拟南芥开花的机理研究. 中国农学通报, 28, 142-147.
- 施征, 史胜青, 钟传飞, 姚洪军, 高荣孚 (2007) γ-氨基丁酸在植物抗逆生理及调控中的作用. 生命科学研究, 11, 57-61.
- 郭启高, 季昆, 吴琼, 何桥, 武宇坤, 李晓林, 梁国鲁 (2010) 龙泉1号天然三倍体枇杷的花粉形态及生活力. 果树学报, 27, 391-396.
- 王胜华, 陈放 (2000) 水稻花粉的离体萌发. 作物学报, 26, 609-612.
- Shivanna (2003) In vitro pollen germination and pollen tube growth. In: Shivanna, Ed., Pollen Biology and Biotechnology, USA Science Publishers, 61-76.
- Holdaway-Clarke, T.L., Weddle, N.M., Kim, S.R., et al. (2003) Effect of extracellular calcium, pH and borate on growth oscillations in Lilium formosanum pollen tubes. Journal of Experimental Botany, 54, 65-72.
- Messerli, M.A. and Robinson, K.R. (2003) Ionic and osmotic disruptions of the lily pollen tube oscillator: testing proposed models. Planta, 217, 147-157.
- 盛仙永, 胡正海 (2005) Ca2+, pH在花粉及萌发花粉管生长中的作用研究进展. 西北植物学报, 25, 194-199.

NOTES
*通讯作者。