Botanical Research
Vol.
08
No.
01
(
2019
), Article ID:
28312
,
9
pages
10.12677/BR.2019.81004
Alternative Ultrasonic and Microwave Assisted Extraction of Isofraxidin from Acanthopanax senticosus
Yadong Du, Junhan Li, Jintao Yu, Chunhui Ma*
College of Material Science and Engineering, Northeast Forestry University, Harbin Heilongjiang

Received: Dec. 10th, 2018; accepted: Dec. 22nd, 2018; published: Dec. 29th, 2018

ABSTRACT
In this study, the dried rhizome of Acanthopanax senticosus was used as raw material, and the isofraxidin was extracted by alternative ultrasonic-assisted and microwave-assisted extraction methods. The experimental conditions of ultrasonic-assisted and microwave-assisted extraction were analyzed by single factor investigation, and the optimal extraction conditions were 60% (volume fraction) ethanol as solvent, solid-liquid ratio was 1:20 g/mL, the optimal ultrasonic power and time were 350 W and 40 min, and the optimal microwave power and time are 500 W and 20 min, respectively. According to the single factor experiment results, the alternative experiment was carried out. The optimal scheme was ultrasound-assisted extraction for 20 min, microwave-assisted extraction for 10 min, and then ultrasound-assisted extraction for 20 min, microwave-assisted extraction for 10 min. The extraction yield of isofraxidin reached to 8.89 ± 0.26 mg/100g. The mechanism of the alternate extraction is explained in detail.
Keywords:A. senticosus, Isofraxidin, Ultrasonic, Microwave, Alternate
超声波与微波交替辅助提取刺五加异 嗪皮啶
杜雅东,李俊含,于金涛,马春慧*
东北林业大学材料科学与工程学院,黑龙江 哈尔滨

收稿日期:2018年12月10日;录用日期:2018年12月22日;发布日期:2018年12月29日

摘 要
本研究以刺五加干燥根茎为原料,采用超声波与微波辅助的提取方法提取异嗪皮啶,分别对超声辅助与微波辅助提取过程中的实验条件进行单因素分析与组合设计。确定最佳提取乙醇体积分数为60%,料液比为1:20 g/mL,最佳的超声功率与时间分别为350 W和40 min,最佳的微波功率和时间为500 W和20 min。根据单因素实验结果,进行超声与微波交替辅助提取异嗪皮啶的实验,得出最佳辅助提取的交替方案为先超声辅助提取20 min,再微波辅助提取10 min,再超声辅助提取20 min,最后微波辅助提取10 min,异嗪皮啶的提取率达到8.89 mg/100g ± 0.26 mg/100g。并对交替提取作用的机理做出详细阐释。
关键词 :刺五加,异嗪皮啶,超声波,微波,交替

Copyright © 2019 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
刺五加为五加科植物刺五加(Acanthopanax sentcosus (Rupr. et Maxim.) Harms)的干燥的根及根茎或茎 [1] 。能够补肾健脾、扶正固本,并且具有益智安神等功效 [2] 。刺五加在我国主要的生长地区在东北地区,其中黑龙江省产量最大,在吉林、河北、辽宁等地也有少量分布 [3] 。刺五加的有效成分有刺五加总苷,包括紫丁香苷、异嗪皮啶、刺五加苷D等 [4] 。异嗪皮啶(Isofraxidin)为刺五加中重要的活性成分之一,具有镇静、抗肿瘤及心血管作用 [5] 。因此药材中异嗪皮啶含量的高低直接影响药品的质量 [6] 。临床上的应用也是非常的广泛,比如主要用于治疗体虚乏力、食欲不振等症状。临床已用刺五加提取物治疗心脑血管疾病、白细胞衰弱症、风湿性类风湿性关节炎和肿瘤等 [7] [8] [9] [10] [11] 。
先前的研究表明,刺五加异嗪皮啶的提取方法主要有回流热提取法 [12] 、超声波辅助提取法 [13] 、微波辅助提取法 [14] 等。回流提取的提取效率较高,但时间长、能耗高;而超声萃取具有设备成本低、溶剂耗量少、操作时间短、操作简便等优势;微波萃取具有选择性高、溶剂耗量少、解热速度快、有效成分得率高等优势 [15] [16] [17] [18] 。所以,近年来超声波与微波辅助提取法被广泛应用于萃取生物碱、黄酮、多糖、苷类等化合物 [19] 。本研究利用超声波萃取与微波萃取的优势,将两种方法结合,设计更适用于刺五加干燥根茎中提取异嗪皮啶的协同或交替方案,并对其萃取机理进行详细地阐释。为超声波与微波协同或交替提取刺五加异嗪皮啶提供实验数据,也为其他天然产物的萃取提供理论依据。
2. 实验
2.1. 材料与仪器
2.1.1. 实验材料
刺五加干燥根茎,产自黑龙江地区,购自黑龙江省哈尔滨市三棵树药材市场,粉碎至60~80目待用。
2.1.2. 实验仪器
超声波微波组合合成/萃取仪(XH300B,北京,中国),高效液相色谱–质谱联用仪(Agilent 1260-6420,美国)。
2.2. 异嗪皮啶的检测方法
异嗪皮啶含量的检测采用高效液相色谱–质谱联用仪,高效液相色谱柱为 ZORBAX SB-C18 (4.6 × 250 mm, 5-Micron),流动相为:乙腈:水:乙酸 = 20:79:1,检测波长为344 nm,柱温箱25℃,检测流速1.0 mL/min,进样量10 μL。在该条件下色谱峰得到完全分离且峰形良好对称。
2.3. 单因素实验
2.3.1. 乙醇体积分数对异嗪皮啶提取率的影响
称取干燥的刺五加原料5.00 g,放入圆底烧瓶中,分别选取体积分数为40%、50%、60%、70%、80%的乙醇溶液,按料液比1:30进行微波提取试验。在微波功率为500 W下工作10 min,提取完成用注射器抽取上清液,冷却,检测有效成分含量。加入100 ml体积分数为60%的乙醇溶液,用微波进行辅助提取30 min,功率分别为300 W、400 W、500 W、600 W、700 W,每隔五分钟,用注射器抽出提取液进行冷却,低温保存,再通过高效液相色谱测定异嗪皮啶的含量。
2.3.2. 提取料液比对异嗪皮啶提取率的影响
准确称取干燥的刺五加将原料5.00 g,放入圆底烧瓶中,按料液比1:10 g/mL、1:15 g/mL、1:20 g/mL、1:25 g/mL和1:30 g/mL分别加入50 mL、75 mL、100 mL、125 mL、150 mL 50%乙醇溶液,在微波功率500 W下工作10 min,提取完成后抽取上清液,冷却,检测其中的有效成分含量。
2.3.3. 超声功率与时间对异嗪皮啶提取率的影响
准确称取绝干的刺五加原料5.00 g六份,放入圆底烧瓶中,分别加入体积分数为60%的乙醇溶液100 mL,分别进行300 W超声辅助提取10 min、20 min、30 min、40 min、50 min、60 min,冷却后取样,经0.22 μm滤膜过滤后,检测其中异嗪皮啶的含量。
准确称取绝干的刺五加原料5.00 g五份,放入圆底烧瓶中,分别加入体积分数为60%的乙醇溶液100 mL,以功率为150 W、250 W、350 W、450 W、550 W进行超声萃取,冷却后取样,经0.22 μm滤膜过滤后,检测其中异嗪皮啶的含量。
2.3.4. 微波功率与时间对异嗪皮啶提取率的影响
准确称取绝干的刺五加原料5.00 g六份于圆底烧瓶中,加入体积分数为60%的乙醇溶液100 mL,进行500 W微波辅助提取5 min、10 min、15 min、20 min、25 min、30 min,冷却后取样,经0.22 μm滤膜过滤后,检测其中异嗪皮啶的含量。
准确称取绝干的刺五加原料5.00 g五份,放入圆底烧瓶中,分别加入体积分数为60%的乙醇溶液100 mL,以功率为300 W、400 W、500 W、600 W、700 W进行超声萃取,冷却后取样,经0.22 μm滤膜过滤后,检测其中异嗪皮啶的含量。
2.3.5. 超声波与微波协同或交替对异嗪皮啶提取率的影响
准确称取绝干的刺五加原料5.00 g于圆底烧瓶中,加入体积分数为60%的乙醇溶液100 mL,放置于超声波微波组合合成/萃取仪中,协同提取为超声波与微波同时作用如表1中方案G,交替辅助提取为超声波与微波分别作用如表1中方案C-F。
2.3.6. 回流提取对比实验
准确称取干燥的刺五加原料50.0 g,放入圆底烧瓶中,加入1000 mL体积分数为60%的乙醇溶液,电热套加热,功率为1000 W,回流提取4 h,每隔一小时提取上清液冷却至室温后,经0.22 μm滤膜过滤,通过高效液相色谱测定异嗪皮啶的含量。
3. 实验结果与分析
3.1. 异嗪皮啶标准曲线的绘制
精密称取异嗪皮啶标准品5.0000 g,转移到10 mL容量瓶中甲醇定容,得异嗪皮啶母液浓度为(50 μg/mL),然后用甲醇将母液稀释至浓度分别为25 μg/mL、12.5 μg/mL、6.25 μg/mL、3.125 μg/mL、1.5625 μg/mL、0.78125、0.390625 μg/mL。高效液相检测峰面积为纵坐标(Y),标准品溶液浓度为横坐标(X)进行线性回归,标准曲线为 。
3.2. 单因素分析结果
3.2.1. 乙醇体积分数对刺五加异嗪皮啶提取率的影响
乙醇体积分数是萃取剂中乙醇体积与萃取剂体积比,也是影响异嗪皮啶提取率的一个重要因素,在其他条件不变的前提下,称取绝干刺五加5.00 g于圆底烧瓶中,分别选取体积分数分别为40%、50%、60%、70%、80%的乙醇溶液,按料液比1:20 g/mL进行微波辅助提取实验。结果如图1(a)所示,在60%的乙醇溶液中提取率最大。而且过大的乙醇浓度会抑制水的电离,使微波加热速率降低,所以在接下来的实验中采取60%的乙醇溶液作为萃取剂。
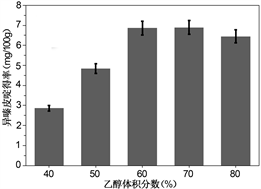 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)
(d)
Figure 1. Single factor analysis results
图1. 单因素分析结果
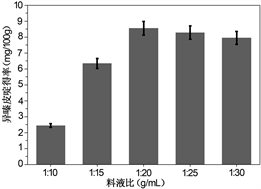
3.2.2. 料液比对刺五加异嗪皮啶提取率的影响
料液比是绝干原料(g)和提取溶剂(mL)之间的比例,属于提取过程中的一个重要的参数,料液比如果过小会造成有效成分不能够快速充分的溶出,但是如果料液比过大又有可能会造成溶剂不必要的浪费和回收时能耗的增加。采用微波提取法优化提取异嗪皮啶的料液比,如图1(b),称取五份原料各5.00 g,分别以1:10、1:15、1:20、1:25、1:30 g/mL料液比加入乙醇溶液,进行微波提取20分钟,计算异嗪皮啶的提取率。料液比由1:10 g/mL增加到1:20 g/mL时,提取率增加的较多,料液比大于1:20 g/mL时,提取率略有下降,并且溶剂的用量也偏大,为了减少溶剂用量,也减少回收能耗,接下来实验的料液比定为1:20 g/mL。
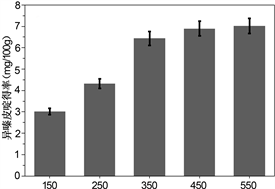
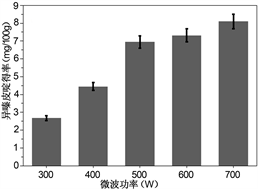
3.2.3. 超声功率与微波功率对提取率的影响
在超声波与微波辅助提取的过程中,功率也是一个需要考虑的因素,其他条件相同,刺五加绝干粉末各5.00 g,以料液比1:20 g/mL加入乙醇溶液在不同功率下进行超声或微波实验。图1(c)和图1(d)分别展示了超声波与微波功率的单因素实验,超声功率小于350 W时,随着超声功率的增加,异嗪皮啶的得率也逐步上升,但350 W和550 W超声时所得异嗪皮啶的得率相差不多,出于节能考虑,后续的实验采用350 W超声;而在微波提取过程中微波功率增加到500 W,异嗪皮啶的得率逐步上升,后续到700 W时产率提升不是很明显,并且会出现提取液爆沸的现象,为了节能与安全考虑,实验采用500 W微波辐射。
3.2.4. 提取方法比较
本实验采用三种不同的提取方法提取刺五加异嗪皮啶,并且对回流提取、超声波和微波辅助提取过程中的参数进行单因素实验分析,比较各种方法异嗪破定的提取率高低。如图2是不同提取方法动力学研究,提取条件为:用50.0 g干燥的刺五加原料以料液比1:20 g/mL加入体积分数为60%的乙醇,回流加热功率为1000 W。5.00 g干燥刺五加以料液比1:20 g/mL,加入体积分数为60%的乙醇超声功率为350 W,微波功率为500 W。从图可以看出,回流提取在4 h后,刺五加异嗪皮啶的提取速率趋于平衡,可达到8.54 mg/100g;超声提取过程中,随着超声提取实验的进行,异嗪皮啶的得率也增加,但超声提取40 min后,异嗪皮啶得率变化很小,保持在7.44 mg/100g ± 0.18 mg/100g;在微波提取过程中,随着提取时间的增加,异嗪皮啶得率也增加,但微波提取20 min后,异嗪皮啶得率几乎不再发生改变,保持在8.08 mg/100g ± 0.26 mg/100g。因此,超声波辅助提取与微波辅助提取能耗小、耗时短,分别经40 min和20 min萃取提取率便趋于平衡,且萃取率与回流提取相当。

Figure 2. Extraction kinetics
图2. 提取动力学研究
3.2.5. 超声波与微波交替辅助提取刺五加异嗪皮啶
根据单因素的实验结果,超声波与微波交替辅助提取异嗪皮啶的实验安排如表1中所示,实验A-F的共同点是提取异嗪皮啶的总时间不变,为60 min;不同之处在于对超声波与微波提取进行了不同的交替安排,观察异嗪皮啶提取率的变化,并将超声波与微波协同提取法(实验G)和回流提取法(实验H)进行比较。如图3,在实验A和B中分别进行了超声波与微波单独辅助提取各60 min,微波提取的异嗪皮啶得率较高(微波提取7.83 mg/100g ± 0.12 mg/100g,超声波提取6.98 mg/100g ± 0.11 mg/100g),但从图3中不难看出,B实验中异嗪皮啶的提取率在40 min后略有下降,说明长时间微波辐射会使天然产物造成异构化。对比实验C和D,共同点为均进行了一次交替实验,在实验进行到20 min时,D的提取率8.02 mg/100g ± 0.32 mg/100g,明显高于C的提取率4.39 mg/100g ± 0.22 mg/100g,在相同的提取时间里,微波辅助的提取率明显高于超声波辅助的提取率,这说明在萃取过程中热效应起主要作用。当提取结束后,比较两者的提取率,C的提取率(8.19 mg/100g ± 0.20 mg/100g)要高于D的提取率(8.48 mg/100g ± 0.33 mg/100g),说明超声波的震荡效应作为预处理时,可加强热效应更快速的传导。并由此进行了实验E和F(交替两次),结果表明,在实验进行10 min后,实验E的提取率(4.69 mg/100g ± 0.24 mg/100g)明显高于实验F的提取率(2.95 mg/100g ± 0.19 mg/100g),但是当实验进行30 min后,由于实验F在20 min到30 min的微波辅助提取,提取率显著增高,达到7.35 mg/100g ± 0.31 mg/100g,高于实验E在30 min时的提取率(6.99 mg/100g ± 0.26 mg/100g),在提取结束时,实验F的提取率(8.89 mg/100g ± 0.26 mg/100g)也明显高于实验E的提取率(8.49 mg/100g ± 0.31 mg/100g)。在C-F的交替实验中可以看出,在提取时间相同的条件下,先超声提取比先微波提取所得异嗪皮啶的得率稍高,且交替2次比交替提取1次的提取率高,异嗪皮啶的得率达到8.89 mg/100 g ±0.26 mg/100g。
Table 1. Ultrasonic and microwave alternating experimental design
表1. 超声波与微波交替实验设计方案

Figure 3. Ultrasonic and microwave alternate assisted extraction
图3. 超声波与微波交替辅助提取
评价一种天然产物的提取方法,除提取率这个要素以外,还要考虑方法的成本和可操作性,以及对环境的污染状况等。本研究主要从异嗪皮啶的提取率,提取时间和环境评估三个方面对超声波与微波辅助交替提取方法进行评估,见表1。回流提取时间为4 h,采用1 kw功率的加热套进行加热,耗费能量4.0 kwh,耗能1 kwh大概排入空气中的二氧化碳量约为800 g,按此计算,回流4 h,要向空气中排放3200 g二氧化碳。微波辅助加热功率为0.50 kw,超声波辅助功率为0.35 kw,依据上面的方法依次计算交替实验向空气中排放的二氧化碳量,远远小于回流提取法排放的二氧化碳量,而且得到最高的异嗪皮啶提取率(交替实验F提取率为8.89 mg/100g ± 0.26 mg/100g)。
3.3. 超声波与微波辅助提取机理分析
3.3.1. 超声波与微波辅助提取的机理
超声波辅助提取过程中,主要应用的是超声波的机械作用而产生的空化效应,机械震荡作用,会使溶剂形成加速度较大的液体射流,显著增大溶剂进入提取物细胞的渗透性,加强传质过程 [20] 。空化作用使细胞中的气泡在一个声波周期内迅速的生成、长大、压缩、崩溃,瞬态空化崩溃时可形成高达5000 K以上的局部热点,展力可达数百乃至上千个大气压,随着高压的释放,将在液体中形成高速射流(非均相)。在萃取过程中,这种强大的冲击流能够有效地减小、消除溶剂与水相之间的阻滞层,从而加大了传质速率。机理示意图如图4(a)所示。
微波辅助提取过程中,刺五加原料中的极性分子(水分子)吸收微波,导致细胞内部的温度迅速升高,从而使胞内压力大于胞外压力,细胞膜与细胞壁膨胀从而造成破裂,细胞中的有效成分充分地溶出,迅速传质,溶解于萃取溶剂中。除此之外,微波还会产生电磁场,加速目标物(刺五加异嗪皮啶)从固相进入溶剂相 [21] 。机理示意图如图4(b)所示。
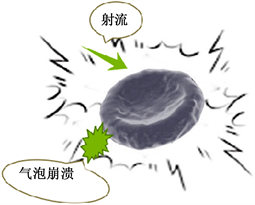 (a)
(a)
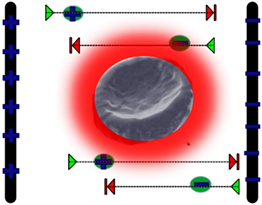 (b)
(b)
Figure 4. Ultrasonic (a) and microwave (b) extraction mechanism
图4. 超声波(a)与微波(b)辅助萃取机理示意图
3.3.2. 超声波与微波交替辅助提取的机理
超声波与微波交替辅助提取技术结合了两种萃取模式的优势,充分利用超声震荡的机械效应与微波辐射的热效应。该方法具有加热速度快,选择性好,能耗低,溶剂用量小,操作简单,且有效成分溶出率高且迅速等诸多优点。同时避免了由于提取时间长而导致天然产物的分解和异构化 [22] 。
最佳的超声波与微波交替辅助提取刺五加异嗪皮啶的实验中,具体方案为先进行超声波提取20 min,再进行微波提取10 min,再进行超声波提取20 min,最后微波提取10 min,从表1中不难看出,此方案异嗪皮啶提取率高,能耗少,环境负荷小。机理示意图如图5所示。分析其原因可能是:刺五加干燥根茎木质化程度较高,原料表面致密,第一步先进行超声震荡作用,由于超声的空化效应,混合在细胞外溶剂中的气泡会产生崩溃溃灭的现象,并且在胞外形成射流,增加溶剂在细胞表面的流动速度,进而进入细胞内部;第二步的微波辅助提取,微波独特的加热方式选择性加热细胞内极性分子,使细胞的胞内压力大于胞外压力而膨胀,甚至涨破,部分有效物质从细胞内溶出。第三步的超声处理,由于震荡效应进一步增加细胞膜的通透性,气体爆破所产生的瞬时巨大的拉力使更多的溶剂进入细胞内,并且溶剂与溶解在溶剂中的气体一同进入细胞内,在细胞内也会发生气泡溃灭的现象,使有效物质更好地溶解于溶剂中;所以,当第四步再次进行微波处理时,热效应不仅使细胞再次膨胀,还使溶解异嗪皮啶的溶剂迅速转移至胞外,大大增加了提取效率,使更多的有效物质分散到胞外溶液中。从图3中可以看出,由单独微波辅助的萃取率大于由单独超声辅助的萃取率,证明在刺五加根茎的提取过程中,热效应占据主要的优势,但交替实验结果说明,超声波辅助作为微波辅助萃取前的预处理,可大大提高异嗪皮啶的提取率,而且交替辅助萃取两次的提取率大于交替辅助萃取一次的提取率。
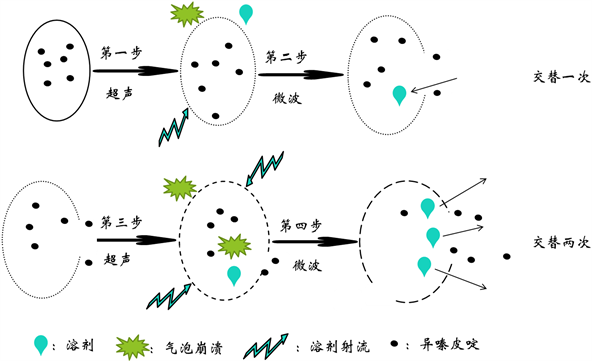
Figure 5. Schematic diagram of alternating ultrasonic and microwave assisted extraction mechanism
图5. 超声波与微波交替辅助提取的机理示意图
4. 结论
本研究将超声波与微波交替辅助提取刺五加异嗪皮啶的技术参数进行了优化,以异嗪皮啶的提取率为响应值,通过单因素分析,得出提取溶剂为体积分数60%的乙醇溶液,最佳料液比是1:20 g/mL,超声辅助提取的功率和时间分别为350 W和40 min;微波辅助提取的功率和时间分别为500 W和20 min。最佳的交替辅助提取方案为先超声辅助提取20 min,再微波辅助提取10 min,再超声辅助提取20 min,最后微波辅助提取10 min,异嗪皮啶的提取率达到8.89 ± 0.26 mg/100g,在此过程中约向大气中释放二氧化碳320 g。并对交替提取作用的过程机理做出详细阐释。为超声波与微波协同或交替提取刺五加异嗪皮啶提供实验数据,也为其他天然产物的萃取提供理论依据。
致谢
作者感谢东北林业大学双一流建设启动金(YQ2015-02)和黑龙江省博士后启动金(LBH-Q16001)。
文章引用
杜雅东,李俊含,于金涛,马春慧. 超声波与微波交替辅助提取刺五加异嗪皮啶
Alternative Ultrasonic and Microwave Assisted Extraction of Isofraxidin from Acanthopanax senticosus[J]. 植物学研究, 2019, 08(01): 25-33. https://doi.org/10.12677/BR.2019.81004
参考文献
- 1. 中国药典[S]. 2015: 206, 1034-1036.
- 2. 孟庆艳, 李莹, 刘圆, 等. 共有峰率和变异峰率双指标序列法分析藏药材红毛五加与濒危药材刺五加的亲缘相似性[J]. 西南民族大学学报: 自然科学版, 2008, 34(2): 290-293.
- 3. 尚海花, 王淼, 刘颖, 郑雅楠, 白润, 廖茂梁. HPLC法测定不同产地刺五加中原儿茶酸、紫丁香苷、绿原酸、刺五加苷E和异嗪皮啶[J]. 现代药物与临床, 2018, 33(6): 1324-1328.
- 4. 谭五丰, 袁艳秋, 于笛笛, 张斌旺, 王建力, 栾广忠. 刺五加与短梗五加中紫丁香苷、刺五加苷E及异嗪皮啶含量比较[J]. 现代食品科技, 2017, 33(10): 302-307.
- 5. 李昌禹. 刺五加生境与药用成分含量关系的研究进展[J]. 北方园艺, 2009(12): 140-142.
- 6. 姚慧敏, 关颖丽, 朱俊义, 葛延杰, 黄媛, 张萌. UPLC法同时测定野生刺五加果和根中5种主要成分的含量[J].中国药房, 2016, 27(12): 1668-1671.
- 7. Zhou, Y.Y., Song, W., Fu, Y.L., Denis, B., Wang, J.P., Li, Y.Z. and Lu, W.H. (2018) Acanthopanax senticosus Reduces Brain Injury in Mice Exposed to Low Linear Energy Transfer Radiation. Biomedicine, 99.
- 8. 田志浩, 马长华, 黄颖, 周艳华, 崔海峰, 孙明杰. 刺五加镇静抗疲劳有效成分的提取、纯化工艺优选[J]. 中国实验方剂学杂志, 2013, 19(19): 38-42.
- 9. Lee, S., Park, H.J., Jeon, S.J., Kim, E., Lee, H.E., Kim, H., Kwon, Y., Zhang, J.B., Jung, I.H. and Ryu, J.H. (2017) Cognitive Ameliorating Effect of Acanthopanax koreanum Against Scopolamine-Induced Memory Impairment in Mice. Phytotherapy Research, 31. https://doi.org/10.1002/ptr.5764
- 10. Han, Y.-H., Li, Z., Um, J.-Y., Liu, X.Q. and Hong, S.-H. (2016) An-ti-Adipogenic Effect of Glycoside St-E2 and Glycoside St-C1 Isolated from the Leaves of Acanthopanax henryi (Oliv.) Harms in 3T3-L1 Cells. Bioscience, Biotechnology, and Biochemistry, 80. https://doi.org/10.1080/09168451.2016.1217150
- 11. Niu, H.S., Hsu, F.L. and Liu, I.M. (2008) Role of Sympathetic Tone in the Loss of Syringin-Induced Plasma Glucose Lowering Action in Conscious Wistar Rats. Neuroscience Letters, 445, 113-116. https://doi.org/10.1016/j.neulet.2008.08.066
- 12. Wang, Z.B., Jiang, H., Xia, Y.G., et al. (2012) α-Glucosidase Inhibitory Constituents from Acanthopanax senticosus Harm Leaves. Molecules, 17, 6269-6276. https://doi.org/10.3390/molecules17066269
- 13. 汪琢, 姜守刚, 郭晓帆, 王虹玲, 刘欣. 刺五加中异嗪皮啶提取工艺优化及其抗肿瘤、抗氧化活性研究[J]. 天然产物研究与开发, 2015, 27(6): 1092-1098.
- 14. 张琳, 刘洋, 盖庆辉, 祖元刚. HPLC-MS/MS法测定超声提取刺五加果实中刺五加苷B、E和异嗪皮啶的含量[J].上海中医药大学学报, 2014, 28(4): 90-95.
- 15. 樊如强, 傅宏征, 金学英, 王建斌, 高纯, 盖春燕, 胡荣. 刺五加有效成分提取工艺考察及不同产地刺五加中有效成分量的比较[J]. 中草药, 2014, 45(2): 260-264.
- 16. 袁昕蓉, 毕开顺, 李强. 正交设计优化刺五加中游离异嗪皮啶提取工艺及结合型异嗪皮啶的水解工艺[J]. 中药材, 2004(3): 209-211.
- 17. 于丽云, 李云鹏, 罗影, 段丽萌. HPLC法比较野生刺五加中的异嗪皮啶[J]. 药物评价研究, 2014, 37(3): 250-252.
- 18. Wang, J.L., Zhang, J., Zhao, B.T., et al. (2010) A Comparison Study on Microwave -Assisted Extraction of Potentillaanserina L. Polysaccharides with Conventional Method: Molecule Weight and Antioxidant Activities Evaluation. Carbo-Hydrate Polymers, 80, 84-93. https://doi.org/10.1016/j.carbpol.2009.10.073
- 19. 宋承富, 叶萍. 黄芩提取物工艺研究[J]. 中华中医药学刊, 2011, 29(3): 641-644.
- 20. 周伟, 于笛, 迟治平, 马萍, 郭增旺, 宋洋, 张丽萍. 超声微波协同萃取紫丁香叶总黄酮工艺及其稳定性研究[J].中国食品添加剂, 2018(8): 111-119.
- 21. 李志锐, 乐粉鹏, 王娟, 韩淑琴. 超声微波协同萃取柚皮总黄酮及其抗氧化性研究[J]. 食品研究与开发, 2018, 39(5): 60-63.
- 22. 王英超, 王蕾, 金红, 李秋闯, 杨孝丽. 超声微波协同萃取法提取菊苣酸条件研究[J]. 食品研究与开发, 2015, 36(15): 28-31.
NOTES
*通讯作者。
