Botanical Research
Vol.
08
No.
04
(
2019
), Article ID:
31544
,
8
pages
10.12677/BR.2019.84045
Study on the Technology of Water Extraction of Eucommia Dry Powder and Active Ingredients
Huiru Qiao*, Wen Zhu*, Xiaojuan Bi, Qi Lu, Yuangang Zu#
Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin Heilongjiang

Received: Jul. 2nd, 2019; accepted: Jul. 23rd, 2019; published: Jul. 30th, 2019

ABSTRACT
Using Eucommia dry powder as raw material, the single-factor experimental method was used to investigate the ratio of material to liquid (1:5 - 1:30 g∙mL−1), extraction time (0.5 - 3.0 h) and extraction temperature (60˚C - 100˚C) to Eucommia dry powder. The effect of total solid yield and active ingredient extraction rate was established. The optimal extraction process for single factor experiment was as follows: material to liquid ratio 1:20, extraction time 1.5 h, extraction temperature 100˚C. The total solid yield was 1.86%; chlorogenic acid yield was 0.0164%; aucubin yield was 0.0317%; geniposide yield was 0.0063%; pinoresinol diglucoside yield was 0.0696% under the optimum extraction processes for single-factor experiment. The method of water extraction of Eucommia dry powder is simple, and hasn’t the problems of environmental pollution and solvent recovery. This paper provides an experimental basis for the extraction and development of active ingredients of Eucommia dry powder.
Keywords:Eucommia, Eucommia Dry Powder, Water-Bath, Total Solid, Active Component
水提取杜仲干粉及活性成分工艺研究
乔慧茹*,朱雯*,毕晓娟,路祺,祖元刚#
东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨

收稿日期:2019年7月2日;录用日期:2019年7月23日;发布日期:2019年7月30日

摘 要
以杜仲干粉为原料,采用单因素实验方法探讨料液比(1:5~1:30 g∙mL−1)、提取时间(0.5~3.0 h)和提取温度(60~100℃)对杜仲干粉总固形物得率及活性成分提取率的影响,并确定单因素实验最佳提取工艺为:料液比1:20,提取时间1.5 h,提取温度100℃。此条件下,总固形物得率为1.86%,其中活性成分绿原酸得率为0.0164%,桃叶珊瑚苷得率为0.0317%,京尼平苷得率为0.0063%,松脂醇二葡萄糖苷得率为0.0696%。水提取杜仲干粉方法简单,无环境污染和溶剂回收问题,本文为杜仲干粉活性成分提取和开发利用提供的实验依据。
关键词 :杜仲,杜仲干粉,水浴,总固形物,活性成分

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
杜仲(Eucommia ulmoides Oliv.)又名思仙、思仲、丝绵树、木棉等 [1] ,是我国特有的名贵树种和十分重要的国家战略资源,不仅有绿化等功能,也是十分重要的名贵中药。杜仲皮是名贵的滋补药材,具有补中益气、强筋骨、降血压、补肝肾的功效 [2] [3] 。杜仲在我国被利用的历史可以追溯到公元二世纪的《神农本草经》 [4] ,其木本和健康资源,是我国国防、军用、民用等多个领域天然橡胶的战略安全资源,发展前景巨大 [5] 。我国已将杜仲作为主要树种纳入《国家储备林树种目录》,并列入重点支持发展的木本油料树种。近年来研究表明:杜仲对血压有“双向调节”作用,是其他化学药物无法比拟的,其所含的活性成分包括绿原酸、桃叶珊瑚苷、松脂醇二葡萄糖苷、京尼平苷酸等 [6] [7] 。有机溶剂法和水煎提法 [8] [9] [10] [11] 是植物活性成分提取常用的方法,其中有机溶剂法一般选用乙醇等有机溶剂或乙醇和甲醇混合溶液 [12] ,有机溶剂法虽然提取率较高,但存在一定的安全隐患,溶剂回收操作比较繁琐,成本相对较高。水煎提法是传统中药提取常采用的方法,具有操作简单,安全隐患小,成本低等优点。因此,本实验以水作为溶剂,提取杜仲干粉成分,为杜仲干粉活性成分的提取提供理论依据,为提高杜仲生产的经济效益提供数据基础。
2. 材料与方法
2.1. 原料与设备
采于三门峡市灵宝市,树龄为15年左右的杜仲干,经东北林业大学森林植物生态学教育部重点实验室毛子军教授鉴定为被子植物门杜仲科,杜仲属植物杜仲干,经过风干后,切断后粉碎备用。
对照品松脂醇二葡萄糖苷(含量 ≥ 98%)、绿原酸(含量 ≥ 98%)、京尼平苷(含量 ≥ 98%)、桃叶珊瑚苷(含量 ≥ 98%)均为成都康邦生物科技有限公司出品。
2.2. 实验方法
分别考察料液比(1:5~1:30 g∙mL−1)、提取时间(0.5~3.0 h)和提取温度(60℃~100℃)对杜仲干粉总固形物得率及活性成分提取率的影响,并确定单因素试验最佳方案,每个条件下的实验重复3次,以平均值为实验结果。
2.2.1. 总固形物得率
称取一定量的杜仲干粉样品,按比例加入蒸馏水,在预定温度下水浴提取一段时间,过滤、过滤液烘干,计算得到杜仲干粉总固形物得率。
(1)
其中:A为总固形物得率,%;W为杜仲干粉水提取液烘干后总质量,g;W0为杜仲干粉绝干质量,g;
2.2.2. 活性成分提取率
采用高效液相色谱法,色谱柱HiQ sil C18W柱(5 μm × 4.6 mm × 250 mm),流速1 mL/min,进样量10 µL,柱温为室温。绿原酸和桃叶珊瑚苷流动相为甲醇–水(5:95,体积比),检测波长为208 nm;京尼平苷和松脂醇二葡萄糖苷流动相为甲醇–水(25:75,体积比),检测波长为235 nm。
标准曲线的绘制:准确称取绿原酸绿原酸、桃叶珊瑚苷、京尼平苷和松脂醇二葡萄糖苷对照品5.0 mg,加入甲醇制成0.5 mg/mL的溶液,作为对照品储备液。精密吸取对照品储备液0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL和5 mL于容量瓶中,加入甲醇定容,分别得相应浓度的对照品溶液。由高效液相色谱仪分别自动精密吸取10 µL,以峰面积作纵坐标,以对照品浓度为横坐标。标准曲线分别为:Y绿原酸标准曲线= 8.09 × 106X + 44687,R2 = 0.9999,在50~500 mg/L线性良好;Y桃叶珊瑚苷标准曲线 = 1.56 × 106X + 21327,R2 = 0.996,在50~500 mg/L线性良好;Y京尼平苷标准曲线 = 1.03 × 107X + 55776,R2 = 0.9992,在50~500 mg/L线性良好;Y松脂醇二葡萄糖苷标准曲线 = 4.15 × 106X – 4352.7,R2 = 0.9999,在50~500 mg/L线性良好。绿原酸的保留时间为22 min,桃叶珊瑚苷的保留时间为13 min,京尼平苷的保留时间为28 min,松脂醇二葡萄糖苷的保留时间为41 min。
样品中绿原酸、桃叶珊瑚苷、京尼平苷和松脂醇二葡萄糖苷提取率测定:提取液计量体积后,取1 mL稀释至适宜的检测浓度后离心(离心条件:温度25℃;速度12000 r/min;时间5 min),取上清液检测,每样重复进样3次,将峰面积取平均值,代入回归方程,依式(2)计算绿原酸、桃叶珊瑚苷、京尼平苷和松脂醇二葡萄糖苷提取率。
(2)
式中,B为活性成分提取率,%;C为活性成分浓度,mg/mL;V为提取液体积,mL;W0为原料质量,g。
2.2.3. 红外光谱分析
将2.0 mg试样与200 mg溴化钾(KBr)经玛瑙研钵研磨后压片,采用美国Nicolet公司的MAGNA-IR560 E.S.P型红外光谱仪(扫描范围4000~400 cm−1)测定。
2.2.4. 扫描电子显微镜分析
英国Camscan公司MX2600FE型扫描电子显微镜对水提取处理前后的杜仲干粉进行观察。
3. 结果与讨论
3.1. 料液比对杜仲干粉成分提取率的影响
在提取温度100℃回流提取1.0 h条件下,不同料液比对杜仲干粉水溶液中总固形物得率的影响见图1。可见,随着料液比的增加杜仲干粉水溶液中总固形物得率随之增加,当料液比大于1:20时,总固形物得率随料液比的增加呈现趋平趋势。
不同料液比对杜仲干粉主要活性成分提取率的影响见图2。由图可知,随着料液比的增加杜仲干粉中四种成分绿原酸、桃叶珊瑚苷、京尼平苷和松脂醇二葡萄糖苷提取率随之增加;当料液比大于1:15时,桃叶珊瑚苷和绿原酸提取率随料液比的增加呈现趋平趋势;当料液比大于1:15时,京尼平苷和松脂醇二葡萄糖苷提取率随料液比的增加呈现逐渐增加趋势,但整个区间(1:5~1:30)增加幅度较小。
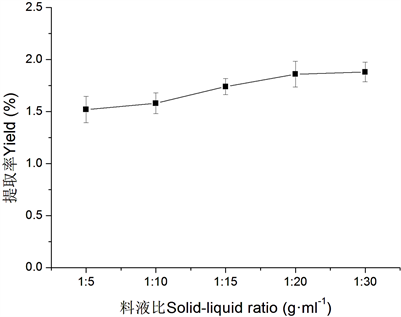
Figure 1. Effect of solid-liquid ratio on total solid yield
图1. 料液比对总固形物得率的影响

Figure 2. Effect of solid-liquid ratio on the active component yields
图2. 料液比对活性成分得率的影响
3.2. 提取时间对杜仲干粉成分提取率的影响
在提取温度100℃回流提取,料液比1:20条件下,不同提取时间对杜仲干粉水溶液中总固形物得率的影响见图3。可以看出,随着提取时间的延长杜仲干粉水溶液中总固形物得率也随之增加,当提取时间超过1.5 h,总固形物得率却呈现下降的趋势。
图4为提取温度100℃回流提取,料液比1:20条件下,不同提取时间对杜仲干粉主要活性成分提取率的影响。从图可以看出,随着提取时间的延长杜仲干粉中绿原酸提取率呈现逐渐降低的趋势;而松脂醇二葡萄糖苷提取率随提取时间的延长呈先增加后趋平趋势;桃叶珊瑚苷和京尼平苷提取率随着提取时间的延长呈现先增加后降低的趋势,在整个区间(0.5~3.0 h)变化幅度较小。

Figure 3. Effect of extraction time on total solid yield
图3. 提取时间对总固形物得率的影响

Figure 4. Effect of extraction time on the active component yields
图4. 提取时间对活性成分得率的影响
3.3. 提取温度对杜仲干粉成分提取率的影响
当料液比1:20,提取时间1.5 h条件下,不同提取温度对杜仲干粉水溶液中总固形物得率的影响见图5。随着提取温度的升高,杜仲干粉水溶液中总固形物得率呈现增加趋势。
不同提取温度对杜仲干粉主要活性成分提取率的影响见图6。由图可知,随着提取温度的升高杜仲干粉中桃叶珊瑚苷提取率随之显著降低;绿原酸提取率随着提取温度的升高呈现略有增加的趋势;京尼平苷和松脂醇二葡萄糖苷提取率随着提取温度的升高呈明显增加趋势。

Figure 5. Effect of extraction temperature on total solid yield
图5. 提取温度对总固形物得率的影响
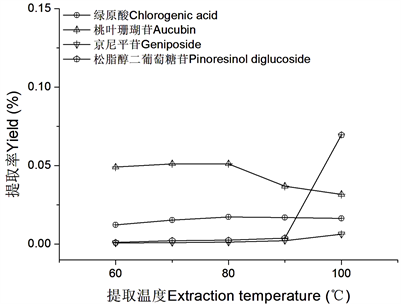
Figure 6. Effect of extraction temperature on the active component yields
图6. 提取温度对活性成分得率的影响
3.4. 杜仲干粉和提取物红外光谱分析
在杜仲干粉原料和杜仲干粉水提取物红外谱图见图7,3370 cm−1处吸收峰是羟基(-OH)伸展振动吸收峰,2937 cm−1处吸收峰是甲基、亚甲基的碳氢键(C-H)伸展振动吸收峰,1600 cm−1处吸收峰是芳香环骨架振动吸收峰,1045 cm−1处吸收峰是醚键(C-O-C)伸展振动吸收峰,表明有醚键存在。杜仲提取物羟基伸展振动吸收峰明显变宽,说明结构中含有更多的羟基,甲基、亚甲基的碳氢键伸展振动吸收峰明显减弱,酮基伸展振动吸收峰基本消失说明杜仲提取物中含有较少的酮基结构。
3.5. 杜仲干粉和杜仲干粉水提取剩余物表面结构分析
图8是杜仲干粉和杜仲干粉水提取剩余物扫描电镜图,从图可知,未经过提取处理的杜仲干粉原料表面(图8(a))比较紧凑且粗糙,经过水提取后杜仲干粉剩余物表面(图8(b))变得松散且光滑,表面有明显缝隙产生,说明水能提取和溶解杜仲干粉中大部分水溶成分,使得杜仲干粉表面结构有了较明显改变。

Figure 7. FTIR of Eucommia wood powder material (A) and water extract (B)
图7. 杜仲干粉原料(A)和水提取物红外光谱图(B)

Figure 8. SEM images of Eucommia wood powder material (a) and residue from water-bath extract (b)
图8. 杜仲干粉原料(a)和杜仲干粉水提剩余物(b)扫描电镜图
4. 结论
杜仲虽然是古老的树种,但它的种植和综合利用却是新兴的产业。目前,杜仲的应用已从单一的药用扩展到多个重要领域,在油料、食品、绿色养殖等行业具有重要地位。杜仲全身都是宝,其皮、花、果、叶等具有很高的食用和药用价值。关于杜仲干粉中有效活性成分提取和分离却研究较少,乙醇和甲醇是最常用的提取溶剂。考虑到溶剂残留问题 [13] [14] ,本实验以杜仲干粉为原料,采用水提取杜仲干粉成分。以杜仲干粉总固形物得率为指标,研究了杜仲干粉成分的水提取工艺,并考察了不同水提取条件对杜仲干粉中主要活性成分提取率的影响。
单因素实验最佳提取工艺为:料液比1:20,提取时间1.5 h,提取温度100℃。此条件下,杜仲干粉总固形物得率为1.86%,其中活性成分绿原酸得率为0.0164%,桃叶珊瑚苷得率为0.0317%,京尼平苷得率为0.0063%,松脂醇二葡萄糖苷得率为0.0696%。由于本实验采用水提取法,杜仲干粉中活性成分得率虽然低,但水提取方法更简单,无环境污染和溶剂回收问题,节省了后续处理,为杜仲干粉的有效成分提取和开发利用提供的实验依据。
基金项目
林业公益性行业科研专项(201504701);青年教师自主创新基金项目(DL12BA37)。
文章引用
乔慧茹,朱 雯,毕晓娟,路 祺,祖元刚. 水提取杜仲干粉及活性成分工艺研究
Study on the Technology of Water Extraction of Eucommia Dry Powder and Active Ingredients[J]. 植物学研究, 2019, 08(04): 370-377. https://doi.org/10.12677/BR.2019.84045
参考文献
- 1. 冯风, 梁志荣. 我国历史上对杜仲的认识和利用[J]. 西北林学院学报, 1996(11): 84-89.
- 2. 杨峻山, 张聿梅. 杜仲研究的现状与展望[J]. 自然资源学报, 1997, 12(1): 60-67.
- 3. 赵军太, 张诚. 杜仲不同部位的化学成分研究与应用[J]. 实用医技杂志, 2003, 10(9): 1025-1026.
- 4. (魏)吴普. 神农本草经[M]. 北京: 人民卫生出版社, 1963.
- 5. 傅主国. 中国植物红皮书——稀有濒危植物(第一册) [M]. 北京: 科学出版社, 1991.
- 6. 程光丽. 杜仲有效成分分析及药理学研究进展[J]. 中成药, 2006, 28(5): 723-725.
- 7. 管淑玉, 苏薇薇. 杜仲化学成分与药理研究进展[J]. 中药材, 2003, 26(2): 124-129.
- 8. 刘海军, 裘爱咏, 任惠兰. 正交实验优化杜仲叶桃叶珊瑚苷提取工艺[J]. 食品研究与开发, 2008, 29(1): 99-103.
- 9. 马希汉, 尉芹. 不同处理方法对杜仲叶有效成分含量的影响[C]//II首届国际杜仲学术会议论文集. 北京: 中国林业出版社, 1997: 156-158.
- 10. 邓勇, 彭明. 杜仲叶有效成分的提取[J]. 农业工程学报, 1997, 13(3): 230-234.
- 11. 陈晓娟, 周春山. 酶法及半仿生法提取杜仲叶中绿原酸和黄酮[J]. 精细化工, 2006, 23(3): 257-260.
- 12. 刘静, 吕海涛. 正交试验法优选杜仲叶中桃叶珊瑚苷和京尼平苷酸的提取工艺研究[J]. 中南药学, 2010, 8(9): 661-664.
- 13. 彭密军, 周春山, 钟世安, 等. 杜仲中桃叶珊瑚苷的提取工艺研究[J]. 林产化学与工业, 2003, 23(3): 65-68.
- 14. 陈晓青, 李宇萍, 彭密军, 等. 杜仲中松脂醇二葡萄糖甙的提纯[J]. 中南工业大学学报, 2003, 34(3): 262-265.
NOTES
*第一作者。
#责任作者。