Botanical Research
Vol.
09
No.
01
(
2020
), Article ID:
33796
,
8
pages
10.12677/BR.2020.91004
The Physiological and Biochemical Changes of Lotus (Nelumbo) Flowers in Natural State and Vase
Jie Min1,2,3, Daike Tian1,2*, Yanci Xiang3*
1Shanghai Chenshan Botanical Garden/Shanghai Chenshan Plant Science Research Center of Chinese Academy of Sciences, Shanghai
2Shanghai Key Laboratory of Plant Functional Genomics and Resources, Shanghai
3Institute of Ecological Landscape Restoration and Planning and Design, Hunan University of Science and Technology, Xiangtan Hunan

Received: Nov. 26th, 2019; accepted: Dec. 27th, 2019; published: Jan. 3rd, 2019

ABSTRACT
The fresh cut flower of lotus (Nelumbo) has a big potential in Chinese flower market. In order to understand the physiological and biochemical differences of lotus flowers under the natural and vase conditions. Nelumbo nucifera “Zhongshan Hongtai” with its morphological changes observed was investigated on the physiological indices including malondialdehyde (MDA), soluble protein, soluble sugar, superoxide dismutase (SOD), catalase (CAT), peroxidase (POD), and etc. The results showed that the contents of soluble protein and sugar in lotus petals presented an overall decline trend while blooming. Whereas, MDA content positively correlated to the aging degree, while SOD and CAT contents rose at the initial stage in vase and declined at the later stage. The variation of POD contents is relatively larger. Thus, the main senescence reason of the cut-flower withering was possibly the peroxidation of membrane lipid caused by the decreased activities of antioxidant enzymes breaking the clearing balance and the increased cell membrane permeability.
Keywords:Fresh Lotus Cut-Flower, Senescence, Physiological and Biochemical Change, Membrane Lipid Peroxidation

自然与瓶插状态荷花(Nelumbo)花朵的生理生化比较分析
闵睫1,2,3,田代科1,2*,向言词3*
1上海辰山植物园/中国科学院上海辰山植物科学研究中心,上海
2上海市资源植物功能基因组学重点实验室,上海
3湖南科技大学生态景观修复与规划设计研究所,湖南 湘潭

收稿日期:2019年11月26日;录用日期:2019年12月27日;发布日期:2019年1月3日

摘 要
鲜切荷花的开发利用在国内具有很大的市场潜力,为了了解荷花切花在自然与瓶插状态下的生理生化差异,以荷花品种“中山红台”的花朵为材料,观测其形态变化,分析花被片的丙二醛(MDA)、可溶性蛋白及酶活性等指标。结果表明,随着花朵开放,可溶性蛋白和可溶性糖整体呈下降趋势,而丙二醛含量则与衰老程度呈正相关,超氧化物歧化酶(SOD)及过氧化氢酶(CAT)在瓶插初期上升后期下降,过氧化物酶(POD)变化幅度较大。由此推测,切花体内抗氧化酶活性减弱及清除平衡的打破,细胞膜透性增强所导致的膜脂过氧化作用可能是荷花切花衰老的主要原因。
关键词 :鲜切荷花,瓶插,衰老,生化变化,膜脂过氧化

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着鲜切花市场的发展,近年来睡莲、荷花、再力花等水生切花兴起,越来越为人们所熟知。荷花是莲科(Nelumbonaceae)莲属(Nelumbo)的多年生挺水植物,也是我国十大名花中唯一的水生花卉,是极具市场潜力的水生切花,但是荷花通气组织发达,保水能力较差,形成瓶插花期短,观赏时长短等特点,制约其市场推广及发展。切花的生命活动在采后瓶插中仍在继续,采收后切花要经历发育、成熟、衰老及凋谢等几个阶段,其中衰老是植物生长发育中一个必经的过程 [1]。切花的瓶插寿命通常较短,其衰老通常由花被的萎蔫、脱落所定义。切花采摘通常在花蕾期或是初开时进行,脱离母体后的花朵仍进行维持生命的新陈代谢活动及生理生化变化。随着瓶插天数延长,切花自身体内也发生着显著而复杂的生理生化变化,包括水分失调、呼吸消耗、可溶性糖含量的增加,生物大分子的降解和脂质过氧化所产生的自由基从而造成切花观赏品质下降 [2] [3] [4] [5]。植物体内的酶也与衰老息息相关,例如脂氧和酶易产生自由基使膜损伤并累积丙二醛。为了与衰老相抗衡,植物体内产生了维护自身清除自由基的保护系统,主要由保护酶和一些抗氧化物质组成,其中包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等 [6]。花朵是切花最主要的部分,而花瓣则是观赏的核心。鉴于花各部分结构和生理的差异,大多数切花衰老通常以花瓣或花被为研究材料。本研究主要是对荷花在自然状态及瓶插状态进行生理生化指标测定,比较分析两种状态下花被片中丙二醛、可溶性蛋白、可溶性糖、超氧化物歧化酶、过氧化氢酶及过氧化物酶等指标,了解荷花鲜切花的采后生理变化,研究其在自然和瓶插状态的生理特性及差异,为荷花切花的保鲜技术提供理论依据。
2. 材料与方法
2.1. 实验材料
实验材料为上海辰山植物园“国际莲属资源圃”所栽植的“中山红台”。该品种为亚洲莲中大型红色重台品种,心皮全泡化或瓣化,有少量雄蕊。实验材料种植于1.2 m × 0.8 m × 0.45 m白色长方形塑料盆中,盆间距60 cm,常规栽培和施肥管理。
2.2. 实验方法
在花蕾初绽放至花被片脱落期间,采取完全随机法每天上午7:00~8:00左右选取3朵“中山红台”花朵正常的花被作为试材。瓶插处理则当天随机采摘放于实验架上的3朵荷花,直至试验结束。取样部位为中间层的两轮花被。生理测定方法参照王学奎(2006)的方法进行,丙二醛含量测定采用硫代巴比妥酸法 [7] ;可溶性糖含量测定采用蒽酮比色法 [7] ;可溶性蛋白采用考马斯亮蓝G-250法 [7] ;超氧化物歧化酶测定采用氮蓝四唑法 [7] ;过氧化氢酶采用紫外吸收法 [7] ;过氧化物酶测定采用愈创木酚法 [7]。采用SPSS19.0统计软件进行统计。
3. 结果与分析
3.1. 荷花衰老过程的形态变化
经观察发现,“中山红台”从花蕾露出水面到花朵初开大致需要11~13天;开放天数从花蕾微绽到花被片褐化及凋零,单朵观赏时期夏季大约可达5天;瓶插时与自然状态下相同,但其观赏品质却有所差异(如图1)。“中山红台”在自然状态下开放程度更大,完全开放时间较瓶插状态的早,花被片排列紧实,而在瓶插状态下开放速度较慢,在开花第1~3天花朵尚未完全张开,且在第三天花朵外被出现褐化痕迹。随着瓶插日期延长,在第4天花朵完全开放但内外被片均出现褐化斑点,到第5天花被出现松散、皱缩等现象,一触即落。









 第一天 第二天第三天 第四天 第五天
第一天 第二天第三天 第四天 第五天
Figure 1. The opening and aging process of lotus flowers in natural state (upper) and vase (below)
图1. 荷花在自然(上)与瓶插(下)状态下的开放及衰老过程
3.2. 荷花自然与瓶插状态下丙二醛含量变化
丙二醛是植物衰老的抗逆性指标之一,是膜脂过氧化的产物之一。随着荷花花朵开放天数增加,自然状态与瓶插状态下花被中的丙二醛含量变化趋势一致,总体逐渐增高,且同一时间两种状态下的丙二醛含量差异很小(如图2)。在第1~4天中,丙二醛含量上升较为缓慢,甚至在瓶插状态下第4天有所下降,但在第5天丙二醛含量急剧上升。就自然与瓶插状态相比,在花朵开放的第1~3天期间,荷花花被的丙二醛含量瓶插状态较自然状态略高,但随着花被衰老,第4~5天的情况相反。当植物逐渐衰老或处于逆境条件下,丙二醛含量越高说明切花体内膜脂过氧化作用越强烈。
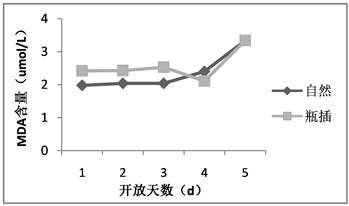
Figure 2. The MDA content of lotus flowers in nature and vase
图2. 荷花自然与瓶插状态下丙二醛含量
3.3. 荷花自然与瓶插状态下可溶性糖含量变化
糖含量是反映植物体内营养状况的指标之一。当处于逆境状态下植物会主动积累可溶性糖,糖分含量对切花体内的激素起到平衡调节的作用。糖含量高可调节水分平衡,引起气孔关闭,减少蒸腾失水,促进细胞分裂素含量增高等以适应外部环境 [8] [9]。自然状态与瓶插下的荷花花被的可溶性糖含量第1天均为测量最大值,随后呈现先降后升再下降基本一致的变化趋势,虽然自然状态下荷花花被的可溶性糖含量总体较瓶插状态的高,但不存在显著差异(如图3)。说明如果对荷花切花进行外源糖分的补充可能会提高自身可溶性糖含量增加,从而延缓衰老。
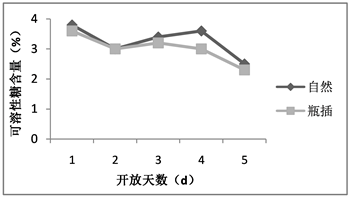
Figure 3. The soluble sugar content of lotus flowers in nature and vase
图3. 荷花自然与瓶插状态下可溶性糖含量
3.4. 荷花自然与瓶插状态下可溶性蛋白含量变化
蛋白质作为生物大分子是构成生物的基本物质,也是生理生化评价最常见的指标之一。荷花在自然状态下花被的可溶性蛋白含量呈现持续下降趋势,而在瓶插状态下的可溶性蛋白含量虽然同自然状态的变化趋势大体相同,但后期(第3~5天)的变化十分平缓。总体上瓶插状态的可溶性蛋白含量较自然状态下略低,但二者未体现出显著差异(如图4)。在植物衰老过程中,核糖核酸酶、蛋白酶、纤维素酶等水解酶的活性增强,从而分解蛋白质和核酸等,蛋白质的合成能力下降,分解加快,因此蛋白质含量呈下降趋势 [10]。随着切花开放,花瓣内蛋白质开始水解,含量逐渐下降。

Figure 4. The soluble protein content of lotus flowers in nature and vase
图4. 荷花自然与瓶插状态下蛋白质含量
3.5. 荷花自然与瓶插状态下超氧化物歧化酶含量变化
超氧化物歧化酶、过氧化氢酶和过氧化物酶同属于抗氧化酶,这几种酶普遍存在于植物体中且活性较高,与植物的光合作用及呼吸作用密切相关 [11]。随着植物的生长发育,为了与衰老相抗衡,植物体内产生了维护自身清除自由基的保护系统,主要由保护酶和一些抗氧化物质组成,其中包括超氧化物歧化酶、过氧化氢酶、过氧化物酶等,通过这些酶的含量变化可了解植物体内代谢的变化。荷花在自然状态下的超氧化物歧化酶含量呈现先升后降的趋势,其中第3天达到最高值,而瓶插状态下的超氧化物歧化酶含量在前4天基本与自然状态下的变化趋势相同,但在第4天后又上升,同一时间段两种状态下的花被中超氧化物歧化酶含量并不存在显著差异(如图5)。在花朵开放前期,超氧化物歧化酶活性上升表明保护酶活性提高是植物维持自身体内代谢平衡对逆境条件的一种应答,但在开放后期,由于植物组织的物质渗漏,膜脂过氧化作用加剧,导致各种代谢平衡的失调,超氧化物歧化酶活性的降低。
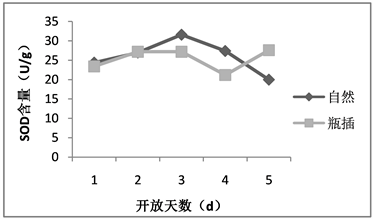
Figure 5. The SOD content of lotus flowers in nature and vase
图5. 荷花自然与瓶插状态下SOD含量
3.6. 荷花自然与瓶插状态下过氧化氢酶含量变化
荷花在自然与瓶插状态下过氧化氢酶的含量,第一天均最低,后呈现先升后降的趋势,但是自然状态下的过氧化氢酶含量在第4、5天持续下降,而瓶插状态下的过氧化氢酶含量在第4、5天变化逐渐稳定(如图6)。除了第一天,自然状态下的过氧化氢酶含量总体显著高于瓶插状态(P < 0.05)。过氧化氢酶含量差异可能是造成瓶插状态与自然状态的观赏性状有所差别的原因,表明瓶插状态下的过氧化氢酶含量增加可能有助于荷花切花活力的维持,过氧化氢酶可能对延缓荷花切花衰老起到一定作用。
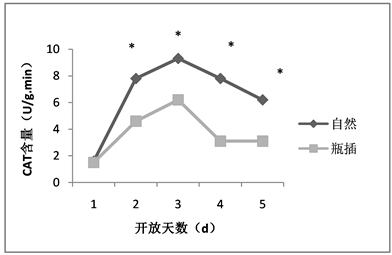 注:*表示P < 0.05的显著性差异。Note: *significant difference of P < 0.05.
注:*表示P < 0.05的显著性差异。Note: *significant difference of P < 0.05.
Figure 6. The CAT content of lotus flowers in nature and vase
图6. 荷花自然与瓶插状态下CAT含量
3.7. 荷花自然与瓶插状态下过氧化物酶含量变化
过氧化物酶普遍存在于植物体内,其活性较高,并且随着植物的生长发育,活性在不断变化。荷花在自然及瓶插状态下的过氧化物酶含量变化趋势基本一致,且同一时间内未发现显著差异。在花开第3天过氧化物酶含量达到最大值,在第2天和第4天呈现下降趋势(如图7)。过氧化物酶活性不断发生变化与花朵呼吸消耗等有很大关系。

Figure 7. The POD content of lotus flowers in nature and vase
图7. 荷花自然与瓶插状态下POD含量
4. 讨论
植物衰老反映在一系列的生理生化变化上,随着花朵生长发育,荷花切花体内淀粉开始发生分解,可溶性糖含量上升,表现为切花干重下降。可溶性糖是维持切花呼吸作用及生命活动的重要基质,随着呼吸速率的增加,可溶性糖含量减少,而糖含量的减少又导致切花衰老加剧 [12]。切花的蛋白质含量变化主要是前期的合成到后期的分解,使蛋白质含量下降,游离氨基酸含量上升 [13] [14] [15]。而在实验中可溶性蛋白含量持续下降,与切花的衰老程度呈正相关,表明蛋白质含量与切花的衰老关系密切。由于荷花切花是花叶分离的,采收之后,花柄上没有叶,缺少叶绿素,因此无净光合作用,这可能是瓶插初期可溶性糖含量急速下降的原因。
有关切花的衰老机制研究较多,月季切花可溶性蛋白含量与呼吸速率变化呈一致性,前期升高衰老时迅速下降 [16],而月季失水胁迫则是与抗氧化酶活性增加幅度有关 [17]。大丽菊切花的衰老进程可能由超氧化物歧化酶、过氧化氢酶、过氧化物酶等活性酶所影响 [18]。文心兰切花丙二醛的含量在衰老初期之后呈明显的下降趋势,可溶性糖含量变化相同,均在前期缓慢增加,盛开前期到衰老期缓慢下降。花瓣中可溶性蛋白总体呈下降趋势,而花萼中可溶性蛋白含量则持续上升 [19]。芍药切花的衰老过程中膜透性增加是造成衰老的主要原因 [20]。国内对于荷花切花生理指标研究较少,张义、刘小红等 [21] 对荷花切花的水分平衡同月季、菊花进行对比,发现荷花切花蒸腾量大,水分平衡负值出现早,水分胁迫可能是荷花切花迅速萎蔫的原因;孔德政等 [22] 对自然状态下“娇容三变”“青菱红莲”的衰老过程的生理生化进行了分析,发现荷花在衰老过程中活性氧和酶系统代谢的失调所造成的生物膜损伤是衰老的主要原因,这与我们的实验结果一致。膜脂过氧化是植物膜中的不饱和脂肪酸在自由基诱导下发生的过氧化反应,而丙二醛就是膜脂过氧化的产物之一,其含量多少直接反映了植物细胞膜脂过氧化程度 [23] [24] [25] [26]。丙二醛在器官中会与蛋白质、核酸等生命大分子反应,损伤生物膜,形成不溶性化合物沉淀,导致植物体内细胞死亡。实验表明,随着切花花瓣的发育生长,丙二醛含量增加,膜脂分解导致细胞膜透性增大,渗出细胞内含物,抑制活性酶。自由基广泛存在于自然界中,其活性高、氧化性强,能导致植物衰老死亡。过多活性氧自由基的存在容易损伤核酸,破坏植物体内蛋白质及酶活性,从而破坏生物膜,作用于不饱和脂肪酸,这是诱发细胞膜脂过氧化的原因之一 [27] [28]。超氧化物歧化酶对自由基具有清除作用,能将两个氧自由基转化为过氧化氢和氧,对植物起到保护作用,可延缓切花瓶插寿命。而过氧化氢酶和过氧化物酶又可以将过氧化氢进行催化分解。超氧化物歧化酶、过氧化氢酶、过氧化物酶共同组成一个酶促机制,形成一个保护酶系统。在荷花瓶插初期,超氧化物歧化酶和过氧化氢酶含量的积累,有利于活性氧自由基的清除,减缓膜脂过氧化作用。实验表明,荷花切花体内抗氧化酶活性减弱及清除平衡的打破,细胞膜透性增强所导致的膜脂过氧化作用是荷花切花衰老的主要原因。
基金项目
本研究得到上海市绿化和市容管理局攻关项目(G192407)资助。
文章引用
闵 睫,田代科,向言词. 自然与瓶插状态荷花(Nelumbo)花朵的生理生化比较分析
The Physiological and Biochemical Changes of Lotus (Nelumbo) Flowers in Natural State and Vase[J]. 植物学研究, 2020, 09(01): 31-38. https://doi.org/10.12677/BR.2020.91004
参考文献
- 1. 陈进, 刘小林. 鲜切花采后生理变化特征及保鲜技术研究进展[J]. 现代农业科技, 2017(15): 136-137+1.
- 2. 姜山. 切花采后生理及其保鲜技术的应用[J]. 南方农业, 2015, 9(36): 59-60.
- 3. 何文华, 李淑英, 董丽. 春光桃切花采后衰老进程及保鲜技术的研究[J]. 江苏农业科学, 2010(1): 264-267.
- 4. 师进霖, 董绍辉, 李军萍, 等. 洋桔梗切花瓶插期生理生化指标的变化[J]. 福建农业学报, 2011, 26(5): 788-792.
- 5. 邱家德. 浅谈百合鲜切花的采后生理与保鲜技术[J]. 农业与技术, 2016, 36(6): 5-6.
- 6. Shahri, W., Tahir, I., Islam, S.T., et al. (2011) Physiological and Biochemical Changes Associated with Flower Development and Senescence in So Far Unexplored Helleborus orientalis Lam. cv. Olympicus. Physiology & Molecular Biology of Plants, 17, 33-39. https://doi.org/10.1007/s12298-010-0045-3
- 7. 王学奎. 植物生理生化实验原理和技术[M]. 第2版. 北京: 高等教育出版社, 2006.
- 8. 刘亚杰. 香雪兰切花瓶插期间的生理生化特性研究[D]: [硕士学位论文]. 上海: 上海交通大学, 2014.
- 9. 李清清, 田磊, 吉建斌, 等. 切花菊采后生理研究进展[J]. 现代农业科技, 2015(24): 161+171.
- 10. 杨克彬, 孟凡志, 郭先锋. 七个切花红掌品种对低温胁迫的生理响应及耐低温能力评价[J]. 植物生理学报, 2017, 53(9): 1609-1618.
- 11. 林如, 薛秋华. 唐菖蒲鲜切花瓶插衰老过程中抗氧化酶活性和膜脂过氧化水平初探[J]. 福建农林大学学报(自然科学版), 2002, 31(3): 352-355.
- 12. Van Doorn, W.G. and Woltering, E.J. (2008) Physiology and Molecular Biology of Petal Senescence. Journal of Experimental Botany, 59, 453-480. https://doi.org/10.1093/jxb/erm356
- 13. 郭绍霞, 郑国生. 芍药切花瓶插期生理生化的变化[J]. 华北农学报, 2009, 24(2): 195-198.
- 14. 王凤兰, 张昭其. 切花花瓣衰老机理研究进展[J]. 浙江农业学报, 2011, 23(5): 1063-1068.
- 15. Hoeberichts, F.A., Van Doorn, W.G., Vorst, O., et al. (2007) Sucrose Prevents Up-Regulation of Senescence-Associated Genes in Carnation Petals. Journal of Experimental Botany, 58, 2873. https://doi.org/10.1093/jxb/erm076
- 16. 严逸伦, 范义荣. 月季切花水插期间的呼吸、乙烯和酶活性的变化[J]. 森林与环境学报, 2000, 20(3): 280-282.
- 17. 谢利娟, 张华, 崔士超. 月季切花品种间失水胁迫耐性与抗氧化酶和内肽酶之间的关联[J]. 林业科学, 2010, 46(7): 84-91.
- 18. 阚雪芹, 孙悦, 苏媚. 大丽菊花瓣衰老过程中保护酶活性变化的研究[J]. 北方园艺, 2010(19): 124-127.
- 19. 勾昕, 胡薇薇, 范亚飞, 等. 文心兰切花不同开放阶段花被的生理生化变化[J]. 热带生物学报, 2016, 7(1): 70-75.
- 20. 许蕊, 张波, 霍燕霞, 等. 芍药切花生理生化及保鲜技术研究进展[J]. 安徽农业科学, 2009, 37(13): 5947-5949.
- 21. 张义, 刘小红. 荷花切花的水分平衡特点比较研究[J]. 长江大学学报(自科版)农学卷, 2005, 2(11): 40-41+46.
- 22. 孔德政, 刘晶晶, 杨秋生. 荷花花瓣衰老过程中的生理生化分析[J]. 河南农业科学, 2007(6): 114-117.
- 23. Otsubo, M. and Iwayainoue, M. (2000) Trehalose Delays Senescence in Cut Gladiolus Spikes. HortScience, 35, 1107-1110. https://doi.org/10.21273/HORTSCI.35.6.1107
- 24. Hunter, D.A., Ferrante, A., Vernieri, P., et al. (2010) Role of Abscisic Acid in Perianth Senescence of Daffodil (Narcissus pseudonarcissus “Dutch Master”). Physiologia Plantarum, 121, 313-321. https://doi.org/10.1111/j.0031-9317.2004.0311.x
- 25. Sunae, H., Poongok, L. and Jongsuk, L. (2009) Effect of Holding Solutions on Vase Ife and Sugar Content during Flower Senescence of Cut Lilium oriental Hybrid “Casa Blanca”. Korean Journal of Horticultural Science & Technology, 27, 263-268.
- 26. 刘占海. 天津市不同地区水生植物生理特性对比研究[J]. 现代农业科技, 2015(1): 165-165.
- 27. 丁义峰. 苯甲酸钠对切花玫瑰花瓣生理代谢的影响[J]. 江苏农业科学, 2015, 43(6): 236-236.
- 28. 朱广慧, 唐蓉, 邓波, 等. 不同品种切花金鱼草对低温胁迫的生理响应及抗寒性分析[J]. 北方园艺, 2013(23): 100-102.
NOTES
*通讯作者。