Botanical Research
Vol.
09
No.
05
(
2020
), Article ID:
37542
,
10
pages
10.12677/BR.2020.95058
燕麦的活性成分与功能研究进展
金梦圆1,李 想1,王铭翠1,丛蔚然2,周选围1*
1上海交通大学农业与生物学院植物科学系,上海
2荀草坊(沈阳)生物科技有限公司,辽宁 本溪
收稿日期:2020年8月16日;录用日期:2020年9月3日;发布日期:2020年9月10日

摘要
燕麦是一种富含营养物质的作物,既可食用、也可作为动物饲料或酿造工业的原料等。有研究表明,食用富含燕麦的食物可以降低患高血脂症、糖尿病等一些慢性病的风险,因此它受到了国内外学者的广泛关注,在食品保健及其他行业中具有广阔的应用前景。本文总结了燕麦中一些活性物质如β-葡聚糖、蛋白质和生物活性肽、酚类、维生素E和脂质成分(甾醇、脂肪酸)等的组成、含量和结构等特点,介绍了这些活性物质各自在降脂、降糖、免疫调节活性等方面的生物学功能等,旨在为开发燕麦产品的提供参考。
关键词
燕麦,活性成分,生理功能

Research Progress on Active Ingredients and Its Functions of Oats
Mengyuan Jin1, Xiang Li1, Mingcui Wang1, Weiran Cong2, Xuanwei Zhou1*
1Department of Plant Science, School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai
2Xuncaofang (Shenyang) Biological Technology Co., Ltd., Benxi Liaoning
Received: Aug. 16th, 2020; accepted: Sep. 3rd, 2020; published: Sep. 10th, 2020

ABSTRACT
Oat is a kind of nutrient-rich crop, which can be used as food for animal feed or as raw material for brewing industry. Studies have shown that consumption of oat-rich foods can reduce the risk of chronic diseases such as hyperlipidemia and diabetes, so it has attracted widespread attention from scholars at home and abroad, and has broad application prospects in food health and other industries. This article summarized the composition, content and structure of some active substances in oats, such as β-glucan, proteins and bioactive peptides, phenols, vitamin E, and lipid components (sterols, fatty acids), etc. And this article emphatically introduced the biological functions of these active substances in lipid-lowering, hypoglycemic, immunomodulatory activity, etc. It can provide a reference for the development and application of oat products.
Keywords:Oat, Bioactive Compound, Physiological Function

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
燕麦(Avena sativa L.)是禾本科燕麦属一年生草本植物,种植面积居全球第六位,主要分布在寒温地区,喜凉爽湿润,抗寒,耐碱,抗逆性强。裸燕麦和皮燕麦是现主要的两种种植类型:皮燕麦是国外主要种植类型,主要分布于美国、加拿大等国家;而我国以种植裸燕麦为主,主要种植于我国华北、西北、西南高海拔地区。燕麦在国外主要用于生产动物饲料,部分用于酿酒,少部分直接用于人类食用 [1],在国内裸燕麦则大部分食用,是燕麦主产区人民的主要食粮。燕麦富含多种营养成分,比如β-葡聚糖、酚酸类物质、脂质物质、蛋白质及活性多肽等等 [2]。国内外大量研究均表明,燕麦具有降低血脂和胆固醇、抑制糖尿病、调节人体免疫功能、降低肠癌患病率和增强人体抵抗力的功能 [3]。燕麦营养成分丰富,其籽粒中含有大量的β-葡聚糖、酚酸类物质、脂质物质、蛋白质及活性多肽等生物活性物质等,被誉为是谷类食物中最好的全价营养食品之一,受到了国内外学者的广泛关注,特别是近年来在药食同源思潮的影响下,人们期望更多的兼备食疗功能的产品为健康饮食服务。本文将对燕麦β-葡聚糖、蛋白质多肽、脂质物质、酚类物质及维生素的结构功能进行总结,进一步综述了这些活性成分的生物学功能,以期为后续产品加工和营养学指导提供依据。
2. 燕麦的活性成分
2.1. 燕麦β-葡聚糖
燕麦β-葡聚糖,一种仅由β-D-吡喃型葡萄糖基单元构成的线性多糖,主要存在于籽粒亚糊粉层,麸皮中也含有一定的含量。β-葡聚糖是由单糖通过β-(1→3)和(1→4)两种糖苷键连接组成的,无支链结构(图1)。β-葡聚糖是谷物中较为重要的一类膳食纤维,具有抗肿瘤、降血糖及调节肠道菌群等的功能。其中,β-葡聚糖分子量及β-1,3/β-1,4糖苷键的比例是影响β-葡聚糖结构和功能性质的最关键因素 [4]。
我国不同地区不同品种的裸燕麦品种的β-葡聚糖含量差异较大,其含量大概在2.0%~7.5%范围内 [5]。
2.2. 燕麦蛋白质和活性多肽
燕麦蛋白以球蛋白为主,其次是醇溶蛋白及谷蛋白,清蛋白含量最低。陈子叶等以56份燕麦原粮为分析对象,结果显示燕麦蛋白质含量平均值为15.43%;燕麦中蛋白质含量明显高于其他谷物,氨基酸平衡性好,蛋白质功效比超过2.0,生物价(biological valence)为72~75,研究报道燕麦种子蛋白营养效价高,具备人体必需的8种氨基酸。因此,同一般谷物蛋白相比,可更好地促进人体生长发育,提高免疫力等 [1]。刘刚等通过燕麦种子蛋白电泳分离,发现燕麦种子蛋白质分子量大概在66.2~14.4 kDa之间 [6],后来王霞霞等多溶剂提取蛋白,报道燕麦种子蛋白分子量范围为90.16~2.76 kDa;蛋白质等电点分布范围为11.48~4.11,这些蛋白涉及结合、催化和营养物质储藏活性等分子功能,参与代谢过程、生物学调节和刺激应答等生物学过程等;显然这种差异是不同蛋白样品的制备方式所造成的。

Figure 1. Structure of the β-1,3 and β-1,4 bonds of β-glucan [1]
图1. (1→3)/(1→4)-β-D-葡聚糖的化学结构 [1]
2.3. 酚类化合物
酚类化合物由一个或多个芳香环组成,含有一个或多个羟基;酚类物质是植物次生代谢产物,在对病原体和寄生虫的防御机制中起着重要作用。除此之外,我们饮食中的酚类化合物还有助于预防慢性疾病,且各种细胞培养和动物模型研究证明了多酚抑制癌症发展的能力 [1]。
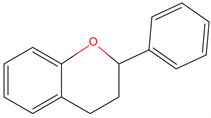
(1) 酚酸。酚酸(图2(a))是苯甲酸或肉桂酸的羟基化衍生物,是燕麦中含量最丰富的化学物质之一,以游离或结合的形式存在着。燕麦中的酚类物质种类繁多,已经发现的酚酸有阿魏酸、咖啡酸、香豆酸、没食子酸、对羟基苯甲酸、水杨酸、香草酸、芥子酸、苯乙酸、原儿茶酸、丁香酸等,阿魏酸、咖啡酸和香豆酸是燕麦中的主要酚酸。研究发现游离及结合两种形式的酚酸,游离酚酸存在于谷壳外壳,结合的酚酸是与谷物细胞壁以酯键结合,需要用酸碱酶水解才能脱离。对燕麦70%的乙醇提取物进行研究,推测燕麦中的大部分酚酸以可溶性的酯或不溶性的酯与多糖,蛋白质,细胞壁结合的酯的形式存在 [7]。
 (a)
(a)
 (b)
(b)
Figure 2. Structures of phenolic compounds (a) phenolic acid; (b) flavonoid [1]
图2. 酚酸化合物的化学结构,(a) 酚酸;(b) 类黄酮 [1]
(2) 类黄酮。黄酮类化合物(图2(b))是植物体内一种重要的活性成分,具有多种生理活性。它是一类具有C6-C3-C6骨架的多酚化合物。5,7,4’-三羟基黄酮、3’,4’,5,7-四羟基黄酮和4’,5,7-三羟基-3’,5’-二甲氧基黄酮等是燕麦中的主要的黄酮类物质。燕麦粉中存在的主要黄酮为芹菜素,木犀草素和曲霉素。大麦中已鉴定出属于原花青素家族的类黄酮 [8]。原花色素(Proanthocyanidins, PAs)是单体黄烷醇聚合而来的,单体黄烷醇包括儿茶素和表儿茶素。相较于酚酸,类黄酮在燕麦中的含量较少,而在蔬菜水果中含量较多。根据刘善鑫等人的研究,黄酮在燕麦中的含量为15. 29 mg/g左右 [9]。人们对其化学成分的研究也相对较少。
(3) 燕麦蒽酰胺(Avenanthramides, AVEs)。燕麦蒽酰胺又称燕麦生物碱,由一系列羟基肉桂酸及其衍生物和邻氨基苯甲酸及其衍生物通过酰胺键(-HNCO-)连接而成的物质,是燕麦中特有的抗氧化成分,仅在燕麦和蚕茧中发现。现已从燕麦麸皮和籽粒中分离得到20多种燕麦生物碱,其中主要的三种是Bp、Bf和Bc (图3),其大部分存在于籽粒外层麸皮和次级糊粉层,其在麸皮中含量最高可达400 mg/kg,而在籽粒中含量约在2~289 mg/kg之间 [10],这些含量的差异与燕麦品种、种植时间、地区以及栽培条件等因子有关。

Figure 3. Structures of the main avenanthramides [11]
图3. 主要燕麦碱的化学结构 [11]
2.4. 燕麦脂质
据调查研究世界上4000种燕麦中,90%以上燕麦脂质含量为5%~9%,含量明显高于其它谷物。燕麦脂质主要分布在燕麦仁中,90%以上分布在麸皮和胚乳中。燕麦脂质以不饱和脂肪酸为主,具有降压、降血糖等多种生物学功能。
(1) 磷脂(Phospholipids, PLs)。磷脂按照其分子结构可分为两大类,即鞘磷脂(Sphingomyelins神经磷脂)和磷酸甘油酯(Phosphateorphosphalipid) (图4)。燕麦的磷脂主要包括磷脂酰胆碱(Phosphatidylcholine, PC)、磷脂酰乙醇胺(Phosphatidylethanolamine, PE)、磷脂酰肌醇(Phosphatidylinositol, PI)、磷脂酰甘油(Phosphatidylglycerol, PG)、磷脂酸(Phosphatidic acid, PA)、溶血磷脂酰胆碱 (Lysophosphatidylcholine, LPC)、溶血磷脂酰乙醇胺(Lysophosphatidylethanolamine, LPE)等 [12],主要位于麸、胚乳、盾片和胚轴中,麸内的LPE、LPC、PE和PC分别约占总脂质的1.7%、2.9%、2.5%和3.6%,胚乳中的LPE、LPC、PE和PC分别约占总脂质的1.7%、3.0%、2.3%和3.5%,而盾片和胚轴中仅发现PC和PE,分别约占总脂质的2.6%和0.9%、2.8%和1.1% [12]。
(2) 植物固醇(Phytosterols) 。植物固醇(Phytosterols)属于植物性甾体化合物,因此又称为植物甾醇。是植物细胞的重要组成部分,是植物中的正常活性成分。燕麦中主要固醇是β-sitosterol、Δ-5-avenasterol和菜油甾醇 [14]。植物固醇与胆固醇结构相似,仅侧链有所不同。截至目前为止,自然界已有250种植物固醇由科学家确认,我国批准认可的新资源食品中最为常见的是β-谷甾醇(β-sitosterol)、菜油甾醇(campesterol)和豆甾醇(stigmasterol) [15] (图5)。
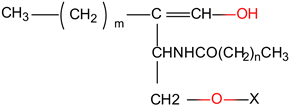 (A) 鞘磷脂
(A) 鞘磷脂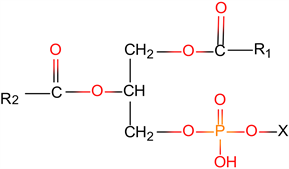 (B) 磷酸甘油酯A:鞘磷脂的结构,式中n、m代表脂肪酸中的亚甲基数,X代表磷酸胆碱或磷酸胆胺。B:磷酸甘油酯的结构通式,式中R1,R2代表脂肪酸残基,其碳原子数一般在12~18,R1、R2可以相同也可以不同。
(B) 磷酸甘油酯A:鞘磷脂的结构,式中n、m代表脂肪酸中的亚甲基数,X代表磷酸胆碱或磷酸胆胺。B:磷酸甘油酯的结构通式,式中R1,R2代表脂肪酸残基,其碳原子数一般在12~18,R1、R2可以相同也可以不同。
Figure 4. Structures of phospholipids [13]
图4. 燕麦磷脂的化学结构 [13]
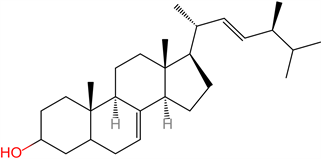 β-谷甾醇(β-sitosterol)
β-谷甾醇(β-sitosterol)
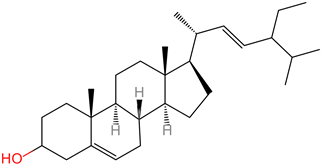 豆甾醇(stigmasterol)
豆甾醇(stigmasterol)
 菜油甾醇(campesterol)
菜油甾醇(campesterol)
Figure 5. Structures of phytosterols [15]
图5. 植物固醇的主要结构 [15]
2.5. 燕麦维生素
母育酚(tocols)。母育酚是指具有维生素E (VE)生物学活性的一族化合物,主要包括生育酚、生育三烯酚以及具有D-α-生育酚生理活性的衍生物,最初于1936年在小麦中发现和分离得到。生育酚主要包括α-生育酚、β-生育酚、γ-生育酚、δ-生育酚,其中α-生育酚较为重要(图6)。有研究显示燕麦中生育酚含量受基因型影响的总生育酚的浓度变化范围为19~30 mg/Kg;受种植地方影响的总生育酚的浓度变化范围为21~32 mg/kg [16]。
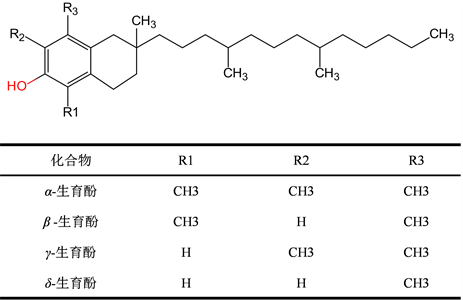
Figure 6. Structures of phytosterols [17]
图6. 生育酚的化学结构 [17]
3. 燕麦活性成分的生物学功能
3.1. 燕麦β-葡聚糖的功能
(1) 清肠减脂。β-葡聚糖是一种膳食纤维,具有热量低,饱腹感强的特点。研究发现在高脂饮食中添加5%燕麦β-葡聚糖,会使得肥胖小鼠的体重计血脂水平下降,每日食用相当于3 g β-葡聚糖的燕麦,45 d后血脂指标总胆固醇、低密度脂蛋白胆固醇明显降低;其潜在的作用机制可能是β-葡聚糖可以通过改善餐后血脂分布来降低肝脏脂质含量也有研究认为可溶性纤维消耗量增加与血清总胆固醇水平降低之间存在联系,可能是通过在小肠中形成粘性物质来降低总血清和低密度脂蛋白胆固醇,从而限制肠道对膳食胆固醇的吸收以及胆汁的再吸收 [18]。还有人认为燕麦β-葡聚糖通过影响肠道中的微生物种群,并对胆汁酸代谢,胆固醇逆向转运,短链脂肪酸产生,胆固醇的细菌代谢和微生物宿主产生潜在影响信号,从而降低人血清胆固醇 [19],也有研究认为β-葡聚糖在生物体中由肠道厌氧微生物酶系统逐步分解为短链脂肪酸,从而起到维持肠道菌群生态平衡、改善机体代谢及调节免疫的作用 [20]。目前关于β-葡聚糖影响肠道菌群的报道还比较少,因此其影响的具体机制还不清楚,需要进一步的研究。
(2) 调节血糖。燕麦β-葡聚糖具有黏性、分子量较大,食用后不易被人体消化的特点。研究发现早餐中增加燕麦β-葡聚糖的粘度会减慢胃排空,并降低血糖和胰岛素反应,引发抑制食欲的胰腺多肽(Peptide Tyrosine Tyrosine, PYY)反应,在增强人的饱腹感的同时,减少人的食欲,并达到调节血糖水平的目的 [21]。其作用机制可能是燕麦β-葡聚糖可在胃肠道内形成高黏度环境,这就形成物理屏障阻碍食物的消化,从而达到降低血糖的目的;研究发现除此之外β-葡聚糖还可以抑制蔗糖酶和麦芽糖酶的活性,减缓糖类物质的吸收与消化;另有研究发现β-葡聚糖还可以通过调控胰岛细胞的凋亡,促进胰岛素的分泌等改善胰岛功能,从而保证机体血糖平衡。但关于其机制研究并无定论,还需进一步研究。
(3) 其它生物学活性。燕麦β-葡聚糖除了上述已知功能以外,还有提高免疫能力、减轻慢性肾脏疾病、抗肿瘤等的功能,这里不再赘述。
3.2. 燕麦蛋白质及多肽的功能
(1) 抗氧化作用。燕麦蛋白质氨基酸成分含量较高,具有自由基清除的特性。在正常生理状况下,机体产生自由基与清除自由基处于动态平衡中,但在环境等因素下,体内产生过多自由基,而这些自由基或者超氧阴离子自由基与很多人类常见的疾病相关,比如癌症、心脑血管疾病等。燕麦蛋白肽对1,1-二苯基-2-三硝基苯肼自由基(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl, DPPH)、超氧阴离子游离基等有较好的清除作用,常用作抗氧化剂。研究发现燕麦蛋白水解物完全防止了过氧自由基对细胞的损害,并且可将细胞内活性氧(Reactive Oxygen Species, ROS)降低20%~40%,并且还增加了谷胱甘肽的细胞内浓度;所有水解产物均相对于对照细胞分别提高了抗氧化酶超氧化物歧化酶和过氧化氢酶的活性至多2倍和3.4倍;实验还发现其水解产物能够降低促凋亡酶caspase-3的活性,从而防止了氧化应激诱导的细胞死亡 [22],实验证明了燕麦蛋白肽具有较强的抗氧化能力。关于起作用机制,研究发现植物衍生的抗氧化剂肽能够减少ROS的产生并增强内源性酶和非酶抗氧化剂的防御能力。研究认为抗氧化肽的N端或C端存在酪氨酸残基,酪氨酸能够通过从其酚基上提供一个氢原子来清除自由基,以此来发挥抗氧化活性;另有研究表明缬氨酸和其他疏水残基的存在可通过帮助它们与膜脂质双层结合并随后进入细胞来促进肽的抗氧化活性,且疏水残基也可能促进抗氧化剂肽与脂溶性自由基的相互作用并减弱脂质过氧化作用;除此之外,细胞抗氧化能力可能与肽构象,特别是α-螺旋和无规卷曲含量之间存在反比关系 [23]。现关于燕麦蛋白肽抗氧化活性的实验较少,只有较少的实验做了燕麦抗氧化肽的证明,因此现需更多的燕麦蛋白的研究。
(2) 调节血糖。燕麦蛋白肽具有良好的α-葡萄糖苷酶(α-glucosidase, AG)和二肽基肽酶IV (Dipeptidyl Peptidase IV, DPP-IV)的抑制活性。AG是碳水消化过程中的关键酶,DPP-Ⅳ是胰岛素分泌过程的关键酶。研究发现利用计算机分析燕麦蛋白水解物具有DPP-IV抑制活性,其抑制率3.7 ± 3.9% and 46.2 ± 28.8% [24]。关于其作用机制,研究发现分离得到的一燕麦蛋白肽可与DPP-Ⅳ的催化结构结合,改变DPP-Ⅳ酶的空间构象,从而抑制DPP-IV。还可通过与AG底物结合域结合,竞争性抑制底物与AG的结合,从而达到抑制AG的目的 [25]。除了DPP-IV抑制活性外,燕麦蛋白还可以刺激胰岛素的产生。可以因此需要更进一步实验,探索燕麦蛋白降血糖的作用机制。
(3) 降压与降脂作用。燕麦蛋白肽具有分子量小,易被吸收的特点。通过用燕麦多肽灌胃原发性高血压大鼠,发现燕麦多肽具有良好的降血压效果,研究发现燕麦蛋白分离物均能抑制血管紧张素转换酶(Angiotesion Converting Enzyme, ACE),其抑制率为86.6% (±10.7%)至96.5% (±25.8%),比评估从大麦中提取的粗蛋白提取物的类似研究要大得多 [24]。研究发现燕麦蛋白显着降低了血浆低密度脂蛋白胆固醇和肝脏总胆固醇的浓度,增加了肝胆固醇7α羟化酶的活性,并增加了粪便胆汁酸和TC的排泄 [26]。关于其作用机制可能是通过增加粪便总脂质,TC和胆汁酸的排泄并调节肝脏CYP7A1的活性来降低血浆LDL-C和肝脏TC的水平 [26];除此之外,燕麦蛋白可以通过抑制ACE活性,来降低高血压。因此,燕麦蛋白可能通过多种途径起降脂作用,但其作用机制还需进一步验证。
(4) 抗疲劳。燕麦中必需氨基酸含量较高,且营养素丰富,有利于运动后恢复。一些新的研究调查发现燕麦蛋白还具有抗疲劳、保护人体运动后机能不受损害的作用。一项调查研究发现食用燕麦蛋白的受试者在下坡运动后可明显减轻离心运动引起的骨骼肌酸痛,可显著抑制破坏性运动后的肢体水肿,并降低血浆IL-6浓度和血清肌酸激酶,而肌红蛋白和C反应蛋白(C-reactive protein, CRP)含量的升高,可减轻对肌肉力量,膝关节活动范围和垂直跳跃性能的不利影响 [27]。但是这一研究并未排除其他燕麦营养素的影响,且这一功能机制尚未发现,需要进一步的研究。
3.3. 酚类化合物的功能
(1) 抗肿瘤作用。燕麦蒽酰胺是一种酚类生物碱,具有抗氧化、抗炎、抗增殖的特性。与正常细胞不同,肿瘤细胞会产生大量的ROS来维持其恶性表型。AVEs的抗氧化活性可减少由ROS诱导的细胞成分的氧化损伤,从而达到抗肿瘤的目的。研究表明燕麦AVEs在肝肿瘤细胞中可以显著降低细胞内的ROS水平,有显著的抗增殖作用。且燕麦AVEs在人皮肤成纤维细胞的外源性或内源性氧化损伤和控制细胞氧化状态方面起着关键作用 [28]。另有研究发现AVEs可与DEAD-box蛋白家族ATP依赖的RNA解旋酶3(DDX3)RNA解旋酶在Arg287和Arg294残基处结合,以抑制ATP水解活性和蛋白稳定性,从而导致大肠癌细胞线粒体生物能崩溃和ROS依赖性细胞凋亡,从而达到抗肿瘤的目的 [29]。研究发现其作用机制主要是上调细胞周期抑制剂蛋白(包括p53,p21和p27)抑制细胞周期进程,细胞衰老的诱导,上皮–间充质转化和转移的抑制及抗增殖作用和诱导凋亡等 [30]。
(2) 其它作用。燕麦酚类物质除了具有强大的抗氧化活性之外,还有抗炎、止痒、抗刺激、抗动脉粥样硬化和抗增殖活性等的功能,可预防或限制细胞的氧化功能障碍和氧化应激相关疾病(例如神经退行性疾病和心血管疾病),并为皮肤刺激,衰老和癌症提供了有利的保护。
3.4. 燕麦脂质的功能
植物固醇具有肠道吸收率较低,与胆固醇运转方式相似的特点。因此,食物中的植物固醇,可以与胆固醇产生竞争作用,从而抑制人体对胆固醇的吸收,降低血液胆固醇水平。研究发现燕麦乙醇提取物可以减轻实验鼠脂质积累,下调与脂质代谢紊乱相关的物质,增加与脂质代谢相关指标呈正相关的物质,从而改善脂质代谢紊乱和高脂血症 [31]。关于作用机制,最新研究发现植物可以抑制肝脏中脂肪酸合成关键酶的表达。另外也可能是通过降低肠道内胆固醇胶束化形成,从而导致胆固醇吸收减少,排泄增多 [32]。但现在关于燕麦脂质的研究较少,急需更多实验来探索。
3.5. 燕麦维生素的功能
燕麦生育酚具有优良的抗氧化性。研究发现维生素E可以预防幼年甲状腺功能减退大鼠海马的长期增强损伤和神经元凋亡。各种临床和临床前研究表明,补充维生素E可能对心肌梗死提供心脏保护作用。而且维生素E还有利于冠心病的治疗与恢复。临床上维生素E还可通过减轻氧化应激反应,减缓软骨组织的破坏,还用来治疗骨关节炎。研究发现维生素E还可以改善与年龄相关的听力障碍问题。关于作用机制,研究发现维生素E通过将其苯并三氢吡喃环上的羟基上的氢原子提供给脂质过氧自由基而发挥直接的抗氧化作用。这导致形成相对稳定的生育酚基或生育三烯氧基基团以及非反应性脂质氢过氧化物,从而基本上终止了氧化链反应;维生素E还可以通过调节细胞途径来减少氧化应激反应 [33];维生素可以通过调控免疫细胞的生长和分化,刺激一些细胞因子的表达以调控免疫应答。
4. 研究展望
随着我国经济发展和人民生活水平提高,人们越来越重视自身健康,从而更加关注健康饮食。而燕麦因其丰富的营养成分和良好功效,越来越受人们的重视,开发和应用前景都十分广阔。对于燕麦的研究和开发,建议从以下三个角度考虑:燕麦的应用基础研究,应用基础研究对加工的指导作用和推进实验室产品的工业化生产等。
首先是加大对燕麦的应用基础研究,开展活性成分定向分子育种,从根本上改变燕麦的品质特征(如提高醇溶蛋白含量),彻底解决导致燕麦加工困境的难题;也可根据特定产品对加工品质的需求,培育燕麦原料新品种,为高营养燕麦产品的开发奠定基础。
其次是重视基础研究对后续加工的指导。基础研究研究发现,不同地区的燕麦营养成分的含量差异较大,如粗淀粉、β-葡聚糖含量东北地区种植的燕麦含量最高,而西北含量最低;粗蛋白的含量东北地区含量最高、西南地区含量最低;粗脂肪含量西南最高,东北地区最低;而AVEs含量华北最低,最高为东北地区;这些研究在燕麦深加工中对产地原料的选取具有重要的意义。又如基础研究表明,发芽是改善燕麦活性成分的有效手段。在发芽过程中,虽然燕麦总蛋白质含量基本上保持不变,但清蛋白含量增加,球蛋白、醇溶蛋白和谷蛋白含量下降;部分高分子储藏类蛋白分解为肤和氨基酸。发芽后的燕麦有不同于普通燕麦的特殊营养成分,其开发利用有着广阔的市场前景。因此,利用微生物发酵、燕麦发芽等提高燕麦中β-葡聚糖的含量是一个提高燕麦产品营养价值的加工方法。
推进实验室产品的工业化生产,加强科技成果转化的研究。现有报道对于燕麦加工制品的工艺研究,大多停留在实验室阶段,应及时探究其工业化、规模化生产的解决方案,早日实现产品的市场化,让燕麦新产品早日惠及普通消费者。
基金项目
荀草坊(沈阳)生物科技有限公司(20H100000125)。
文章引用
金梦圆,李 想,王铭翠,丛蔚然,周选围. 燕麦的活性成分与功能研究进展
Research Progress on Active Ingredients and Its Functions of Oats[J]. 植物学研究, 2020, 09(05): 461-470. https://doi.org/10.12677/BR.2020.95058
参考文献
- 1. Gangopadhyay, N., Hossain, M.B., Rai, D.K. and Brunton, N.P. (2015) A Review of Extraction and Analysis of Bioactives in Oat and Barley and Scope for Use of Novel Food Processing Technologies. Molecules, 20, 10884-10909. https://doi.org/10.3390/molecules200610884
- 2. Rauf, M., Yoon, H., Lee, S., Shin, M.-J., Ko, H.-C., Lee, M.-C., Oh, S., Hyun, D.-Y., Hur, O. and Choi, Y.M. (2019) Evaluation of Major Dietary Ingredients in Diverse Oats (Avena sativa L.) Germplasm. Journal of Crop Science and Biotechnology, 22, 495-507. https://doi.org/10.1007/s12892-019-0274-0
- 3. Shaveta, H.K. and Kaur, S. (2019) Hulless Barley: A New Era of Research for Food Purposes. Journal of Cereal Research, 11, 114-124. https://doi.org/10.25174/2249-4065/2019/83719
- 4. 谢勇, 覃小丽, 金剑波, 等. 来源与加工方式对β-葡聚糖理化特性的影响及其在肠道的降解机理[J/OL]. 食品与发酵工业, 2019, 45(23): 282-294.
- 5. 郑殿升, 吕耀昌, 田长叶, 等. 中国裸燕麦β-葡聚糖含量的鉴定研究[J]. 植物遗传资源学报, 2006, 7(1): 54-58.
- 6. 刘刚, 刘英, 陈旺, 等. 燕麦粉蛋白的理化性质研究[J]. 食品科学, 2008, 29(6): 70-74.
- 7. Butt, M.S., Tahir·Nadeem, M, Khan, M.K.I., Shabir, R. and Butt, M.S. (2008) Oat: Unique among the Cereals. European Journal of Nutrition, 47, 68-79. https://doi.org/10.1007/s00394-008-0698-7
- 8. Klausen, K., Mortensen, A.G., Laursen, B., et al. (2010) Phenolic Compounds in Different Barley Varieties: Identification by Tandem Mass Spectrometry (QStar) and NMR; Quantification by Liquid Chromatography Triple Quadrupole-Linear Ion Trap Mass Spectrometry (Q-Trap). Natural Product Communications, 5, 407-414. https://doi.org/10.1177/1934578X1000500314
- 9. 刘善鑫, 刘素纯, 李再贵. 冠突散囊菌对燕麦黄酮含量的影响[J]. 中国酿造, 2019, 38(2): 93-97.
- 10. Bratt, K. (2003) Avenanthramides in Oats (Avena sativa L.) Andstructure-Antioxidant Activity Relationship. Journal of Agricultural and Food Chemistry, 51, 594-600.https://doi.org/10.1021/jf020544f
- 11. 任祎, 马挺军, 崔林. 燕麦生物碱及其潜在的保健作用[J]. 中国粮油学报, 2012, 27(1): 124-128.
- 12. 颜韶兵, 童川, 包劲松. 谷物磷脂及其与谷物品质的关系研究进展[J]. 中国稻米, 2018, 24(1): 38-44.
- 13. 曹栋, 裘爱泳, 王兴国. 磷脂结构、性质、功能及研究现状(1) [J]. 粮食与油脂, 2004(5): 3-6.
- 14. Ilias, M., Nezha, S., Bouchra, M., et al. (2016) Nutritional Characteristics, Biochemical Composition and Antioxidant Activities of Moroccan Oat varieties. Journal of Food Measurement and Characterization, 10, 156-165. https://doi.org/10.1007/s11694-015-9289-5
- 15. 陈晨, 覃雅婷, 吕超, 等. 植物固醇的功能与心血管疾病的关系[J]. 中国动脉硬化杂志, 2020, 28(1): 67-73.
- 16. 刘军海, 裘爱泳, 朱向菊. 燕麦脂质及其应用[J]. 粮食与油脂, 2003(5): 19-20.
- 17. 宋晓燕, 杨天奎. 天然维生素E的功能及应用[J]. 中国油脂, 2000, 25(6): 45.
- 18. Nwachukwu, I.D., Devassy, J.G., Aluko, R.E. and Jonesab, P.J.H. (2015) Cholesterol-Lowering Properties of Oat β-Glucan and the Promotion of Cardiovascular Health: Did Health Canada Make the Right Call? Applied Physiology, Nutrition, and Metabolism, 40, 535-542. https://doi.org/10.1139/apnm-2014-0410
- 19. Joyce, S.A., Kamil, A., Fleige, L. and Gahan, C.G.M. (2019) The Cholesterol-Lowering Effect of Oats and Oat Beta Glucan: Modes of Action and Potential Role of Bile Acids and the Microbiome. Frontiers in Nutrition, 6, 171. https://doi.org/10.3389/fnut.2019.00171
- 20. 谢勇, 覃小丽, 金剑波, 等. 来源与加工方式对β-葡聚糖理化特性的影响及其在肠道的降解机理[J]. 食品与发酵工业, 2019, 45(23), 282-294.
- 21. 颜燕, 郭婕, 姚文环, 等. 燕麦β-葡聚糖对四氧嘧啶致糖尿病小鼠血糖的影响[J]. 现代预防医学, 2011, 38(3): 449-450.
- 22. Esfandi, R., Willmore, W.G. and Tsopmo, A. (2019) Antioxidant and Anti-Apoptotic Properties of Oat Bran Protein Hydrolysates in Stressed Hepatic Cells. Foods, 8, 160. https://doi.org/10.3390/foods8050160
- 23. Wong, F.C., Xiao, J.B., Wang, S.Y., Ee, K.-Y. and Chai, T.-T. (2020) Advances on the Antioxidant Peptides from Edible Plant Sources. Trends in Food Science & Technology, 99, 44-57. https://doi.org/10.1016/j.tifs.2020.02.012
- 24. Bleakley, S., Hayes, M., O’Shea, N., Gallagher, E. and Lafarga, T. (2017) Predicted Release and Analysis of Novel ACE-I, Renin, and DPP-IV Inhibitory Peptides from Common Oat (Avena sativa) Protein Hydrolysates Using in Silico Analysis. Foods, 6, 108. https://doi.org/10.3390/foods6120108
- 25. 董宇婷, 王荣春. 降糖肽的发展现状及研究进展[J]. 生物信息学, 2018, 16(2): 83-89.
- 26. Tong, L.T., Guo, L., Zhou, X.R., et al. (2016) Effects of Dietary oat Proteins on Cholesterol Metabolism of Hypercholesterolaemic Hamsters. Journal of the Science of Food and Agriculture, 96, 1396-1401. https://doi.org/10.1002/jsfa.7236
- 27. Xia, Z., Cholewa, J.M., Dardevet, D., et al. (2018) Effects of Oat Protein Supplementation on Skeletal Muscle Damage, Inflammation and Performance Recovery Following Downhill Running in Untrained Collegiate Men. Food & Function, 9, 4720-4729. https://doi.org/10.1039/C8FO00786A
- 28. Roberta, M., Claudio, G., Rosaria, V., et al. (2001) Effects of Dietary Virgin Olive Oil Phenos on Low Density Lipoprotein Oxidation in Hyperlipidemic Patients. Lipids, 36, 1195-1202. https://doi.org/10.1007/s11745-001-0832-3
- 29. Paola, V., Aurora, N. and Vincenzo, F. (2008) Cereal Dietary Fibre: A Natural Functional Ingredient to Deliver Phenolic Compounds into the Gut. Trends in Food Science & Technology, 19, 451-463. https://doi.org/10.1016/j.tifs.2008.02.005
- 30. Turrini, E., Maffei, F., Milelli, A., Calcabrini, C. and Fimognari, C. (2019) Overview of the Anticancer Profile of Avenanthramides from Oat. International Journal of Molecular Sciences, 20, 4536. https://doi.org/10.3390/ijms20184536
- 31. Huang, K., Yu, W., Li, S., et al. (2020) Effect of Embryo-Remaining Oat Rice on the Lipid Profile and Intestinal Microbiota in High-Fat Diet Fed Rats. Food Research International, 129, Article ID: 108816 https://doi.org/10.1016/j.foodres.2019.108816
- 32. 陈晨, 覃雅婷, 吕超, 等. 植物固醇的功能与心血管疾病的关系[J]. 中国动脉硬化杂志, 2020, 28(1): 67-73.
- 33. Zarkasi, K.A., Jenkit, T. and Jubri, Z. (2019) Molecular Understanding of the Cardiomodulation in Myocardial Infarction and the Mechanism of Vitamin E Protections. Mini-Reviews in Medicinal Chemistry, 19, 1407-1426.
NOTES
*通讯作者。