Journal of Water Resources Research
Vol.05 No.04(2016), Article ID:18279,16
pages
10.12677/JWRR.2016.54040
Microbial Transport in Saturated Porous Media
Ruiqiang Yuan1, Wei Guo1, Shiqin Wang2, Peng Wang3
1School of Environment and Resource, Shanxi University, Taiyuan Shanxi
2Center for Agricultural Resources Research, Institute of Genetics and Developmental Biology, CAS, Shijiazhuang Hebei
3Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang Jiangxi

Received: Jul. 24th, 2016; accepted: Aug. 6th, 2016; published: Aug. 16th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Microbial transport in porous media is a hot issue in fields of hydrology and water environment. Researches on the issue are helpful to restrain water-borne diseases and to improve the efficiency of polluted groundwater recovery. Over the past 15 years, the understanding about microbial transport in a saturated porous media has been improved substantially. However, the DLVO theory and the colloid filtration theory cannot support a sufficient explanation in microbial transport. Straining, heterogeneity, pore scale force/ torque balance, microbial features, growth and death significantly affect the microbial transport of which mechanisms and modeling need to be enhanced in future studies. In addition, results from laboratorial studies are mostly different with field results, which highlights the necessity to do more field researches. In field experiments, there are many uncontrollable factors and complex situations compared with laboratorial experiments. More field experiments will offer valuable chances to get a thorough comprehension of microbial transport promoting development of transport mechanisms and models. New models tend to become more complicated when trying to integrate more mechanisms. Therefore, how to find the main mechanisms simplifying models and improving efficiency is also a key question.
Keywords:Micro-Organism, Bio-Colloid, Transport, Sorption-Desorption, Porous Media, Groundwater

微生物在饱和多孔介质中的迁移
袁瑞强1,郭威1,王仕琴2,王鹏3
1山西大学环境与资源学院,山西 太原
2中国科学院遗传所农业资源研究中心,河北 石家庄
3江西师范大学鄱阳湖湿地与流域研究教育部重点实验室,江西 南昌

收稿日期:2016年7月24日;录用日期:2016年8月6日;发布日期:2016年8月16日

摘 要
微生物在多孔介质中的迁移是水文与水环境研究的热点问题。对该问题的深入探讨有助于遏制水传播疾病,提高受污染地下水微生物修复的效率。过去十五年来,对微生物在饱和多孔介质中迁移问题的研究获得很大进展。然而,传统的DLVO理论和胶体过滤理论解释微生物在多孔介质中的迁移过程时存在明显的不足。沥滤、异质性、优先流、微生物特征及生长衰亡过程等对生物胶体迁移存在显著的影响,其实验机理研究和模型模拟研究需要进一步深入。实验室的研究成果往往与野外条件下的不一致,这是加强野外研究的客观要求。野外实验不可控因素多,相对于实验室实验更加复杂。加强野外条件下的研究有助于深入理解生物胶体迁移的复杂规律,促进机理研究和模型模拟的发展。考虑多种机理的模型有复杂化的趋势,如何识别主要机理、简化模型、提高效率是模型研究要注意的问题。
关键词 :微生物,生物胶体,迁移,吸附解吸,多孔介质,地下水

1. 引言
近年来,生物胶体在多孔介质中的迁移逐渐成为热点问题。一方面,致病微生物通过地下水传播可导致水源地污染、水传播疾病爆发。研究微生物在地下水中的迁移规律有助于降低水污染的风险。另一方面,利用微生物降解污染物是一种重要的场地地下水、土壤污染修复方法。掌握微生物的迁移规律是该方法能否成功的关键。
细菌、病毒和原生动物统称为生物胶体。细菌的大小一般为0.5 μm~2 μm,具有鞭毛、纤毛使其具有能动性。环境中的肠道致病菌主要包括志贺氏菌、沙门氏菌、霍乱弧菌等。大肠菌群作为温血动物肠道中最普遍的一类细菌,在水环境中具有较强的抗逆性且数量与肠道致病菌呈一定的相关性,常作为细菌在地下介质中迁移的研究对象。病毒的大小约为20 nm~200 nm,在地下水中的迁移能力更强 [1] 。常见致病性病毒有萨科齐病毒、诺瓦克病毒、肝炎类病毒等。原生动物大小约为3 μm~12 μm,常见的有隐孢子虫和肠兰伯氏贾第虫。原生动物在地下介质中迁移规律的研究相对较少。
地下水面以下含水介质被水饱和是固液二相系统,称为饱和带;地下水面以上是介质颗粒、水分和空气共存的三相系统,称为非饱和带。微生物在饱和介质中的迁移能力大于在非饱和土壤中的迁移能力。非饱和带中除了具有岩土颗粒–水分界面以外,还有空气–水界面,迁移吸附机理更加复杂。本文总结了近年来生物胶体在饱和多孔介质中迁移的主要研究进展,指明亟待解决的问题。
2. 迁移机理研究进展
生物胶体在岩土中的迁移过程包括物理过程、地球化学过程和生物过程。物理过程指对流和水动力弥散,地球化学过程指的是是过滤、沉积、吸附、解析等过程,生物过程包括微生物的生长、衰亡、趋化性等。近年来,在生物胶体迁移机理方面的研究加速,取得了许多重要进展。
2.1. 传统DLVO理论的局限性
传统DLVO (Derjaguin-Landau-Verwey-Overbeek)理论解释胶体之间的距离和胶体之间总势能的关系,可用来解释胶体的解析与吸附。其局限性在于总势能中仅考虑了范德华力引起的吸引势能和双电层力引起的排斥势能之和。除了范德华力和双电层的相互作用力,生物胶体和多孔介质之间还存在着水合力、氢键作用力、疏水力、溶解力、楔裂压力(disjoining pressure)、空间排斥力和路易斯酸碱作用力等。近来的研究多在DLVO理论的基础上,用上述作用力辅助说明生物胶体在多孔介质中的迁移行为。通常把这些理论称为扩展DLVO理论。Bergendahl等 [2] 考虑了胶体之间的双电层力、范德华力、生斥力和路易斯酸碱作用力这四种力的综合作用描述胶体的解析过程,对量化胶体的解析程度做出了重要贡献。
传统DLVO理论认为初级势阱具有无限深的特点,吸附到初级势阱中的胶体受到极大的吸引力,构成不可逆吸附。然而已有实验表明吸附到初级势阱中的胶体也会被释放出来,证明初级势阱的深度是有限的。尽管扩展DLVO证明了初级势阱的深度是有限的,但仍然不能很好的解释部分实验现象。例如,在不利环境下仅有少量的胶体可通过降低溶液的离子强度而释放出来,即表明不利环境下仍有大量的胶体吸附在初级势阱中 [3] [4] ;而在有利环境下,多孔介质表面仅有极小部分的吸附位点有利于胶体的滞留 [5] 。
2.2. 胶体过滤理论的不足
胶体过滤理论(CFT, Colloid Filtration Theory)常用来描述微生物在多孔介质中的迁移过程,该理论认为微生物在迁移过程中经由某种接触机制,即布朗扩散、拦截和沉降到达介质表面,形成不可逆的滞留过程 [6] 。该过程常用一阶动力学方程来表示,并且假设水流状态稳定,初始时微生物的浓度为零,忽略水动力弥散。学者们常用土柱实验得到的穿透曲线和生物胶体在土柱中的滞留剖面来分析生物胶体的迁移行为。穿透曲线分为上升阶段、平衡阶段和下降阶段。然而,一些实验结果表明平衡阶段内流出液浓度仍有变化,将浓度在稳定阶段出现缓慢上升的现象称为Blocking,微弱下降的现象称为Ripening。Blocking现象是由于介质表面的吸附位点越来越少造成吸附速率越来越低。Bradford等 [7] 发现胶体粒径越小Blocking现象越明显。而Ripening是由于微生物吸附在基质表面后,微生物表面形成新的吸附位点造成吸附速率越来越快 [8] 。此外,一些研究表明进入平稳阶段后延长土柱的淋洗时间,流出液浓度会达到另一个更高的平稳阶段,穿透曲线图像变成一种类似双峰的图像 [9] 。这些现象均与胶体过滤理论不符。
根据胶体过滤理论,滞留在多孔介质中的胶体浓度随着深度增加呈指数下降。发生有利吸附时,胶体过滤理论与实验结果大致相符;发生不利吸附时的滞留剖面与理论有着很大的差异。主要包括:胶体滞留浓度和深度呈超指数(hyper-exponentially)的下降关系 [10] - [12] ,或者呈非单调规律 [7] ,以及胶体滞留浓度不随深度变化 [13] 。学者们认为差异产生的原因包括:首先,胶体过滤理论假设胶体和土壤颗粒是理想均匀的,即表面电荷均匀分布,胶体和土壤颗粒表面光滑且没有差异。事实上介质表面粗糙且存在一些杂质,表面电荷分布不均匀 [12] ,同时胶体之间存在异质性 [11] ,这些造成实验结果与理论不符。其次,在不利环境下较为显著的沥滤过程也导致胶体滞留剖面呈现出一种非单调的趋势。胶体浓度随着土柱深度的增加先增加后降低 [7] 。最后,胶体过滤理论认为吸附是不可逆的。然而由于次级势阱较浅,吸附于次级势阱中的胶体可以随水流释放出来。这些可逆吸附往往在迁移过程中扮演着重要作用,造成实验结果与胶体过滤理论不相符 [14] [15] 。
2.3. 沥滤
沥滤是胶体颗粒无法通过较小孔隙体积而被滞留的一种现象。沥滤过程包括滞留在介质表面粗糙的位点上、滞留在颗粒与颗粒接触位点上,以及水力桥接和大小排斥等。其中,水力桥接(hydrodynamic bridging)指的是很多胶体同时吸附在大的空隙喉道上,造成孔隙堵塞和土壤渗透性的下降 [16] 。大小排斥效应(size exclusion)是大的胶体无法通过细小的孔隙喉道的一种现象,可造成胶体的流速大于平均水流速率 [17] 。沥滤使土壤的渗透性下降,逐渐被重视。
影响沥滤效果最重要的因素是胶体的平均粒径与多孔介质平均粒径的比值(dp/dm)。一般地,介质颗粒越小或胶体颗粒越大时,沥滤效果更明显。因此沥滤对细菌和原生动物的影响较大,而对病毒的迁移几乎没有影响。影响沥滤机制发生的临界值dp/dm一直有很大的争议。最初采用几何学的方法来计算dp/dm的临界值,Herzig等 [18] 认为当dp/dm > 0.05时沥滤作用显著。而后来的实验结果表明dp/dm的临界值要远小于人们的预期。Bradford等 [19] 研究表明当dp/dm > 0.0017时,应该考虑沥滤作用,当dp/dm > 0.005时,沥滤作用效果显著。
沥滤作用还受到流速、离子强度、胶体形状、表面活性剂的影响。高流速水流具有较强的剪切力,流速降低会使沥滤的作用增强 [7] [20] 。高离子强度有利于沥滤作用的发生 [21] 。Xu等 [22] 发现球状胶体的直径与花生状胶体短轴长度一致时,这两种胶体的沥滤效果几乎相同。Du等 [20] 研究了非离子型表面活性剂聚乙二醇辛基苯基醚对胶体沥滤作用的影响,发现其浓度增加会抑制沥滤作用的发生。此外,沥滤作用大小和介质深度有关,沥滤作用在介质入口处效果最明显 [23] 。
Johnson等 [24] 对沥滤作用提出了质疑。首先,不利环境下介质表面粗糙度和表面电荷异质性也可能对胶体产生滞留。其次,CFT不适用于不利环境下的胶体迁移过程,因而不能得到准确的截获效率因子。最后,为了使模型与穿透曲线和滞留剖面的拟合度更高,在原有模型基础上进行了改进,但这并不能证实这种改进是由沥滤作用而不是其他机理造成的。因此,沥滤作用仍需要深入研究。
2.4. 异质性
单个胶体与多孔介质之间的相互作用能存在一定差异,这种差异产生的原因通常是由于异质性或不均匀性造成的,这里将异质性分为物理异质性、化学异质性和种群异质性。物理异质性和化学异质性均可导致排斥势垒降低并将无利吸附转化成有利吸附 [25] [26] 。
物理异质性主要指多孔介质表面的粗糙度,可削弱排斥势垒促进胶体在初级势阱中的沉降 [27] [28] 。Shen等 [27] 发现不论是在初级势阱中还是在次级势阱中,胶体在土壤中的滞留量均高于胶体在玻璃珠介质中的滞留量,并且离子强度越大时滞留量的差异也越明显。粗糙的多孔介质表面可形成像坑一样的凹处,减弱水力的作用,有利于胶体滞留。而较大的凹处会使局部的排斥势垒和次级势阱变高变深,这些均有利于胶体在次级势阱中的吸附。同时,粗糙度也会减弱初级势阱的深度,当离子强度降低或者pH增加均可能导致胶体从初级势阱中释放出来 [29] 。
化学异质性是由于多孔介质表面存在矿物质、离子、有机质等杂质造成的,其中铝、铁、锰的氧化物是引起化学异质性的常见物质 [30] [31] 。化学异质性有利于降低排斥势垒促进胶体在初级势阱中吸附 [32] 。Shen等 [33] 进一步指出在不利环境下杂质的大小超过临界值时才会导致胶体吸附到多孔介质表面,这个临界的大小随着离子强度的增加或者胶体颗粒大小的降低而降低,并且这种吸附是不可逆的。Adamczyk等 [34] 也证实了这种由化学异质性造成的吸附是不可逆的。但也有研究表明可以通过改变溶液的化学环境使胶体释放出来 [35] [36] 。近年来,物理异质性与化学异质性被一起考虑,以研究它们的共同效应 [30] 。
种群异质性来源于胶体大小、表面电荷、表面蛋白、疏水性的不一致等,造成生物胶体间吸附能力的差异 [37] 。种群异质性被认为是造成不利环境下滞留剖面呈超指数规律的重要原因。由于种群异质性存在,微生物在土壤中的迁移距离远远超出人们预期 [10] 。
2.5. 孔隙尺度下的力/力矩平衡
通过孔隙尺度下的力/力矩平衡可以判断吸附在介质表面的胶体是否会脱落下来,包括水力力矩(applied hydrodynamic torque, Tapplied)和抵抗粘附力矩(resisting adhesive torque, Tadhesion)。当Tapplied ≤ Tadhesion,此时胶体将无法移动,而当Tapplied > Tadhesion,胶体便会在介质表面滚动。Torkzaban等 [38] 发现水流作用力、DLVO相关力、基质的性质和大小均显著影响胶体的吸附,胶体只能吸附在剪切力的力矩小于粘附力矩的位点上。当溶液离子强度增加、介质体积增大、流速降低时,可以发生吸附的位点占介质表面的百分比(Sf)会相应增大。Adamczyk等 [13] [39] 建立了Sf和Smax (最大吸附量)之间的关系。Bradford等 [40] 通过累积密度函数预测模拟不同胶体大小、不同基质大小以及不同水流速度下的Sf,对于探索胶体的迁移吸附过程具有重要意义。
2.6. 水环境对迁移的影响
水环境中影响微生物迁移的因素主要有pH、温度、水流速率、灌水方式以及离子强度。由于微生物和土壤的等电点相对较低,因此,在自然环境下其表面均携带负电荷。随着pH的降低,土壤和微生物表面的负电荷均有所减少,造成相互之间的排斥力减少,微生物在土柱上的吸附量随之增加。Guan等 [41] 发现当pH值小于微生物或多孔介质的等电点最大值0.5时,病毒的迁移能力会发生极大的改变。温度可以通过影响液体粘度从而影响到土壤渗透系数,温度越高越有利于微生物及其他颗粒的迁移 [42] 。pH和温度也对微生物的活性吸附能力以及生长衰亡速率产生影响,从而影响微生物的迁移。
水流速率影响了微生物和土壤颗粒之间的作用时间。一般来说,水流速率越快,接触作用时间越短,吸附量也就越低 [43] 。同时,水流速率越大水的剪切力越大,越易使吸附的微生物随水流冲刷下来 [44] 。另一方面,水流速度越低沥滤效果越明显 [45] 。灌水方式也会影响微生物的迁移效果,李桂花和李保国 [46] 发现脉冲输入方式的最大流出浓度大于阶跃式输入方式。
增加溶液离子强度会压缩双电子层使排斥势垒降低,降低溶液离子强度会导致排斥势垒增加,次级势阱减弱,有利于生物胶体的滞留。而马雪姣等 [47] 通过对噬菌体MS2的迁移规律研究发现,当离子强度大于临界值0.065 M时,病毒的吸附能力反而迅速降低,而当离子强度大于0.08 M时,病毒吸附能力随着离子强度增加而缓慢增加。这可能是由于高离子强度下多孔介质表面水合阳离子周围的水分子重新排列产生斥力,从而导致吸附能力随着离子强度的增加而迅速降低 [47] 。
2.7. 岩土的性质对迁移的影响
一些实验采用石英砂或玻璃珠代替岩土颗粒进行研究,以忽略岩土颗粒的不均匀性使实验环境理想化。实际上岩土质地、结构和有机质含量等都影响着微生物的迁移。岩土粒越小比表面积越大,越有利于生物胶体的吸附;岩土粒越大,大孔隙越多,吸附能力较差。高琼 [48] 通过实验证实了壤土对大肠杆菌的吸附能力比砂土吸附能力强,同时壤土对大肠杆菌的吸附能力随大肠杆菌浓度增加而减少,而砂土对大肠杆菌的吸附能力随大肠杆菌浓度增加而增加。Pang等 [49] 发现当岩土基质为火山灰、浮石砂、细砂、高度风化含水层岩石时微生物的去除率较高;而当岩土基质为结构化的粘质壤土、石质土、粗砂粒、破碎岩石、岩溶石灰岩时,微生物的去除率较低。岩土环境的变化常常导致胶体从介质表面释放出来 [44] [50] [51] 。腐殖酸 [52] [53] 和溶解性有机碳 [54] - [56] 等对微生物在岩土中的迁移过程产生了明显的影响。一般情况下,有机质占据着岩土颗粒表面的吸附位点导致微生物的吸附能力下降,从而促进微生物的迁移。然而,一些实验发现当DOC的含量较低且处于一定范围内时,有机碳含量的增加会导致次级势阱变深,微生物迁移能力下降 [56] 。
2.8. 微生物特征对迁移的影响
微生物特征,如微生物的大小、形状、种类、能动性、疏水性以及表面大分子物质等对迁移的影响十分复杂。体积过大或者形状细长的微生物更容易在孔隙喉道中被卡住,形成机械过滤和沥滤。通常情况下,病毒的大小小于细菌,因而在多孔介质中的迁移能力更强。可是在无污染的土柱中,MS2噬菌体都要比大肠杆菌J6-2的去除率要高 [56] 。Gupta等 [57] 也发现细胞大的细菌要比细胞小的具有更强的迁移能力。Reynolds等 [58] 在静止饱和土柱中发现有鞭毛的细菌比没有鞭毛的迁移速率快4倍。然而,一些实验中不具有能动性的微生物迁移距离更远 [59] 。疏水性的微生物比亲水性的更能有效的吸附在疏水性的多孔介质上 [60] 。一些研究发现胞外大分子物质阻碍微生物的吸附 [61] - [63] ,例如,大肠杆菌表面的大分子物质可以阻碍土壤颗粒和大肠杆菌之间的不可逆接触 [61] 。另一些研究则表明胞外大分子物质提高了微生物的吸附能力 [64] [65] 。
微生物可以相互絮凝形成一个较大的细胞簇或微生物膜,并且增加溶液的离子强度可提高细胞的聚集速率和沉降速率 [66] 。絮凝的群体体积增大、能动性变差、沥滤作用增强并发生桥连作用造成堵塞,直接导致微生物迁移能力下降。同时,已吸附的微生物团体能够吸附尚未吸附的微生物,致使吸附速率越来越快。此外,絮凝的微生物可能成团地随水流脱落对实验产生干扰 [61] 。
Bradford等 [45] 发现增加微生物的输入浓度会使流出液中微生物的相对数量增加,证明微生物浓度对微生物的迁移存在影响。同时,微生物的在多孔介质表面的停留时间延长会导致微生物粘附力的增加,影响微生物的释放过程 [67] 。
3. 实验方面的问题
研究微生物的迁移通常包括实验室条件下的以及野外条件下的研究。实验室条件研究包括土柱淋溶实验和批量平衡吸附实验两类。
Bitton等 [68] 提出了研究细菌运移的土柱试验规范,建议水流从下至上穿过土柱以忽略重力对实验造成的影响。陈星欣等 [69] 的研究证明了溶液自上向下流时颗粒的迁移能力更大,并且流速较低时,重力对颗粒迁移的影响更明显。实验中常通过在菌悬液中添加示踪剂来与胶体的迁移行为进行比对,并且从示踪剂的实验结果拟合得到胶体的弥散系数。一些实验表明胶体要比示踪剂提前从土柱中流出来。这可能由于大小排斥效应造成的,而且离子强度的降低会扩大胶体的双电子层,使大小排斥效应越明显,即胶体流的更快 [70] 。另外,胶体弥散性随着胶体大小和孔隙水流速度的增加而增加 [71] 。这就使得用示踪剂来拟合胶体的迁移过程需要商榷。
批量平衡吸附实验的结果常用等温吸附曲线或等温吸附方程来表示。Jiang等 [72] 通过批量平衡实验发现恶臭假单胞杆菌在矿物上的吸附行为可以用Langmuir等温线性方程拟合。李桂花等 [46] 发现大肠杆菌在砂土上的吸附符合Freundlich方程。然而,平衡实验所测得的生物胶体吸附能力参数与土柱实验的结果往往不符 [73] 。Treumann等 [73] 认为在平衡吸附实验中水力作用的大小和方向频繁改变使得胶体不利于吸附,并且胶体颗粒越大,吸附差异越明显。
野外实验由于不可控因素较多,更加复杂,造成野外实验与土柱实验的结果不一致。土柱实验中微生物的去除率要高于野外实验中微生物的去除率,即致病菌在野外的迁移能力要大于实验室中得出的结论。造成这些差异的原因包括:
1) 优先流。优先流使微生物在野外的迁移距离比实验室模拟的距离更长,速度更快,造成更大的环境风险 [74] - [76] 。实验土柱常用玻璃珠等均匀材料或者重新填装的土壤来代替野外原状土,忽略了土壤结构对微生物迁移的影响。近年来一些实验采用原状土,也有一些实验将采集回来的土壤进行风化处理。Safadoust等 [77] 通过比较实验发现未风化的土柱对大肠杆菌的过滤效果更明显。
2) 有机物。野外实验土壤中的有机物,如腐殖质等,占据了土壤基质表面的吸附位点,使微生物的迁移能力增加,尤其对病毒迁移的影响大。实验室中的土柱一般进行过预处理或者采用别的物质来代替,仅有极少的或者不含有机物,低估了微生物的迁移能力 [56] [78] 。
3) 种群异质性。野外场地开阔,吸附能力差的微生物种群可以展现出相对更强的迁移能力。受限于土柱尺寸,实验室实验无法反映这点 [10] [79] 。
4) 阳离子交换。研究表明当溶液中的阳离子由二价态换为一价态的,会导致基质表面的胶体解吸 [80] [81] 。实验室中的溶液通常为统一的电解液,而野外地下水中存在各种各样的阳离子。因此,在野外可能发生阳离子交换导致生物胶体迁移能力增加 [81] 。
4. 模型模拟方面的进展
微生物在多孔介质内的迁移包括三方面的过程和机理:1) 随水流迁移;2) 在液相和固相之间交换;3) 失活和死亡。早期基于胶体过滤理论对微生物的迁移进行模拟。表达式如下:
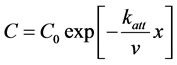 (1)
(1)
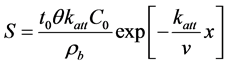 (2)
(2)
式中:C (M L−3)、S (M M−1)分别表示距离起始点距离为x时,液相和固相中微生物的浓度;C0表示在x = 0处液相中的浓度;t0 (T)表示时间;x (L)表示距离;v (L T−1)表示平均孔隙流速;θ表示有效孔隙度;ρb (M L−3)表示多孔介质的容重;katt (T−1)表示吸附速率常数,用下式来计算:
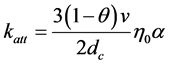 (3)
(3)
式中:dc (L)为平均颗粒大小;η0为单一位点接触效率(single-collector contact efficiency);α为碰撞效率,表示发生接触的胶体的沉降概率。当吸附环境条件为有利吸附时,则α = 1,否则α < 1。α的表达式如下 [82] :
 (4)
(4)
式中:Cmax/C0为土柱实验中流出液平稳后的相对浓度;L (L)为土柱长度。
由于胶体过滤理论的不足,现在主要在对流弥散的基础上对微生物的迁移进行模拟。在饱和多孔介质中,仅考虑一维情况下,微生物在空间和时间的变化可用如下对流弥散吸附方程(ADS)表示:
 (5)
(5)
式中:C (M L−3)、S (M M−1)分别为液相、固相中微生物的浓度;D (L2 T−1)为水动力弥散系数。方程左边第一项表示溶液中微生物的变化速率,第二项表示吸附在固相上的微生物变化速率,即吸附项。方程右边两项分别为水动力弥散项和对流项。方程中吸附项用不同的表达式或者在方程中加入生物过程项,可得到不同的迁移模型。
4.1. 平衡动力学吸附模型
物理化学吸附包括可逆吸附和不可逆吸附,可逆吸附通常用平衡吸附或动力学吸附来表示,而不可逆吸附通常用一阶动力学方程来表示。早些的模型通常只考虑平衡吸附或者动力学吸附。若平衡吸附符合等温线性吸附方程,即:
 (6)
(6)
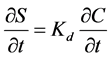 (7)
(7)
则,微生物在多孔介质中的一维运移方程为:
 (8)
(8)
式中:Kd (L3 M−1)为微生物土壤吸附分配系数;R为吸附滞留因子,且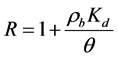 。
。
一般吸附是动态过程,不能立刻达到吸附平衡状态。此时可用动力学模型来描述吸附解析机理,即吸附、解析过程均用一阶动力学方程来表达 [83] ,即:
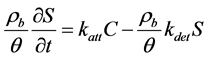 (9)
(9)
式中:kdet (T−1)为微生物的解吸速率常数。
4.2. 双位点或双种群模型
根据吸附位点的差异或者种群间的差异,将胶体的吸附速率分为两类来讨论的模型称为双位点模型或双种群模型。通常,双位点模型要比单独的动力学模型和平衡模型具有更好的模拟效果。早期的双位点模型通常采用平衡吸附结合动力学吸附的模拟方法 [84] [85] :
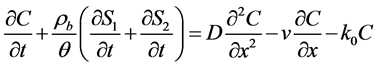 (10)
(10)
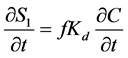 (11)
(11)
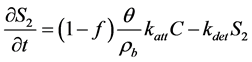 (12)
(12)
式中:S1 (M M−1)、S2 (M M−1)为平衡吸附位点和动力学吸附位点上微生物胶体的浓度;f和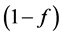 为平衡吸附位点和动力学吸附位点的百分数;k0 (T−1)为不可逆滞留速率。
为平衡吸附位点和动力学吸附位点的百分数;k0 (T−1)为不可逆滞留速率。
Schijven等 [86] 发现平衡吸附在病毒的迁移过程中可以忽略不计。因此,用两种动力学吸附建立双位点的模型逐渐发展起来。例如,将吸附位点分为具有不同吸附解析速率的两类可逆一阶动力学吸附位点 [87] [88] :
 (13)
(13)
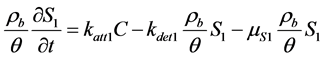 (14)
(14)
 (15)
(15)
式中:μ为微生物衰亡速率(T−1);下角标1、2代表具有不同吸附解吸速率的吸附位点。
双种群/多种群理论也可以用来解释微生物吸附速率不一致的原因。Foppen等 [10] 假设生物胶体由具有不同吸附速率的两部分组成,在胶体过滤理论的基础上提出了一种双种群模型:
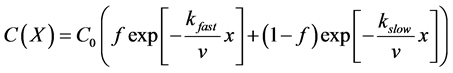 (16)
(16)
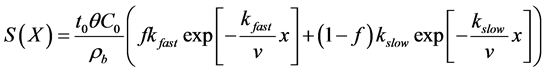 (17)
(17)
式中:kfast (T−1)、kslow (T−1)分别为吸附速率快和吸附速率慢的种群的吸附速率常数;f、1 − f分别为吸附速率快和吸附速率慢的种群的比例。在此基础上,一些学者也尝试采用概率密度分布函数表示具有不同吸附速率的种群的比例 [89] [90] 。
近来,Feighner [88] 提出了双位点双种群模型。第一类种群分别用可逆/不可逆吸附双位点模型来表示,而第二类种群用简单的一阶不可逆动力学方程来表示吸附过程。实验结果表明,对于平均粒径大且细颗粒百分含量少的多孔介质,双位点双种群模型的模拟效果更好。
4.3. 有限捕获模型
在一些土柱实验中流出液的相对浓度大于1,此外在某些环境下BTC曲线呈现出类似双峰的形态。针对这些现象,有限捕获模型 [9] 假设:1) 土壤孔隙捕获细菌的能力有限;2) 随着捕获的细菌数量增多,捕获细菌的速度也随着加快;3) 捕获细菌形成的细胞簇可能释放到水流中。表达式为:
 (18)
(18)
式中:b (L3 M−1 T−1)为捕获速率。
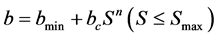 (19)
(19)
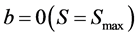 (20)
(20)
式中:bmin (L3 M−1 T−1)为初始捕获速率;bc和n均用来描述捕获速率增加的快慢;Smax (M M−1)为多孔介质的最大吸附量。
4.4. 关于物理不平衡的模拟
由于土壤介质中的孔隙分布不均匀,流体的状态并不一致,存在所谓的物理不平衡。优先流便是这一不平衡过程的产物,在自然界中普遍存在,造成微生物迁移在实验室内和野外得到不同的结果。因此,需要一种模型来描述物理不平衡现象并用于模拟野外条件下微生物的迁移。MIM模型将多孔介质中的孔隙分为流动区和滞留区两部分区域,在可移动区域中溶质发生对流弥散,两区域间通过扩散作用发生的溶质的交换,用一阶动力学方程来表示 [91] :
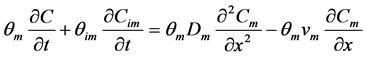 (21)
(21)
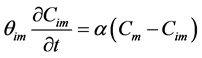 (22)
(22)
式中:θm、θim分别为流动区和滞留区的含水量;Cm、Cim分别为流动区和滞留区溶质的含量;α (T−1)为溶质在两区域间的交换系数。该模型适用于生物胶体以及所有溶质的迁移,可以很好的解释穿透曲线中呈圆滑曲线的上升和下降过程。然而,这种模型并没有考虑到胶体的吸附过程。之后,不同的吸附机理被考虑进来形成了不同的模型。例如,Leji等 [92] 在MIM模型和双位点模型的基础上提出了一种双渗透性模型,该模型根据水域渗透性的不同将水域分为i、j两部分,每部分均发生不可逆吸附和可逆吸附过程,用一阶动力学方程来表示,且两区域间发生线性交换,模型方程为:
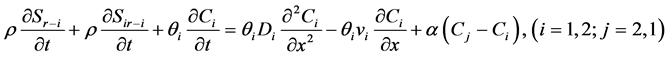 (23)
(23)
式中:下角标r、ir分别表示可逆吸附和不可逆吸附,下角标1、2分别代表渗透性不同的水域。在存在优先流的多孔介质中,该模型对实验结果有较好的拟合度。
4.5. 沥滤的模拟
越来越多的研究表明沥滤在迁移过程中发挥着非常重要的作用 [93] 。然而上述模型未考虑沥滤,仅用一阶动力学方程来模拟包括沥滤在内所有不可逆吸附。Bradford等 [94] 提出了描述沥滤过程的模型:
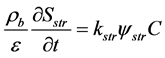 (24)
(24)
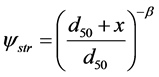 (25)
(25)
式中:Sstr (M M−1)为因沥滤作用而吸附在介质上的胶体浓度;kstr (T−1)为沥滤系数;Ψstr为和深度有关的幂次函数;β为控制胶体空间分布形状的拟合参数。
4.6. Blocking和Ripening
Blocking或Ripening现象指穿透曲线中流出液浓度稳定后仍出现的轻微上升或下降,反映出吸附速率有轻微的下降或增加。通常用一阶动力学方程分别表示吸附和解吸过程,考虑到Blocking作用时,常在一阶动力学吸附项上加一个表示Blocking的无量纲函数ψs:
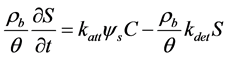 (26)
(26)
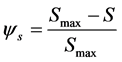 (27)
(27)
类似地,Hosseini等 [95] 提出了表示Ripening的函数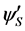 的经验表达式:
的经验表达式:
 (28)
(28)
式中:A、β均为拟合参数。Bradford等 [96] 则在模拟方程中增加了一项表示Ripening过程:
 (29)
(29)
式中:kint (T−1)为微生物相互作用速率。
4.7. 微生物过程
实验中常用胶体颗粒,如聚苯乙烯胶体颗粒,代替生物胶体作为研究对象,或者将实验温度控制在4℃左右以消除微生物过程对吸附和迁移的影响。然而,野外条件下微生物过程对其迁移发挥了非常重要的作用。通常用一阶动力学方程表示微生物的生长,即Monod方程 [97] :
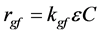 (30)
(30)
 (31)
(31)
式中:rgf (M L−1 T−1)、rgs (M L−1 T−1)分别为液相、固相中细胞的增长速率;kgf (T−1)、kgs (T−1)分别为液相、固相中细胞的比增长速率。假设kgf和kgs相同,即为kg:
 (32)
(32)
式中:kgmax为最大比增长速率(T−1);KS (M L−3)为莫诺常数;CF (M L−3)为液相中营养基质的浓度。微生物的衰亡过程常用不可逆一阶动力学方程来表示:
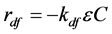 (33)
(33)
 (34)
(34)
式中:rdf (M L−3 T−1)、rds (M L−3 T−1)分别为液相、固相中细胞的衰亡速率;kdf (T−1)、kds (T−1)分别为液相、固相中细胞的比衰亡速率。尽管Feighery等 [88] 的实验结果表明悬浮于液体中的微生物和吸附在不同位点上的微生物衰亡速率近乎相同,但是考虑到吸附在介质上的和悬浮在溶液中的微生物所处环境不同,可把这些微生物的衰亡分开来计算。微生物的活性受环境条件,如温度、pH、溶液成分等的影响十分复杂。对微生物生长、衰亡过程的模拟需要更多的探索。
Sen等 [97] 指出微生物的趋化性在微生物的迁移过程,尤其在微生物修复中具有重要作用,将微生物的趋化性等生物过程加入微生物迁移模型方程:
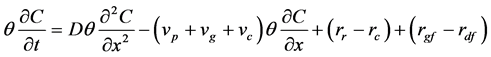 (35)
(35)
 (36)
(36)
 (37)
(37)
式中:vp (L T−1)为孔隙水流速率;vg (L T−1)为细菌沉降速率,常忽略;vc (L T−1)为细菌的趋化速率;rr (M L−3 T−1)、rc (M L−3 T−1)分别为解析和吸附速率;CF (M L−3)为刺激性物质的浓度;X(CF)为趋化性敏感系数;v'为某种特异性频率;s (L T−1)为细菌一维迁移速率,通常介于20~60 μm之间;Rt为微生物表面受体数量;Kd为分配常数。
5. 研究展望
由于人类活动的强烈影响,细菌、病毒和原生动物在多孔介质中的迁移成为近年来水文和水环境研究的热点问题。尽管近来的研究取得了大量的新认识,然而存在的问题也十分突出。首先,沥滤作用、异质性、微生物过程等对生物胶体迁移影响的实验机理研究和模型模拟研究需要进一步深入。例如,如何定量沥滤作用在生物胶体滤除中所占的比重;如何描述在物理异质性、化学异质性以及微生物种群异质性作用下微生物的迁移;微生物的生长衰亡在生物胶体迁移过程中发挥了怎样的作用等。其次,野外条件下的研究工作需要加强。野外实验不可控因素多,相对于实验室实验更加复杂。实验室的研究成果往往与野外条件下的不一致,这是加强野外研究的客观要求。加强野外条件下的研究有助于深入理解生物胶体迁移的复杂规律,促进机理研究和模型模拟的发展。最后,未来的模型模拟研究要进一步完善对具体机理的描述,并在此基础上抓住主要机理、简化模型、提高效率。
基金项目
国家自然科学基金项目(41301033)资助。
文章引用
袁瑞强,郭 威,王仕琴,王 鹏. 微生物在饱和多孔介质中的迁移
Microbial Transport in Saturated Porous Media[J]. 水资源研究, 2016, 05(04): 334-349. http://dx.doi.org/10.12677/JWRR.2016.54040
参考文献 (References)
- 1. TORKZABAN, S., HASSANIZADEH, S., SCHIJVEN, J., et al. Virus transport in saturated and unsaturated sand columns. Vadose Zone Journal, 2006, 5(3): 877-885. http://dx.doi.org/10.2136/vzj2005.0086
- 2. BERGENDAHL, J., GRASSO, D. Prediction of colloid detachment in a model porous media: Hydrodynamics. Chemical Engineering Science, 2000, 55(9): 1523-1532. http://dx.doi.org/10.1016/S0009-2509(99)00422-4
- 3. SHEN, C., LAZOUSKAYA, V., ZHANG, H., et al. Theoretical and experimental investigation of detachment of colloids from rough collector surfaces. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2012, 410: 98-110. http://dx.doi.org/10.1016/j.colsurfa.2012.06.025
- 4. TORKZABAN, S., BRADFORD, S. A., WAN, J., et al. Release of quantum dot nanoparticles in porous media: Role of cation exchange and aging time. Environmental Science & Technology, 2013, 47(20): 11528-11536. http://dx.doi.org/10.1021/es402075f
- 5. EINAT, M., NOAM, W., YOSEPH, Y., et al. Colloid transport in porous media: Impact of hyper-saline solutions. Water Research, 2011, 45(11): 3521-3532. http://dx.doi.org/10.1016/j.watres.2011.04.021
- 6. YAO, K.-M., HABIBIAN, M. T. and O’MELIA, C. R. Water and waste water filtration. Concepts and applications. Environmental Science & Technology, 1971, 5(11): 1105-1112. http://dx.doi.org/10.1021/es60058a005
- 7. BRADFORD, S. A., SIMUNEK, J. and WALKER, S. L. Transport and straining of E. coli O157:H7 in saturated porous media. Water Resources Research, 2006, 42(12): W12S10. http://dx.doi.org/10.1029/2005WR004805
- 8. TONG, M., MA, H. and JOHNSON, W. P. Funneling of flow into grain-to-grain contacts drives colloid-colloid aggregation in the presence of an energy barrier. Environmental Science & Technology, 2008, 42(8): 2826-2832. http://dx.doi.org/10.1021/es071888v
- 9. PACHEPSKY, Y., DEVIN, B., POLYANSKAYA, L., et al. Limited entrapment model to simulate the breakthrough of Arthrobacter and Aquaspirillum in soil columns. International Agrophysics, 2006, 20(3): 207.
- 10. FOPPEN, J. W., VAN HERWERDEN, M. and SCHIJVEN, J. Transport of Escherichia coli in saturated porous media: Dual mode deposition and intra-population heterogeneity. Water Research, 2007, 41(8): 1743-1753. http://dx.doi.org/10.1016/j.watres.2006.12.041
- 11. TONG, M., JOHNSON, W. P. Colloid population heterogeneity drives hyperexponential deviation from classic filtration theory. Environmental Science & Technology, 2007, 41(2): 493-499. http://dx.doi.org/10.1021/es061202j
- 12. LI, X., SCHEIBE, T. D. and JOHNSON, W. P. Apparent decreases in colloid deposition rate coefficients with distance of transport under unfavorable deposition conditions: A general phenomenon. Environmental Science & Technology, 2004, 38(21): 5616-5625. http://dx.doi.org/10.1021/es049154v
- 13. BRADFORD, S. A., KIM, H. N., HAZNEDAROGLU, B. Z., et al. Coupled factors influencing concentration-dependent colloid transport and retention in saturated porous media. Environmental Science & Technology, 2009, 43(18): 6996-7002. http://dx.doi.org/10.1021/es900840d
- 14. TUFENKJI, N., ELIMELECH, M. Breakdown of colloid filtration theory: Role of the secondary energy minimum and surface charge heterogeneities. Langmuir, 2005, 21(3): 841-852. http://dx.doi.org/10.1021/la048102g
- 15. KNAPPETT, P., DU, J., LIU, P., et al. Importance of reversible attachment in predicting E. coli transport in saturated aquifers from column experiments. Advances in Water Resources, 2014, 63: 120-130. http://dx.doi.org/10.1016/j.advwatres.2013.11.005
- 16. RAMACHANDRAN, V., FOGLER, H. S. Plugging by hydrodynamic bridging during flow of stable colloidal particles within cylindrical pores. Journal of Fluid Mechanics, 1999, 385(01): 129-156. http://dx.doi.org/10.1017/S0022112098004121
- 17. BRADFORD, S. A., TORKZABAN, S. and SHAPIRO, A. A theoretical analysis of colloid attachment and straining in chemically heterogeneous porous media. Langmuir, 2013, 29(23): 6944-6952. http://dx.doi.org/10.1021/la4011357
- 18. HERZIG, J., LECLERC, D. and GOFF, P. L. Flow of suspensions through porous media—Application to deep filtration. Industrial & Engineering Chemistry, 1970, 62(5): 8-35. http://dx.doi.org/10.1021/ie50725a003
- 19. BRADFORD, S. A., SIMUNEK, J., BETTAHAR, M., et al. Straining of colloids at textural interfaces. Water Resources Research, 2005, 41(10): W10404. http://dx.doi.org/10.1029/2004WR003675
- 20. DU, Y., SHEN, C., ZHANG, H. and HUANG, Y. Effects of flow velocity and nonionic surfactant on colloid straining in saturated porous media under unfavorable conditions. Transport in Porous Media, 2013, 98(1): 193-208. http://dx.doi.org/10.1007/s11242-013-0140-3
- 21. SHEN, C., HUANG, Y., LI, B. and YAN, J. Effects of solution chemistry on straining of colloids in porous media under unfavorable conditions. Water Resources Research, 2008, 44(5): W05419. http://dx.doi.org/10.1029/2007WR006580
- 22. XU, S., LIAO, Q. and SAIERS, J. E. Straining of nonspherical colloids in saturated porous media. Environmental Science & Technology, 2008, 42(3): 771-778. http://dx.doi.org/10.1021/es071328w
- 23. BRADFORD, S. A., YATES, S. R., BETTAHAR, M., et al. Physical factors affecting the transport and fate of colloids in saturated porous media. Water Resources Research, 2002, 38(12): 63-1-63-12.
- 24. JOHNSON, W. P., MA, H. and PAZMINO, E. Straining credibility: A general comment regarding common arguments used to infer straining as the mechanism of colloid retention in porous media. Environmental Science & Technology, 2011, 45(9): 3831-3832. http://dx.doi.org/10.1021/es200868e
- 25. DUFFADAR, R., KALASIN, S., DAVIS, J. M. and SANTORE, M. M. The impact of nanoscale chemical features on micron-scale adhesion: Crossover from heterogeneity-dominated to mean-field behavior. Journal of Colloid and Interface Science, 2009, 337(2): 396-407. http://dx.doi.org/10.1016/j.jcis.2009.05.046
- 26. KALASIN, S., SANTORE, M. Hydrodynamic crossover in dynamic microparticle adhesion on surfaces of controlled nanoscale heterogeneity. Langmuir, 2008, 24(9): 4435-4438. http://dx.doi.org/10.1021/la8000202
- 27. SHEN, C., LI, B., WANG, C., et al. Surface roughness effect on deposition of nano- and micro-sized colloids in saturated columns at different solution ionic strengths. Vadose Zone Journal, 2011, 10(3): 1071-1081. http://dx.doi.org/10.2136/vzj2011.0011
- 28. SHEN, C., WANG, L.-P., LI, B., et al. Role of surface roughness in chemical detachment of colloids deposited at primary energy minima. Vadose Zone Journal, 2012, 11(1): 1-12. http://dx.doi.org/10.2136/vzj2011.0057
- 29. TORKZABAN, S., BRADFORD, S. A. Critical role of surface roughness on colloid retention and release in porous media. Water Research, 2016, 88: 274-284. http://dx.doi.org/10.1016/j.watres.2015.10.022
- 30. BRADFORD, S. A., TORKZABAN, S. Colloid interaction energies for physically and chemically heterogeneous porous media. Langmuir, 2013, 29(11): 3668-3676. http://dx.doi.org/10.1021/la400229f
- 31. SPARKS, D. L. Environmental soil chemistry. Cambridge: Academic Press, 2003.
- 32. DUFFADAR, R. D., DAVIS, J. M. Interaction of micrometer-scale particles with nanotextured surfaces in shear flow. Journal of Colloid and Interface Science, 2007, 308(1): 20-29. http://dx.doi.org/10.1016/j.jcis.2006.12.068
- 33. SHEN, C., LAZOUSKAYA, V., ZHANG, H., et al. Influence of surface chemical heterogeneity on attachment and detachment of microparticles. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 433: 14-29. http://dx.doi.org/10.1016/j.colsurfa.2013.04.048
- 34. ADAMCZYK, Z., JASZCZółt, K., MICHNA, A., et al. Irreversible adsorption of particles on heterogeneous surfaces. Advances in Colloid and Interface Science, 2005, 118(1): 25-42. http://dx.doi.org/10.1016/j.cis.2005.03.003
- 35. ROY, S. B., DZOMBAK, D. A. Chemical factors influencing colloid-facilitated transport of contaminants in porous media. Environmental Science & Technology, 1997, 31(3): 656-664. http://dx.doi.org/10.1021/es9600643
- 36. KOZLOVA, N., SANTORE, M. M. Manipulation of micrometer-scale adhesion by tuning nanometer-scale surface features. Langmuir, 2006, 22(3): 1135-1142. http://dx.doi.org/10.1021/la0515221
- 37. MOLNAR, I. L, JOHNSON, W. P., GERHARD, J. I., et al. Predicting colloid transport through saturated porous media: A critical review. Water Resources Research, 2015, 51(9): 6804-6845. http://dx.doi.org/10.1002/2015WR017318
- 38. TORKZABAN, S., BRADFORD, S. A. and WALKER, S. L. Resolving the coupled effects of hydrodynamics and DLVO forces on colloid attachment in porous media. Langmuir, 2007, 23(19): 9652-9660. http://dx.doi.org/10.1021/la700995e
- 39. ADAMCZYK, Z., SIWEK, B., ZEMBALA, M. and BELOUSCHEK, P. Kinetics of localized adsorption of colloid particles. Advances in Colloid and Interface Science, 1994, 48: 151-280. http://dx.doi.org/10.1016/0001-8686(94)80008-1
- 40. BRADFORD, S. A., TORKZABAN, S. and WIEGMANN, A. Pore-scale simulations to determine the applied hydrodynamic torque and colloid immobilization. Vadose Zone Journal, 2011, 10(1): 252-261. http://dx.doi.org/10.2136/vzj2010.0064
- 41. GUAN, H., SCHULZE-MAKUCH, D., SCHAFFER, S. and PILLAI, S. D. The effect of critical pH on virus fate and transport in saturated porous medium. Groundwater, 2003, 41(5): 701-708. http://dx.doi.org/10.1111/j.1745-6584.2003.tb02408.x
- 42. GHARABAGHI, B., SAFADOUST, A., MAHBOUBI, A., et al. Temperature effect on the transport of bromide and E. coli NAR in saturated soils. Journal of Hydrology, 2015, 522: 418-427. http://dx.doi.org/10.1016/j.jhydrol.2015.01.003
- 43. 殷宪强, 孙慧敏, 易磊, 等. 孔隙水流速对胶体在饱和多孔介质中运移的影响[J]. 水土保持学报, 2010, 24(5): 101-104. YIN Xianqiang, SUN Huimin, YI Lei, et al. Effect of flowrate of pore water on the transport of colloid in sarutated porous media. Journal of Soil and Water Conservation, 2010, 24(5): 101-104. (in Chinese)
- 44. TORKZABAN, S., BRADFORD, S. A., VANDERZALM, J. L., et al. Colloid release and clogging in porous media: Effects of solution ionic strength and flow velocity. Journal of Contaminant Hydrology, 2015, 181: 161-171. http://dx.doi.org/10.1016/j.jconhyd.2015.06.005
- 45. BRADFORD, S. A., BETTAHAR, M. Concentration dependent transport of colloids in saturated porous media. Journal of Contaminant Hydrology, 2006, 82(1-2): 99-117. http://dx.doi.org/10.1016/j.jconhyd.2005.09.006
- 46. 李桂花, 李保国. 大肠杆菌在饱和砂土中的运移及其模拟[J]. 土壤学报, 2003, 40(5): 783-786. LI Guihua, LI Baoguo. Transport of Escherichia coli through saturated sandy soil: experiments and modelling. Acta Pedologica Sinica, 2003, 40(5): 783-786. (in Chinese)
- 47. 马雪姣, 金妍, 黄元仿, 等. 冠状病毒IBV和噬菌体MS2在饱和多孔介质中的运移规律[J]. 中国环境科学, 2007, 27(2): 255-259. MA Xuejiao, JIN Yan, HUANG Yuanfang, et al. Transport of avian infectious bronchitis virus (IBV) and bacteriophage (MS2) in saturated porous media. China Environmental Science, 2007, 27(2): 255-259. (in Chinese)
- 48. 高琼. 大肠杆菌在土壤中的迁移特性实验研究[D]: [硕士学位论文]. 天津: 天津理工大学, 2011. GAO Qiong. Experimental study of transport characteristics of E. coli in Soils. Tianjin: Tianjin University of Technology, 2011. (in Chinese)
- 49. PANG, L. Microbial removal rates in subsurface media estimated from published studies of field experiments and large intact soil cores. Journal of Environmental Quality, 2009, 38(4): 1531-1559. http://dx.doi.org/10.2134/jeq2008.0379
- 50. BRADFORD, S. A., WANG, Y., TORKZABAN, S. and ŠIMŮNEK, J. Modeling the release of E. coli D21g with transients in water content. Water Resources Research, 2015, 51(5): 3303-3316. http://dx.doi.org/10.1002/2014WR016566
- 51. BRADFORD, S. A., TORKZABAN, S., KIM, H. and ŠIMŮNEK, J. Modeling colloid and microorganism transport and release with transients in solution ionic strength. Water Resources Research, 2012, 48(9): 77-86. http://dx.doi.org/10.1029/2012WR012468
- 52. YANG, H., KIM, H. and TONG, M. Influence of humic acid on the transport behavior of bacteria in quartz sand. Colloids and Surfaces B: Biointerfaces, 2012, 91: 122-129. http://dx.doi.org/10.1016/j.colsurfb.2011.10.058
- 53. FOPPEN, J. W, LIEM, Y. and SCHIJVEN, J. Effect of humic acid on the attachment of Escherichia coli in columns of goethite-coated sand. Water Research, 2008, 42(1): 211-219. http://dx.doi.org/10.1016/j.watres.2007.06.064
- 54. HARVEY, R. W, METGE, D. W, BARBER, L. and AIKEN, G. R. Effects of altered groundwater chemistry upon the pH-dependency and magnitude of bacterial attachment during transport within an organically contaminated sandy aquifer. Water Research, 2010, 44(4): 1062-1071. http://dx.doi.org/10.1016/j.watres.2009.09.008
- 55. WALSHE, G. E., PANG, L., FLURY, M., CLOSE, M. E. and FLINTOFT, M. Effects of pH, ionic strength, dissolved organic matter, and flow rate on the co-transport of MS2 bacteriophages with kaolinite in gravel aquifer media. Water Research, 2010, 44(4): 1255-1269. http://dx.doi.org/10.1016/j.watres.2009.11.034
- 56. WEAVER, L., SINTON, L. W., PANG, L., DANN, R. and CLOSE, M. Transport of microbial tracers in clean and organically contaminated silica sand in laboratory columns compared with their transport in the field. Science of the Total Environment, 2013, 443: 55-64. http://dx.doi.org/10.1016/j.scitotenv.2012.09.049
- 57. GUPTA, V., JOHNSON, W. P., SHAFIEIAN, P., et al. Riverbank filtration: comparison of pilot scale transport with theory. Environmental Science & Technology, 2009, 43(3): 669-676. http://dx.doi.org/10.1021/es8016396
- 58. REYNOLDS, P., SHARMA, P., JENNEMAN, G., et al. Mechanisms of microbial movement in subsurface materials. Applied and Environmental Microbiology, 1989, 55(9): 2280-2286.
- 59. LUTTERODT, G., BASNET, M., FOPPEN, J. and UHLENBROOK, S. The effect of surface characteristics on the transport of multiple Escherichia coli isolates in large scale columns of quartz sand. Water Research, 2009, 43(3): 595-604. http://dx.doi.org/10.1016/j.watres.2008.11.001
- 60. STEVIK, T. K., AA, K., AUSLAND, G. and HANSSEN, J. F. Retention and removal of pathogenic bacteria in wastewater percolating through porous media: A review. Water Research, 2004, 38(6): 1355-1367. http://dx.doi.org/10.1016/j.watres.2003.12.024
- 61. KIM, H. N., WALKER, S. L. and BRADFORD, S. A. Macromolecule mediated transport and retention of Escherichia coli O157:H7 in saturated porous media. Water Research, 2010, 44(4): 1082-1093. http://dx.doi.org/10.1016/j.watres.2009.09.027
- 62. KUZNAR, Z. A., ELIMELECH, M. Role of surface proteins in the deposition kinetics of Cryptosporidium parvum oocysts. Langmuir, 2005, 21(2): 710-716. http://dx.doi.org/10.1021/la047963m
- 63. KUZNAR, Z. A., ELIMELECH, M. Cryptosporidium oocyst surface macromolecules significantly hinder oocyst attachment. Environmental Science & Technology, 2006, 40(6): 1837-1842. http://dx.doi.org/10.1021/es051859p
- 64. RIJNAARTS, H. H., NORDE, W., LYKLEMA, J. and ZEHNDER, A. J. B. DLVO and steric contributions to bacterial deposition in media of different ionic strengths. Colloids and Surfaces B: Biointerfaces, 1999, 14(1): 179-195. http://dx.doi.org/10.1016/S0927-7765(99)00035-1
- 65. GARGIULO, G., BRADFORD, S., ŠIMŮNEK, J., et al. Bacteria transport and deposition under unsaturated conditions: The role of the matrix grain size and the bacteria surface protein. Journal of Contaminant Hydrology, 2007, 92(3): 255-273. http://dx.doi.org/10.1016/j.jconhyd.2007.01.009
- 66. GROLIMUND, D., ELIMELECH, M. and BORKOVEC, M. Aggregation and deposition kinetics of mobile colloidal particles in natural porous media. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2001, 191(1): 179-188. http://dx.doi.org/10.1016/S0927-7757(01)00773-7
- 67. GINN, T. R. On the distribution of multicomponent mixtures over generalized exposure time in subsurface flow and reactive transport: Theory and formulations for residence-time-dependent sorption/desorption with memory. Water Resources Research, 2000, 36(10): 2885-2893. http://dx.doi.org/10.1029/2000WR900170
- 68. BITTON, G., DAVIDSON, J. M. and FARRAH, S. On the value of soil columns for assessing the transport pattern of viruses through soils: A critical outlook. Water, Air, and Soil Pollution, 1979, 12(4): 449-457. http://dx.doi.org/10.1007/BF01046866
- 69. 陈星欣, 白冰. 重力对饱和多孔介质中颗粒输运特性的影响[J]. 岩土工程学报, 2012, 34(9): 1661-1667. CHEN Xingxin, BAI Bing. Effect of gravity on transport of particles in saturated porous media. Chinese Journal of Geotechnical Engineering, 2012, 34(9): 1661-1667. (in Chinese)
- 70. HARTER, T., WAGNER, S. and ATWILL, E. R. Colloid transport and filtration of Cryptosporidium parvum in sandy soils and aquifer sediments. Environmental science & technology, 2000, 34(1): 62-70. http://dx.doi.org/10.1021/es990132w
- 71. CHRYSIKOPOULOS, C. V., KATZOURAKIS, V. E. Colloid particle size-dependent dispersivity. Water Resources Research, 2015, 51: 4668-4683. http://dx.doi.org/10.1002/2014WR016094
- 72. JIANG, G., NOONAN, M. J., BUCHAN, G. D., et al. Transport of Escherichia coli through variably saturated sand columns and modeling approaches. Journal of Contaminant Hydrology, 2007, 93(1-4): 2-20. http://dx.doi.org/10.1016/j.jconhyd.2007.01.010
- 73. TREUMANN, S., TORKZABAN, S., BRADFORD, S. A., et al. An explanation for differences in the process of colloid adsorption in batch and column studies. Journal of Contaminant Hydrology, 2014, 164: 219-229. http://dx.doi.org/10.1016/j.jconhyd.2014.06.007
- 74. CEY, E. E., RUDOLPH, D. L. Field study of macropore flow processes using tension infiltration of a dye tracer in partially saturated soils. Hydrological Processes, 2009, 23(12): 1768-1779. http://dx.doi.org/10.1002/hyp.7302
- 75. PANG, L., MCLEOD, M., AISLABIE, J., et al. Modeling transport of microbes in ten undisturbed soils under effluent irrigation. Vadose Zone Journal, 2008, 7(1): 97-111. http://dx.doi.org/10.2136/vzj2007.0108
- 76. ŠIMŮNEK, J., HE, C., PANG, L. and BRADFORD, S. A. Colloid-facilitated solute transport in variably saturated porous media. Vadose Zone Journal, 2006, 5(3): 1035-1047. http://dx.doi.org/10.2136/vzj2005.0151
- 77. SAFADOUST, A., MAHBOUBI, A., GHARABAGHI, B., et al. Bacterial filtration rates in repacked and weathered soil columns. Geoderma, 2011, 167: 204-213. http://dx.doi.org/10.1016/j.geoderma.2011.08.014
- 78. WALL, K., PANG, L., SINTON, L. and CLOSE, M. Transport and attenuation of microbial tracers and effluent microorganisms in saturated pumice sand aquifer material. Water, Air, and Soil Pollution, 2008, 188(1-4): 213-224. http://dx.doi.org/10.1007/s11270-007-9537-3
- 79. BOLSTER, C. H., MILLS, A. L., HORNBERGER, G. and HERMAN, J. Effect of intra-population variability on the long- distance transport of bacteria. Groundwater, 2000, 38(3): 370-375. http://dx.doi.org/10.1111/j.1745-6584.2000.tb00222.x
- 80. ROY, S. B., DZOMBAK, D. A. Na+-Ca 2+ Exchange effects in the detachment of latex colloids deposited in glass bead porous media. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1996, 119(2): 133-139. http://dx.doi.org/10.1016/S0927-7757(96)03764-8
- 81. SHEN, C., LAZOUSKAYA, V., Jin, Y., et al. Coupled factors influencing detachment of nano-and micro-sized particles from primary minima. Journal of Contaminant Hydrology, 2012, 134: 1-11. http://dx.doi.org/10.1016/j.jconhyd.2012.04.003
- 82. FOPPEN, J. W. A., SCHIJVEN, J. F. Transport of E. coli in columns of geochemically heterogeneous sediment. Water Research, 2005, 39(13): 3082-3088. http://dx.doi.org/10.1016/j.watres.2005.05.023
- 83. ŠIMŮNEK, J., ŠEJNA, M., SAITO, H., et al. The HYDRUS-1D software package for simulating the movement of water, heat, and multiple solutes in variably saturated media, version 4.0, HYDRUS software series 3. Riverside: Department of Environmental Sciences, University of California Riverside, 2008: 315.
- 84. VAN GENUCHTEN, M. T., WAGENET, R. Two-site/two-region models for pesticide transport and degradation: Theoretical development and analytical solutions. Soil Science Society of America Journal, 1989, 53(5): 1303-1310. http://dx.doi.org/10.2136/sssaj1989.03615995005300050001x
- 85. 李桂花, 李保国. 大肠杆菌在饱和砂质壤土中非平衡运移的 CDE 数学模型模拟[J]. 土壤学报, 2006, 43(2): 197-202. LI Guihua, LI Baoguo. Non-equilibrium transport of Escherichia coli through saturated sandy loam and its simulation with CDE model. Acta Pedologica Sinica, 2006, 43(2): 197-202. (in Chinese)
- 86. SCHIJVEN, J. F., HASSANIZADEH, S. M. Removal of viruses by soil passage: Overview of modeling, processes, and parameters. Critical Reviews in Environmental Science and Technology, 2000, 30(1): 49-127. http://dx.doi.org/10.1080/10643380091184174
- 87. SCHIJVEN, J. F., HASSANIZADEH, S. M. and DE BRUIN, R. H. Two-site kinetic modeling of bacteriophages transport through columns of saturated dune sand. Journal of Contaminant Hydrology, 2002, 57(3): 259-279. http://dx.doi.org/10.1016/S0169-7722(01)00215-7
- 88. FEIGHERY, J., MAILLOUX, B. J., FERGUSON, A., et al. Transport of E. coli in aquifer sediments of Bangladesh: Implications for widespread microbial contamination of groundwater. Water Resources Research, 2013, 49(7): 3897-3911. http://dx.doi.org/10.1002/wrcr.20289
- 89. TUFENKJI, N., REDMAN, J. A. and ELIMELECH, M. Interpreting deposition patterns of microbial particles in laboratory-scale column experiments. Environmental Science & Technology, 2003, 37(3): 616-623. http://dx.doi.org/10.1021/es025871i
- 90. BRADFORD, S., TORIDE, N. A stochastic model for colloid transport and deposition. Journal of Environmental Quality, 2007, 36(5): 1346-1356. http://dx.doi.org/10.2134/jeq2007.0004
- 91. LEIJ, F. J., BRADFORD, S. A. Combined physical and chemical nonequilibrium transport model: Analytical solution, moments, and application to colloids. Journal of Contaminant Hydrology, 2009, 110(3): 87-99. http://dx.doi.org/10.1016/j.jconhyd.2009.09.004
- 92. LEIJ, F. J., BRADFORD, S. A. Colloid transport in dual-permeability media. Journal of Contaminant Hydrology, 2013, 150: 65-76. http://dx.doi.org/10.1016/j.jconhyd.2013.03.010
- 93. DÍAZ, J., RENDUELES, M. and DÍAZ, M. Straining phenomena in bacteria transport through natural porous media. Environmental Science and Pollution Research, 2010, 17(2): 400-409. http://dx.doi.org/10.1007/s11356-009-0160-2
- 94. BRADFORD, S. A., SIMUNEK, J., BETTAHAR, M., et al. Modeling colloid attachment, straining, and exclusion in saturated porous media. Environmental Science & Technology, 2003, 37(10): 2242-2250. http://dx.doi.org/10.1021/es025899u
- 95. HOSSEINI, S. M., TOSCO, T. Transport and retention of high concentrated nano-Fe/Cu particles through highly flow-rated packed sand column. Water Research, 2013, 47(1): 326-338. http://dx.doi.org/10.1016/j.watres.2012.10.002
- 96. BRADFORD, S. A., VAN GENUCHTEN, M. T. and ŠIMŮNEK, J. Modeling of colloid transport and deposition in porous media//Department of Earth Sciences. Proceedings of Workshop on Hydrus Applications, Netherlands: Utrecht University, 2005: 1.
- 97. SEN, T. K., DAS, D., KHILAR, K. C., et al. Bacterial transport in porous media: New aspects of the mathematical model. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2005, 260(1): 53-62. http://dx.doi.org/10.1016/j.colsurfa.2005.02.033